福建省漳州市2022-2023学年高二上学期期末教学质量检测化学试卷(含答案)
文档属性
| 名称 | 福建省漳州市2022-2023学年高二上学期期末教学质量检测化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 793.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-08 09:32:42 | ||
图片预览



文档简介
漳州市2022-2023学年高二上学期期末教学质量检测
化学(化学反应原理)试题
试卷说明:
(1)本试卷满分100分,考试时间75分钟。
(2)本试卷可能用到的相对原子质量:H 1 C 12 O 16 Cu 64
一、选择题(本题包括10小题,每小题4分,共40分,每小题只有一个正确答案)
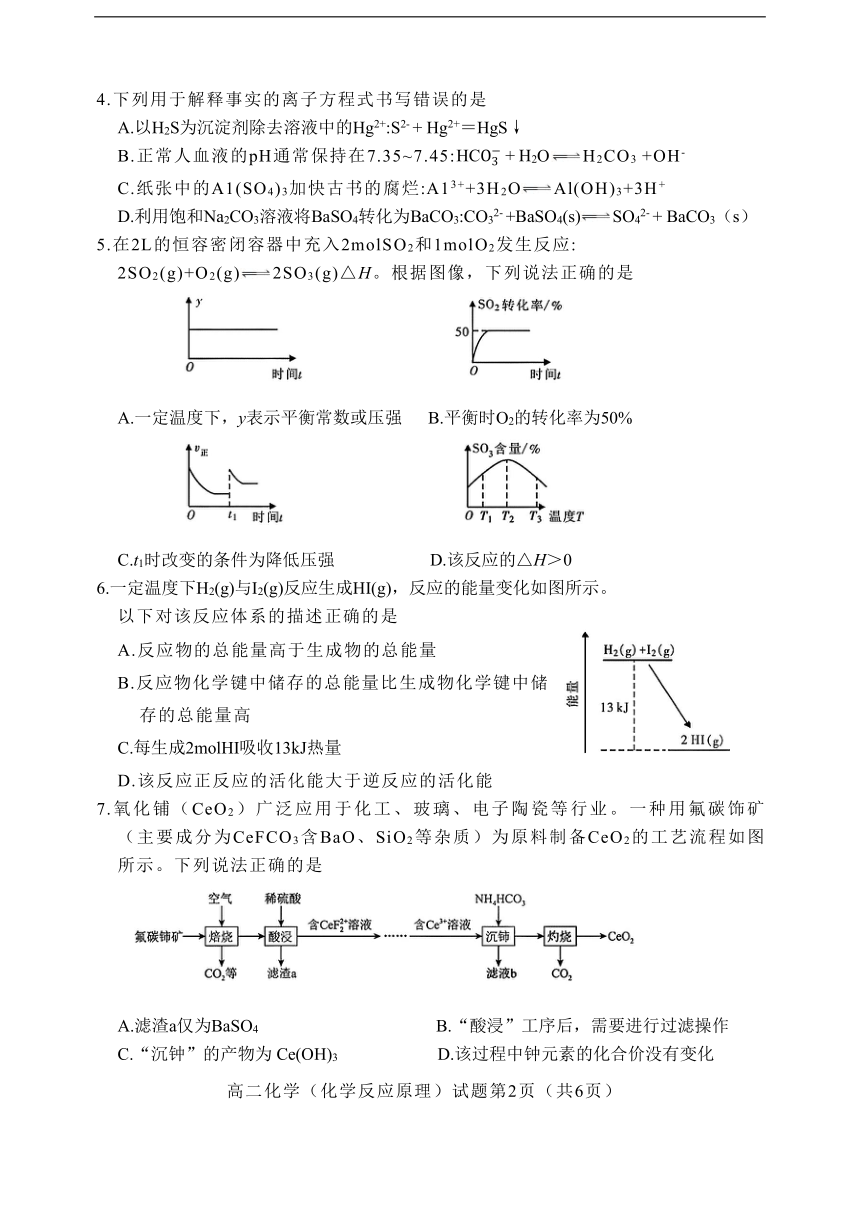
1.科学家成功研制出一种催化剂,为Cu/Zn/A/M'/M''五组分共存的金属氧化物,实现了CO2与H2反应生成醇、羚酸等产物。下列说法正确的是
A.Zn不属于过渡元素 B.乙醇为非电解质
C.催化剂通过降低反应热加快反应速率 D.CO2与H2生成乙酸是之大的反应
2.研究小组利用左图装置探究铁粉腐蚀原理。挤压胶头滴管将醋酸滴人铁粉与碳粉的均匀混合物中,容器内的压强随时间的变化如右图所示。下列说法正确的是
A.铁粉发生反应转化为Fe3+ B.该实验中铁粉只发生电化学腐蚀
C.0-t1段压强增大只是因为产生了H2 D.t1-t2段铁粉有发生吸氧腐蚀
3.下列关于酸碱中和滴定实验操作或装置叙述错误的是
高二化学(化学反应原理)试题第1页(共6页)
4.下列用于解释事实的离子方程式书写错误的是
A.以H2S为沉淀剂除去溶液中的Hg2+:S2- + Hg2+=HgS↓
B.正常人血液的pH通常保持在7.35~7.45:2OH2CO3 +OH-
C.纸张中的A1(SO4)3加快古书的腐烂:A13++3H2OAl(OH)3+3H+
D.利用饱和Na2CO3溶液将BaSO4转化为BaCO3:CO32- +BaSO4(s)SO42- + BaCO3(s)
5.在2L的恒容密闭容器中充入2molSO2和1molO2发生反应:
2SO2(g)+O2(g)2SO3(g)△H。根据图像,下列说法正确的是
A.一定温度下,y表示平衡常数或压强 B.平衡时O2的转化率为50%
C.t1时改变的条件为降低压强 D.该反应的△H>0
6.一定温度下H2(g)与I2(g)反应生成HI(g),反应的能量变化如图所示。
以下对该反应体系的描述正确的是
A.反应物的总能量高于生成物的总能量
B.反应物化学键中储存的总能量比生成物化学键中储
存的总能量高
C.每生成2molHI吸收13kJ热量
D.该反应正反应的活化能大于逆反应的活化能
7.氧化铺(CeO2)广泛应用于化工、玻璃、电子陶瓷等行业。一种用氟碳饰矿(主要成分为CeFCO3含BaO、SiO2等杂质)为原料制备CeO2的工艺流程如图所示。下列说法正确的是
A.滤渣a仅为BaSO4 B.“酸浸”工序后,需要进行过滤操作
C.“沉钟”的产物为 Ce(OH)3 D.该过程中钟元素的化合价没有变化
高二化学(化学反应原理)试题第2页(共6页)
8.热激活电池(又称热电池)可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCI混合物一旦受热熔融,电池瞬间即可输出电能。该电池总反应为: PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。
关于该电池的下列说法正确的是
A.负极的电极反应:Ca+2C1- +2e- =CaCl2
B.放电过程中, Li+向钙电极移动
C.正极反应物为 LiCl
D.常温时,在正负极之间连上检流计,指针不偏转
9.105℃时,将一定量的某碳酸氢盐(MHCO3)固体置于真空恒容容器中,存在如下反应:
2MHCO3(s) M2CO3(s)+H2O(g)+CO2(g)。已知该条件下,反应达平衡时体系的总压强为46kPa。保持温度不变,下列说法正确的是
A.混合气体中各组分的体积分数不变,说明反应达到平衡状态
B.混合气体的平均摩尔质量为31g·mo1-1
C.再添加一定量的MHCO3固体,体系的压强一定不变
D.若原容器中有残留空气,达平衡时,体系的总压仍为46kPa
10.常温下,向某浓度的H2A溶液中逐滴加入NaOH溶液,溶液中-lgc(x)(x为H2A、HA-或A2-)与溶液pH的变化关系如图所示。下列说法正确的是
A.曲线m代表H2A B.b点对应溶液的pH为3.05
C.c点溶液中c(Na+)>3c(A2-) D.整个过程中[c(H2A)+c(HA-)+c(A2-)]保持不变
二、非选择题(本题包括5小题,共60分)
11.(10分)为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的燃变并采取相应措施。化学反应的熔变通常用实验进行测定,也可进行理论推算。
(1)在中和热测定实验中,用酸代替盐酸进行实验,测得的△H____(填“偏大”或“偏小”),产生偏差的原因是______________。
(2)相同条件下,石墨比金刚石更稳定,则C(s,金刚石)=C(s,石墨)△H____0 (填“>”或“<”)。
(3)实验测得,1gCH3OH(1)完全燃烧生成CO2(g)和H2O(1)时放热23kJ。该状态下CH3OH燃烧热的热化学方程式为___________。
(4)已知在298.15K、100kPa条件下,
N2(g)+3H2(g)2NH3(g)△H=-92kJ·mol-1。
高二化学(化学反应原理)试题第3页(共6页)
① 结合表格数据计算a=____。
② N2(g)、H(g)和NH(g)的比热容分别为29.1、28.9和35.6J·k-1·mol-1。一定压强下1mol反应中,反应物[N2(g)+3H2(g)]、生成物[2NH3(g)]的能量随温度T的变化示意图合理的是____(填标号)。
12.(10分)根据要求回答下列问题。
(1)常温下,将pH和体积均相同的HNO3和CH3COOH溶液分别稀释,溶液pH随加水体积的变化如图所示:
① 曲线I代表____溶液(填“HNO3”或“CH3COOH”)。
② a、b两点对应的溶液中,水的电离程度a_____b
(填“>”、“<”或“=”)。
③ 向上述HNO3溶液和CH3COOH溶液分别滴加等浓度的 NaOH 溶液,当恰好中和时,消耗 NaOH 溶液体积分别为V1和V2,则V1_____V2(填“>”、“<”或“=”)。
(2)25℃时,往H2C2O4溶液中加入NaOH溶液。已知:H2C2O4的电离平衡常数
Ka1=5.9×10-2、Ka2=6.4×10-5。
① 现有物质的量浓度均为0.1mol·L-1的三种溶液:
a. Na2 C2O4 b. NaHC2 O4 c. H2C2O4
溶液中c(H2C2O4)由大到小的顺序是_____(填标号)。
② 当n(H2C2O4) : n(NaOH)=1:1时,溶液显_____性(填“酸”、“碱”或“中”),请结合数据说明理由___________。
13.(13分)以镁铝复合氧化物(MgO-A1203)为载体的负载型镍铜双金属催化剂(Ni-Cu/ Mg0-Al203)是一种新型高效加氢或脱氢催化剂,其制备流程如下:
已知:常温下,Ksp[Cu(OH)2]=2.21×10-20、 Ksp[Al(OH)3]=1.30×10-33。
回答下列问题:
(1)加热条件下,尿素[CO(NH2)2]在水中发生水解反应生成CO2和另一种气体,写出水解反应的化学方程式___________。
高二化学(化学反应原理)试题第4页(共6页)
(2)“晶化”过程中,需保持恒温60℃,可采用的加热方式为______。
(3)“洗涤”过程中,可通过检验______(填离子符号)判断滤饼是否洗净。
(4)常温下,若“悬浊液”的pH=10,则溶液中_____。
(5)“还原”过程的产物是______(填化学式)。
(6)镍的化合物NiO(OH)能用作碱性镍镉二次电池的正极材料,装置如图所示。
① M是_____离子交换膜(填“阳”或“阴”)。
② 理论上,放电时电路中转移1mol电子,b极区质量变化_____g。
14.(14分)某实验小组通过以下实验,探究一定温度下锻件表面锻铜的最佳条件。
[查阅资料]① Cu2++2P2O74-[Cu(P2O7)2]6- K=1×109
② Cu+在溶液中不稳定,容易发生歧化反应(歧化反应是指同种元素的化合价既有升高又有降低的反应)。
[实验设计]用CusO4·5H2O、Na4P2O7·10H2O(焦磷酸钠)、添加剂配制一定浓度的电锻液,用纯铜和镀件作为两极材料,探究电锁液的pH、电流密度对锻层的影响。
(1)配制一定体积40g·L-1的CuSO4溶液,以下仪器一定不需要用到的是_(填仪器名称)。
(2)镀件表面的油污可用热的纯碱溶液清洗,理由是_____________________。
(3)纯铜与电源的_____相连(填“正极”或“负极”)。
(4)电镀时阴极上发生的主要反应的电极反应式为______________________。
1.其他条件不变时,通电10min,探究pH对电镀的影响如下:
[实验结果与数据分析]
(5)实验3中,铜镀层的沉积速率v(Cu)=____mol·min-1(保留两位有效数字)。
(6)实验1和实验4中,酸性或做性较强时,锁层均出现斑驳,可能的原因是____。
高二化学(化学反应原理)试题第5页(共6页)
i.电流密度与镀膜质量的关系如图所示:
(7)本实验电镀的最佳条件是pH为8.5,电流密度为________ A·dm-2。
(8)使用最佳条件电镀时,在阳极附近的电镀液中出现红色固体(Cu)沉积物,用离子方程式表示其产生原因____,通空气搅拌可防止红色固体沉积物生成。
15.(13分)工业上利用天然气制备H2,还可得到C2H4、C2H2等化工产品。一定条件下,有关反应如下:
反应1: 2CH4(g)C2H2(g)+3H2(g)△H1=376.3kJ·mol-1
反应2: 2CH(g)C2H4(g)+2H2(g)△H2=202kJ·mol-1
回答下列问题:
(1)相同条件下,反应C2H4(g)C2H2(g)+H1(g) △H3,△H3=____ k]· mol-1。
(2)实验测得反应1的速率方程:v正=k正c2(CH4),v逆=k逆c(C2H2)c3(H3)(k正、k逆分别为正、逆反应速率常数)。
① 结合速率的影响因素,推测速率常数k的影响因素有____(填标号)。
A.温度 B.浓度 C.催化剂 D.固体表面性质
② T℃下反应达到平衡时k正=1.5k逆该温度下平衡常数K=_________。
(3)向恒温恒容密闭容器中充入适量CH4,同时发生上述反应1和反应2。在不同催化剂Cat1、Cat2作用下,测得单位时间内H2的产率与温度的关系如右图所示。在其他条件相同时,催化效率较高的是______(填“Cat1”或“Cat2”)。在Cat2 作用下,温度高于500℃时,H2的产率降低的可能原因是_________。
(4)一定温度下,总压强恒定为121kPa时,向密闭容器中充入CH4和N2的混合气体(N2不参与反应),同时发生反应1和反应2,测得CH4的平衡转化率与通入气体中 CH4 的物质的量分数的关系如下图所示。
① 随着通入气体中CH4的物质的量分数增大,CH4衡转化率降低的主要原因是____。
② 已知M点对应的乙快的选择性为75%(乙快
的选择性%)。
该温度下,反应2的平衡常数Kp=_____kPa (结果保留2位有效数字)。(提示:用平衡时气体分压计算的平衡常数为Kp,气体分压=气体总压×气体的物质的量分数。)
高二化学(化学反应原理)试题第6页(共6页)
化学(化学反应原理)试题
试卷说明:
(1)本试卷满分100分,考试时间75分钟。
(2)本试卷可能用到的相对原子质量:H 1 C 12 O 16 Cu 64
一、选择题(本题包括10小题,每小题4分,共40分,每小题只有一个正确答案)
1.科学家成功研制出一种催化剂,为Cu/Zn/A/M'/M''五组分共存的金属氧化物,实现了CO2与H2反应生成醇、羚酸等产物。下列说法正确的是
A.Zn不属于过渡元素 B.乙醇为非电解质
C.催化剂通过降低反应热加快反应速率 D.CO2与H2生成乙酸是之大的反应
2.研究小组利用左图装置探究铁粉腐蚀原理。挤压胶头滴管将醋酸滴人铁粉与碳粉的均匀混合物中,容器内的压强随时间的变化如右图所示。下列说法正确的是
A.铁粉发生反应转化为Fe3+ B.该实验中铁粉只发生电化学腐蚀
C.0-t1段压强增大只是因为产生了H2 D.t1-t2段铁粉有发生吸氧腐蚀
3.下列关于酸碱中和滴定实验操作或装置叙述错误的是
高二化学(化学反应原理)试题第1页(共6页)
4.下列用于解释事实的离子方程式书写错误的是
A.以H2S为沉淀剂除去溶液中的Hg2+:S2- + Hg2+=HgS↓
B.正常人血液的pH通常保持在7.35~7.45:2OH2CO3 +OH-
C.纸张中的A1(SO4)3加快古书的腐烂:A13++3H2OAl(OH)3+3H+
D.利用饱和Na2CO3溶液将BaSO4转化为BaCO3:CO32- +BaSO4(s)SO42- + BaCO3(s)
5.在2L的恒容密闭容器中充入2molSO2和1molO2发生反应:
2SO2(g)+O2(g)2SO3(g)△H。根据图像,下列说法正确的是
A.一定温度下,y表示平衡常数或压强 B.平衡时O2的转化率为50%
C.t1时改变的条件为降低压强 D.该反应的△H>0
6.一定温度下H2(g)与I2(g)反应生成HI(g),反应的能量变化如图所示。
以下对该反应体系的描述正确的是
A.反应物的总能量高于生成物的总能量
B.反应物化学键中储存的总能量比生成物化学键中储
存的总能量高
C.每生成2molHI吸收13kJ热量
D.该反应正反应的活化能大于逆反应的活化能
7.氧化铺(CeO2)广泛应用于化工、玻璃、电子陶瓷等行业。一种用氟碳饰矿(主要成分为CeFCO3含BaO、SiO2等杂质)为原料制备CeO2的工艺流程如图所示。下列说法正确的是
A.滤渣a仅为BaSO4 B.“酸浸”工序后,需要进行过滤操作
C.“沉钟”的产物为 Ce(OH)3 D.该过程中钟元素的化合价没有变化
高二化学(化学反应原理)试题第2页(共6页)
8.热激活电池(又称热电池)可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCI混合物一旦受热熔融,电池瞬间即可输出电能。该电池总反应为: PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。
关于该电池的下列说法正确的是
A.负极的电极反应:Ca+2C1- +2e- =CaCl2
B.放电过程中, Li+向钙电极移动
C.正极反应物为 LiCl
D.常温时,在正负极之间连上检流计,指针不偏转
9.105℃时,将一定量的某碳酸氢盐(MHCO3)固体置于真空恒容容器中,存在如下反应:
2MHCO3(s) M2CO3(s)+H2O(g)+CO2(g)。已知该条件下,反应达平衡时体系的总压强为46kPa。保持温度不变,下列说法正确的是
A.混合气体中各组分的体积分数不变,说明反应达到平衡状态
B.混合气体的平均摩尔质量为31g·mo1-1
C.再添加一定量的MHCO3固体,体系的压强一定不变
D.若原容器中有残留空气,达平衡时,体系的总压仍为46kPa
10.常温下,向某浓度的H2A溶液中逐滴加入NaOH溶液,溶液中-lgc(x)(x为H2A、HA-或A2-)与溶液pH的变化关系如图所示。下列说法正确的是
A.曲线m代表H2A B.b点对应溶液的pH为3.05
C.c点溶液中c(Na+)>3c(A2-) D.整个过程中[c(H2A)+c(HA-)+c(A2-)]保持不变
二、非选择题(本题包括5小题,共60分)
11.(10分)为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的燃变并采取相应措施。化学反应的熔变通常用实验进行测定,也可进行理论推算。
(1)在中和热测定实验中,用酸代替盐酸进行实验,测得的△H____(填“偏大”或“偏小”),产生偏差的原因是______________。
(2)相同条件下,石墨比金刚石更稳定,则C(s,金刚石)=C(s,石墨)△H____0 (填“>”或“<”)。
(3)实验测得,1gCH3OH(1)完全燃烧生成CO2(g)和H2O(1)时放热23kJ。该状态下CH3OH燃烧热的热化学方程式为___________。
(4)已知在298.15K、100kPa条件下,
N2(g)+3H2(g)2NH3(g)△H=-92kJ·mol-1。
高二化学(化学反应原理)试题第3页(共6页)
① 结合表格数据计算a=____。
② N2(g)、H(g)和NH(g)的比热容分别为29.1、28.9和35.6J·k-1·mol-1。一定压强下1mol反应中,反应物[N2(g)+3H2(g)]、生成物[2NH3(g)]的能量随温度T的变化示意图合理的是____(填标号)。
12.(10分)根据要求回答下列问题。
(1)常温下,将pH和体积均相同的HNO3和CH3COOH溶液分别稀释,溶液pH随加水体积的变化如图所示:
① 曲线I代表____溶液(填“HNO3”或“CH3COOH”)。
② a、b两点对应的溶液中,水的电离程度a_____b
(填“>”、“<”或“=”)。
③ 向上述HNO3溶液和CH3COOH溶液分别滴加等浓度的 NaOH 溶液,当恰好中和时,消耗 NaOH 溶液体积分别为V1和V2,则V1_____V2(填“>”、“<”或“=”)。
(2)25℃时,往H2C2O4溶液中加入NaOH溶液。已知:H2C2O4的电离平衡常数
Ka1=5.9×10-2、Ka2=6.4×10-5。
① 现有物质的量浓度均为0.1mol·L-1的三种溶液:
a. Na2 C2O4 b. NaHC2 O4 c. H2C2O4
溶液中c(H2C2O4)由大到小的顺序是_____(填标号)。
② 当n(H2C2O4) : n(NaOH)=1:1时,溶液显_____性(填“酸”、“碱”或“中”),请结合数据说明理由___________。
13.(13分)以镁铝复合氧化物(MgO-A1203)为载体的负载型镍铜双金属催化剂(Ni-Cu/ Mg0-Al203)是一种新型高效加氢或脱氢催化剂,其制备流程如下:
已知:常温下,Ksp[Cu(OH)2]=2.21×10-20、 Ksp[Al(OH)3]=1.30×10-33。
回答下列问题:
(1)加热条件下,尿素[CO(NH2)2]在水中发生水解反应生成CO2和另一种气体,写出水解反应的化学方程式___________。
高二化学(化学反应原理)试题第4页(共6页)
(2)“晶化”过程中,需保持恒温60℃,可采用的加热方式为______。
(3)“洗涤”过程中,可通过检验______(填离子符号)判断滤饼是否洗净。
(4)常温下,若“悬浊液”的pH=10,则溶液中_____。
(5)“还原”过程的产物是______(填化学式)。
(6)镍的化合物NiO(OH)能用作碱性镍镉二次电池的正极材料,装置如图所示。
① M是_____离子交换膜(填“阳”或“阴”)。
② 理论上,放电时电路中转移1mol电子,b极区质量变化_____g。
14.(14分)某实验小组通过以下实验,探究一定温度下锻件表面锻铜的最佳条件。
[查阅资料]① Cu2++2P2O74-[Cu(P2O7)2]6- K=1×109
② Cu+在溶液中不稳定,容易发生歧化反应(歧化反应是指同种元素的化合价既有升高又有降低的反应)。
[实验设计]用CusO4·5H2O、Na4P2O7·10H2O(焦磷酸钠)、添加剂配制一定浓度的电锻液,用纯铜和镀件作为两极材料,探究电锁液的pH、电流密度对锻层的影响。
(1)配制一定体积40g·L-1的CuSO4溶液,以下仪器一定不需要用到的是_(填仪器名称)。
(2)镀件表面的油污可用热的纯碱溶液清洗,理由是_____________________。
(3)纯铜与电源的_____相连(填“正极”或“负极”)。
(4)电镀时阴极上发生的主要反应的电极反应式为______________________。
1.其他条件不变时,通电10min,探究pH对电镀的影响如下:
[实验结果与数据分析]
(5)实验3中,铜镀层的沉积速率v(Cu)=____mol·min-1(保留两位有效数字)。
(6)实验1和实验4中,酸性或做性较强时,锁层均出现斑驳,可能的原因是____。
高二化学(化学反应原理)试题第5页(共6页)
i.电流密度与镀膜质量的关系如图所示:
(7)本实验电镀的最佳条件是pH为8.5,电流密度为________ A·dm-2。
(8)使用最佳条件电镀时,在阳极附近的电镀液中出现红色固体(Cu)沉积物,用离子方程式表示其产生原因____,通空气搅拌可防止红色固体沉积物生成。
15.(13分)工业上利用天然气制备H2,还可得到C2H4、C2H2等化工产品。一定条件下,有关反应如下:
反应1: 2CH4(g)C2H2(g)+3H2(g)△H1=376.3kJ·mol-1
反应2: 2CH(g)C2H4(g)+2H2(g)△H2=202kJ·mol-1
回答下列问题:
(1)相同条件下,反应C2H4(g)C2H2(g)+H1(g) △H3,△H3=____ k]· mol-1。
(2)实验测得反应1的速率方程:v正=k正c2(CH4),v逆=k逆c(C2H2)c3(H3)(k正、k逆分别为正、逆反应速率常数)。
① 结合速率的影响因素,推测速率常数k的影响因素有____(填标号)。
A.温度 B.浓度 C.催化剂 D.固体表面性质
② T℃下反应达到平衡时k正=1.5k逆该温度下平衡常数K=_________。
(3)向恒温恒容密闭容器中充入适量CH4,同时发生上述反应1和反应2。在不同催化剂Cat1、Cat2作用下,测得单位时间内H2的产率与温度的关系如右图所示。在其他条件相同时,催化效率较高的是______(填“Cat1”或“Cat2”)。在Cat2 作用下,温度高于500℃时,H2的产率降低的可能原因是_________。
(4)一定温度下,总压强恒定为121kPa时,向密闭容器中充入CH4和N2的混合气体(N2不参与反应),同时发生反应1和反应2,测得CH4的平衡转化率与通入气体中 CH4 的物质的量分数的关系如下图所示。
① 随着通入气体中CH4的物质的量分数增大,CH4衡转化率降低的主要原因是____。
② 已知M点对应的乙快的选择性为75%(乙快
的选择性%)。
该温度下,反应2的平衡常数Kp=_____kPa (结果保留2位有效数字)。(提示:用平衡时气体分压计算的平衡常数为Kp,气体分压=气体总压×气体的物质的量分数。)
高二化学(化学反应原理)试题第6页(共6页)
同课章节目录
