专题6 化学反应与能量 第三单元 阶段重点突破练(二) (含答案)
文档属性
| 名称 | 专题6 化学反应与能量 第三单元 阶段重点突破练(二) (含答案) |
|
|
| 格式 | docx | ||
| 文件大小 | 493.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-08 00:00:00 | ||
图片预览




文档简介
专题6 化学反应与能量 阶段重点突破练(二)
一、吸热反应和放热反应
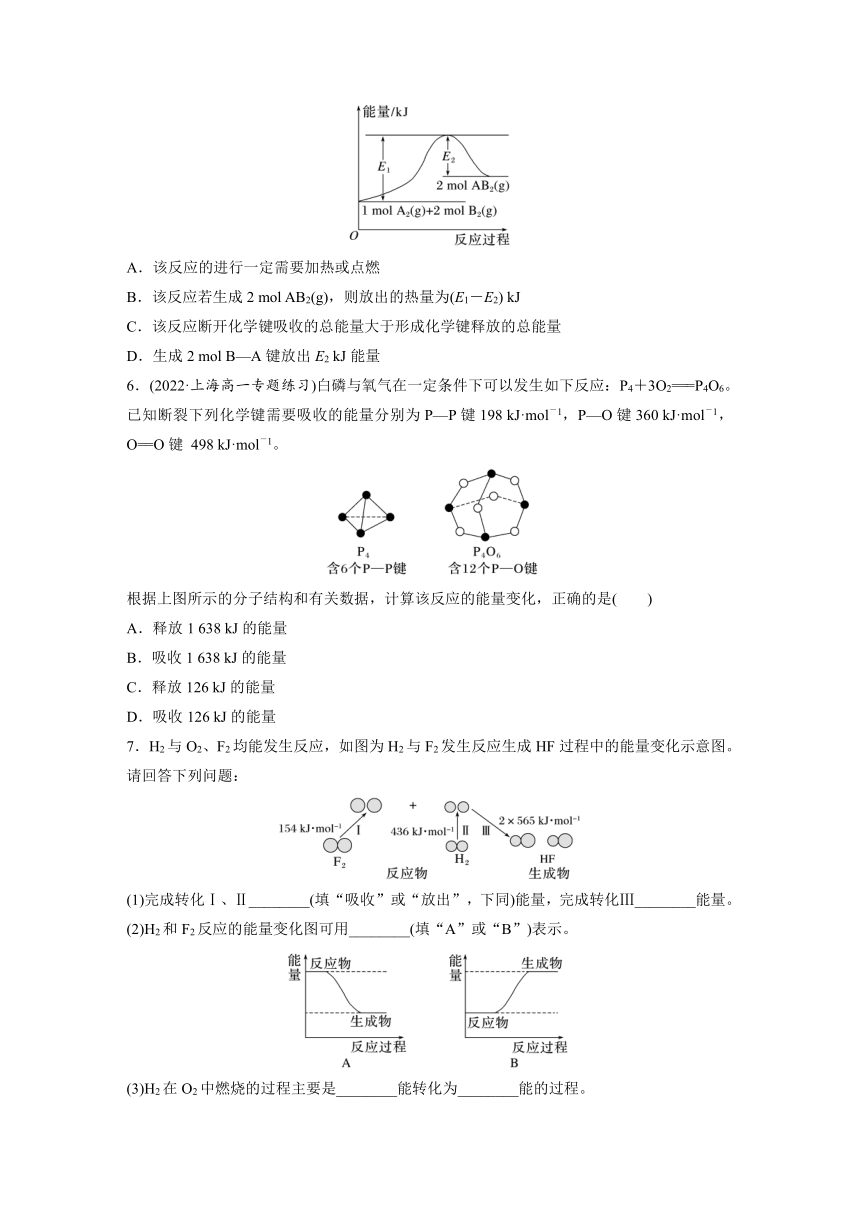
1.(2022·兰州一中高一阶段练习)已知反应A(g)+B(g)===C(g)+D(g)的能量变化如图所示,下列说法中正确的是( )
A.A(g)的能量一定低于C(g)
B.反应物断键吸收的总能量大于生成物新键形成放出的总能量
C.化学反应中的能量变化都表现为热量的变化
D.物质的能量越高,稳定性越好
2.运载火箭常使用偏二甲肼(C2H8N2)和液态四氧化二氮作推进剂,发生反应:C2H8N2+2N2O4===3N2↑+2CO2↑+4H2O。下列说法正确的是( )
A.断裂C2H8N2和N2O4中的化学键时放出能量
B.C2H8N2具有的能量高于N2具有的能量
C.反应物具有的总能量高于生成物具有的总能量
D.该反应中,C2H8N2作氧化剂
3.工业上由CO2和H2合成气态甲醇的化学方程式为CO2(g)+3H2(g)===CH3OH(g)+H2O(g),已知该反应是放热反应。下列表示合成甲醇的反应的能量变化示意图中正确的是( )
4.在两支试管中分别加入3 mL稀盐酸(均足量),将两个各装有0.3 g NaHCO3或Na2CO3粉末的小气球分别套在两支试管口(如下图)。将气球内的NaHCO3或Na2CO3同时倒入试管中。
(1)①Ⅰ试管和Ⅱ试管中分别发生反应的离子方程式:____________________________
__________________________________________________________________________;
__________________________________________________________________________。
②两支试管中的现象为______________________________________________________
__________________________________________________________________________。
③甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3粉末的试管变热。由此他得出:不管其状态如何,NaHCO3和盐酸反应为吸热反应,而Na2CO3和盐酸反应为放热反应。甲得出结论的方法是否正确?________(填“正确”或“不正确”)。
(2)为研究两反应是吸热反应还是放热反应,继续进行了下列实验(每次实验各做3次平行实验,取平均值):
序号 试剂1 试剂2 混合前温度 混合后最高或最低温度
① 50 mL水 2.5 g NaHCO3固体 20 ℃ 18.5 ℃
② 50 mL水 3.2 g Na2CO3固体 20 ℃ 23.3 ℃
③ 35 mL稀盐酸 含2.5 g NaHCO3的饱和溶液15 mL 20 ℃ 18.8 ℃
④ 35 mL稀盐酸 含3.2 g Na2CO3的饱和溶液15 mL 20 ℃ 21.2 ℃
通过上述实验可得出三条结论:
a.NaHCO3的溶解是________(填“吸热”或“放热”,下同)过程。
b.Na2CO3的饱和溶液和盐酸的反应是______反应。
c.NaHCO3的饱和溶液和盐酸的反应是________反应。
二、吸热反应和放热反应的计算
5.已知某化学反应A2(g)+2B2(g)===2AB2(g)(A2、B2、AB2的结构式分别为A===A、B—B、B—A—B),反应过程中的能量变化如图所示,下列有关叙述正确的是( )
A.该反应的进行一定需要加热或点燃
B.该反应若生成2 mol AB2(g),则放出的热量为(E1-E2) kJ
C.该反应断开化学键吸收的总能量大于形成化学键释放的总能量
D.生成2 mol B—A键放出E2 kJ能量
6.(2022·上海高一专题练习)白磷与氧气在一定条件下可以发生如下反应:P4+3O2===P4O6。已知断裂下列化学键需要吸收的能量分别为P—P键198 kJ·mol-1,P—O键360 kJ·mol-1,O==O键 498 kJ·mol-1。
根据上图所示的分子结构和有关数据,计算该反应的能量变化,正确的是( )
A.释放1 638 kJ的能量
B.吸收1 638 kJ的能量
C.释放126 kJ的能量
D.吸收126 kJ的能量
7.H2与O2、F2均能发生反应,如图为H2与F2发生反应生成HF过程中的能量变化示意图。请回答下列问题:
(1)完成转化Ⅰ、Ⅱ________(填“吸收”或“放出”,下同)能量,完成转化Ⅲ________能量。
(2)H2和F2反应的能量变化图可用________(填“A”或“B”)表示。
(3)H2在O2中燃烧的过程主要是________能转化为________能的过程。
三、能源的利用
8.(2022·大连高一期末)在第七十五届联合国大会一般性辩论上,“碳中和”被“高亮提及”。我国向国际社会作出“碳达峰、碳中和”的郑重承诺,中国将提高国家自主贡献力度,采取更加有力的政策和措施将二氧化碳排放力争于2030年前达到峰值,力争2060年前实现“碳中和”,树立了大国形象,彰显了大国担当。下列说法不正确的是( )
A.大力发展电动汽车、氢燃料电池汽车等新能源汽车
B.大力支持风电、光伏发电、生物质发电等行业健康有序发展
C.一定条件下,将CO2转化为CH3OH,实现CO2的资源化利用
D.鼓励农村居民燃烧农作物秸秆用于做饭、冬季取暖
9.为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想。
下列说法正确的是( )
A.H2O的分解反应是放热反应
B.氢能源已被普遍使用
C.2 mol H2O具有的总能量低于2 mol H2和1 mol O2具有的总能量
D.氢气不易贮存和运输,无开发利用价值
10.分析下图,回答以下问题:
(1)电解水生成H2,首先要解决的问题是_________________________________________。
(2)标准状况下,11.2 L H2燃烧生成液态的水,放出Q kJ的热量,写出该反应的热化学方程式:________________________________________________________________________。
(3)氢气作为理想的“绿色能源”的主要理由是___________________________________。
(4)氢氧燃料电池是氢能源利用的一个重要方向。氢气在________极上发生________反应,氧气在________极上发生________反应。
若电解质溶液为KOH溶液,写出正、负极上的电极反应式:
负极:_____________________________________________________________________,
正极:_____________________________________________________________________。
四、原电池的工作原理和应用
11.如图所示,电流计的指针发生偏转,同时A极的质量减小,B极上有气泡产生,C为电解质溶液,下列说法错误的是( )
A.B极为原电池的正极
B.A、B、C分别可能为Zn、Cu和稀盐酸
C.C中阳离子向A极移动
D.A极发生氧化反应
12.把a、b、c、d四种金属片浸泡在稀H2SO4中,用导线两两相连可以组成各种原电池。若a、b相连时,a为负极;c、d相连时,c为负极;a、c相连时,c为正极;b、d相连时,b为正极,则这四种金属活动性顺序由大到小为( )
A.a>b>c>d B.a>c>d>b
C.c>a>b>d D.b>d>c>a
五、化学电源和电极反应式的书写
13.锌-空气电池具有蓄电量大、循环次数多等优点。下列说法正确的是( )
A.电池放电时,Zn电极逐渐溶解
B.电池放电时,石墨为负极
C.电池放电时,电子由石墨经导线流向Zn片
D.电池放电时,实现了电能向化学能的转化
14.(2021·广东,9)火星大气中含有大量CO2,一种有CO2参加反应的新型全固态电池有望为火星探测器供电。该电池以金属钠为负极,碳纳米管为正极,放电时( )
A.负极上发生还原反应
B.CO2在正极上得电子
C.阳离子由正极移向负极
D.将电能转化为化学能
15.(2022·湖南长沙高一期中)化学电源在生产生活中有着广泛的应用。请回答下列问题:
(1)根据构成原电池的本质判断,下列化学(或离子)方程式正确且能设计成原电池的是________(填字母,下同)。
A.KOH+HCl===KCl+H2O
B.Cu+Fe3+===Fe2++Cu2+
C.Na2O+H2O===2NaOH
D.Fe+H2SO4===FeSO4 +H2↑
(2)为了探究化学反应中的能量变化,某同学设计了如下两个实验(如图)。有关反应一段时间后的实验现象,下列说法正确的是________。
A.图Ⅰ中温度计的示数高于图Ⅱ的示数
B.图Ⅰ和图Ⅱ中温度计的示数相等,且均高于室温
C.图Ⅰ和图Ⅱ的气泡均产生于锌棒表面
D.图Ⅱ中产生气体的速率比Ⅰ慢
(3)电动汽车上用的铅蓄电池是以一组海绵状铅板和另一组结构相似的充满二氧化铅的铅板组成,用H2SO4作电解质溶液。放电时总反应为Pb+PbO2+2H2SO4===2PbSO4+2H2O。
①写出放电时正极的电极反应式:_____________________________________________;
②铅蓄电池放电时,负极质量将_________(填“增大”“减小”或“不变”)。当外电路上有2 mol电子通过时,溶液中消耗H2SO4的物质的量为________。
六、原电池的综合
16.Ⅰ.现有两个反应:
a.NaOH+HCl===NaCl+H2O
b.Cu+2Ag+===2Ag+Cu2+
(1)根据两反应本质,判断它们能否设计成原电池:_______________________________
____________。如果不能,说明其原因:_______________________________________。
(2)如果可以,则写出正、负极材料,电极反应式及反应类型(“氧化反应”或“还原反应”),电解质溶液名称。
负极:________,________________,_____________。
正极:________,________________,_____________。
电解质溶液:________________________。
Ⅱ.常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示。反应过程中有红棕色气体产生。
O~t1时,原电池的负极是Al片,此时,正极的电极反应式是___________________,
溶液中的H+向________移动;t1时,原电池中电子流动方向发生改变,其原因是________________________________________________________________________。
17.某实验的实验装置如图所示,回答下列有关该实验的问题。
(1)该实验所用的石墨棒须经过预处理;先经高温火焰灼烧到红热,再迅速浸入冷水中。这种预处理的目的是______________________________________________________________。
(2)要使发光二极管发亮,实验时的操作顺序是先关闭S1,打开S2,电解一段时间后,再打开S1,关闭S2,请写出整个实验过程中的能量转化形式:____________________________。
(3)写出下列操作时的电极反应式,并注明电极名称:
①按下开关S1:C1附近发生2H2O+2e-===H2↑+2OH-的电极反应;
②断开开关S1,迅速按下开关S2:(提示:此时C1附近溶液显碱性,C2附近溶液显酸性)C2:________________________________,________。
阶段重点突破练(二)
1.B 2.C 3.A
4.(1)①HCO+H+===CO2↑+H2O CO+2H+===CO2↑+H2O ②两支试管中都产生大量气泡,但加入NaHCO3的试管中产生气泡的速度要快得多 ③不正确 (2)吸热 放热 吸热
解析 (1)②与同浓度盐酸反应时,NaHCO3比Na2CO3剧烈,产生气泡的速度快。③甲得出结论的方法不正确,因为两种粉末与盐酸的反应包括两个过程:一是粉末的溶解过程,二是在溶液中与盐酸的反应过程。(2)由表中数据①②可知,NaHCO3固体的溶解是吸热的,Na2CO3固体的溶解是放热的。分析③④两组数据可知NaHCO3饱和溶液与盐酸反应是吸热的,Na2CO3饱和溶液与盐酸反应是放热的。
5.C [根据图示可知,该反应断开化学键吸收的总能量大于形成化学键释放的总能量,为吸热反应;若生成2 mol AB2(g),则吸收热量为(E1-E2) kJ,C项正确、B项错误;该反应的进行不一定需要加热或点燃,A项错误;生成4 mol B—A键放出E2 kJ能量,D项错误。]
6.A [拆开反应物的化学键需要吸收的能量为198×6+498×3=2 682 kJ,形成生成物的化学键释放的能量为360×12=4 320 kJ,二者之差为释放能量4 320 kJ-2 682 kJ=1 638 kJ。]
7.(1)吸收 放出 (2)A (3)化学 热
解析 (1)断开化学键吸收能量,形成化学键释放能量。转化Ⅰ、Ⅱ是断开化学键的过程,吸收能量;转化Ⅲ是形成化学键的过程,放出能量。(2)由图可知,H2和F2生成HF的反应能量变化为154 kJ·mol-1+436 kJ·mol-1-2×565 kJ·mol-1=-540 kJ·mol-1,是放热反应,则反应物的总能量大于生成物的总能量,A图符合。(3)氢气在氧气中燃烧是放热反应,主要是化学能转化为热能的过程。
8.D [燃烧农作物秸秆增大二氧化碳的排放不利于“碳达峰、碳中和”的初衷,故D错误。]
9.C [2H2O===2H2↑+O2↑是吸热反应,说明2 mol H2O的能量低于2 mol H2 和1 mol O2的能量之和。因由水制取H2耗能多且H2不易贮存和运输,所以氢能源利用并未普及,但发展前景广阔。]
10.(1)需大量电能 (2)2H2(g)+O2(g)===2H2O(l) ΔH=-4Q kJ·mol-1 (3)来源丰富(H2O)、燃烧放出的热量多、产物无污染 (4)负 氧化 正 还原 2H2-4e-+4OH-===4H2O O2+4e-+2H2O===4OH-
解析 (2)标准状况下,11.2 L H2的物质的量为=0.5 mol,故2 mol H2燃烧生成液态水放出的热量为×2 mol=4Q kJ,故该反应的热化学方程式为2H2(g)+O2(g)===2H2O(l) ΔH=-4Q kJ·mol-1。
(3)H2作为“绿色能源”的优点有来源丰富、热值高、无污染。
(4)在氢氧燃料电池中,H2在负极失电子发生氧化反应,O2在正极得电子发生还原反应。若电解质为KOH溶液,则负极反应为2H2-4e-+4OH-===4H2O,正极反应为O2+4e-+2H2O===4OH-。
11.C [原电池中,负极金属失去电子,发生氧化反应而溶解,质量减小,故A极为负极,B极为正极,A、D项正确;A、B、C分别为Zn、Cu和稀盐酸时,可以构成原电池,且现象符合题意,B项正确;电解质溶液中阳离子移向正极,C项错误。]
12.B [若a、b相连时,a为负极,根据原电池的工作原理,金属活动性强的作原电池的负极,故金属的活动性顺序为a>b;c、d相连时,c为负极,所以金属的活动性顺序为c>d;a、c相连时,c为正极,所以金属的活动性顺序为a>c;b、d相连时,b是正极,所以金属的活动性顺序为d>b;则这四种金属活动性顺序为a>c>d>b。]
13.A [电池放电时,锌为负极,碱性条件下被氧化而溶解,故A正确;电池放电时,石墨为正极,正极上氧气得电子被还原,故B错误;电池放电时,锌为负极,石墨为正极,电子由锌片经导线流向石墨,故C错误;电池放电时为原电池反应,实现了化学能向电能的转化,故D错误。]
14.B [根据题干信息可知,放电时总反应为4Na+3CO2===2Na2CO3+C。负极上Na发生氧化反应失去电子生成Na+,故A错误;放电时正极上CO2得到电子生成C,故B正确;放电时阳离子移向正极,故C错误;放电时该装置为原电池,将化学能转化为电能,故D错误。]
15.(1)D (2)A (3)①PbO2+2e-+SO+4H+===PbSO4+2H2O ②增大 2 mol
解析 (1)自发进行的氧化还原反应在理论上可以设计成原电池。KOH+HCl===KCl+H2O是复分解反应,不是氧化还原反应,故A错误;Cu+Fe3+===Fe2++Cu2+中的电荷不守恒,离子方程式不正确,故B错误;Na2O+H2O===2NaOH不是氧化还原反应,故C错误;Fe+H2SO4===FeSO4+H2↑是自发进行的氧化还原反应,可以设计成原电池,故D正确。(2)图Ⅰ中发生的是锌的化学腐蚀,图Ⅱ形成铜锌原电池。图Ⅰ主要将化学能转化为热能,而图Ⅱ主要将化学能转化为电能,则图Ⅰ中温度计的示数高于图Ⅱ的示数,故A正确;由A中分析可知,图Ⅰ和图Ⅱ中温度计的示数不相等,但均高于室温,故B错误;图 Ⅱ 中铜为正极,铜棒的表面有气泡产生,故C错误;利用原电池反应可以使金属与酸的反应速率加快,故图 Ⅱ 中产生气体的速率比 Ⅰ 快,故D错误。(3)①依据放电时总反应为Pb+PbO2+2H2SO4===2PbSO4+2H2O,正极上PbO2得电子发生还原反应,生成难溶于水的PbSO4,故正极反应式为PbO2+2e-+SO+4H+===PbSO4+2H2O。②依据放电时总反应为Pb+PbO2+2H2SO4===2PbSO4+2H2O,负极上Pb失电子发生氧化反应,产生的Pb2+结合SO生成难溶于水的PbSO4,故负极质量将增大;根据总反应,当外电路上有2 mol电子通过时,溶液中消耗H2SO4的物质的量为2 mol。
16.Ⅰ.(1)a不能,b可以 a是非氧化还原反应,没有电子转移 (2)Cu Cu-2e-===Cu2+ 氧化反应 石墨棒(或Ag、铂、金等,任选一种) 2Ag++2e-===2Ag 还原反应 硝酸银溶液
Ⅱ.2H++NO+e-===NO2↑+H2O 正极(或Cu片) Al在浓硝酸中发生钝化,形成的氧化膜阻止了Al进一步反应
解析 Ⅰ.(1)能设计成原电池的化学反应必须是自发进行的氧化还原反应,否则不能设计成原电池。(2)根据Cu+2Ag+===2Ag+Cu2+可知,Cu应为负极,失电子被氧化,正极可为石墨棒、Ag等,正极上Ag+得电子生成Ag,电解质溶液为AgNO3溶液。
Ⅱ.正极上NO得电子发生还原反应,故电极反应式为2H++NO+e-===NO2↑+H2O;由图2可知t1时刻电流方向改变,说明原电池的正、负极发生变化,Al因为在浓硝酸中发生钝化不再进一步反应,则t1时刻后Cu片与浓HNO3反应,Cu片作负极,Al片作正极。
17.(1)使石墨棒表面变得粗糙,有利于吸附气体
(2)电能→化学能→电能→光能
(3)O2+4H++4e-===2H2O 正极
解析 (1)经高温火焰灼烧到红热,再迅速浸入冷水中,可以使石墨棒表面变得粗糙,有利于吸附气体。(2)根据以上分析,关闭S1,打开S2,构成电解池,电能转化为化学能;打开S1,关闭S2时,构成氢氧燃料电池,化学能转化为电能;所以整个实验过程中的能量转化形式为电能→化学能→电能→光能。(3)断开开关S1,迅速按下开关S2构成氢氧燃料电池,C2附近有氧气,是电池正极,电极反应式为O2+4H++4e-===2H2O。
一、吸热反应和放热反应
1.(2022·兰州一中高一阶段练习)已知反应A(g)+B(g)===C(g)+D(g)的能量变化如图所示,下列说法中正确的是( )
A.A(g)的能量一定低于C(g)
B.反应物断键吸收的总能量大于生成物新键形成放出的总能量
C.化学反应中的能量变化都表现为热量的变化
D.物质的能量越高,稳定性越好
2.运载火箭常使用偏二甲肼(C2H8N2)和液态四氧化二氮作推进剂,发生反应:C2H8N2+2N2O4===3N2↑+2CO2↑+4H2O。下列说法正确的是( )
A.断裂C2H8N2和N2O4中的化学键时放出能量
B.C2H8N2具有的能量高于N2具有的能量
C.反应物具有的总能量高于生成物具有的总能量
D.该反应中,C2H8N2作氧化剂
3.工业上由CO2和H2合成气态甲醇的化学方程式为CO2(g)+3H2(g)===CH3OH(g)+H2O(g),已知该反应是放热反应。下列表示合成甲醇的反应的能量变化示意图中正确的是( )
4.在两支试管中分别加入3 mL稀盐酸(均足量),将两个各装有0.3 g NaHCO3或Na2CO3粉末的小气球分别套在两支试管口(如下图)。将气球内的NaHCO3或Na2CO3同时倒入试管中。
(1)①Ⅰ试管和Ⅱ试管中分别发生反应的离子方程式:____________________________
__________________________________________________________________________;
__________________________________________________________________________。
②两支试管中的现象为______________________________________________________
__________________________________________________________________________。
③甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3粉末的试管变热。由此他得出:不管其状态如何,NaHCO3和盐酸反应为吸热反应,而Na2CO3和盐酸反应为放热反应。甲得出结论的方法是否正确?________(填“正确”或“不正确”)。
(2)为研究两反应是吸热反应还是放热反应,继续进行了下列实验(每次实验各做3次平行实验,取平均值):
序号 试剂1 试剂2 混合前温度 混合后最高或最低温度
① 50 mL水 2.5 g NaHCO3固体 20 ℃ 18.5 ℃
② 50 mL水 3.2 g Na2CO3固体 20 ℃ 23.3 ℃
③ 35 mL稀盐酸 含2.5 g NaHCO3的饱和溶液15 mL 20 ℃ 18.8 ℃
④ 35 mL稀盐酸 含3.2 g Na2CO3的饱和溶液15 mL 20 ℃ 21.2 ℃
通过上述实验可得出三条结论:
a.NaHCO3的溶解是________(填“吸热”或“放热”,下同)过程。
b.Na2CO3的饱和溶液和盐酸的反应是______反应。
c.NaHCO3的饱和溶液和盐酸的反应是________反应。
二、吸热反应和放热反应的计算
5.已知某化学反应A2(g)+2B2(g)===2AB2(g)(A2、B2、AB2的结构式分别为A===A、B—B、B—A—B),反应过程中的能量变化如图所示,下列有关叙述正确的是( )
A.该反应的进行一定需要加热或点燃
B.该反应若生成2 mol AB2(g),则放出的热量为(E1-E2) kJ
C.该反应断开化学键吸收的总能量大于形成化学键释放的总能量
D.生成2 mol B—A键放出E2 kJ能量
6.(2022·上海高一专题练习)白磷与氧气在一定条件下可以发生如下反应:P4+3O2===P4O6。已知断裂下列化学键需要吸收的能量分别为P—P键198 kJ·mol-1,P—O键360 kJ·mol-1,O==O键 498 kJ·mol-1。
根据上图所示的分子结构和有关数据,计算该反应的能量变化,正确的是( )
A.释放1 638 kJ的能量
B.吸收1 638 kJ的能量
C.释放126 kJ的能量
D.吸收126 kJ的能量
7.H2与O2、F2均能发生反应,如图为H2与F2发生反应生成HF过程中的能量变化示意图。请回答下列问题:
(1)完成转化Ⅰ、Ⅱ________(填“吸收”或“放出”,下同)能量,完成转化Ⅲ________能量。
(2)H2和F2反应的能量变化图可用________(填“A”或“B”)表示。
(3)H2在O2中燃烧的过程主要是________能转化为________能的过程。
三、能源的利用
8.(2022·大连高一期末)在第七十五届联合国大会一般性辩论上,“碳中和”被“高亮提及”。我国向国际社会作出“碳达峰、碳中和”的郑重承诺,中国将提高国家自主贡献力度,采取更加有力的政策和措施将二氧化碳排放力争于2030年前达到峰值,力争2060年前实现“碳中和”,树立了大国形象,彰显了大国担当。下列说法不正确的是( )
A.大力发展电动汽车、氢燃料电池汽车等新能源汽车
B.大力支持风电、光伏发电、生物质发电等行业健康有序发展
C.一定条件下,将CO2转化为CH3OH,实现CO2的资源化利用
D.鼓励农村居民燃烧农作物秸秆用于做饭、冬季取暖
9.为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想。
下列说法正确的是( )
A.H2O的分解反应是放热反应
B.氢能源已被普遍使用
C.2 mol H2O具有的总能量低于2 mol H2和1 mol O2具有的总能量
D.氢气不易贮存和运输,无开发利用价值
10.分析下图,回答以下问题:
(1)电解水生成H2,首先要解决的问题是_________________________________________。
(2)标准状况下,11.2 L H2燃烧生成液态的水,放出Q kJ的热量,写出该反应的热化学方程式:________________________________________________________________________。
(3)氢气作为理想的“绿色能源”的主要理由是___________________________________。
(4)氢氧燃料电池是氢能源利用的一个重要方向。氢气在________极上发生________反应,氧气在________极上发生________反应。
若电解质溶液为KOH溶液,写出正、负极上的电极反应式:
负极:_____________________________________________________________________,
正极:_____________________________________________________________________。
四、原电池的工作原理和应用
11.如图所示,电流计的指针发生偏转,同时A极的质量减小,B极上有气泡产生,C为电解质溶液,下列说法错误的是( )
A.B极为原电池的正极
B.A、B、C分别可能为Zn、Cu和稀盐酸
C.C中阳离子向A极移动
D.A极发生氧化反应
12.把a、b、c、d四种金属片浸泡在稀H2SO4中,用导线两两相连可以组成各种原电池。若a、b相连时,a为负极;c、d相连时,c为负极;a、c相连时,c为正极;b、d相连时,b为正极,则这四种金属活动性顺序由大到小为( )
A.a>b>c>d B.a>c>d>b
C.c>a>b>d D.b>d>c>a
五、化学电源和电极反应式的书写
13.锌-空气电池具有蓄电量大、循环次数多等优点。下列说法正确的是( )
A.电池放电时,Zn电极逐渐溶解
B.电池放电时,石墨为负极
C.电池放电时,电子由石墨经导线流向Zn片
D.电池放电时,实现了电能向化学能的转化
14.(2021·广东,9)火星大气中含有大量CO2,一种有CO2参加反应的新型全固态电池有望为火星探测器供电。该电池以金属钠为负极,碳纳米管为正极,放电时( )
A.负极上发生还原反应
B.CO2在正极上得电子
C.阳离子由正极移向负极
D.将电能转化为化学能
15.(2022·湖南长沙高一期中)化学电源在生产生活中有着广泛的应用。请回答下列问题:
(1)根据构成原电池的本质判断,下列化学(或离子)方程式正确且能设计成原电池的是________(填字母,下同)。
A.KOH+HCl===KCl+H2O
B.Cu+Fe3+===Fe2++Cu2+
C.Na2O+H2O===2NaOH
D.Fe+H2SO4===FeSO4 +H2↑
(2)为了探究化学反应中的能量变化,某同学设计了如下两个实验(如图)。有关反应一段时间后的实验现象,下列说法正确的是________。
A.图Ⅰ中温度计的示数高于图Ⅱ的示数
B.图Ⅰ和图Ⅱ中温度计的示数相等,且均高于室温
C.图Ⅰ和图Ⅱ的气泡均产生于锌棒表面
D.图Ⅱ中产生气体的速率比Ⅰ慢
(3)电动汽车上用的铅蓄电池是以一组海绵状铅板和另一组结构相似的充满二氧化铅的铅板组成,用H2SO4作电解质溶液。放电时总反应为Pb+PbO2+2H2SO4===2PbSO4+2H2O。
①写出放电时正极的电极反应式:_____________________________________________;
②铅蓄电池放电时,负极质量将_________(填“增大”“减小”或“不变”)。当外电路上有2 mol电子通过时,溶液中消耗H2SO4的物质的量为________。
六、原电池的综合
16.Ⅰ.现有两个反应:
a.NaOH+HCl===NaCl+H2O
b.Cu+2Ag+===2Ag+Cu2+
(1)根据两反应本质,判断它们能否设计成原电池:_______________________________
____________。如果不能,说明其原因:_______________________________________。
(2)如果可以,则写出正、负极材料,电极反应式及反应类型(“氧化反应”或“还原反应”),电解质溶液名称。
负极:________,________________,_____________。
正极:________,________________,_____________。
电解质溶液:________________________。
Ⅱ.常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示。反应过程中有红棕色气体产生。
O~t1时,原电池的负极是Al片,此时,正极的电极反应式是___________________,
溶液中的H+向________移动;t1时,原电池中电子流动方向发生改变,其原因是________________________________________________________________________。
17.某实验的实验装置如图所示,回答下列有关该实验的问题。
(1)该实验所用的石墨棒须经过预处理;先经高温火焰灼烧到红热,再迅速浸入冷水中。这种预处理的目的是______________________________________________________________。
(2)要使发光二极管发亮,实验时的操作顺序是先关闭S1,打开S2,电解一段时间后,再打开S1,关闭S2,请写出整个实验过程中的能量转化形式:____________________________。
(3)写出下列操作时的电极反应式,并注明电极名称:
①按下开关S1:C1附近发生2H2O+2e-===H2↑+2OH-的电极反应;
②断开开关S1,迅速按下开关S2:(提示:此时C1附近溶液显碱性,C2附近溶液显酸性)C2:________________________________,________。
阶段重点突破练(二)
1.B 2.C 3.A
4.(1)①HCO+H+===CO2↑+H2O CO+2H+===CO2↑+H2O ②两支试管中都产生大量气泡,但加入NaHCO3的试管中产生气泡的速度要快得多 ③不正确 (2)吸热 放热 吸热
解析 (1)②与同浓度盐酸反应时,NaHCO3比Na2CO3剧烈,产生气泡的速度快。③甲得出结论的方法不正确,因为两种粉末与盐酸的反应包括两个过程:一是粉末的溶解过程,二是在溶液中与盐酸的反应过程。(2)由表中数据①②可知,NaHCO3固体的溶解是吸热的,Na2CO3固体的溶解是放热的。分析③④两组数据可知NaHCO3饱和溶液与盐酸反应是吸热的,Na2CO3饱和溶液与盐酸反应是放热的。
5.C [根据图示可知,该反应断开化学键吸收的总能量大于形成化学键释放的总能量,为吸热反应;若生成2 mol AB2(g),则吸收热量为(E1-E2) kJ,C项正确、B项错误;该反应的进行不一定需要加热或点燃,A项错误;生成4 mol B—A键放出E2 kJ能量,D项错误。]
6.A [拆开反应物的化学键需要吸收的能量为198×6+498×3=2 682 kJ,形成生成物的化学键释放的能量为360×12=4 320 kJ,二者之差为释放能量4 320 kJ-2 682 kJ=1 638 kJ。]
7.(1)吸收 放出 (2)A (3)化学 热
解析 (1)断开化学键吸收能量,形成化学键释放能量。转化Ⅰ、Ⅱ是断开化学键的过程,吸收能量;转化Ⅲ是形成化学键的过程,放出能量。(2)由图可知,H2和F2生成HF的反应能量变化为154 kJ·mol-1+436 kJ·mol-1-2×565 kJ·mol-1=-540 kJ·mol-1,是放热反应,则反应物的总能量大于生成物的总能量,A图符合。(3)氢气在氧气中燃烧是放热反应,主要是化学能转化为热能的过程。
8.D [燃烧农作物秸秆增大二氧化碳的排放不利于“碳达峰、碳中和”的初衷,故D错误。]
9.C [2H2O===2H2↑+O2↑是吸热反应,说明2 mol H2O的能量低于2 mol H2 和1 mol O2的能量之和。因由水制取H2耗能多且H2不易贮存和运输,所以氢能源利用并未普及,但发展前景广阔。]
10.(1)需大量电能 (2)2H2(g)+O2(g)===2H2O(l) ΔH=-4Q kJ·mol-1 (3)来源丰富(H2O)、燃烧放出的热量多、产物无污染 (4)负 氧化 正 还原 2H2-4e-+4OH-===4H2O O2+4e-+2H2O===4OH-
解析 (2)标准状况下,11.2 L H2的物质的量为=0.5 mol,故2 mol H2燃烧生成液态水放出的热量为×2 mol=4Q kJ,故该反应的热化学方程式为2H2(g)+O2(g)===2H2O(l) ΔH=-4Q kJ·mol-1。
(3)H2作为“绿色能源”的优点有来源丰富、热值高、无污染。
(4)在氢氧燃料电池中,H2在负极失电子发生氧化反应,O2在正极得电子发生还原反应。若电解质为KOH溶液,则负极反应为2H2-4e-+4OH-===4H2O,正极反应为O2+4e-+2H2O===4OH-。
11.C [原电池中,负极金属失去电子,发生氧化反应而溶解,质量减小,故A极为负极,B极为正极,A、D项正确;A、B、C分别为Zn、Cu和稀盐酸时,可以构成原电池,且现象符合题意,B项正确;电解质溶液中阳离子移向正极,C项错误。]
12.B [若a、b相连时,a为负极,根据原电池的工作原理,金属活动性强的作原电池的负极,故金属的活动性顺序为a>b;c、d相连时,c为负极,所以金属的活动性顺序为c>d;a、c相连时,c为正极,所以金属的活动性顺序为a>c;b、d相连时,b是正极,所以金属的活动性顺序为d>b;则这四种金属活动性顺序为a>c>d>b。]
13.A [电池放电时,锌为负极,碱性条件下被氧化而溶解,故A正确;电池放电时,石墨为正极,正极上氧气得电子被还原,故B错误;电池放电时,锌为负极,石墨为正极,电子由锌片经导线流向石墨,故C错误;电池放电时为原电池反应,实现了化学能向电能的转化,故D错误。]
14.B [根据题干信息可知,放电时总反应为4Na+3CO2===2Na2CO3+C。负极上Na发生氧化反应失去电子生成Na+,故A错误;放电时正极上CO2得到电子生成C,故B正确;放电时阳离子移向正极,故C错误;放电时该装置为原电池,将化学能转化为电能,故D错误。]
15.(1)D (2)A (3)①PbO2+2e-+SO+4H+===PbSO4+2H2O ②增大 2 mol
解析 (1)自发进行的氧化还原反应在理论上可以设计成原电池。KOH+HCl===KCl+H2O是复分解反应,不是氧化还原反应,故A错误;Cu+Fe3+===Fe2++Cu2+中的电荷不守恒,离子方程式不正确,故B错误;Na2O+H2O===2NaOH不是氧化还原反应,故C错误;Fe+H2SO4===FeSO4+H2↑是自发进行的氧化还原反应,可以设计成原电池,故D正确。(2)图Ⅰ中发生的是锌的化学腐蚀,图Ⅱ形成铜锌原电池。图Ⅰ主要将化学能转化为热能,而图Ⅱ主要将化学能转化为电能,则图Ⅰ中温度计的示数高于图Ⅱ的示数,故A正确;由A中分析可知,图Ⅰ和图Ⅱ中温度计的示数不相等,但均高于室温,故B错误;图 Ⅱ 中铜为正极,铜棒的表面有气泡产生,故C错误;利用原电池反应可以使金属与酸的反应速率加快,故图 Ⅱ 中产生气体的速率比 Ⅰ 快,故D错误。(3)①依据放电时总反应为Pb+PbO2+2H2SO4===2PbSO4+2H2O,正极上PbO2得电子发生还原反应,生成难溶于水的PbSO4,故正极反应式为PbO2+2e-+SO+4H+===PbSO4+2H2O。②依据放电时总反应为Pb+PbO2+2H2SO4===2PbSO4+2H2O,负极上Pb失电子发生氧化反应,产生的Pb2+结合SO生成难溶于水的PbSO4,故负极质量将增大;根据总反应,当外电路上有2 mol电子通过时,溶液中消耗H2SO4的物质的量为2 mol。
16.Ⅰ.(1)a不能,b可以 a是非氧化还原反应,没有电子转移 (2)Cu Cu-2e-===Cu2+ 氧化反应 石墨棒(或Ag、铂、金等,任选一种) 2Ag++2e-===2Ag 还原反应 硝酸银溶液
Ⅱ.2H++NO+e-===NO2↑+H2O 正极(或Cu片) Al在浓硝酸中发生钝化,形成的氧化膜阻止了Al进一步反应
解析 Ⅰ.(1)能设计成原电池的化学反应必须是自发进行的氧化还原反应,否则不能设计成原电池。(2)根据Cu+2Ag+===2Ag+Cu2+可知,Cu应为负极,失电子被氧化,正极可为石墨棒、Ag等,正极上Ag+得电子生成Ag,电解质溶液为AgNO3溶液。
Ⅱ.正极上NO得电子发生还原反应,故电极反应式为2H++NO+e-===NO2↑+H2O;由图2可知t1时刻电流方向改变,说明原电池的正、负极发生变化,Al因为在浓硝酸中发生钝化不再进一步反应,则t1时刻后Cu片与浓HNO3反应,Cu片作负极,Al片作正极。
17.(1)使石墨棒表面变得粗糙,有利于吸附气体
(2)电能→化学能→电能→光能
(3)O2+4H++4e-===2H2O 正极
解析 (1)经高温火焰灼烧到红热,再迅速浸入冷水中,可以使石墨棒表面变得粗糙,有利于吸附气体。(2)根据以上分析,关闭S1,打开S2,构成电解池,电能转化为化学能;打开S1,关闭S2时,构成氢氧燃料电池,化学能转化为电能;所以整个实验过程中的能量转化形式为电能→化学能→电能→光能。(3)断开开关S1,迅速按下开关S2构成氢氧燃料电池,C2附近有氧气,是电池正极,电极反应式为O2+4H++4e-===2H2O。
