2023年中考化学沪教版(上海)专题练习--初识酸和碱(含答案)
文档属性
| 名称 | 2023年中考化学沪教版(上海)专题练习--初识酸和碱(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 213.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-08 11:44:40 | ||
图片预览



文档简介
2023年中考化学沪教版(上海)专题练习--初识酸和碱
一、单选题
1.下列有关实验现象描述正确的是( )
A.硫在氧气中燃烧产生淡蓝色火焰
B.电解水时,正、负电极上产生气体的体积比2:1
C.打开一瓶浓盐酸,瓶口会出现白色烟雾
D.镁在空气中燃烧发出耀眼白光
2.安全重于泰山,化学实验正确操作十分重要。下列操作错误的是
A.不用手接触药品不品尝药品 B.不慎将少量酸沾皮肤上应立即涂碳酸氢钠溶液
C.用完酒精灯必须用灯帽盖灭 D.实验室剩余药品不放回原瓶要放入指定容器中
3.下列物质的应用中,体现物质化学性质的是
A.生石灰做食品干燥剂 B.洗洁精乳化油污
C.稀有气体通电发光 D.分离液态空气制氧气
4.分析推理是学习化学常用的一种思维方法,下列分析推理正确的是
A.可燃物燃烧时温度必须达到其着火点,则可燃物燃烧的温度达到其着火点时一定能燃烧
B.碱性溶液能使酚酞溶液变红,则能使酚酞溶液变红的溶液一定是碱性溶液
C.用带火星的木条伸入集气瓶中木条不复燃,则集气瓶中一定不含有氧气
D.分子、原子均可以构成物质,则物质一定是由分子、原子构成的
5.下列变化中有一种变化不同于其他变化本质的是( )
A.通电氖灯发红光 B.灼烧羊毛线辨真伪
C.工业上制氧气 D.浓盐酸敞放变轻
6.下列关于化学与日常生活关系的归纳中,全部正确的是
A.化学与健康 B.化学与生活
①使用乙醇汽油——彻底杜绝空气污染 ②包装食品——可用聚氯乙烯塑料 ①保存动物标本——甲醛溶液浸泡 ②防止食品受潮——浓硫酸作干燥剂
C.化学与安全 D.化学与环境
①重金属盐中毒——喝生理盐水解毒 ②煤气泄漏——打开油烟机通风 ①加碘食盐——预防甲状腺肿大 ②含氟牙膏——预防龋齿
A.A B.B C.C D.D
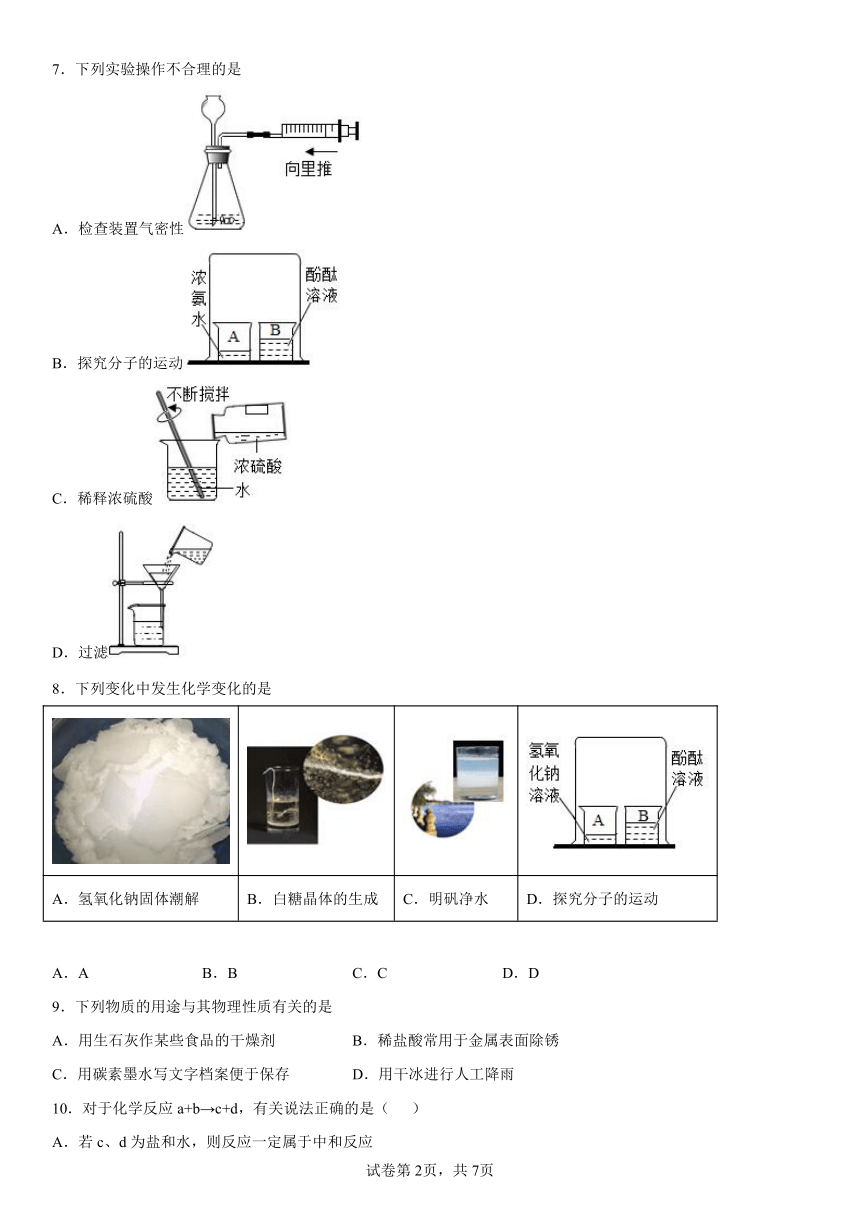
7.下列实验操作不合理的是
A.检查装置气密性
B.探究分子的运动
C.稀释浓硫酸
D.过滤
8.下列变化中发生化学变化的是
A.氢氧化钠固体潮解 B.白糖晶体的生成 C.明矾净水 D.探究分子的运动
A.A B.B C.C D.D
9.下列物质的用途与其物理性质有关的是
A.用生石灰作某些食品的干燥剂 B.稀盐酸常用于金属表面除锈
C.用碳素墨水写文字档案便于保存 D.用干冰进行人工降雨
10.对于化学反应a+b→c+d,有关说法正确的是( )
A.若c、d为盐和水,则反应一定属于中和反应
B.若c、d为单质和化合物,则反应一定为置换反应
C.若a、c均为金属,则b和d可能为可溶性盐溶液
D.若a、b为金属和盐酸,则反应后溶液的质量不一定增加
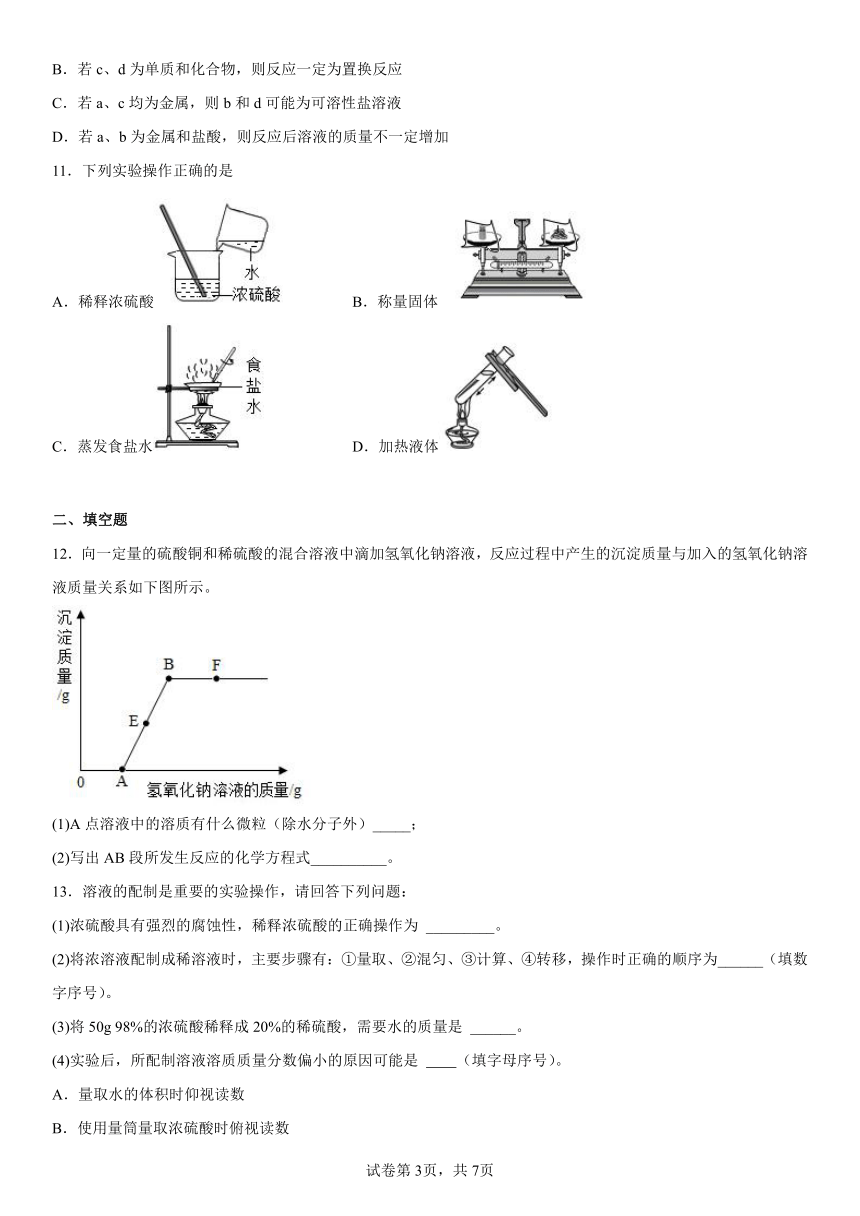
11.下列实验操作正确的是
A.稀释浓硫酸 B.称量固体
C.蒸发食盐水 D.加热液体
二、填空题
12.向一定量的硫酸铜和稀硫酸的混合溶液中滴加氢氧化钠溶液,反应过程中产生的沉淀质量与加入的氢氧化钠溶液质量关系如下图所示。
(1)A点溶液中的溶质有什么微粒(除水分子外)_____;
(2)写出AB段所发生反应的化学方程式__________。
13.溶液的配制是重要的实验操作,请回答下列问题:
(1)浓硫酸具有强烈的腐蚀性,稀释浓硫酸的正确操作为 _________。
(2)将浓溶液配制成稀溶液时,主要步骤有:①量取、②混匀、③计算、④转移,操作时正确的顺序为______(填数字序号)。
(3)将50g 98%的浓硫酸稀释成20%的稀硫酸,需要水的质量是 ______。
(4)实验后,所配制溶液溶质质量分数偏小的原因可能是 (填字母序号)。
A.量取水的体积时仰视读数
B.使用量筒量取浓硫酸时俯视读数
C.从量筒倾倒出浓硫酸时,浓硫酸洒出
D.转移配制好的溶液时,液体溅出
14.地壳中含量最高的金属元素是________________,碱具有相似的化学性质,是因为碱溶液中都含有_____________________。
15.写出下列变化的化学方程式:
(1)用稀硫酸除铁锈:_________________________________。
(2)用氯酸钾与二氧化锰混合加热制氧气:_________________________________________。
16.盐酸是一种重要的化工原料,也是实验室中重要的化学试剂,初中化学中许多实验都用到了盐酸。
(1)打开浓盐酸的试剂瓶,观察到瓶口有 ___________ 产生。下列实验中一定不会用到盐酸的是 ____________ (填序号)。
A.除去熟石灰中的石灰石 B.鉴别氯化钠和碳酸钠
C.实验室制取二氧化碳 D.除去铁钉上的锈迹
(2)用盐酸按照下图的方式进行中和反应实验,其化学反应方程式是 ___________________________ ,向烧杯中逐滴滴入盐酸至过量的过程中,能够说明盐酸与氢氧化钠发生了化学反应的实验现象是 _________________________ 。以下证明盐酸过量的操作及实验现象的叙述正确的是 _________ (填序号)。
A.滴加石蕊溶液,搅拌后溶液变蓝
B.另滴加氢氧化钠溶液,搅拌后溶液颜色不变
C.加入蒸馏水,搅拌后溶液颜色不变
D.加入金属Cu片,产生气泡
17.物质结构决定性质,性质决定用途,现象反映本质。如图是小科构建的硫酸部分知识网络,其中“一”表示相连物质能发生化学反应。
(1)石蕊试液在H2SO4溶液中显红色,该溶液中能使石蕊试液变红的离子是______;
(2)在实验室中常用浓硫酸做干燥剂,这是利用它的______。
三、推断题
18.A~G是初中化学常见的物质,其中A是一种常见的钠盐,C是大理石的主要成分,各物质间相互转化的关系如下图所示。请回答下列问题:
(1)反应④属于_______(填“放热”或“吸热”)反应。
(2)反应①的化学方程式为______。
(3)反应③的化学方程式为________。
19.如图,甲是氧化物,其中金属元素质量分数为70%;乙是黑色粉末;丙和丁是可溶性盐。反应①和②的化学方程式分别为_________________、__________________;试剂B是__________________(填化学式)溶液;反应③的发生需要氧气和水,其化学方程式为______________________。
四、实验题
20.某化学兴趣小组为探究硫酸的化学性质,进行了如下的实验(所加稀硫酸均过量)。
(1)试管A中观察到紫色石蕊试液变______色。
(2)试管B中观察到溶液由无色逐渐变成黄色,是因为反应生成了______(填化学式),一段时间后有气泡产生,写出产生气泡的化学方程式______。
(3)试管C中碳酸钠溶液发生反应的化学方程式是______。
(4)试管D中加稀硫酸至过量,则试管D中溶质含有的离子有______(填离子符号),该试管中发生反应的微观实质是______。
21.请回答下列问题
(1)现提供下列仪器和装置。
①图1所示的仪器B、D的名称为______、______,若利用锌和稀硫酸的反应制取氢气,组装制取氢气的发生装置应选用图1中的仪器______ (填字母)。
②锌与稀硫酸反应的化学方程式为______。
③若用图2所示装置测量生成H2的体积,H2应从______ (填“甲”或“乙”)管通入。
④下列混合气体(括号内气体为杂质)能用图3装置进行除杂、干燥、收集的是______(填序号)。
a O2(CO2) b CO2(HCl) c NH3(O2) d H2(HCl)
(2)实验室用氯化钠固体配制50g溶质质量分数为15%的氯化钠溶液。
①量取水,应选择______ (填“10mL”或“50mL”)量筒。
②下列操作导致氯化钠溶液的溶质质量分数偏大的是______ (填序号)。
a取用潮湿的氯化钠 b称量时,所用砝码表面已生锈
c量取水时仰视读数 d转移溶液后,烧杯内还有少量氯化钠固体
五、计算题
22.学习小组用已知浓度的氢氧化钠溶液测定某硫酸溶液的浓度。取该硫酸溶液20g,滴加10%的氢氧化钠溶液,恰好完全反应时,共消耗氢氧化钠溶液40g。计算。
(1)消耗的NaOH溶液中溶质的质量为___________g:
(2)该硫酸溶液的溶质质量分数?
23.某品牌炉具清洁剂的有效成分是氢氧化钠,化学兴趣小组的同学测定该炉具清洁剂中氢氧化钠的含量。取100 g炉具清洁剂倒入烧杯中,逐次加入质量分数为9.8%的稀硫酸,测出溶液的pH随加入稀硫酸的质量变化关系如图所示。完成下列问题:
(1)当pH=13时,溶液中所含的溶质是______(填化学式)。
(2)当恰好中和时,消耗的稀硫酸的质量为______。
(3)计算该炉具清洁剂中氢氧化钠的质量分数。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.B
3.A
4.B
5.B
6.D
7.D
8.C
9.D
10.C
11.C
12.(1)钠离子、硫酸根离子和铜离子或Na+、和Cu2+
(2)CuSO4 + 2NaOH = Cu(OH)2↓+ Na2SO4
13.(1)浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时地扩散
(2)③①④②
(3)195g
(4)ABC
14. 铝元素 氢氧根离子
15.
16. 白雾 A 溶液红色褪去 B
17.(1)氢离子H+
(2)吸水性
18. 放热
19. Fe2O3+3CO2Fe+3CO2 Fe2O3+6HCl=2FeCl3+3H2O NaOH
4Fe(OH)2+O2+2H2O=4Fe(OH)3
20.(1)红
(2)
(3)
(4) Na+、H+、 H+和结合生成H2O
21. 酒精灯 长颈漏斗 ACD 乙 d 50mL b
22.(1)4
(2)该硫酸溶液的溶质质量分数为24.5%
23.(1)Na2SO4、NaOH
(2)50 g
(3)该炉具清洁剂中氢氧化钠的质量分数为4%。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列有关实验现象描述正确的是( )
A.硫在氧气中燃烧产生淡蓝色火焰
B.电解水时,正、负电极上产生气体的体积比2:1
C.打开一瓶浓盐酸,瓶口会出现白色烟雾
D.镁在空气中燃烧发出耀眼白光
2.安全重于泰山,化学实验正确操作十分重要。下列操作错误的是
A.不用手接触药品不品尝药品 B.不慎将少量酸沾皮肤上应立即涂碳酸氢钠溶液
C.用完酒精灯必须用灯帽盖灭 D.实验室剩余药品不放回原瓶要放入指定容器中
3.下列物质的应用中,体现物质化学性质的是
A.生石灰做食品干燥剂 B.洗洁精乳化油污
C.稀有气体通电发光 D.分离液态空气制氧气
4.分析推理是学习化学常用的一种思维方法,下列分析推理正确的是
A.可燃物燃烧时温度必须达到其着火点,则可燃物燃烧的温度达到其着火点时一定能燃烧
B.碱性溶液能使酚酞溶液变红,则能使酚酞溶液变红的溶液一定是碱性溶液
C.用带火星的木条伸入集气瓶中木条不复燃,则集气瓶中一定不含有氧气
D.分子、原子均可以构成物质,则物质一定是由分子、原子构成的
5.下列变化中有一种变化不同于其他变化本质的是( )
A.通电氖灯发红光 B.灼烧羊毛线辨真伪
C.工业上制氧气 D.浓盐酸敞放变轻
6.下列关于化学与日常生活关系的归纳中,全部正确的是
A.化学与健康 B.化学与生活
①使用乙醇汽油——彻底杜绝空气污染 ②包装食品——可用聚氯乙烯塑料 ①保存动物标本——甲醛溶液浸泡 ②防止食品受潮——浓硫酸作干燥剂
C.化学与安全 D.化学与环境
①重金属盐中毒——喝生理盐水解毒 ②煤气泄漏——打开油烟机通风 ①加碘食盐——预防甲状腺肿大 ②含氟牙膏——预防龋齿
A.A B.B C.C D.D
7.下列实验操作不合理的是
A.检查装置气密性
B.探究分子的运动
C.稀释浓硫酸
D.过滤
8.下列变化中发生化学变化的是
A.氢氧化钠固体潮解 B.白糖晶体的生成 C.明矾净水 D.探究分子的运动
A.A B.B C.C D.D
9.下列物质的用途与其物理性质有关的是
A.用生石灰作某些食品的干燥剂 B.稀盐酸常用于金属表面除锈
C.用碳素墨水写文字档案便于保存 D.用干冰进行人工降雨
10.对于化学反应a+b→c+d,有关说法正确的是( )
A.若c、d为盐和水,则反应一定属于中和反应
B.若c、d为单质和化合物,则反应一定为置换反应
C.若a、c均为金属,则b和d可能为可溶性盐溶液
D.若a、b为金属和盐酸,则反应后溶液的质量不一定增加
11.下列实验操作正确的是
A.稀释浓硫酸 B.称量固体
C.蒸发食盐水 D.加热液体
二、填空题
12.向一定量的硫酸铜和稀硫酸的混合溶液中滴加氢氧化钠溶液,反应过程中产生的沉淀质量与加入的氢氧化钠溶液质量关系如下图所示。
(1)A点溶液中的溶质有什么微粒(除水分子外)_____;
(2)写出AB段所发生反应的化学方程式__________。
13.溶液的配制是重要的实验操作,请回答下列问题:
(1)浓硫酸具有强烈的腐蚀性,稀释浓硫酸的正确操作为 _________。
(2)将浓溶液配制成稀溶液时,主要步骤有:①量取、②混匀、③计算、④转移,操作时正确的顺序为______(填数字序号)。
(3)将50g 98%的浓硫酸稀释成20%的稀硫酸,需要水的质量是 ______。
(4)实验后,所配制溶液溶质质量分数偏小的原因可能是 (填字母序号)。
A.量取水的体积时仰视读数
B.使用量筒量取浓硫酸时俯视读数
C.从量筒倾倒出浓硫酸时,浓硫酸洒出
D.转移配制好的溶液时,液体溅出
14.地壳中含量最高的金属元素是________________,碱具有相似的化学性质,是因为碱溶液中都含有_____________________。
15.写出下列变化的化学方程式:
(1)用稀硫酸除铁锈:_________________________________。
(2)用氯酸钾与二氧化锰混合加热制氧气:_________________________________________。
16.盐酸是一种重要的化工原料,也是实验室中重要的化学试剂,初中化学中许多实验都用到了盐酸。
(1)打开浓盐酸的试剂瓶,观察到瓶口有 ___________ 产生。下列实验中一定不会用到盐酸的是 ____________ (填序号)。
A.除去熟石灰中的石灰石 B.鉴别氯化钠和碳酸钠
C.实验室制取二氧化碳 D.除去铁钉上的锈迹
(2)用盐酸按照下图的方式进行中和反应实验,其化学反应方程式是 ___________________________ ,向烧杯中逐滴滴入盐酸至过量的过程中,能够说明盐酸与氢氧化钠发生了化学反应的实验现象是 _________________________ 。以下证明盐酸过量的操作及实验现象的叙述正确的是 _________ (填序号)。
A.滴加石蕊溶液,搅拌后溶液变蓝
B.另滴加氢氧化钠溶液,搅拌后溶液颜色不变
C.加入蒸馏水,搅拌后溶液颜色不变
D.加入金属Cu片,产生气泡
17.物质结构决定性质,性质决定用途,现象反映本质。如图是小科构建的硫酸部分知识网络,其中“一”表示相连物质能发生化学反应。
(1)石蕊试液在H2SO4溶液中显红色,该溶液中能使石蕊试液变红的离子是______;
(2)在实验室中常用浓硫酸做干燥剂,这是利用它的______。
三、推断题
18.A~G是初中化学常见的物质,其中A是一种常见的钠盐,C是大理石的主要成分,各物质间相互转化的关系如下图所示。请回答下列问题:
(1)反应④属于_______(填“放热”或“吸热”)反应。
(2)反应①的化学方程式为______。
(3)反应③的化学方程式为________。
19.如图,甲是氧化物,其中金属元素质量分数为70%;乙是黑色粉末;丙和丁是可溶性盐。反应①和②的化学方程式分别为_________________、__________________;试剂B是__________________(填化学式)溶液;反应③的发生需要氧气和水,其化学方程式为______________________。
四、实验题
20.某化学兴趣小组为探究硫酸的化学性质,进行了如下的实验(所加稀硫酸均过量)。
(1)试管A中观察到紫色石蕊试液变______色。
(2)试管B中观察到溶液由无色逐渐变成黄色,是因为反应生成了______(填化学式),一段时间后有气泡产生,写出产生气泡的化学方程式______。
(3)试管C中碳酸钠溶液发生反应的化学方程式是______。
(4)试管D中加稀硫酸至过量,则试管D中溶质含有的离子有______(填离子符号),该试管中发生反应的微观实质是______。
21.请回答下列问题
(1)现提供下列仪器和装置。
①图1所示的仪器B、D的名称为______、______,若利用锌和稀硫酸的反应制取氢气,组装制取氢气的发生装置应选用图1中的仪器______ (填字母)。
②锌与稀硫酸反应的化学方程式为______。
③若用图2所示装置测量生成H2的体积,H2应从______ (填“甲”或“乙”)管通入。
④下列混合气体(括号内气体为杂质)能用图3装置进行除杂、干燥、收集的是______(填序号)。
a O2(CO2) b CO2(HCl) c NH3(O2) d H2(HCl)
(2)实验室用氯化钠固体配制50g溶质质量分数为15%的氯化钠溶液。
①量取水,应选择______ (填“10mL”或“50mL”)量筒。
②下列操作导致氯化钠溶液的溶质质量分数偏大的是______ (填序号)。
a取用潮湿的氯化钠 b称量时,所用砝码表面已生锈
c量取水时仰视读数 d转移溶液后,烧杯内还有少量氯化钠固体
五、计算题
22.学习小组用已知浓度的氢氧化钠溶液测定某硫酸溶液的浓度。取该硫酸溶液20g,滴加10%的氢氧化钠溶液,恰好完全反应时,共消耗氢氧化钠溶液40g。计算。
(1)消耗的NaOH溶液中溶质的质量为___________g:
(2)该硫酸溶液的溶质质量分数?
23.某品牌炉具清洁剂的有效成分是氢氧化钠,化学兴趣小组的同学测定该炉具清洁剂中氢氧化钠的含量。取100 g炉具清洁剂倒入烧杯中,逐次加入质量分数为9.8%的稀硫酸,测出溶液的pH随加入稀硫酸的质量变化关系如图所示。完成下列问题:
(1)当pH=13时,溶液中所含的溶质是______(填化学式)。
(2)当恰好中和时,消耗的稀硫酸的质量为______。
(3)计算该炉具清洁剂中氢氧化钠的质量分数。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.B
3.A
4.B
5.B
6.D
7.D
8.C
9.D
10.C
11.C
12.(1)钠离子、硫酸根离子和铜离子或Na+、和Cu2+
(2)CuSO4 + 2NaOH = Cu(OH)2↓+ Na2SO4
13.(1)浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时地扩散
(2)③①④②
(3)195g
(4)ABC
14. 铝元素 氢氧根离子
15.
16. 白雾 A 溶液红色褪去 B
17.(1)氢离子H+
(2)吸水性
18. 放热
19. Fe2O3+3CO2Fe+3CO2 Fe2O3+6HCl=2FeCl3+3H2O NaOH
4Fe(OH)2+O2+2H2O=4Fe(OH)3
20.(1)红
(2)
(3)
(4) Na+、H+、 H+和结合生成H2O
21. 酒精灯 长颈漏斗 ACD 乙 d 50mL b
22.(1)4
(2)该硫酸溶液的溶质质量分数为24.5%
23.(1)Na2SO4、NaOH
(2)50 g
(3)该炉具清洁剂中氢氧化钠的质量分数为4%。
答案第1页,共2页
答案第1页,共2页
