人教版化学九下第十单元课题1 常见的酸和碱(第一课时)课件(共34张PPT)
文档属性
| 名称 | 人教版化学九下第十单元课题1 常见的酸和碱(第一课时)课件(共34张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 4.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-08 20:33:35 | ||
图片预览





文档简介
(共34张PPT)
第十单元 酸和碱
课题1 常见的酸和碱(第一课时)
人教版 化学 九年级 下册
哪些水果有酸味?你知道这些水果为什么会有酸味吗?
苹果
葡萄
橙子
柠檬
生活中发现的酸和碱
“碱”一词在阿拉伯语中表示灰。人们将草木灰放到水中,利用灰汁洗浴、印染等。
“酸”一词从有酸味的酒而来。最早,在制酒的时候,有时把比较珍贵的酒放在窖中保存,在微生物的作用下,产生了酸。
资料卡片
1. 认识和使用常见的酸碱指示剂:石蕊溶液和酚酞溶液,知道它们遇酸、碱的变色情况。
2.认识盐酸和硫酸的主要性质及用途。
3. 通过对几种常见的酸的化学性质的探究比较,初步学会从特殊到一般思维的认识规律。
学习目标
酸、碱与指示剂的作用
知识点 1
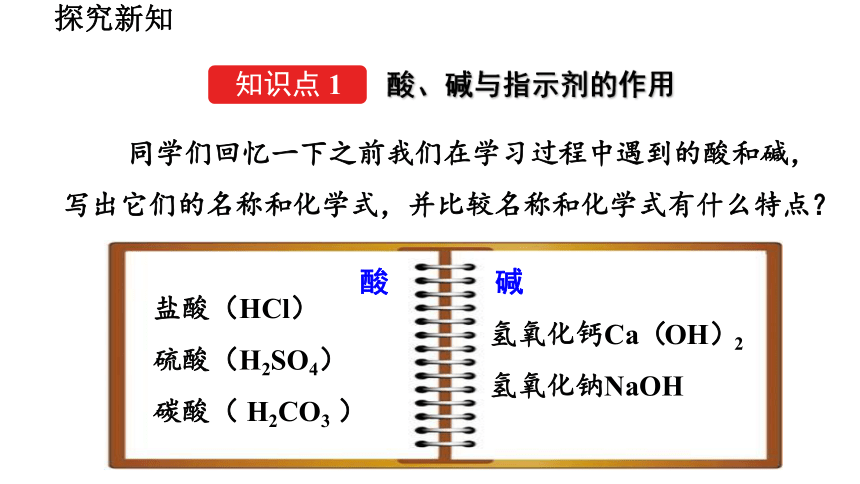
同学们回忆一下之前我们在学习过程中遇到的酸和碱,写出它们的名称和化学式,并比较名称和化学式有什么特点?
盐酸(HCl)
硫酸(H2SO4)
碳酸( H2CO3 )
氢氧化钙Ca(OH)2
氢氧化钠NaOH
酸
碱
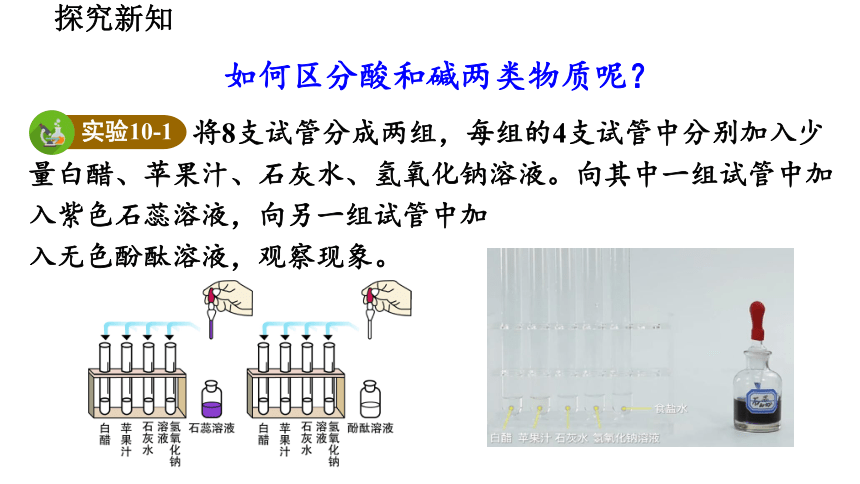
将8支试管分成两组,每组的4支试管中分别加入少量白醋、苹果汁、石灰水、氢氧化钠溶液。向其中一组试管中加入紫色石蕊溶液,向另一组试管中加
入无色酚酞溶液,观察现象。
实验10-1
如何区分酸和碱两类物质呢?
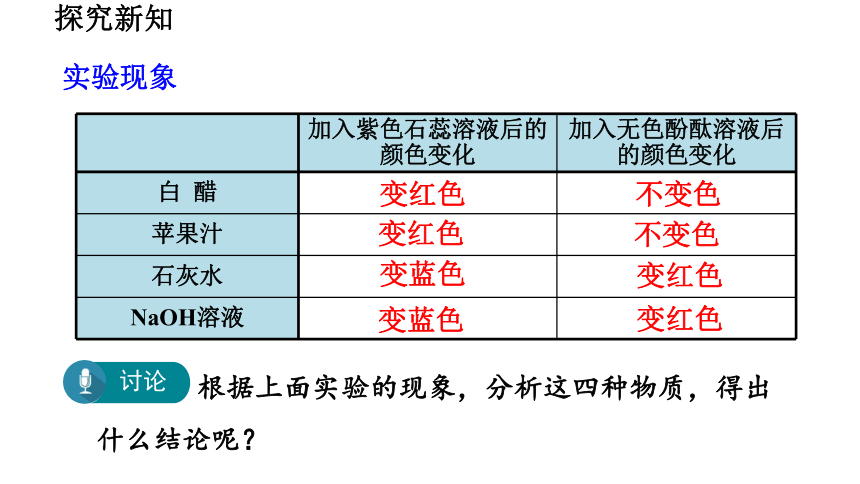
实验现象
加入紫色石蕊溶液后的颜色变化 加入无色酚酞溶液后的颜色变化
白 醋
苹果汁
石灰水
NaOH溶液
变红色
不变色
变蓝色
变红色
不变色
变蓝色
变红色
变红色
根据上面实验的现象,分析这四种物质,得出什么结论呢?
讨论
酸碱指示剂
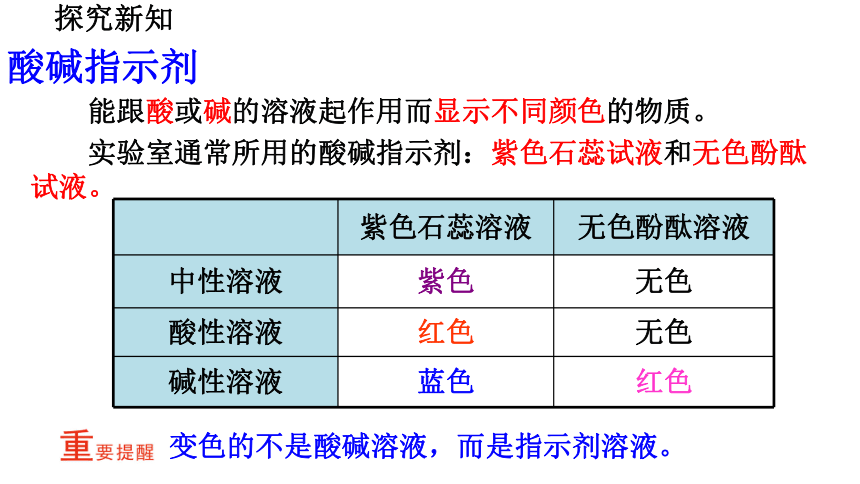
紫色石蕊溶液 无色酚酞溶液
中性溶液 紫色 无色
酸性溶液 红色 无色
碱性溶液 蓝色 红色
能跟酸或碱的溶液起作用而显示不同颜色的物质。
实验室通常所用的酸碱指示剂:紫色石蕊试液和无色酚酞试液。
变色的不是酸碱溶液,而是指示剂溶液。
资料卡片
酸碱指示剂的发现
英国科学家波义尔在一次实验中不慎将浓盐酸溅到一束紫罗兰花的花瓣上,喜爱花的他马上进行冲洗,一会儿却发现紫色的花瓣变红了。惊奇的他没有放过这一偶然的发现,而是进行了进一步的实验和思考。结果发现,许多种植物花瓣的浸出液遇到酸性溶液或碱性溶液都能变色,其中变色效果最好的是地衣类植物——石蕊。这就是最早使用的酸碱指示剂。之后,人们从地衣类植物中提取蓝色粉末状的石蕊色素,制成了酸碱指示剂。
自制酸碱指示剂
(1)取几种植物的花瓣或果实(如牵牛花、月季花等),分别在研钵中捣烂,加入酒精(乙醇与水的体积比为1:1)浸泡;
(2)用纱布将浸泡出的汁液过滤或挤出,得到指示剂;
(3)试验指示剂在下表内4种溶液中的颜色变化。
【活动·探究】
【活动·探究】
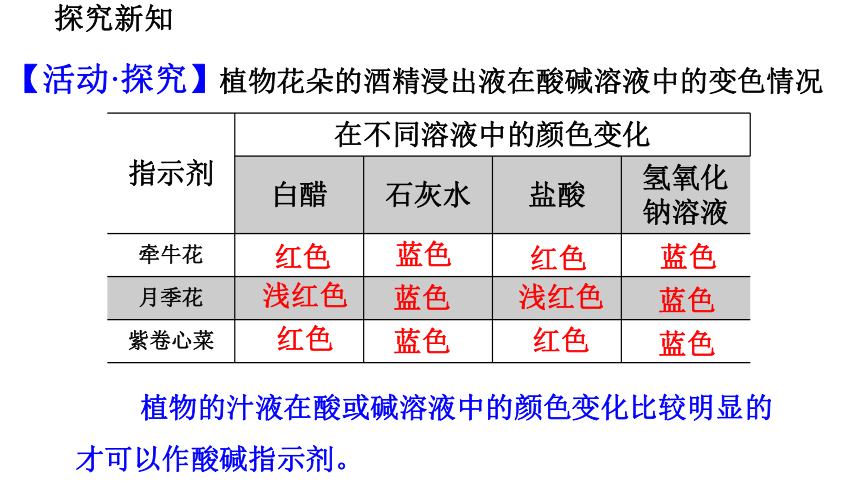
指示剂 在不同溶液中的颜色变化 白醋 石灰水 盐酸 氢氧化钠溶液
牵牛花
月季花
紫卷心菜
植物花朵的酒精浸出液在酸碱溶液中的变色情况
红色
浅红色
红色
蓝色
蓝色
蓝色
红色
浅红色
红色
蓝色
蓝色
蓝色
植物的汁液在酸或碱溶液中的颜色变化比较明显的才可以作酸碱指示剂。
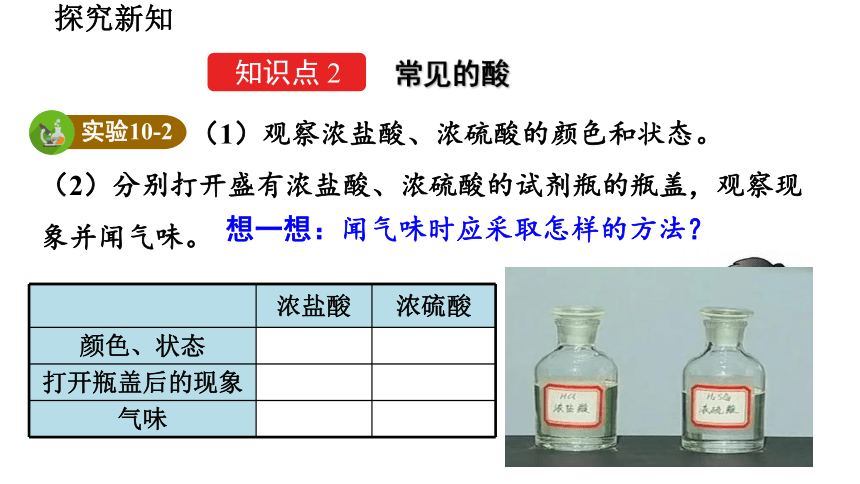
(1)观察浓盐酸、浓硫酸的颜色和状态。
(2)分别打开盛有浓盐酸、浓硫酸的试剂瓶的瓶盖,观察现象并闻气味。
知识点 2
常见的酸
实验10-2
正确闻气味的方法
浓盐酸 浓硫酸
颜色、状态
打开瓶盖后的现象
气味
想一想:闻气味时应采取怎样的方法?
浓盐酸 浓硫酸
颜色、状态
打开瓶盖后的现象
气味
吸水性 无 具有吸水性
无色液体
无色、粘稠的油状液体
在空气中会形成白雾(挥发性)
不易挥发
有刺激性气味
无味
注意:盐酸有“挥发性”,瓶口出现白雾是挥发出来的氯化氢气体遇到空气中的水蒸气形成盐酸小液滴。
敞口久置于空气中的浓硫酸和浓盐酸,各成分怎样变化?
溶质质量 溶剂质量 溶液质量 溶质质量分数
浓盐酸
浓硫酸
减小
不变
减小
减小
不变
增大
增大
减小
讨论
实验室和工业生产中常用的酸除了盐酸、硫酸,还有硝酸(HNO3)、醋酸(CH3COOH)。另外,生活中常见的许多物质中也含有酸。
资料卡片
食醋中含有醋酸
柠檬、柑橘等水果中含有柠檬酸
铅酸蓄电池中含有硫酸
实验 放置一会儿后的现象
将浓硫酸滴到滤纸上
将浓硫酸滴到小木条上
将浓硫酸滴到一小块纱布上
滤纸变黑破损
小木条蘸有浓硫酸的部位变黑
纱布变黑破损
将白纸、木棍、布条放在玻璃片上做下列实验。
实验10-3
浓硫酸的腐蚀性
注意:(1)吸水性是物理性质,而腐蚀性是化学性质。
(2)如果不慎将浓硫酸沾到皮肤或衣服上,应立即用大量水冲洗,然后涂上3%~5%的碳酸氢钠溶液。
浓硫酸有强烈的腐蚀性。它能夺取纸张、木材、皮肤(都由含碳、氢、氧等元素的化合物组成)里的水分,生成黑色的炭。
浓硫酸的稀释:
在稀释浓硫酸时,一定要
把浓硫酸沿器壁慢慢注入水里,
并不断搅拌。
切不可将水倒入浓硫酸。
知识点 3
酸的化学性质
【活动·探究】 酸的化学性质
1. 在稀盐酸和稀硫酸中分别滴加紫色石蕊溶液和酚酞溶液,观察现象。
滴加紫色石蕊溶液 滴加无色酚酞溶液
稀盐酸
稀硫酸
变红
变红
无色
无色
酸能使紫色的石蕊溶液变红,不能使无色酚酞溶液变色。
2. 回忆前面学习的镁、锌、铁与稀盐酸或稀硫酸反应的现象,并写出化学方程式。
与稀盐酸反应 与稀硫酸反应
镁
锌
铁
有气泡产生,固体逐渐减少
有气泡产生,固体逐渐减少
有气泡产生
有气泡产生
有气泡产生,溶液变为浅绿色
有气泡产生,溶液变为浅绿色
与稀盐酸反应 与稀硫酸反应
镁
锌
铁
Mg+2HCl=MgCl2+H2↑
Zn+2HCl=ZnCl2+H2↑
Fe+2HCl=FeCl2+H2↑
Mg+H2SO4=MgSO4+H2↑
Zn+H2SO4=ZnSO4+H2↑
Fe+H2SO4=FeSO4+H2↑
讨论
上面反应的生成物有什么共同之处?
H2
3. 在盛有稀盐酸和稀硫酸的试管里分别放入一根生锈(铁锈的主要成分是Fe2O3)的铁钉,过一会儿取出,用水洗净,铁钉表面和溶液颜色有什么变化?
现象 化学方程式
铁锈+盐酸
铁锈+硫酸
Fe2O3+6HCl = 2FeCl3+3H2O
Fe2O3+3H2SO4 = Fe2(SO4)3+3H2O
铁锈溶解,溶液由无色变为黄色
都生成+3价的铁盐和水。
不能。
当铁钉表面的铁锈被清除完,酸将与铁发生反应。
如盐酸:Fe+2HCl=FeCl2+H2↑
注:含有Fe3+的溶液显黄色。
讨论
①上面反应的生成物有什么共同之处?
②上述反应,除锈时能否将铁制品长期浸在酸中?为什么?
4.根据上述实验和讨论,归纳出盐酸、硫酸等酸具有哪些相似的化学性质。
酸能使酸碱指示剂显示不同的颜色,如酸溶液使紫色的石蕊溶液变红,使无色酚酞溶液不变色。
酸能与活泼金属反应,产生氢气。利用此性质在实验室可用酸来制备氢气。
酸能与某些金属氧化物反应,生成水。利用此性质可用稀盐酸或稀硫酸来除锈。
用 途
盐 酸 HCl 重要化工产品。用于金属表面除锈、制造药物(如盐酸麻黄素、氯化锌)等;人体胃液中有盐酸,可帮助消化。
硫 酸 H2SO4 重要化工原料。用于生产化肥、农药、火药、染料以及冶炼金属、精炼石油和金属除锈等。
浓硫酸有吸水性,在实验室中常用它做干燥剂。(不能干燥氨气)
盐酸、硫酸的用途
1.下图是物质X溶于水中发生解离的微观示意图,其中能说明X是一种酸的是( )
C
基础巩固题
2.下列有关酸的说法正确的是( )
A.盐酸能使紫色石蕊试液变蓝
B.浓硫酸露置于空气中,溶质质量分数变大
C.露置于空气中的浓硫酸,其成分不会发生变化
D.打开浓盐酸的试剂瓶,瓶口会产生白雾
D
基础巩固题
3.假设与排除是探索未知物的一种方法。《本草纲目拾遗》中记载:“强水性最烈,能蚀五金(金、银、铜、铅、铁 )”,下列物质最可能是“强水 ”的是( )
A. 硫酸亚铁溶液 B. 稀盐酸
C. 浓硝酸和浓盐酸的混合物 D. 稀硫酸
C
基础巩固题
4.化学变化多姿多彩,美丽如花。图中甲、乙、丙、X分别是我们已经学过的一种物质,甲、乙、丙均能与X发生反应,若X是稀盐酸,则甲、乙、丙不可能是下列物质中的( )
A.Cu B.Fe2O3
C.Fe D.CaCO3
A
基础巩固题
5.如下图所示,在白色点滴板1~6的孔穴中,分别滴加2滴紫色石蕊溶液。
(1)孔穴4中溶液变为蓝色,说明
碳酸钾溶液显 (填“酸性”或
“碱性”)。
(2)溶液变为红色的孔穴有 (填孔穴序号,下同)。
(3) 作为空白对照实验的孔穴是 。
碱性
2、5
3
基础巩固题
能力提升题
1.下列关于H2SO4性质描述中,不属于酸的通性的是( )
A.使紫色石蕊溶液变红
B.与氧化铁反应生成黄色溶液
C.浓硫酸滴到白纸上使纸变黑
D.与Mg反应放出氢气
C
能力提升题
2.氧化铜与稀盐酸发生反应时,容器中溶液总质量随时间的变化曲线如图所示。下列说法错误的是( )
C
A.该实验是将稀盐酸逐渐加入
到盛有氧化铜的容器中
B.n点表示氧化铜与稀盐酸恰
好完全反应
C.m点和n点对应溶液中铜元素的质量不相等
D.m点和n点对应溶液蒸发结晶后得到的固体成分相同
能力提升题
3.如图化学反应的溶液颜色变化体现了“魔法世界,魅力化学”,请回答:
(1)溶液X是 (填“酸”或“碱”),
试剂A的名称是 。
(2)若X是稀硫酸,B是氧化物,则B的化学式
为 。
(3)若X是稀盐酸,C是单质,则C与X反应的化学方程式是 。
酸
紫色石蕊试液
Fe2O3
Fe+2HCl═FeCl2+H2↑
酸碱指示剂
常见的酸
盐酸和硫酸
石蕊、酚酞
①盐酸与硫酸的物理性质
② 浓硫酸腐蚀性
③浓硫酸的稀释
① 与酸碱指示剂反应
② 酸 + 活泼金属 → 盐 + 氢气
③ 酸 + 金属氧化物 →盐 + 水
酸的化学性质
课堂小结
第十单元 酸和碱
课题1 常见的酸和碱(第一课时)
人教版 化学 九年级 下册
哪些水果有酸味?你知道这些水果为什么会有酸味吗?
苹果
葡萄
橙子
柠檬
生活中发现的酸和碱
“碱”一词在阿拉伯语中表示灰。人们将草木灰放到水中,利用灰汁洗浴、印染等。
“酸”一词从有酸味的酒而来。最早,在制酒的时候,有时把比较珍贵的酒放在窖中保存,在微生物的作用下,产生了酸。
资料卡片
1. 认识和使用常见的酸碱指示剂:石蕊溶液和酚酞溶液,知道它们遇酸、碱的变色情况。
2.认识盐酸和硫酸的主要性质及用途。
3. 通过对几种常见的酸的化学性质的探究比较,初步学会从特殊到一般思维的认识规律。
学习目标
酸、碱与指示剂的作用
知识点 1
同学们回忆一下之前我们在学习过程中遇到的酸和碱,写出它们的名称和化学式,并比较名称和化学式有什么特点?
盐酸(HCl)
硫酸(H2SO4)
碳酸( H2CO3 )
氢氧化钙Ca(OH)2
氢氧化钠NaOH
酸
碱
将8支试管分成两组,每组的4支试管中分别加入少量白醋、苹果汁、石灰水、氢氧化钠溶液。向其中一组试管中加入紫色石蕊溶液,向另一组试管中加
入无色酚酞溶液,观察现象。
实验10-1
如何区分酸和碱两类物质呢?
实验现象
加入紫色石蕊溶液后的颜色变化 加入无色酚酞溶液后的颜色变化
白 醋
苹果汁
石灰水
NaOH溶液
变红色
不变色
变蓝色
变红色
不变色
变蓝色
变红色
变红色
根据上面实验的现象,分析这四种物质,得出什么结论呢?
讨论
酸碱指示剂
紫色石蕊溶液 无色酚酞溶液
中性溶液 紫色 无色
酸性溶液 红色 无色
碱性溶液 蓝色 红色
能跟酸或碱的溶液起作用而显示不同颜色的物质。
实验室通常所用的酸碱指示剂:紫色石蕊试液和无色酚酞试液。
变色的不是酸碱溶液,而是指示剂溶液。
资料卡片
酸碱指示剂的发现
英国科学家波义尔在一次实验中不慎将浓盐酸溅到一束紫罗兰花的花瓣上,喜爱花的他马上进行冲洗,一会儿却发现紫色的花瓣变红了。惊奇的他没有放过这一偶然的发现,而是进行了进一步的实验和思考。结果发现,许多种植物花瓣的浸出液遇到酸性溶液或碱性溶液都能变色,其中变色效果最好的是地衣类植物——石蕊。这就是最早使用的酸碱指示剂。之后,人们从地衣类植物中提取蓝色粉末状的石蕊色素,制成了酸碱指示剂。
自制酸碱指示剂
(1)取几种植物的花瓣或果实(如牵牛花、月季花等),分别在研钵中捣烂,加入酒精(乙醇与水的体积比为1:1)浸泡;
(2)用纱布将浸泡出的汁液过滤或挤出,得到指示剂;
(3)试验指示剂在下表内4种溶液中的颜色变化。
【活动·探究】
【活动·探究】
指示剂 在不同溶液中的颜色变化 白醋 石灰水 盐酸 氢氧化钠溶液
牵牛花
月季花
紫卷心菜
植物花朵的酒精浸出液在酸碱溶液中的变色情况
红色
浅红色
红色
蓝色
蓝色
蓝色
红色
浅红色
红色
蓝色
蓝色
蓝色
植物的汁液在酸或碱溶液中的颜色变化比较明显的才可以作酸碱指示剂。
(1)观察浓盐酸、浓硫酸的颜色和状态。
(2)分别打开盛有浓盐酸、浓硫酸的试剂瓶的瓶盖,观察现象并闻气味。
知识点 2
常见的酸
实验10-2
正确闻气味的方法
浓盐酸 浓硫酸
颜色、状态
打开瓶盖后的现象
气味
想一想:闻气味时应采取怎样的方法?
浓盐酸 浓硫酸
颜色、状态
打开瓶盖后的现象
气味
吸水性 无 具有吸水性
无色液体
无色、粘稠的油状液体
在空气中会形成白雾(挥发性)
不易挥发
有刺激性气味
无味
注意:盐酸有“挥发性”,瓶口出现白雾是挥发出来的氯化氢气体遇到空气中的水蒸气形成盐酸小液滴。
敞口久置于空气中的浓硫酸和浓盐酸,各成分怎样变化?
溶质质量 溶剂质量 溶液质量 溶质质量分数
浓盐酸
浓硫酸
减小
不变
减小
减小
不变
增大
增大
减小
讨论
实验室和工业生产中常用的酸除了盐酸、硫酸,还有硝酸(HNO3)、醋酸(CH3COOH)。另外,生活中常见的许多物质中也含有酸。
资料卡片
食醋中含有醋酸
柠檬、柑橘等水果中含有柠檬酸
铅酸蓄电池中含有硫酸
实验 放置一会儿后的现象
将浓硫酸滴到滤纸上
将浓硫酸滴到小木条上
将浓硫酸滴到一小块纱布上
滤纸变黑破损
小木条蘸有浓硫酸的部位变黑
纱布变黑破损
将白纸、木棍、布条放在玻璃片上做下列实验。
实验10-3
浓硫酸的腐蚀性
注意:(1)吸水性是物理性质,而腐蚀性是化学性质。
(2)如果不慎将浓硫酸沾到皮肤或衣服上,应立即用大量水冲洗,然后涂上3%~5%的碳酸氢钠溶液。
浓硫酸有强烈的腐蚀性。它能夺取纸张、木材、皮肤(都由含碳、氢、氧等元素的化合物组成)里的水分,生成黑色的炭。
浓硫酸的稀释:
在稀释浓硫酸时,一定要
把浓硫酸沿器壁慢慢注入水里,
并不断搅拌。
切不可将水倒入浓硫酸。
知识点 3
酸的化学性质
【活动·探究】 酸的化学性质
1. 在稀盐酸和稀硫酸中分别滴加紫色石蕊溶液和酚酞溶液,观察现象。
滴加紫色石蕊溶液 滴加无色酚酞溶液
稀盐酸
稀硫酸
变红
变红
无色
无色
酸能使紫色的石蕊溶液变红,不能使无色酚酞溶液变色。
2. 回忆前面学习的镁、锌、铁与稀盐酸或稀硫酸反应的现象,并写出化学方程式。
与稀盐酸反应 与稀硫酸反应
镁
锌
铁
有气泡产生,固体逐渐减少
有气泡产生,固体逐渐减少
有气泡产生
有气泡产生
有气泡产生,溶液变为浅绿色
有气泡产生,溶液变为浅绿色
与稀盐酸反应 与稀硫酸反应
镁
锌
铁
Mg+2HCl=MgCl2+H2↑
Zn+2HCl=ZnCl2+H2↑
Fe+2HCl=FeCl2+H2↑
Mg+H2SO4=MgSO4+H2↑
Zn+H2SO4=ZnSO4+H2↑
Fe+H2SO4=FeSO4+H2↑
讨论
上面反应的生成物有什么共同之处?
H2
3. 在盛有稀盐酸和稀硫酸的试管里分别放入一根生锈(铁锈的主要成分是Fe2O3)的铁钉,过一会儿取出,用水洗净,铁钉表面和溶液颜色有什么变化?
现象 化学方程式
铁锈+盐酸
铁锈+硫酸
Fe2O3+6HCl = 2FeCl3+3H2O
Fe2O3+3H2SO4 = Fe2(SO4)3+3H2O
铁锈溶解,溶液由无色变为黄色
都生成+3价的铁盐和水。
不能。
当铁钉表面的铁锈被清除完,酸将与铁发生反应。
如盐酸:Fe+2HCl=FeCl2+H2↑
注:含有Fe3+的溶液显黄色。
讨论
①上面反应的生成物有什么共同之处?
②上述反应,除锈时能否将铁制品长期浸在酸中?为什么?
4.根据上述实验和讨论,归纳出盐酸、硫酸等酸具有哪些相似的化学性质。
酸能使酸碱指示剂显示不同的颜色,如酸溶液使紫色的石蕊溶液变红,使无色酚酞溶液不变色。
酸能与活泼金属反应,产生氢气。利用此性质在实验室可用酸来制备氢气。
酸能与某些金属氧化物反应,生成水。利用此性质可用稀盐酸或稀硫酸来除锈。
用 途
盐 酸 HCl 重要化工产品。用于金属表面除锈、制造药物(如盐酸麻黄素、氯化锌)等;人体胃液中有盐酸,可帮助消化。
硫 酸 H2SO4 重要化工原料。用于生产化肥、农药、火药、染料以及冶炼金属、精炼石油和金属除锈等。
浓硫酸有吸水性,在实验室中常用它做干燥剂。(不能干燥氨气)
盐酸、硫酸的用途
1.下图是物质X溶于水中发生解离的微观示意图,其中能说明X是一种酸的是( )
C
基础巩固题
2.下列有关酸的说法正确的是( )
A.盐酸能使紫色石蕊试液变蓝
B.浓硫酸露置于空气中,溶质质量分数变大
C.露置于空气中的浓硫酸,其成分不会发生变化
D.打开浓盐酸的试剂瓶,瓶口会产生白雾
D
基础巩固题
3.假设与排除是探索未知物的一种方法。《本草纲目拾遗》中记载:“强水性最烈,能蚀五金(金、银、铜、铅、铁 )”,下列物质最可能是“强水 ”的是( )
A. 硫酸亚铁溶液 B. 稀盐酸
C. 浓硝酸和浓盐酸的混合物 D. 稀硫酸
C
基础巩固题
4.化学变化多姿多彩,美丽如花。图中甲、乙、丙、X分别是我们已经学过的一种物质,甲、乙、丙均能与X发生反应,若X是稀盐酸,则甲、乙、丙不可能是下列物质中的( )
A.Cu B.Fe2O3
C.Fe D.CaCO3
A
基础巩固题
5.如下图所示,在白色点滴板1~6的孔穴中,分别滴加2滴紫色石蕊溶液。
(1)孔穴4中溶液变为蓝色,说明
碳酸钾溶液显 (填“酸性”或
“碱性”)。
(2)溶液变为红色的孔穴有 (填孔穴序号,下同)。
(3) 作为空白对照实验的孔穴是 。
碱性
2、5
3
基础巩固题
能力提升题
1.下列关于H2SO4性质描述中,不属于酸的通性的是( )
A.使紫色石蕊溶液变红
B.与氧化铁反应生成黄色溶液
C.浓硫酸滴到白纸上使纸变黑
D.与Mg反应放出氢气
C
能力提升题
2.氧化铜与稀盐酸发生反应时,容器中溶液总质量随时间的变化曲线如图所示。下列说法错误的是( )
C
A.该实验是将稀盐酸逐渐加入
到盛有氧化铜的容器中
B.n点表示氧化铜与稀盐酸恰
好完全反应
C.m点和n点对应溶液中铜元素的质量不相等
D.m点和n点对应溶液蒸发结晶后得到的固体成分相同
能力提升题
3.如图化学反应的溶液颜色变化体现了“魔法世界,魅力化学”,请回答:
(1)溶液X是 (填“酸”或“碱”),
试剂A的名称是 。
(2)若X是稀硫酸,B是氧化物,则B的化学式
为 。
(3)若X是稀盐酸,C是单质,则C与X反应的化学方程式是 。
酸
紫色石蕊试液
Fe2O3
Fe+2HCl═FeCl2+H2↑
酸碱指示剂
常见的酸
盐酸和硫酸
石蕊、酚酞
①盐酸与硫酸的物理性质
② 浓硫酸腐蚀性
③浓硫酸的稀释
① 与酸碱指示剂反应
② 酸 + 活泼金属 → 盐 + 氢气
③ 酸 + 金属氧化物 →盐 + 水
酸的化学性质
课堂小结
同课章节目录
