专题6 第二单元 第1课时 放热反应与吸热反应 热化学方程式 课件(共81张PPT)
文档属性
| 名称 | 专题6 第二单元 第1课时 放热反应与吸热反应 热化学方程式 课件(共81张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-08 15:47:10 | ||
图片预览










文档简介
(共81张PPT)
第1课时
DIYIKESHI
放热反应与吸热反应 / 热化学方程式 / 随堂演练 知识落实 / 课时对点练
放热反应与吸热反应 热化学方程式
专题6
核心素养
发展目标
1.知道化学反应可以实现化学能与热能的转化,认识吸热和放热反应。
2.知道热化学方程式与普通化学方程式的不同,能正确书写热化学方程式。
内容索引
一、放热反应与吸热反应
二、热化学方程式
随堂演练 知识落实
课时对点练
放热反应与吸热反应
一
1.化学反应中的热量变化
(1)化学反应过程中能量转化形式
化学反应中不仅有物质的转变,同时还伴随着 的变化。化学反应中比较常见的是化学能与热能、电能、光能等的互相转化。
能量
(2)放热反应和吸热反应
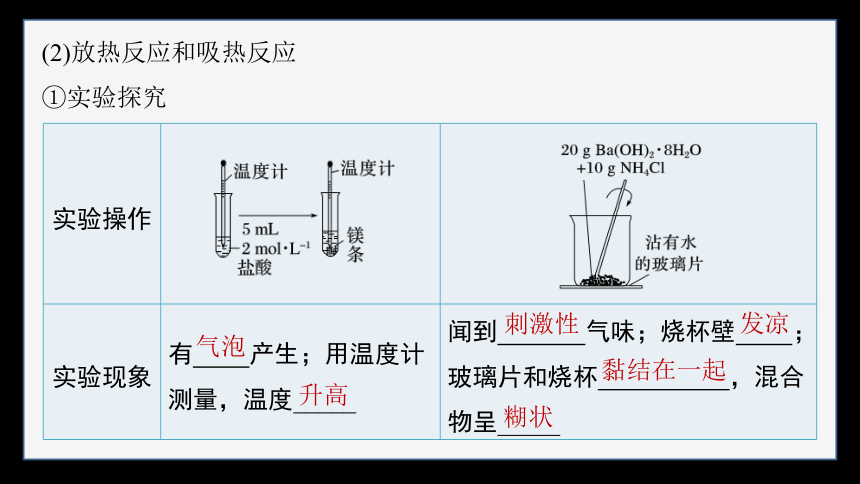
①实验探究
实验操作
实验现象 有 产生;用温度计测量,温度_____ 闻到 气味;烧杯壁 ;玻璃片和烧杯 ,混合物呈_____
气泡
升高
刺激性
发凉
黏结在一起
糊状
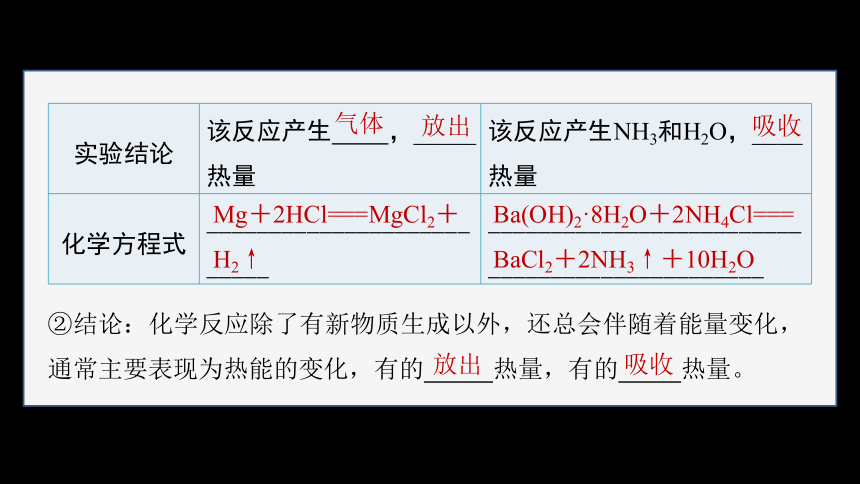
实验结论 该反应产生 ,_____ 热量 该反应产生NH3和H2O,____
热量
化学方程式 __________________________ _______________________________________________
气体
放出
Mg+2HCl===MgCl2+
H2↑
吸收
Ba(OH)2·8H2O+2NH4Cl===
BaCl2+2NH3↑+10H2O
②结论:化学反应除了有新物质生成以外,还总会伴随着能量变化,通常主要表现为热能的变化,有的 热量,有的 热量。
放出
吸收
2.放热反应与吸热反应
(1)概念
①放热反应: 热的反应。
②吸热反应: 热的反应。
放出
吸收
(2)常见的放热反应和吸热反应
放热反应 吸热反应
①所有燃烧反应 ②酸碱中和反应 ③大多数化合反应 ④活泼金属跟水或酸的反应 ⑤物质的缓慢氧化 ①大多数分解反应
②铵盐与碱的反应,如Ba(OH)2·8H2O或Ca(OH)2与NH4Cl反应
③以C、H2、CO为还原剂的氧化还原反应,如C与H2O(g)反应,C与CO2反应
④NaHCO3与盐酸的反应
正误判断
(1)硝酸铵固体溶于水,溶液的温度降低,该变化为吸热反应( )
(2)氢气燃烧,浓硫酸溶于水,都放出热量,这些变化都为放热反应( )
(3)镁条在空气中燃烧是放热反应,反应过程中所释放的能量全部转化为热能( )
(4)吸热反应需要加热才能进行,放热反应都不需要加热就可以进行( )
(5)火药爆炸时所释放的能量包括热、光、声、机械能等多种能量形式
( )
×
×
×
×
√
化学兴趣小组的同学在开展研究性学习时,做了一个有关物质溶解和物质发生化学反应过程中能量变化的探究实验,装置如图所示。
深度思考
已知:小试管A、B中分别盛有两种不同的无色液体,U形管内均为滴有红墨水的水。
(1)若试管A中的无色液体是稀硫酸,向A试管中加入铁粉,可以观察到的实验现象是什么?
深度思考
提示 看到试管A中产生大量无色气泡,且U形管a、b两端液面的变化是a端液面下降,b端液面上升。
(2)产生图1中的现象的原因是什么?
深度思考
提示 铁粉与稀硫酸反应放热,致使瓶内气体膨胀,瓶内气压大于外界气压,从而将U形管中的红色墨水压往U形管的右侧。
(3)若试管B中的无色液体是水,向试管B中加入一种固体,且U形管的a、b两端液面的变化与图1相同,则所加固体可能是什么(从冰、氧化钙、氢氧化钠、硝酸铵、干冰五种物质中选择)
深度思考
提示 氧化钙或氢氧化钠(由于U形管的a、b两端液面的变化与图1相同,则加入水的物质应该是溶于水或与水反应放热的物质)。
(4)若试管B中的液体是NaOH溶液,若加入酸性溶液,U形管的a、b两端液面的变化与图1相同吗?
深度思考
提示 相同
应用体验
1.下列说法正确的是
①需要加热才能发生的反应一定是吸热反应 ②放热反应在常温下一定很容易发生 ③放热反应的逆向反应为吸热反应 ④放热反应加热到一定温度引发后,停止加热反应可能会继续进行
A.③④ B.①②
C.①②③④ D.②③④
√
需加热才能发生的反应不一定是吸热反应,如木炭燃烧反应;放热反应在常温下不一定容易发生,如木炭燃烧反应;某反应为放热反应,则该反应的逆向反应为吸热反应;由于放热反应在反应过程中放出热量,所以停止加热后反应可能会继续进行。
2.下列反应中,既属于氧化还原反应同时又属于吸热反应的是
A.CaCO3的分解反应
B.灼热的炭与CO2反应
C.铝与稀盐酸反应
D.稀H2SO4与稀KOH的反应
√
CaCO3的分解反应属于非氧化还原反应,故A不选;
灼热的炭与CO2反应生成CO,反应为氧化还原反应,同时为吸热反应,故B选;
铝与稀盐酸的反应属于氧化还原反应,但属于放热反应,故C不选;
稀H2SO4与稀KOH的反应属于非氧化还原反应,同时属于放热反应,故D不选。
归纳总结
有关放热反应和吸热反应理解的三个“不一定”
(1)放热反应不一定容易发生,如合成氨反应需要在高温、高压和催化剂作用下才能发生;吸热反应不一定难发生,如Ba(OH)2·8H2O晶体与NH4Cl晶体的反应在常温下就能发生。
(2)需要加热才能发生的反应不一定是吸热反应,如硫与铁的反应;吸热反应不一定需要加热,如Ba(OH)2·8H2O晶体和NH4Cl晶体的反应。
归纳总结
(3)放热过程不一定是放热反应,如NaOH固体的溶解和浓硫酸的稀释是放热过程,但不是放热反应;吸热过程不一定是吸热反应,如升华、蒸发等过程是吸热过程,但不是吸热反应。
返回
热化学方程式
二
1.概念
能表示化学反应中 的热量的化学方程式。
放出或吸收
2.书写——“三字诀”
放
吸
例如,已知1 mol C(s)与1 mol O2(g)完全反应生成1 mol CO2(g)放出393.6 kJ热量,则该反应的热化学方程式为_______________________
。
C(s)+O2(g)===CO2(g)
ΔH=-393.6 kJ·mol-1
已知SO2和O2反应生成4 mol SO3时放出的热量为Q kJ,那么2 mol SO2和1 mol O2在一有催化剂的密闭容器中发生反应时,放出的热量___(填“>”“=”或“<”) Q kJ。
深度思考
<
正误判断
(1)CaCO3(g)===CaO+CO2(g) ΔH=178.2 kJ( )
(2)C(s)+H2O(g)===CO(g)+H2(g) ΔH=-131.3 kJ·mol-1( )
×
×
√
√
应用体验
1.热化学方程式中的物质要注明状态,原因是
A.能描述出反应发生的现象
B.为了区别一般的化学方程式
C.说明反应条件
D.物质呈现的状态与反应热有关
√
在化学反应中,反应的能量变化与物质的聚集状态有关,如:液体水和气态水具有不同的能量,所以书写热化学方程式要注明物质的聚集状态,故选D。
2.胶状液氢(主要成分是H2和CH4)有望用于未来的运载火箭和空间运输系统。实验测得:101 kPa时,1 mol H2完全燃烧生成液态水,放出285.8 kJ的热量;1 mol CH4完全燃烧生成液态水和CO2,放出890.3 kJ的热量。下列热化学方程式书写正确的是
A.CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=890.3 kJ·mol-1
B.CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
C.CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ
D.2H2+O2===2H2O ΔH=-285.8 kJ·mol-1
√
CH4燃烧为放热反应,ΔH<0,A错误;
1 mol CH4完全燃烧生成液态水和CO2,放出890.3 kJ的热量,则热化学方程式为CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1,B正确;
热化学方程式中ΔH的单位应该为kJ·mol-1,C错误;
没有标明各物质的聚集状态,D错误。
3.写出298 K时,下列反应的热化学方程式:
(1)1 mol HgO(s)分解为液态汞和氧气,吸热90.7 kJ:_________________
___________________________________________________________________________。
2HgO(s)===2Hg(l)
90.7 kJ·mol-1]
(2)16 g固体硫完全燃烧时放出148.4 kJ的热量:_______________________
_____________________________________________________________。
ΔH=-148.4 kJ·mol-1[或S(s)+O2(g)===SO2(g) ΔH=-296.8 kJ·mol-1]
(3)2.00 g C2H2气体完全燃烧生成液态水和CO2,放出99.6 kJ的热量:
_______________________________________________________。
归纳总结
热化学方程式的书写方法
(1)遵循一般化学方程式的书写规则(一般不写反应条件)。
(2)要注明反应物和生成物的状态。
(3)在右端注明ΔH的符号(正号常省略)、大小及单位。
(4)化学计量数只表示物质的量,因此可以是整数,也可以是分数。化学计量数改变,ΔH的数值要相应改变。
返回
随堂演练 知识落实
1.(2022·天津高一检测)下列说法正确的是
A.有发光、放热现象的变化就是燃烧
B.在化学反应中只有燃烧能放出热量
C.有些化学反应会吸收热量
D.人类利用的能量都是通过燃烧获得的
√
1
2
3
4
5
1
2
3
4
5
电灯泡发光,并无新物质的生成,属于物理变化,而不属于燃烧,故A错误;
在化学反应中除燃烧能放出热量外,还有:金属与水或酸反应,酸碱中和反应,大部分的化合反应也会放热,故B错误;
大部分的分解反应,碳和二氧化碳反应,碳和高温水蒸气反应,碳酸钙的分解反应等均吸热,故C正确;
人类利用的能量不完全是通过燃烧获得的,比如水能、风能、地热能、海洋能等就不是通过燃烧而获得的能量,故D错误。
2.已知石墨在一定条件下转化成金刚石是吸热反应,由此可得出的正确结论是
A.石墨比金刚石更稳定
B.金刚石比石墨更稳定
C.石墨转化成金刚石是物理变化
D.石墨和金刚石的结构相同
√
1
2
3
4
5
能量越低越稳定,石墨在一定条件下转化成金刚石是吸热反应,说明金刚石能量高,所以石墨比金刚石更稳定,故A正确、B错误;
石墨转化成金刚石,生成了新物质,属于化学变化,故C错误;
石墨和金刚石是两种不同的碳的单质,它们结构不相同,故D错误。
1
2
3
4
5
3.已知在1×105 Pa、298 K条件下,2 mol氢气燃烧生成水蒸气放出484 kJ热量,下列热化学方程式正确的是
A.H2O(g)===H2(g)+ O2(g) ΔH=242 kJ·mol-1
B.2H2(g)+O2(g)===2H2O(l) ΔH=-484 kJ·mol-1
C.H2(g)+ O2(g)===H2O(g) ΔH=242 kJ·mol-1
D.2H2(g)+O2(g)===2H2O(g) ΔH=484 kJ·mol-1
1
2
3
4
5
√
1
2
3
4
5
2 mol氢气燃烧生成水蒸气放出484 kJ热量,则1 mol氢气燃烧生成水蒸气应放出 ×484 kJ=242 kJ热量,放出热量ΔH为“-”,各物质的状态分别是H2(g)、O2(g)、H2O(g);
B项中H2O的状态应为气态;
C、D两项中ΔH的符号应为“-”;
A项是逆向进行的反应,ΔH为正值,数值为2 mol H2燃烧放热数值的一半,书写正确,故应选A项。
4.下列各组热化学方程式中,化学反应的ΔH前者大于后者的是
①C(s)+O2(g)===CO2(g) ΔH1
C(s)+ O2(g)===CO(g) ΔH2
②S(s)+O2(g)===SO2(g) ΔH3
S(g)+O2(g)===SO2(g) ΔH4
③H2(g)+ O2(g)===H2O(l) ΔH5
2H2(g)+O2(g)===2H2O(l) ΔH6
④CaCO3(s)===CaO(s)+CO2(g) ΔH7
CaO(s)+H2O(l)===Ca(OH)2(s) ΔH8
A.仅① B.仅④ C.②③④ D.①②③
1
2
3
4
5
√
碳与氧气反应放热,即ΔH1<0,ΔH2<0,等量的碳完全燃烧生成CO2放出的热多于不完全燃烧生成CO放出的热,所以ΔH1<ΔH2;等量的固态硫变为气态硫时吸收热,故在与O2作用产生同样多的SO2(g)时,气态硫放出的热多,即ΔH3>ΔH4;发生同样的燃烧反应,物质的量越多,放出的热越多,故ΔH5>ΔH6;碳酸钙分解吸收热,ΔH7>0,CaO与H2O反应放出热,ΔH8<0,显然ΔH7>ΔH8。
1
2
3
4
5
1
2
3
4
5
5.除了用手触摸和温度计测量外还可以借助其他方法感知温度的变化,如在探究化学反应过程中有热量变化时,某兴趣小组设计了右面三套装置:
(1)该小组选择装置Ⅰ探究Na2O2和H2O反应为放热反应,将水滴入盛有过氧化钠的试管中,现象为__________________________________,化学方程式:_____________________________。
U形管右侧液面下降,左侧液面上升
2Na2O2+2H2O===4NaOH+O2↑
1
2
3
4
5
(2)该小组选择装置Ⅱ探究硝酸铵溶于水的能量变化,当向盛有硝酸铵固体的试管中滴入少量水,发现导管中上升一段水柱,则该变化______(填“是”或“不是”)吸热反应,原因为____________________
_____________________。
不是
硝酸铵溶于水没有新
物质生成,为物理变化
1
2
3
4
5
(3)该小组在探究镁和盐酸反应热量变化时,选择了装置Ⅲ,发现反应过程中,导管口有气泡冒出,该装置______(填“能”或“不能”)证明镁和盐酸反应为放热反应,原因为_______________________________
_____________________________________________。
不能
镁和盐酸反应生成氢气,无论是吸
热反应还是放热反应,烧杯中导管口都有气泡冒出
返回
课时对点练
题组一 化学反应与能量变化的关系
1.(2022·上海浦东高一期中)下列对于化学反应过程的理解,错误的是
A.化学反应过程中同时存在物质和能量的变化
B.凡是能量变化一定发生在化学变化中
C.化学反应中同时存在质量守恒和能量守恒
D.能量的释放和吸收以发生变化的物质为基础
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
化学反应过程中都会伴随着物质变化和能量变化,A正确;
化学变化过程中往往伴随着能量的变化,而有能量变化时不一定发生化学变化,如灯泡通电发光放热,B错误;
化学反应的实质是原子的重新组合,符合质量守恒定律;反应过程中往往伴随着能量的变化,符合能量守恒定律,C正确;
化学反应过程中同时存在物质和能量的变化,且能量的释放和吸收是以发生变化的物质为基础的,二者密不可分,D正确。
2.下列关于化学反应中能量变化的说法正确的是
A.煤的燃烧过程是放热过程
B.可逆反应进行的过程中没有能量变化
C.在常温下可以发生的反应一定是放热反应
D.化学反应中能量变化的大小与反应物的质量多少无关
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
3.下列属于吸热反应的是
A.气态水液化为液态水 B.高温分解石灰石
C.氢氧化钠和盐酸反应 D.氢气在氯气中燃烧
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
气态水液化为液态水是一个放热过程,属于物理变化,故A错误;
高温分解石灰石是一个吸热反应,故B正确;
氢氧化钠和盐酸反应为中和反应,属于放热反应,故C错误;
氢气在氯气中燃烧生成氯化氢的反应为放热反应,故D错误。
题组二 吸热反应与放热反应
4.(2022·安徽淮北高二期末)下列物质间能量的变化与如图所示相符的是
A.盐酸与碳酸氢钠的反应
B.氮气与氧气生成一氧化氮的反应
C.氢氧化钡与氯化铵的反应
D.铝片与盐酸的反应
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
图示为稀释浓硫酸,为放热过程;盐酸与碳酸氢钠的反应、氮气与氧气生成一氧化氮的反应、氢氧化钡与氯化铵的反应均为吸热反应,铝片与盐酸的反应为放热反应。
5.(2022·南京高一检测)为了探究化学反应的能量变化情况,某同学设计了如图装置,向盛有A试剂的试管中滴加B试剂时,看到U形管中,甲处液面上升,乙处液面下降,则A试剂和B试剂为
A.金属钠和水
B.碳酸氢钠和盐酸
C.生石灰和水
D.氢氧化钠和硝酸
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
金属钠和水反应,生石灰和水反应,氢氧化钠和硝酸反应,都为放热反应,现象应为甲处液面下降,乙处液面上升,与题意不符,故A、C、D错误;
NaHCO3和盐酸反应为吸热反应,温度降低,试剂瓶中
气体压强降低,U形管中甲处液面上升,乙处液面下降,故B正确。
6.“即食即热型”快餐适合外出时携带和食用,其内层中有用铝箔包裹的已加工好的真空包装食品,外层有分别包装的两包化学物质,拉动预留在外的拉线使这两种化学物质相互作用,放出的热量便可对食物进行加热。这两包化学物质最合理的组合是
A.浓硫酸和水 B.生石灰和水
C.熟石灰和水 D.氯化钠和水
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
选项中只有浓硫酸与水、生石灰和水相互作用是明显放热的,但浓硫酸为腐蚀品,不适用于食物加热,且浓硫酸与水混合所得的稀硫酸能与铝箔反应,故不适用。
7.(2022·洛阳高一期中)下列反应或变化过程放热的个数为
①Ba(OH)2晶体与NH4Cl晶体反应 ②硫酸和氢氧化钠溶液混合 ③硫受热融化 ④灼热的炭和二氧化碳反应生成一氧化碳 ⑤生石灰和水反应生成熟石灰 ⑥镁条在氮气中燃烧
A.3个 B.2个
C.5个 D.4个
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
①Ba(OH)2晶体与NH4Cl晶体反应是吸热反应,故不选;
②硫酸和氢氧化钠溶液混合放出热量,是放热反应,故选;
③硫受热融化,为吸热变化,故不选;
④灼热的炭和二氧化碳反应生成一氧化碳,为吸热反应,故不选;
⑤生石灰和水反应生成熟石灰,为放热反应,故选;
⑥镁条在氮气中燃烧是燃烧反应,为放热反应,故选;故选A。
题组三 热化学方程式的意义与书写
8.下列说法正确的是
A.书写热化学方程式时,只要在化学方程式的右端写上热量的符号和
数值即可
B.凡是在加热或点燃条件下进行的反应都是吸热反应
C.表明反应所放出或吸收热量的化学方程式叫做热化学方程式
D.氢气在氧气中燃烧的热化学方程式是2H2(g)+O2(g)===2H2O(g)
ΔH=-483.6 kJ
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
A项中要标明物质的状态;
B项中C在O2中燃烧是放热反应;
D项中ΔH的单位是kJ·mol-1。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
9.下列对热化学方程式 H2(g)+ I2(g)===HI(g) ΔH=-9 kJ·mol-1的叙述中,正确的是
A.1 mol氢气和1 mol碘蒸气完全反应需要吸收9 kJ热量
B.1个氢分子和1个碘分子完全反应需要放出9 kJ的热量
C.1 mol H2(g)与1 mol I2(g)完全反应生成2 mol的HI气体放出18 kJ的热量
D.1 mol H2(g)与1 mol I2(g)完全反应吸收18 kJ的热量
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
热化学方程式的具体形式是表示一定物质的量、一定聚集状态的反应物完全反应生成一定聚集状态的生成物时的放热或吸热情况。只要依据书写热化学方程式的注意事项,对于本题就不难作出判断。
10.1 g氢气在氧气中燃烧生成液态水,放出142.9 kJ的热量,表示该反应的热化学方程式是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
由1 g氢气燃烧生成液态水放出142.9 kJ的热量可知,1 mol H2燃烧生成液态水放出285.8 kJ的热量,故该反应ΔH=-285.8 kJ·mol-1。
11.下列实验现象中,不能说明相应的化学反应是放热反应的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
选项 A B C D
实验装置
实验现象 温度计的示数增大 反应开始后,气球慢慢胀大 反应开始后,甲侧液面低于乙侧液面 反应开始后,针筒活塞向右移动
√
12.下列说法或表示方法正确的是
A.等物质的量的硫蒸气和硫固体分别完全燃烧生成SO2气体,放出的热量
一样多
B.12 g石墨转化为CO时,放出110.5 kJ热量:2C(石墨,s)+O2(g)===2CO(g)
ΔH=-110.5 kJ·mol-1
C.已知:H2(g)+ O2(g)===H2O(l) ΔH1,H2(g)+ O2(g)===H2O(g) ΔH2,
则ΔH1<ΔH2
D.已知:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,则相同条件下,
在密闭容器中,1 mol N2和3 mol H2混合充分反应后放出92.4 kJ的热量
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
因为硫蒸气转化为硫固体放出能量,因此等物质的量的硫蒸气和硫固体分别完全燃烧生成SO2气体时,硫蒸气放出的热量大于硫固体,故A错误;
两反应反应物化学计量数及状态相同,生成的产物也相同,只是生成物的状态不同,由于H2O(g)转化为H2O(l)要放热,故生成H2O(l)放出的热量多,即ΔH1<ΔH2,故C正确;
该反应为可逆反应,不能完全进行到底,因此相同条件下,在密闭容器中,1 mol N2和3 mol H2混合充分反应后放出的热量小于92.4 kJ,故D错误。
13.在25 ℃、101 kPa下,1 g乙醇燃烧生成CO2和液态水时放热29.71 kJ,下列热化学方程式正确的是
A.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l) ΔH=1 366.66 kJ·mol-1
B.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l) ΔH=-1 366.66 kJ·mol-1
D.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l) ΔH=-29.71 kJ·mol-1
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
乙醇燃烧是放热反应,ΔH的符号应为“-”,A不正确;
1 g C2H5OH燃烧放出29.71 kJ热量,则1 mol(46 g)C2H5OH燃烧放出的热量为1 366.66 kJ。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
14.根据日常生活和回忆已学化学反应,对下列变化按吸热或放热的标准分类:
①钠投入水中 ②煅烧石灰石制生石灰 ③食物腐烂 ④炸药爆炸 ⑤氢气在氯气中燃烧 ⑥生石灰与水作用制熟石灰 ⑦碳与水蒸气制取水煤气(CO和H2) ⑧硫酸与氢氧化钠的中和反应 ⑨氦气球受热爆炸
(1)属于放热反应的有_______________(填序号,下同)。
(2)属于吸热反应的有______。
①③④⑤⑥⑧
②⑦
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
15.化学在能源开发与利用中起着十分关键的作用。
(1)0.3 mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5 kJ热量,其热化学方程式为____________
______________________________________________。
B2H6(g)+
3O2(g)===B2O3(s)+3H2O(l) ΔH=-2 165 kJ·mol-1
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(2)家用液化气中主要成分之一是丁烷。当1 g丁烷(C4H10)完全燃烧并生成CO2和液态水时,放出热量50 kJ。试写出丁烷燃烧的热化学方程式:
________________________________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
16.为了探究化学能与热能的转化,某实验小组设计了如图所示的三套实验装置:
(1)上述3个装置中,不能验证“铜与浓硝酸的反应是吸热反应还是放热反应”的装置是______(填装置序号)。
Ⅲ
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
装置Ⅰ可通过U形管中红墨水液面的变化判断铜与浓硝酸的反应是放热反应还是吸热反应;装置Ⅱ可通过烧杯中是否产生气泡判断铜与浓硝酸的反应是放热反应还是吸热反应;装置Ⅲ只是一个铜与浓硝酸反应并将生成的气体用水吸收的装置,不能验证该反应是放热反应还是吸热反应。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(2)某同学选用装置Ⅰ进行实验(实验前U形管里液面左右相平),在试管中加入适量Ba(OH)2溶液与稀硫酸,U形管中可观察到的现象是______
_____________________________,说明该反应属于_____(填“吸热”或“放热”)反应。
U形管
内左端液面降低,右端液面升高
放热
Ba(OH)2溶液与稀硫酸的反应属于中和反应,中和反应都是放热反应。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(3)为探究固体M溶于水的热效应,选择装置Ⅱ进行实验(反应在甲试管中进行)。
①若M为钠,则实验过程中烧杯中可观察到的现象是_______________
_________________________________________________________。
导气管口处产生
气泡,反应完毕后,冷却至室温,烧杯中的导管内形成一段水柱
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
②若观察到烧杯中产生气泡,则说明M溶于水________________(填“一定是放热反应”“一定是吸热反应”或“可能是放热反应”),理由是________________________________________________。
可能是放热反应
某些物质(如NaOH固体)溶于水放热,但不是放热反应
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
返回
NaOH固体、硝酸铵等溶于水时有热量的变化,但发生的是物理变化,不属于化学反应,故不是放热或吸热反应。
本课结束
专题6
第1课时
DIYIKESHI
放热反应与吸热反应 / 热化学方程式 / 随堂演练 知识落实 / 课时对点练
放热反应与吸热反应 热化学方程式
专题6
核心素养
发展目标
1.知道化学反应可以实现化学能与热能的转化,认识吸热和放热反应。
2.知道热化学方程式与普通化学方程式的不同,能正确书写热化学方程式。
内容索引
一、放热反应与吸热反应
二、热化学方程式
随堂演练 知识落实
课时对点练
放热反应与吸热反应
一
1.化学反应中的热量变化
(1)化学反应过程中能量转化形式
化学反应中不仅有物质的转变,同时还伴随着 的变化。化学反应中比较常见的是化学能与热能、电能、光能等的互相转化。
能量
(2)放热反应和吸热反应
①实验探究
实验操作
实验现象 有 产生;用温度计测量,温度_____ 闻到 气味;烧杯壁 ;玻璃片和烧杯 ,混合物呈_____
气泡
升高
刺激性
发凉
黏结在一起
糊状
实验结论 该反应产生 ,_____ 热量 该反应产生NH3和H2O,____
热量
化学方程式 __________________________ _______________________________________________
气体
放出
Mg+2HCl===MgCl2+
H2↑
吸收
Ba(OH)2·8H2O+2NH4Cl===
BaCl2+2NH3↑+10H2O
②结论:化学反应除了有新物质生成以外,还总会伴随着能量变化,通常主要表现为热能的变化,有的 热量,有的 热量。
放出
吸收
2.放热反应与吸热反应
(1)概念
①放热反应: 热的反应。
②吸热反应: 热的反应。
放出
吸收
(2)常见的放热反应和吸热反应
放热反应 吸热反应
①所有燃烧反应 ②酸碱中和反应 ③大多数化合反应 ④活泼金属跟水或酸的反应 ⑤物质的缓慢氧化 ①大多数分解反应
②铵盐与碱的反应,如Ba(OH)2·8H2O或Ca(OH)2与NH4Cl反应
③以C、H2、CO为还原剂的氧化还原反应,如C与H2O(g)反应,C与CO2反应
④NaHCO3与盐酸的反应
正误判断
(1)硝酸铵固体溶于水,溶液的温度降低,该变化为吸热反应( )
(2)氢气燃烧,浓硫酸溶于水,都放出热量,这些变化都为放热反应( )
(3)镁条在空气中燃烧是放热反应,反应过程中所释放的能量全部转化为热能( )
(4)吸热反应需要加热才能进行,放热反应都不需要加热就可以进行( )
(5)火药爆炸时所释放的能量包括热、光、声、机械能等多种能量形式
( )
×
×
×
×
√
化学兴趣小组的同学在开展研究性学习时,做了一个有关物质溶解和物质发生化学反应过程中能量变化的探究实验,装置如图所示。
深度思考
已知:小试管A、B中分别盛有两种不同的无色液体,U形管内均为滴有红墨水的水。
(1)若试管A中的无色液体是稀硫酸,向A试管中加入铁粉,可以观察到的实验现象是什么?
深度思考
提示 看到试管A中产生大量无色气泡,且U形管a、b两端液面的变化是a端液面下降,b端液面上升。
(2)产生图1中的现象的原因是什么?
深度思考
提示 铁粉与稀硫酸反应放热,致使瓶内气体膨胀,瓶内气压大于外界气压,从而将U形管中的红色墨水压往U形管的右侧。
(3)若试管B中的无色液体是水,向试管B中加入一种固体,且U形管的a、b两端液面的变化与图1相同,则所加固体可能是什么(从冰、氧化钙、氢氧化钠、硝酸铵、干冰五种物质中选择)
深度思考
提示 氧化钙或氢氧化钠(由于U形管的a、b两端液面的变化与图1相同,则加入水的物质应该是溶于水或与水反应放热的物质)。
(4)若试管B中的液体是NaOH溶液,若加入酸性溶液,U形管的a、b两端液面的变化与图1相同吗?
深度思考
提示 相同
应用体验
1.下列说法正确的是
①需要加热才能发生的反应一定是吸热反应 ②放热反应在常温下一定很容易发生 ③放热反应的逆向反应为吸热反应 ④放热反应加热到一定温度引发后,停止加热反应可能会继续进行
A.③④ B.①②
C.①②③④ D.②③④
√
需加热才能发生的反应不一定是吸热反应,如木炭燃烧反应;放热反应在常温下不一定容易发生,如木炭燃烧反应;某反应为放热反应,则该反应的逆向反应为吸热反应;由于放热反应在反应过程中放出热量,所以停止加热后反应可能会继续进行。
2.下列反应中,既属于氧化还原反应同时又属于吸热反应的是
A.CaCO3的分解反应
B.灼热的炭与CO2反应
C.铝与稀盐酸反应
D.稀H2SO4与稀KOH的反应
√
CaCO3的分解反应属于非氧化还原反应,故A不选;
灼热的炭与CO2反应生成CO,反应为氧化还原反应,同时为吸热反应,故B选;
铝与稀盐酸的反应属于氧化还原反应,但属于放热反应,故C不选;
稀H2SO4与稀KOH的反应属于非氧化还原反应,同时属于放热反应,故D不选。
归纳总结
有关放热反应和吸热反应理解的三个“不一定”
(1)放热反应不一定容易发生,如合成氨反应需要在高温、高压和催化剂作用下才能发生;吸热反应不一定难发生,如Ba(OH)2·8H2O晶体与NH4Cl晶体的反应在常温下就能发生。
(2)需要加热才能发生的反应不一定是吸热反应,如硫与铁的反应;吸热反应不一定需要加热,如Ba(OH)2·8H2O晶体和NH4Cl晶体的反应。
归纳总结
(3)放热过程不一定是放热反应,如NaOH固体的溶解和浓硫酸的稀释是放热过程,但不是放热反应;吸热过程不一定是吸热反应,如升华、蒸发等过程是吸热过程,但不是吸热反应。
返回
热化学方程式
二
1.概念
能表示化学反应中 的热量的化学方程式。
放出或吸收
2.书写——“三字诀”
放
吸
例如,已知1 mol C(s)与1 mol O2(g)完全反应生成1 mol CO2(g)放出393.6 kJ热量,则该反应的热化学方程式为_______________________
。
C(s)+O2(g)===CO2(g)
ΔH=-393.6 kJ·mol-1
已知SO2和O2反应生成4 mol SO3时放出的热量为Q kJ,那么2 mol SO2和1 mol O2在一有催化剂的密闭容器中发生反应时,放出的热量___(填“>”“=”或“<”) Q kJ。
深度思考
<
正误判断
(1)CaCO3(g)===CaO+CO2(g) ΔH=178.2 kJ( )
(2)C(s)+H2O(g)===CO(g)+H2(g) ΔH=-131.3 kJ·mol-1( )
×
×
√
√
应用体验
1.热化学方程式中的物质要注明状态,原因是
A.能描述出反应发生的现象
B.为了区别一般的化学方程式
C.说明反应条件
D.物质呈现的状态与反应热有关
√
在化学反应中,反应的能量变化与物质的聚集状态有关,如:液体水和气态水具有不同的能量,所以书写热化学方程式要注明物质的聚集状态,故选D。
2.胶状液氢(主要成分是H2和CH4)有望用于未来的运载火箭和空间运输系统。实验测得:101 kPa时,1 mol H2完全燃烧生成液态水,放出285.8 kJ的热量;1 mol CH4完全燃烧生成液态水和CO2,放出890.3 kJ的热量。下列热化学方程式书写正确的是
A.CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=890.3 kJ·mol-1
B.CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
C.CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ
D.2H2+O2===2H2O ΔH=-285.8 kJ·mol-1
√
CH4燃烧为放热反应,ΔH<0,A错误;
1 mol CH4完全燃烧生成液态水和CO2,放出890.3 kJ的热量,则热化学方程式为CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1,B正确;
热化学方程式中ΔH的单位应该为kJ·mol-1,C错误;
没有标明各物质的聚集状态,D错误。
3.写出298 K时,下列反应的热化学方程式:
(1)1 mol HgO(s)分解为液态汞和氧气,吸热90.7 kJ:_________________
___________________________________________________________________________。
2HgO(s)===2Hg(l)
90.7 kJ·mol-1]
(2)16 g固体硫完全燃烧时放出148.4 kJ的热量:_______________________
_____________________________________________________________。
ΔH=-148.4 kJ·mol-1[或S(s)+O2(g)===SO2(g) ΔH=-296.8 kJ·mol-1]
(3)2.00 g C2H2气体完全燃烧生成液态水和CO2,放出99.6 kJ的热量:
_______________________________________________________。
归纳总结
热化学方程式的书写方法
(1)遵循一般化学方程式的书写规则(一般不写反应条件)。
(2)要注明反应物和生成物的状态。
(3)在右端注明ΔH的符号(正号常省略)、大小及单位。
(4)化学计量数只表示物质的量,因此可以是整数,也可以是分数。化学计量数改变,ΔH的数值要相应改变。
返回
随堂演练 知识落实
1.(2022·天津高一检测)下列说法正确的是
A.有发光、放热现象的变化就是燃烧
B.在化学反应中只有燃烧能放出热量
C.有些化学反应会吸收热量
D.人类利用的能量都是通过燃烧获得的
√
1
2
3
4
5
1
2
3
4
5
电灯泡发光,并无新物质的生成,属于物理变化,而不属于燃烧,故A错误;
在化学反应中除燃烧能放出热量外,还有:金属与水或酸反应,酸碱中和反应,大部分的化合反应也会放热,故B错误;
大部分的分解反应,碳和二氧化碳反应,碳和高温水蒸气反应,碳酸钙的分解反应等均吸热,故C正确;
人类利用的能量不完全是通过燃烧获得的,比如水能、风能、地热能、海洋能等就不是通过燃烧而获得的能量,故D错误。
2.已知石墨在一定条件下转化成金刚石是吸热反应,由此可得出的正确结论是
A.石墨比金刚石更稳定
B.金刚石比石墨更稳定
C.石墨转化成金刚石是物理变化
D.石墨和金刚石的结构相同
√
1
2
3
4
5
能量越低越稳定,石墨在一定条件下转化成金刚石是吸热反应,说明金刚石能量高,所以石墨比金刚石更稳定,故A正确、B错误;
石墨转化成金刚石,生成了新物质,属于化学变化,故C错误;
石墨和金刚石是两种不同的碳的单质,它们结构不相同,故D错误。
1
2
3
4
5
3.已知在1×105 Pa、298 K条件下,2 mol氢气燃烧生成水蒸气放出484 kJ热量,下列热化学方程式正确的是
A.H2O(g)===H2(g)+ O2(g) ΔH=242 kJ·mol-1
B.2H2(g)+O2(g)===2H2O(l) ΔH=-484 kJ·mol-1
C.H2(g)+ O2(g)===H2O(g) ΔH=242 kJ·mol-1
D.2H2(g)+O2(g)===2H2O(g) ΔH=484 kJ·mol-1
1
2
3
4
5
√
1
2
3
4
5
2 mol氢气燃烧生成水蒸气放出484 kJ热量,则1 mol氢气燃烧生成水蒸气应放出 ×484 kJ=242 kJ热量,放出热量ΔH为“-”,各物质的状态分别是H2(g)、O2(g)、H2O(g);
B项中H2O的状态应为气态;
C、D两项中ΔH的符号应为“-”;
A项是逆向进行的反应,ΔH为正值,数值为2 mol H2燃烧放热数值的一半,书写正确,故应选A项。
4.下列各组热化学方程式中,化学反应的ΔH前者大于后者的是
①C(s)+O2(g)===CO2(g) ΔH1
C(s)+ O2(g)===CO(g) ΔH2
②S(s)+O2(g)===SO2(g) ΔH3
S(g)+O2(g)===SO2(g) ΔH4
③H2(g)+ O2(g)===H2O(l) ΔH5
2H2(g)+O2(g)===2H2O(l) ΔH6
④CaCO3(s)===CaO(s)+CO2(g) ΔH7
CaO(s)+H2O(l)===Ca(OH)2(s) ΔH8
A.仅① B.仅④ C.②③④ D.①②③
1
2
3
4
5
√
碳与氧气反应放热,即ΔH1<0,ΔH2<0,等量的碳完全燃烧生成CO2放出的热多于不完全燃烧生成CO放出的热,所以ΔH1<ΔH2;等量的固态硫变为气态硫时吸收热,故在与O2作用产生同样多的SO2(g)时,气态硫放出的热多,即ΔH3>ΔH4;发生同样的燃烧反应,物质的量越多,放出的热越多,故ΔH5>ΔH6;碳酸钙分解吸收热,ΔH7>0,CaO与H2O反应放出热,ΔH8<0,显然ΔH7>ΔH8。
1
2
3
4
5
1
2
3
4
5
5.除了用手触摸和温度计测量外还可以借助其他方法感知温度的变化,如在探究化学反应过程中有热量变化时,某兴趣小组设计了右面三套装置:
(1)该小组选择装置Ⅰ探究Na2O2和H2O反应为放热反应,将水滴入盛有过氧化钠的试管中,现象为__________________________________,化学方程式:_____________________________。
U形管右侧液面下降,左侧液面上升
2Na2O2+2H2O===4NaOH+O2↑
1
2
3
4
5
(2)该小组选择装置Ⅱ探究硝酸铵溶于水的能量变化,当向盛有硝酸铵固体的试管中滴入少量水,发现导管中上升一段水柱,则该变化______(填“是”或“不是”)吸热反应,原因为____________________
_____________________。
不是
硝酸铵溶于水没有新
物质生成,为物理变化
1
2
3
4
5
(3)该小组在探究镁和盐酸反应热量变化时,选择了装置Ⅲ,发现反应过程中,导管口有气泡冒出,该装置______(填“能”或“不能”)证明镁和盐酸反应为放热反应,原因为_______________________________
_____________________________________________。
不能
镁和盐酸反应生成氢气,无论是吸
热反应还是放热反应,烧杯中导管口都有气泡冒出
返回
课时对点练
题组一 化学反应与能量变化的关系
1.(2022·上海浦东高一期中)下列对于化学反应过程的理解,错误的是
A.化学反应过程中同时存在物质和能量的变化
B.凡是能量变化一定发生在化学变化中
C.化学反应中同时存在质量守恒和能量守恒
D.能量的释放和吸收以发生变化的物质为基础
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
化学反应过程中都会伴随着物质变化和能量变化,A正确;
化学变化过程中往往伴随着能量的变化,而有能量变化时不一定发生化学变化,如灯泡通电发光放热,B错误;
化学反应的实质是原子的重新组合,符合质量守恒定律;反应过程中往往伴随着能量的变化,符合能量守恒定律,C正确;
化学反应过程中同时存在物质和能量的变化,且能量的释放和吸收是以发生变化的物质为基础的,二者密不可分,D正确。
2.下列关于化学反应中能量变化的说法正确的是
A.煤的燃烧过程是放热过程
B.可逆反应进行的过程中没有能量变化
C.在常温下可以发生的反应一定是放热反应
D.化学反应中能量变化的大小与反应物的质量多少无关
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
3.下列属于吸热反应的是
A.气态水液化为液态水 B.高温分解石灰石
C.氢氧化钠和盐酸反应 D.氢气在氯气中燃烧
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
气态水液化为液态水是一个放热过程,属于物理变化,故A错误;
高温分解石灰石是一个吸热反应,故B正确;
氢氧化钠和盐酸反应为中和反应,属于放热反应,故C错误;
氢气在氯气中燃烧生成氯化氢的反应为放热反应,故D错误。
题组二 吸热反应与放热反应
4.(2022·安徽淮北高二期末)下列物质间能量的变化与如图所示相符的是
A.盐酸与碳酸氢钠的反应
B.氮气与氧气生成一氧化氮的反应
C.氢氧化钡与氯化铵的反应
D.铝片与盐酸的反应
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
图示为稀释浓硫酸,为放热过程;盐酸与碳酸氢钠的反应、氮气与氧气生成一氧化氮的反应、氢氧化钡与氯化铵的反应均为吸热反应,铝片与盐酸的反应为放热反应。
5.(2022·南京高一检测)为了探究化学反应的能量变化情况,某同学设计了如图装置,向盛有A试剂的试管中滴加B试剂时,看到U形管中,甲处液面上升,乙处液面下降,则A试剂和B试剂为
A.金属钠和水
B.碳酸氢钠和盐酸
C.生石灰和水
D.氢氧化钠和硝酸
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
金属钠和水反应,生石灰和水反应,氢氧化钠和硝酸反应,都为放热反应,现象应为甲处液面下降,乙处液面上升,与题意不符,故A、C、D错误;
NaHCO3和盐酸反应为吸热反应,温度降低,试剂瓶中
气体压强降低,U形管中甲处液面上升,乙处液面下降,故B正确。
6.“即食即热型”快餐适合外出时携带和食用,其内层中有用铝箔包裹的已加工好的真空包装食品,外层有分别包装的两包化学物质,拉动预留在外的拉线使这两种化学物质相互作用,放出的热量便可对食物进行加热。这两包化学物质最合理的组合是
A.浓硫酸和水 B.生石灰和水
C.熟石灰和水 D.氯化钠和水
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
选项中只有浓硫酸与水、生石灰和水相互作用是明显放热的,但浓硫酸为腐蚀品,不适用于食物加热,且浓硫酸与水混合所得的稀硫酸能与铝箔反应,故不适用。
7.(2022·洛阳高一期中)下列反应或变化过程放热的个数为
①Ba(OH)2晶体与NH4Cl晶体反应 ②硫酸和氢氧化钠溶液混合 ③硫受热融化 ④灼热的炭和二氧化碳反应生成一氧化碳 ⑤生石灰和水反应生成熟石灰 ⑥镁条在氮气中燃烧
A.3个 B.2个
C.5个 D.4个
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
①Ba(OH)2晶体与NH4Cl晶体反应是吸热反应,故不选;
②硫酸和氢氧化钠溶液混合放出热量,是放热反应,故选;
③硫受热融化,为吸热变化,故不选;
④灼热的炭和二氧化碳反应生成一氧化碳,为吸热反应,故不选;
⑤生石灰和水反应生成熟石灰,为放热反应,故选;
⑥镁条在氮气中燃烧是燃烧反应,为放热反应,故选;故选A。
题组三 热化学方程式的意义与书写
8.下列说法正确的是
A.书写热化学方程式时,只要在化学方程式的右端写上热量的符号和
数值即可
B.凡是在加热或点燃条件下进行的反应都是吸热反应
C.表明反应所放出或吸收热量的化学方程式叫做热化学方程式
D.氢气在氧气中燃烧的热化学方程式是2H2(g)+O2(g)===2H2O(g)
ΔH=-483.6 kJ
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
A项中要标明物质的状态;
B项中C在O2中燃烧是放热反应;
D项中ΔH的单位是kJ·mol-1。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
9.下列对热化学方程式 H2(g)+ I2(g)===HI(g) ΔH=-9 kJ·mol-1的叙述中,正确的是
A.1 mol氢气和1 mol碘蒸气完全反应需要吸收9 kJ热量
B.1个氢分子和1个碘分子完全反应需要放出9 kJ的热量
C.1 mol H2(g)与1 mol I2(g)完全反应生成2 mol的HI气体放出18 kJ的热量
D.1 mol H2(g)与1 mol I2(g)完全反应吸收18 kJ的热量
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
热化学方程式的具体形式是表示一定物质的量、一定聚集状态的反应物完全反应生成一定聚集状态的生成物时的放热或吸热情况。只要依据书写热化学方程式的注意事项,对于本题就不难作出判断。
10.1 g氢气在氧气中燃烧生成液态水,放出142.9 kJ的热量,表示该反应的热化学方程式是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
由1 g氢气燃烧生成液态水放出142.9 kJ的热量可知,1 mol H2燃烧生成液态水放出285.8 kJ的热量,故该反应ΔH=-285.8 kJ·mol-1。
11.下列实验现象中,不能说明相应的化学反应是放热反应的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
选项 A B C D
实验装置
实验现象 温度计的示数增大 反应开始后,气球慢慢胀大 反应开始后,甲侧液面低于乙侧液面 反应开始后,针筒活塞向右移动
√
12.下列说法或表示方法正确的是
A.等物质的量的硫蒸气和硫固体分别完全燃烧生成SO2气体,放出的热量
一样多
B.12 g石墨转化为CO时,放出110.5 kJ热量:2C(石墨,s)+O2(g)===2CO(g)
ΔH=-110.5 kJ·mol-1
C.已知:H2(g)+ O2(g)===H2O(l) ΔH1,H2(g)+ O2(g)===H2O(g) ΔH2,
则ΔH1<ΔH2
D.已知:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,则相同条件下,
在密闭容器中,1 mol N2和3 mol H2混合充分反应后放出92.4 kJ的热量
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
因为硫蒸气转化为硫固体放出能量,因此等物质的量的硫蒸气和硫固体分别完全燃烧生成SO2气体时,硫蒸气放出的热量大于硫固体,故A错误;
两反应反应物化学计量数及状态相同,生成的产物也相同,只是生成物的状态不同,由于H2O(g)转化为H2O(l)要放热,故生成H2O(l)放出的热量多,即ΔH1<ΔH2,故C正确;
该反应为可逆反应,不能完全进行到底,因此相同条件下,在密闭容器中,1 mol N2和3 mol H2混合充分反应后放出的热量小于92.4 kJ,故D错误。
13.在25 ℃、101 kPa下,1 g乙醇燃烧生成CO2和液态水时放热29.71 kJ,下列热化学方程式正确的是
A.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l) ΔH=1 366.66 kJ·mol-1
B.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l) ΔH=-1 366.66 kJ·mol-1
D.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l) ΔH=-29.71 kJ·mol-1
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
乙醇燃烧是放热反应,ΔH的符号应为“-”,A不正确;
1 g C2H5OH燃烧放出29.71 kJ热量,则1 mol(46 g)C2H5OH燃烧放出的热量为1 366.66 kJ。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
14.根据日常生活和回忆已学化学反应,对下列变化按吸热或放热的标准分类:
①钠投入水中 ②煅烧石灰石制生石灰 ③食物腐烂 ④炸药爆炸 ⑤氢气在氯气中燃烧 ⑥生石灰与水作用制熟石灰 ⑦碳与水蒸气制取水煤气(CO和H2) ⑧硫酸与氢氧化钠的中和反应 ⑨氦气球受热爆炸
(1)属于放热反应的有_______________(填序号,下同)。
(2)属于吸热反应的有______。
①③④⑤⑥⑧
②⑦
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
15.化学在能源开发与利用中起着十分关键的作用。
(1)0.3 mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5 kJ热量,其热化学方程式为____________
______________________________________________。
B2H6(g)+
3O2(g)===B2O3(s)+3H2O(l) ΔH=-2 165 kJ·mol-1
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(2)家用液化气中主要成分之一是丁烷。当1 g丁烷(C4H10)完全燃烧并生成CO2和液态水时,放出热量50 kJ。试写出丁烷燃烧的热化学方程式:
________________________________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
16.为了探究化学能与热能的转化,某实验小组设计了如图所示的三套实验装置:
(1)上述3个装置中,不能验证“铜与浓硝酸的反应是吸热反应还是放热反应”的装置是______(填装置序号)。
Ⅲ
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
装置Ⅰ可通过U形管中红墨水液面的变化判断铜与浓硝酸的反应是放热反应还是吸热反应;装置Ⅱ可通过烧杯中是否产生气泡判断铜与浓硝酸的反应是放热反应还是吸热反应;装置Ⅲ只是一个铜与浓硝酸反应并将生成的气体用水吸收的装置,不能验证该反应是放热反应还是吸热反应。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(2)某同学选用装置Ⅰ进行实验(实验前U形管里液面左右相平),在试管中加入适量Ba(OH)2溶液与稀硫酸,U形管中可观察到的现象是______
_____________________________,说明该反应属于_____(填“吸热”或“放热”)反应。
U形管
内左端液面降低,右端液面升高
放热
Ba(OH)2溶液与稀硫酸的反应属于中和反应,中和反应都是放热反应。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(3)为探究固体M溶于水的热效应,选择装置Ⅱ进行实验(反应在甲试管中进行)。
①若M为钠,则实验过程中烧杯中可观察到的现象是_______________
_________________________________________________________。
导气管口处产生
气泡,反应完毕后,冷却至室温,烧杯中的导管内形成一段水柱
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
②若观察到烧杯中产生气泡,则说明M溶于水________________(填“一定是放热反应”“一定是吸热反应”或“可能是放热反应”),理由是________________________________________________。
可能是放热反应
某些物质(如NaOH固体)溶于水放热,但不是放热反应
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
返回
NaOH固体、硝酸铵等溶于水时有热量的变化,但发生的是物理变化,不属于化学反应,故不是放热或吸热反应。
本课结束
专题6
