专题6 第三单元 第2课时 化学电池 课件(共90张PPT)
文档属性
| 名称 | 专题6 第三单元 第2课时 化学电池 课件(共90张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-08 15:49:14 | ||
图片预览










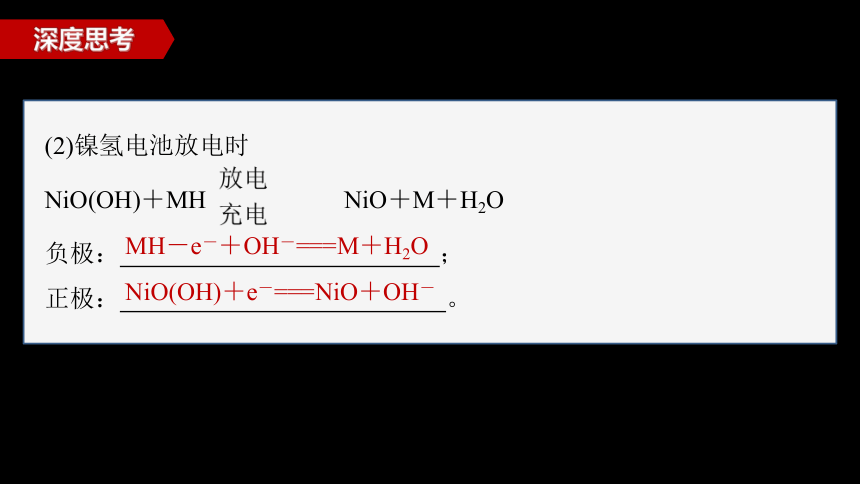
文档简介
(共90张PPT)
第2课时
DIERKESHI
一次电池、二次电池 / 燃料电池 / 电解在物质制备中的应用 / 随堂演练 知识落实 / 课时对点练
化学电池
专题6
核心素养
发展目标
1.了解一次电池、二次电池、燃料电池等化学电池的特点及在生活中的应用。
2.掌握构成化学电池的基本要素,了解常见化学电池的工作原理。
内容索引
一、一次电池、二次电池
二、燃料电池
三、电解在物质制备中的应用
随堂演练 知识落实
课时对点练
一次电池、二次电池
一
1.一次电池(干电池)
(1)特点:电池用过之后 复原,如锌锰干电池属于一次电池。
不能
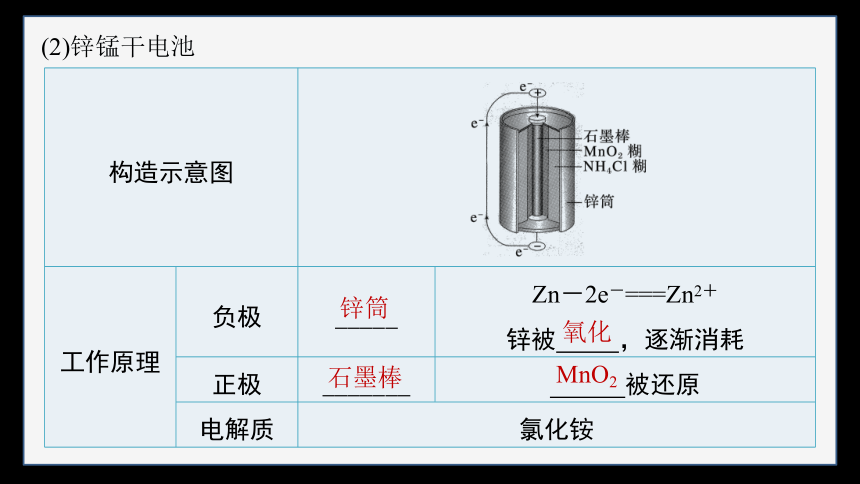
(2)锌锰干电池
构造示意图 工作原理 负极 _____ Zn-2e-===Zn2+
锌被 ,逐渐消耗
正极 _______ 被还原
电解质 氯化铵 锌筒
石墨棒
氧化
MnO2
2.二次电池(充电电池)
(1)充电电池又称二次电池。其能量的转化关系是化学能 电能。
(2)常见的充电电池
①铅蓄电池:常作汽车电瓶,电压稳定,使用方便安全。负极材料是 ,正极材料是 ,电解质溶液是 。
②镍氢电池:寿命长,性能好。负极材料是 ,常用 表示贮氢合金M中吸收结合的氢,正极材料是泡沫氧化镍,电解质溶液是
。
Pb
PbO2
硫酸
贮氢合金
MH
氢氧化钾溶液
③锂离子电池:是笔记本电脑、手机等数码产品中使用最为广泛的电池。它具有供电 、 充放电、使用 、便携、 等优点,在一定程度上改变了人们的生活方式。
稳定
可反复
寿命长
无污染
正误判断
×
×
×
×
(1)锌锰干电池工作一段时间后碳棒变细( )
(2)干电池放电之后可以再充电( )
(3)充电电池可以无限制地反复充电、放电( )
(4)二次电池充电时化学能转化为电能( )
深度思考
1.写出下列电池的正负极反应式。
(1)银锌纽扣电池
Zn+Ag2O+H2O Zn(OH)2+2Ag
负极: ;
正极: 。
Zn-2e-+2OH-===Zn(OH)2
Ag2O+H2O+2e-===2Ag+2OH-
深度思考
(2)镍氢电池放电时
NiO(OH)+MH NiO+M+H2O
负极: ;
正极: 。
MH-e-+OH-===M+H2O
NiO(OH)+e-===NiO+OH-
2.铅蓄电池放电时正极、负极电极反应式分别为
负极:Pb(s)+ (aq)-2e-===PbSO4(s);
正极:PbO2(s)+4H+(aq)+ (aq)+2e-===PbSO4(s)+2H2O(l)。
当电路中转移0.2 mol电子时,负极、正极质量如何变化?
深度思考
提示 负极质量增加9.6 g,正极质量增加6.4 g。
应用体验
1.某普通锌锰干电池的结构如图所示。下列说法正确的是
A.锌筒是原电池的正极
B.石墨电极上发生氧化反应
C.铵根离子流向石墨电极
D.电子经石墨棒沿电解质溶液流向锌筒
√
锌锰干电池中,锌筒作负极,石墨棒作正极,正极上二氧化锰得电子发生还原反应,A、B错误;
原电池中阳离子向正极移动,故铵根离子流向石墨电极,C正确;
电子经导线由负极锌筒流向石墨棒,D错误。
2.(2022·兰州第一中学高一期中)镍氢电池放电时的总反应是: H2+NiO(OH)===Ni(OH)2,根据此反应判断,下列说法正确的是
A.电池放电时,电池负极周围溶液的碱性不断增大
B.电池放电时,镍元素被氧化
C.电池放电时,氢元素被还原
D.电池放电时,通入H2的一极是负极
√
电池放电时,负极反应式为H2-2e-+2OH-===2H2O,所以负极周围溶液的氢氧根离子减少,溶液的pH减小,A错误;
电池放电时,正极反应式为NiO(OH)+H2O+e-===OH-+Ni(OH)2,镍元素被还原,B错误;
电池放电时,H2是负极,氢元素化合价升高,被氧化,C错误、D正确。
放电时,Cd由0价到+2价,失电子,故负材料为Cd。
3.镍-镉(Ni-Cd)可充电电池的总反应为Cd(OH)2+2Ni(OH)2 Cd+2NiO(OH)+2H2O,由此可知,放电时该电池的负极材料是
A.Cd B.NiO(OH)
C.Cd(OH)2 D.Ni(OH)2
返回
√
燃料电池
二
1.概念
一种将燃料(如氢气、甲烷、乙醇)和氧化剂(如氧气)的化学能直接转化为电能的电化学反应装置。
2.特点
(1)清洁、安全、高效等;
(2)能量转化率可以达到80%以上;
(3)反应物不是储存在电池内部,而是从外部提供,供电量易于调节。
3.氢氧燃料电池
该电池反应式为
负极: ;
正极: ;
总反应: 。
H2+2OH--2e-===2H2O
O2+2H2O+4e-===4OH-
2H2+O2===2H2O
特点提醒 (1)燃料电池工作中化学能直接转化为电能,燃料并没有燃烧。
(2)氢氧燃料电池在不同介质中的总反应相同,均为2H2+O2===2H2O,但正、负极反应与电解质溶液有关。
正误判断
(1)燃料电池是利用燃料的燃烧发电( )
(2)燃料电池中,燃料在正极上发生氧化反应( )
(3)氢氧燃料电池将热能直接转变为电能( )
(4)氢氧燃料电池将化学能完全转变为电能( )
(5)氢氧燃料电池比氢气直接燃烧发电能量利用率高( )
×
×
×
×
√
深度思考
写出下列燃料电池的正负极反应式和总反应。
(1)氢氧酸性燃料电池
负极: ;
正极: ;
总反应: 。
2H2-4e-===4H+
O2+4H++4e-===2H2O
2H2+O2===2H2O
深度思考
(2)CH4酸性燃料电池
负极: ;
正极: ;
总反应: 。
(3)甲醇-空气碱性燃料电池
负极: ;
正极: ;
总反应: 。
CH4+2H2O-8e-===CO2+8H+
2O2+8H++8e-===4H2O
CH4+2O2===CO2+2H2O
3O2+12e-+6H2O===12OH-
(4)铝-空气燃料电池(NaOH溶液为电解质溶液)
负极: ;
正极: ;
总反应: 。
O2+2H2O+4e-===4OH-
深度思考
归纳总结
电极反应式的书写步骤
应用体验
1.科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机酸转化为氢气,氢气进入以磷酸为电解质的燃料电池中发电,电池负极反应式为
A.H2+2OH--2e-===2H2O
B.O2+4H++4e-===2H2O
C.H2-2e-===2H+
D.O2+2H2O+4e-===4OH-
√
电解质溶液为酸性溶液,电极反应式中不能出现OH-,A、D错误;
又因为燃料电池中负极通入氢气,正极通入氧气,B错误。
2.电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图所示。下列说法正确的是
A.电流由a极流向b极
B.溶液中的OH-向b极移动
C.a极的电极反应式为2NH3-6e-===N2+6H+
D.b极的电极反应式为O2+4e-+2H2O===4OH-
√
氧气在b极发生还原反应,则b极为正极,电流由正极流向负极,则电流由b极流向a极,A项错误;
溶液中的阴离子会移向负极,故OH-向a极移动,B项错误;
a极通入氨气生成氮气,电解质溶液显碱性,则a极的电极反应式为2NH3+6OH--6e-===N2+6H2O,C项错误;
b极通入氧气,氧气得电子被还原,电极反应式为O2+4e-+2H2O===
4OH-,D项正确。
返回
电解在物质制备中的应用
三
1.电解池
将 能转化为 能的装置。
2.电解在物质制备中的应用
(1)电解水制氢气和氧气
(2)电解饱和食盐水制备烧碱、氯气和氢气
电
化学
(3)电解制取金属
①电解熔融的氧化铝制备铝
阴极反应式: ;
阳极反应式: ;
总反应式: 。
②电解制备其他活泼金属
电解熔融的 、 、 可分别得到钠、镁、钙的单质和氯气。
(4)通常条件下无法自发进行的化学反应可通过电解的方法实现。
Al3++3e-===Al
2O2--4e-===O2↑
氯化钠
氯化镁
氯化钙
应用体验
1.下列金属单质一般不用电解的方法制取的是
A.钠 B.铝
C.钙 D.铁
√
2.请写出下列过程中能量转化的主要形式。
(1)铅蓄电池的充电过程:_________________;
(2)铅蓄电池的放电过程:_________________;
(3)氢气在氧气中燃烧:_______________________;
(4)氢气和氧气在燃料电池中反应:_________________;
(5)电解水:_________________。
返回
电能转化为化学能
化学能转化为电能
化学能转化为热能和光能
化学能转化为电能
电能转化为化学能
随堂演练 知识落实
1.下列电池工作时,O2在正极得电子的是
1
2
3
4
A B C D
锌锰干电池 铅蓄电池 氢氧燃料电池 镍镉电池
√
氢氧燃料电池的总反应是2H2+O2===2H2O,因而正极是O2得电子发生还原反应。
2.汽车的启动电源常用铅蓄电池。其结构如图所示,放电时的电池反应为PbO2+Pb+2H2SO4===2PbSO4+2H2O,根据此反应判断下列说法正确的是
A.负极反应式:Pb-2e-+ ===PbSO4
B.电池放电时,溶液的酸性增强
C.PbO2得电子,被氧化
D.PbO2是电池的负极
1
2
3
4
√
1
2
3
4
Pb失电子作负极,电极反应式为Pb+
-2e-===PbSO4,故A正确;
放电时,硫酸参加反应,导致溶液中氢离子浓度减小,则溶液的酸性减弱,故B错误;
PbO2得电子,被还原,故C错误;
根据电池反应式知,PbO2在反应中得电子,Pb元素的化合价由+4变为+2,所以二氧化铅作正极,故D错误。
3.(2022·安徽亳州二中高二开学考试)如图为氢氧燃料电池示意图,电池总反应式为2H2+O2===2H2O,下列说法正确的是
A.电流由a极经导线流向b极
B.a极为燃料电池的正极
C.该电池属于环境友好电池
D.该装置将电能转化为化学能
√
1
2
3
4
1
2
3
4
根据总反应可知氢气被氧化,氧气被还原,所以a电极为负极,b电极为正极。电流由正极流向负极,即由b极经导线流向a极,A错误;
a电极上氢气发生氧化反应,为燃料电池的负极,B错误;
该电池的产物为水,无污染,为环境友好电池,C正确;
原电池可以将化学能转化为电能,D错误。
4.有一种微型电池,其电极分别为Zn和Ag2O,电解质溶液是KOH溶液,试回答下列问题:
(1)原电池是把______能转化成____能的装置。
(2)该电池中Zn极为____极。
(3)当金属Zn消耗了16.25 g时,转移电子的物质的量为________。
1
2
3
4
化学
电
负
0.5 mol
返回
课时对点练
题组一 一次电池、二次电池
1.下列有关锌锰干电池的说法正确的是
A.锌外壳是负极,石墨棒是正极
B.在外电路中电子从石墨棒流向锌外壳
C.电流从锌外壳流到石墨棒上
D.在电池内部阳离子从石墨棒向锌外壳移动
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
A项,在锌锰干电池中,锌外壳是负极,石墨棒是正极,故正确;
B项,在外电路中电子从锌外壳流向石墨棒,故错误;
C项,电流的方向与电子的流向相反,应从石墨棒流向锌外壳,故错误;
D项,电池内部,阳离子向正极石墨棒移动,故错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
2.银锌纽扣电池如图所示,其电池的总反应式为Zn+Ag2O+H2O===
Zn(OH)2+2Ag。
下列说法不正确的是
A.锌作负极,发生氧化反应
B.正极为Ag2O,发生还原反应
C.电池工作时,电流从Ag2O流向Zn
D.负极的电极反应式为Zn-2e-===Zn2+
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
Zn失电子发生氧化反应而作负极,故A正确;
正极上Ag2O得电子发生还原反应,故B正确;
原电池中电流从正极沿导线流向负极,该电池
中Zn是负极、Ag2O是正极,所以放电时电流从Ag2O经导线流向Zn,故C正确;
碱性条件下锌离子生成Zn(OH)2,所以负极电极反应式为Zn+2OH--2e-===Zn(OH)2,故D错误。
3.(2022·山东日照高一检测)一种锂水电池以锂和钢板为电极,LiOH为电解质,使用时加入水即可放电,总反应为2Li+2H2O===2LiOH+H2↑。下列有关该电池的说法错误的是
A.锂极为负极
B.OH-移向正极
C.H2为正极产物
D.电子由锂经导线流向钢板
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
由方程式可知,Li失去电子,发生氧化反应,作负极,则钢板作正极,A项正确;
正极上的电极反应式为2H2O+2e-===2OH-+H2↑,可知氢气为正极产物,C项正确;
电子会从负极流向正极,即电子由锂经导线流向钢板,D项正确。
4.某华人科学家和他的团队研发出“纸电池”。这种一面镀锌、一面镀二氧化锰的超薄电池在使用印刷与压层技术后,变成一张可任意裁剪大小的“电纸”,厚度仅为0.5毫米,可以任意弯曲和裁剪。纸内的离子“流过”水和氧化锌组成电解质溶液,电池总反应式为Zn+2MnO2+H2O===ZnO+2MnO(OH)。下列说法正确的是
A.该电池的正极材料为锌
B.该电池反应中二氧化锰发生氧化反应
C.电池的正极反应式为MnO2+H2O+e-===MnO(OH)+OH-
D.当有0.1 mol锌溶解时,流经电解质溶液的电子数为1.204×1023
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
该原电池中,锌元素化合价由0变为+2,锌失电子作负极,故A错误;
该原电池中,锰元素化合价由+4变为+3,所以二氧化锰作正极,发生还原反应,故B错误;
正极上二氧化锰得电子发生还原反应,电极反应为MnO2+e-+H2O
===MnO(OH)+OH-,故C正确;
电子从负极沿导线流向正极,不经过电解质溶液,故D错误。
5.(2022·广州高一期中)手机使用的锂电池以质量轻、能量高而备受关注,目前已成功研制出多种锂电池。某种锂电池的总反应是Li+MnO2===
LiMnO2。下列说法中正确的是
A.MnO2是负极,电极反应式为MnO2+e-===
B.电池工作时,电子由正极通过外电路流向负极
C.电池内部产生的 向锂电极移动
D.钠比锂更活泼,相同质量的钠作电极比锂提供的电能更多
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
由锂电池的总反应为Li+MnO2===LiMnO2可知Li失去电子,Li作负极,正极上MnO2得到电子,正极反应为MnO2+e-=== ,故A错误;
电池工作时,电子由负极通过外电路流向正极,故B错误;
电池内部产生的 向负极即锂电极移动,故C正确;
钠和锂为同主族元素,相同物质的量的Na和Li失电子数相同,Li的相对原子质量较小,则相同质量的钠作电极比锂失电子数少,提供的电能少,故D错误。
题组二 燃料电池
6.燃料电池是目前电池研究的热点之一。某课外小组自制的氢氧燃料电池如图所示,a、b均为惰性电极。下列叙述错误的是
A.a极是负极,该电极上发生氧化反应
B.b极发生的电极反应是2H2O+2e-===H2↑+2OH-
C.电池总反应为2H2+O2===2H2O
D.氢氧燃料电池是一种具有应用前景的绿色电源
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
A项,a极通入H2,为负极,电极反应式为2H2+4OH--4e-===4H2O,发生的是氧化反应,正确;
B项,b极通入O2,为正极,电极反应式为O2+2H2O+4e-===4OH-,错误;
C项,正、负极电极反应式相加可得,电池总反应为2H2+O2===2H2O,正确;
D项,氢氧燃料电池的能量高,且产物为水,对环境无污染,故是具有应用前景的绿色电源,正确。
7.一种直接铁燃料电池(电池反应为3Fe+2O2===Fe3O4)的装置如图所示,下列说法正确的是
A.Fe极为电池正极
B.KOH溶液为电池的电解质溶液
C.电子由多孔碳极沿导线移向Fe极
D.5.6 g Fe参与反应,导线中转移1.204
×1023个电子
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
该电池中铁失去电子,为电池负极,A项错误;
电子由Fe极沿导线移向多孔碳极,C项错误;
根据电池反应3Fe+2O2===Fe3O4,可知,3 mol铁参与反应时转移8 mol电子,故5.6 g Fe参与反应,导线中转移1.605×1023个电子,D项错误。
8.可用于电动汽车的铝-空气燃料电池,若以氢氧化钠溶液为电解质溶液,铝为负极,通入空气的电极为正极。下列说法正确的是
A.正极反应式为O2+2H2O+4e-===4OH-
B.负极反应式为Al+3OH--3e-===Al(OH)3
C.电池在工作过程中电解质溶液的碱性保持不变
D.电池工作时,电子通过外电路从正极流向负极
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
A对,通入空气的电极为正极,碱性条件下的正极反应式为O2+2H2O+4e-===4OH-;
B错,铝为负极,碱性条件下的负极反应式为Al+4OH--3e-===
+2H2O;
C错,该电池在碱性条件下消耗NaOH,总反应为4Al+4OH-+3O2===
+2H2O,则碱性不断减弱;
D错,电池工作时,电子从负极流出经过外电路流向正极。
题组三 电解在物质制备中的应用
9.下列说法错误的是
A.电解水可以制得氢气和氧气
B.电解饱和食盐水可以制得钠和氯气
C.电解熔融的氧化铝可以制得金属铝
D.手机充电时电能转化为化学能
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
电解饱和食盐水得到的是NaOH、H2和Cl2,电解熔融NaCl可以得到Na和Cl2,B项错误。
10.(2022·河南省洛阳市第一中学高一期中)下面是几种常见的化学电源示意图,有关说法不正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
A.上述电池分别属于一次电池、二次电池和燃料电池
B.干电池在长时间使用后,锌筒被破坏
C.铅蓄电池在工作中,负极每消耗1 mol铅,则硫酸中就转移2 mol电子
D.氢氧燃料电池是一种具有广阔应用前景的绿色电源
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
干电池是一次电池,铅蓄电池是可充电电池,属于二次电池,氢氧燃料电池属于燃料电池,故A正确;
在干电池中,Zn作负极,被氧化,故B正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
铅蓄电池工作过程中负极每消耗1 mol铅,则线路中会转移2 mol电子,硫酸中无电子转移,故C错误。
11.随着环保整治的逐渐推进,乙醇作为一种燃料逐渐走进人们的视野,如“乙醇汽油”“乙醇电池”等。如图是一种新型的乙醇电池的工作示意图,该电池总反应为C2H5OH+3O2===2CO2+3H2O。下列有关该电池的说法正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
A.a极为正极,b极为负极
B.负极反应式为C2H5OH+3H2O-12e-===2CO2↑+12H+
C.反应中转移6 mol电子时,正极消耗33.6 L O2
D.该燃料电池工作一段时间后,酸性增强
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
质子为H+,依据质子(H+)向正极移动,可确定a极为负极,b极为正极,A项错误;
在电池负极,C2H5OH在酸性电解质溶液中失电子,生成二氧化碳等 ,负极反应式为C2H5OH+3H2O-12e-===2CO2↑+12H+,B项正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
正极反应式为O2+4e-+4H+===2H2O,当反应中转移6 mol电子时,正极消耗1.5 mol O2,但由于温度、压强未知,所以O2的体积不一定是33.6 L,C项错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
由电池总反应C2H5OH+3O2===2CO2+3H2O可知,该燃料电池工作一段时间后,H+的物质的量不变,但溶剂的质量增加,所以溶液的酸性减弱,D项错误。
12.银制器皿表面日久因生成Ag2S而变黑,可进行如下处理:将表面发黑的银器浸入盛有食盐水的铝质容器中(如图),一段时间后黑色褪去。下列说法正确的是
A.该处理过程中电能转化为化学能
B.银器为正极,Ag2S还原为单质银
C.Ag2S溶于食盐水中生成了AgCl
D.铝质容器为阳极,其质量变轻
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
将表面发黑的银器浸入盛有食盐水的铝质容器中,形成原电池,能量变化是化学能转化为电能,故A错误;
依据原电池原理分析,铝和硫化银在食盐水中形成原电池,铝做负极,银器做正极,硫化银被还原为银,故B正确;
原电池反应中硫化银被还原为银单质,不是Ag2S溶于食盐水中生成了AgCl,故C错误;
铝在原电池中做负极,质量减轻,故D错误。
13.(2022·云南师大附中高一检测)锌-空气电池装置如图所示,该电池的核心是ORR反应和OER反应,KOH溶液为电解质溶液,放电时总反应为2Zn+O2+4OH-+2H2O=== ,下列有关说法正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
A.放电时电解质溶液中OH-向正极移动
B.放电时,电路中通过2 mol电子,消耗氧气11.2 L
C.发生OER反应的电极反应式为2H2O-4e-===O2↑+4H+
D.在电池放电过程中,空气进入电池,发生ORR反应,释放OH-
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
原电池中阴离子向负极移动,故放电时电解质溶液中OH-向负极移动,A错误;
没有说明是标况,不能计算氧气体积,B错误;
反应在碱性条件下进行,发生OER反应的电极反应式为4OH--4e-===O2↑+2H2O,C错误;
空气进入电池,氧气得到电子发生还原反应,ORR反应:O2+4e-+2H2O===4OH-,D正确。
14.(2021·山东威海高一期末)一种肼(N2H4)-空气碱性燃料电池工作原理如图所示。下列说法错误的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
A.a为空气,b为N2H4
B.M为正极,电极反应为O2+4e-+4H+===2H2O
C.电路中通过1 mol电子时,同时有1 mol OH-从左室通过阴离子交换膜
移到右室
D.当有16 g N2H4完全反应生成N2,消耗标准状况下11.2 L O2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
燃料电池通入燃料的一极为负极、电子从负极流出,故 b为N2H4,A正确;
此电池为碱性燃料电池,M为正极,则电极反应为O2+4e-+2H2O===4OH-,B不正确;
燃料电池中,阴离子移向负极,根据得失电子守恒,有关系式e-~OH-,则电路中通过1 mol电子时,同时有1 mol OH-从左室正极区通过阴离子交换膜移到右室负极区,C正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
负极反应式为N2H4-4e-+4OH-===N2+4H2O,正极电极反应为O2+4e-+2H2O===
4OH-,根据得失电子守恒,N2H4~4e-~O2,当有1 mol即32 g N2H4完全反应生成N2,消耗
1 mol O2,则当有16 g N2H4完全反应生成N2,消耗0.5 mol O2,即标准状况下11.2 L O2,D正确。
15.(2022·天津高一期中)(1)如图为氢氧燃料电池的构造示意图,根据电子运动方向可知,氧气从______(填“a”或“b”)口通入,X极为电池的______(填“正”或“负”)极。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
b
负
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
氢氧燃料电池中,电子从负极向正极移动,X是负极,Y是正极,氧气应通入正极。
(2)某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,两极上发生的电极反应分别为
A极:2H2+2O2--4e-===2H2O
B极:O2+4e-===2O2-
则A极是电池的____极;电子从该极______
(填“流入”或“流出”)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
负
流出
根据电极反应可知,A极发生氧化反应,应该是电池的负极,电子从该极流出。
(3)若将(1)中燃料电池改为甲烷-空气燃料电池,工作时,负极反应式为__________
______________________,电池总反应式为_________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
CH4-8e-
CH4+2O2+2KOH===K2CO3+3H2O
甲烷-空气燃料电池,通甲烷的一极(X)为负极,通空气的一极(Y)为正极,电池总反应式为CH4+2O2+2KOH===K2CO3+3H2O,负极反应式为CH4-8e-+10OH-=== +7H2O。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
16.(1)科研人员设想用如图甲所示装置生产硫酸。
①题述生产硫酸的总反应方程式为____________
________________,b是____极,b电极反应式为_________________________,生产过程中H+向____(填“a”或“b”)电极区域运动。
2SO2+O2+
2H2O===2H2SO4
正
O2+4e-+4H+===2H2O
b
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
根据装置图甲可知a电极通入SO2,SO2发生失去电子的氧化反应,O2从正极通入,因此上述生产硫酸的总反应方程式为2SO2+O2+2H2O===2H2SO4,b电极通入O2是正极,O2在酸性条件下得电子生成水,反应式为O2+4e-+4H+===2H2O,原电池中
阳离子向正极移动,则生产过程中H+向b电极区域运动。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
②该小组同学反思原电池的原理,其中观点正确的是_____(填字母)。
A.原电池反应的过程中可能没有电子发生转移
B.原电池装置一定需要两个活泼性不同的金属
电极
C.电极一定不能参加反应
D.氧化反应和还原反应可以拆开在两极发生
D
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
原电池反应的过程中一定有电子发生转移,A项错误;
原电池装置不一定需要两个活泼性不同的金属电极,例如燃料电池等 ,B项错误;
原电池中电极可以参加反应,例如铜、锌、稀硫酸组成的原电池中锌电极参加反应,C项错误;
原电池中氧化反应和还原反应可以拆开在两极发生,D项正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(2)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的原电池如图乙所示,质子交换膜(只允许H+通过)左右两侧的溶液均为1 L 2 mol·L-1
H2SO4溶液。电池总反应为2CH3OH+3O2===2CO2+4H2O,电极c为______(填“正极”或“负极”),c电极反应式为__________________
___________________。当电池中有1 mol e-发生转移时左右两侧溶液的质量之差为_____g (假设反应物耗尽,忽略气体的溶解)。
负极
CH3OH-6e-+
H2O===CO2↑+6H+
12
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
根据装置图乙可知电子从c电极流出,则c电极是负极,电池总反应为2CH3OH+3O2===2CO2
+4H2O,所以CH3OH在负极发生失去电子的氧化反应转化为CO2,则c电极反应式为CH3OH
-6e-+H2O===CO2↑+6H+;当转移1 mol电子时,左侧质量减轻 ×
(18-6) g=2 g,还有1 mol H+通过质子交换膜进入右侧,质量减少1 g,正极反应式为O2+4H++4e-===2H2O,右侧质量增加32 g× =8 g,加上转移过来的1 g H+,因此左右两侧溶液的质量之差为8 g+1 g+2 g+1 g=12 g。
返回
本课结束
专题6
第2课时
DIERKESHI
一次电池、二次电池 / 燃料电池 / 电解在物质制备中的应用 / 随堂演练 知识落实 / 课时对点练
化学电池
专题6
核心素养
发展目标
1.了解一次电池、二次电池、燃料电池等化学电池的特点及在生活中的应用。
2.掌握构成化学电池的基本要素,了解常见化学电池的工作原理。
内容索引
一、一次电池、二次电池
二、燃料电池
三、电解在物质制备中的应用
随堂演练 知识落实
课时对点练
一次电池、二次电池
一
1.一次电池(干电池)
(1)特点:电池用过之后 复原,如锌锰干电池属于一次电池。
不能
(2)锌锰干电池
构造示意图 工作原理 负极 _____ Zn-2e-===Zn2+
锌被 ,逐渐消耗
正极 _______ 被还原
电解质 氯化铵 锌筒
石墨棒
氧化
MnO2
2.二次电池(充电电池)
(1)充电电池又称二次电池。其能量的转化关系是化学能 电能。
(2)常见的充电电池
①铅蓄电池:常作汽车电瓶,电压稳定,使用方便安全。负极材料是 ,正极材料是 ,电解质溶液是 。
②镍氢电池:寿命长,性能好。负极材料是 ,常用 表示贮氢合金M中吸收结合的氢,正极材料是泡沫氧化镍,电解质溶液是
。
Pb
PbO2
硫酸
贮氢合金
MH
氢氧化钾溶液
③锂离子电池:是笔记本电脑、手机等数码产品中使用最为广泛的电池。它具有供电 、 充放电、使用 、便携、 等优点,在一定程度上改变了人们的生活方式。
稳定
可反复
寿命长
无污染
正误判断
×
×
×
×
(1)锌锰干电池工作一段时间后碳棒变细( )
(2)干电池放电之后可以再充电( )
(3)充电电池可以无限制地反复充电、放电( )
(4)二次电池充电时化学能转化为电能( )
深度思考
1.写出下列电池的正负极反应式。
(1)银锌纽扣电池
Zn+Ag2O+H2O Zn(OH)2+2Ag
负极: ;
正极: 。
Zn-2e-+2OH-===Zn(OH)2
Ag2O+H2O+2e-===2Ag+2OH-
深度思考
(2)镍氢电池放电时
NiO(OH)+MH NiO+M+H2O
负极: ;
正极: 。
MH-e-+OH-===M+H2O
NiO(OH)+e-===NiO+OH-
2.铅蓄电池放电时正极、负极电极反应式分别为
负极:Pb(s)+ (aq)-2e-===PbSO4(s);
正极:PbO2(s)+4H+(aq)+ (aq)+2e-===PbSO4(s)+2H2O(l)。
当电路中转移0.2 mol电子时,负极、正极质量如何变化?
深度思考
提示 负极质量增加9.6 g,正极质量增加6.4 g。
应用体验
1.某普通锌锰干电池的结构如图所示。下列说法正确的是
A.锌筒是原电池的正极
B.石墨电极上发生氧化反应
C.铵根离子流向石墨电极
D.电子经石墨棒沿电解质溶液流向锌筒
√
锌锰干电池中,锌筒作负极,石墨棒作正极,正极上二氧化锰得电子发生还原反应,A、B错误;
原电池中阳离子向正极移动,故铵根离子流向石墨电极,C正确;
电子经导线由负极锌筒流向石墨棒,D错误。
2.(2022·兰州第一中学高一期中)镍氢电池放电时的总反应是: H2+NiO(OH)===Ni(OH)2,根据此反应判断,下列说法正确的是
A.电池放电时,电池负极周围溶液的碱性不断增大
B.电池放电时,镍元素被氧化
C.电池放电时,氢元素被还原
D.电池放电时,通入H2的一极是负极
√
电池放电时,负极反应式为H2-2e-+2OH-===2H2O,所以负极周围溶液的氢氧根离子减少,溶液的pH减小,A错误;
电池放电时,正极反应式为NiO(OH)+H2O+e-===OH-+Ni(OH)2,镍元素被还原,B错误;
电池放电时,H2是负极,氢元素化合价升高,被氧化,C错误、D正确。
放电时,Cd由0价到+2价,失电子,故负材料为Cd。
3.镍-镉(Ni-Cd)可充电电池的总反应为Cd(OH)2+2Ni(OH)2 Cd+2NiO(OH)+2H2O,由此可知,放电时该电池的负极材料是
A.Cd B.NiO(OH)
C.Cd(OH)2 D.Ni(OH)2
返回
√
燃料电池
二
1.概念
一种将燃料(如氢气、甲烷、乙醇)和氧化剂(如氧气)的化学能直接转化为电能的电化学反应装置。
2.特点
(1)清洁、安全、高效等;
(2)能量转化率可以达到80%以上;
(3)反应物不是储存在电池内部,而是从外部提供,供电量易于调节。
3.氢氧燃料电池
该电池反应式为
负极: ;
正极: ;
总反应: 。
H2+2OH--2e-===2H2O
O2+2H2O+4e-===4OH-
2H2+O2===2H2O
特点提醒 (1)燃料电池工作中化学能直接转化为电能,燃料并没有燃烧。
(2)氢氧燃料电池在不同介质中的总反应相同,均为2H2+O2===2H2O,但正、负极反应与电解质溶液有关。
正误判断
(1)燃料电池是利用燃料的燃烧发电( )
(2)燃料电池中,燃料在正极上发生氧化反应( )
(3)氢氧燃料电池将热能直接转变为电能( )
(4)氢氧燃料电池将化学能完全转变为电能( )
(5)氢氧燃料电池比氢气直接燃烧发电能量利用率高( )
×
×
×
×
√
深度思考
写出下列燃料电池的正负极反应式和总反应。
(1)氢氧酸性燃料电池
负极: ;
正极: ;
总反应: 。
2H2-4e-===4H+
O2+4H++4e-===2H2O
2H2+O2===2H2O
深度思考
(2)CH4酸性燃料电池
负极: ;
正极: ;
总反应: 。
(3)甲醇-空气碱性燃料电池
负极: ;
正极: ;
总反应: 。
CH4+2H2O-8e-===CO2+8H+
2O2+8H++8e-===4H2O
CH4+2O2===CO2+2H2O
3O2+12e-+6H2O===12OH-
(4)铝-空气燃料电池(NaOH溶液为电解质溶液)
负极: ;
正极: ;
总反应: 。
O2+2H2O+4e-===4OH-
深度思考
归纳总结
电极反应式的书写步骤
应用体验
1.科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机酸转化为氢气,氢气进入以磷酸为电解质的燃料电池中发电,电池负极反应式为
A.H2+2OH--2e-===2H2O
B.O2+4H++4e-===2H2O
C.H2-2e-===2H+
D.O2+2H2O+4e-===4OH-
√
电解质溶液为酸性溶液,电极反应式中不能出现OH-,A、D错误;
又因为燃料电池中负极通入氢气,正极通入氧气,B错误。
2.电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图所示。下列说法正确的是
A.电流由a极流向b极
B.溶液中的OH-向b极移动
C.a极的电极反应式为2NH3-6e-===N2+6H+
D.b极的电极反应式为O2+4e-+2H2O===4OH-
√
氧气在b极发生还原反应,则b极为正极,电流由正极流向负极,则电流由b极流向a极,A项错误;
溶液中的阴离子会移向负极,故OH-向a极移动,B项错误;
a极通入氨气生成氮气,电解质溶液显碱性,则a极的电极反应式为2NH3+6OH--6e-===N2+6H2O,C项错误;
b极通入氧气,氧气得电子被还原,电极反应式为O2+4e-+2H2O===
4OH-,D项正确。
返回
电解在物质制备中的应用
三
1.电解池
将 能转化为 能的装置。
2.电解在物质制备中的应用
(1)电解水制氢气和氧气
(2)电解饱和食盐水制备烧碱、氯气和氢气
电
化学
(3)电解制取金属
①电解熔融的氧化铝制备铝
阴极反应式: ;
阳极反应式: ;
总反应式: 。
②电解制备其他活泼金属
电解熔融的 、 、 可分别得到钠、镁、钙的单质和氯气。
(4)通常条件下无法自发进行的化学反应可通过电解的方法实现。
Al3++3e-===Al
2O2--4e-===O2↑
氯化钠
氯化镁
氯化钙
应用体验
1.下列金属单质一般不用电解的方法制取的是
A.钠 B.铝
C.钙 D.铁
√
2.请写出下列过程中能量转化的主要形式。
(1)铅蓄电池的充电过程:_________________;
(2)铅蓄电池的放电过程:_________________;
(3)氢气在氧气中燃烧:_______________________;
(4)氢气和氧气在燃料电池中反应:_________________;
(5)电解水:_________________。
返回
电能转化为化学能
化学能转化为电能
化学能转化为热能和光能
化学能转化为电能
电能转化为化学能
随堂演练 知识落实
1.下列电池工作时,O2在正极得电子的是
1
2
3
4
A B C D
锌锰干电池 铅蓄电池 氢氧燃料电池 镍镉电池
√
氢氧燃料电池的总反应是2H2+O2===2H2O,因而正极是O2得电子发生还原反应。
2.汽车的启动电源常用铅蓄电池。其结构如图所示,放电时的电池反应为PbO2+Pb+2H2SO4===2PbSO4+2H2O,根据此反应判断下列说法正确的是
A.负极反应式:Pb-2e-+ ===PbSO4
B.电池放电时,溶液的酸性增强
C.PbO2得电子,被氧化
D.PbO2是电池的负极
1
2
3
4
√
1
2
3
4
Pb失电子作负极,电极反应式为Pb+
-2e-===PbSO4,故A正确;
放电时,硫酸参加反应,导致溶液中氢离子浓度减小,则溶液的酸性减弱,故B错误;
PbO2得电子,被还原,故C错误;
根据电池反应式知,PbO2在反应中得电子,Pb元素的化合价由+4变为+2,所以二氧化铅作正极,故D错误。
3.(2022·安徽亳州二中高二开学考试)如图为氢氧燃料电池示意图,电池总反应式为2H2+O2===2H2O,下列说法正确的是
A.电流由a极经导线流向b极
B.a极为燃料电池的正极
C.该电池属于环境友好电池
D.该装置将电能转化为化学能
√
1
2
3
4
1
2
3
4
根据总反应可知氢气被氧化,氧气被还原,所以a电极为负极,b电极为正极。电流由正极流向负极,即由b极经导线流向a极,A错误;
a电极上氢气发生氧化反应,为燃料电池的负极,B错误;
该电池的产物为水,无污染,为环境友好电池,C正确;
原电池可以将化学能转化为电能,D错误。
4.有一种微型电池,其电极分别为Zn和Ag2O,电解质溶液是KOH溶液,试回答下列问题:
(1)原电池是把______能转化成____能的装置。
(2)该电池中Zn极为____极。
(3)当金属Zn消耗了16.25 g时,转移电子的物质的量为________。
1
2
3
4
化学
电
负
0.5 mol
返回
课时对点练
题组一 一次电池、二次电池
1.下列有关锌锰干电池的说法正确的是
A.锌外壳是负极,石墨棒是正极
B.在外电路中电子从石墨棒流向锌外壳
C.电流从锌外壳流到石墨棒上
D.在电池内部阳离子从石墨棒向锌外壳移动
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
A项,在锌锰干电池中,锌外壳是负极,石墨棒是正极,故正确;
B项,在外电路中电子从锌外壳流向石墨棒,故错误;
C项,电流的方向与电子的流向相反,应从石墨棒流向锌外壳,故错误;
D项,电池内部,阳离子向正极石墨棒移动,故错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
2.银锌纽扣电池如图所示,其电池的总反应式为Zn+Ag2O+H2O===
Zn(OH)2+2Ag。
下列说法不正确的是
A.锌作负极,发生氧化反应
B.正极为Ag2O,发生还原反应
C.电池工作时,电流从Ag2O流向Zn
D.负极的电极反应式为Zn-2e-===Zn2+
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
Zn失电子发生氧化反应而作负极,故A正确;
正极上Ag2O得电子发生还原反应,故B正确;
原电池中电流从正极沿导线流向负极,该电池
中Zn是负极、Ag2O是正极,所以放电时电流从Ag2O经导线流向Zn,故C正确;
碱性条件下锌离子生成Zn(OH)2,所以负极电极反应式为Zn+2OH--2e-===Zn(OH)2,故D错误。
3.(2022·山东日照高一检测)一种锂水电池以锂和钢板为电极,LiOH为电解质,使用时加入水即可放电,总反应为2Li+2H2O===2LiOH+H2↑。下列有关该电池的说法错误的是
A.锂极为负极
B.OH-移向正极
C.H2为正极产物
D.电子由锂经导线流向钢板
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
由方程式可知,Li失去电子,发生氧化反应,作负极,则钢板作正极,A项正确;
正极上的电极反应式为2H2O+2e-===2OH-+H2↑,可知氢气为正极产物,C项正确;
电子会从负极流向正极,即电子由锂经导线流向钢板,D项正确。
4.某华人科学家和他的团队研发出“纸电池”。这种一面镀锌、一面镀二氧化锰的超薄电池在使用印刷与压层技术后,变成一张可任意裁剪大小的“电纸”,厚度仅为0.5毫米,可以任意弯曲和裁剪。纸内的离子“流过”水和氧化锌组成电解质溶液,电池总反应式为Zn+2MnO2+H2O===ZnO+2MnO(OH)。下列说法正确的是
A.该电池的正极材料为锌
B.该电池反应中二氧化锰发生氧化反应
C.电池的正极反应式为MnO2+H2O+e-===MnO(OH)+OH-
D.当有0.1 mol锌溶解时,流经电解质溶液的电子数为1.204×1023
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
该原电池中,锌元素化合价由0变为+2,锌失电子作负极,故A错误;
该原电池中,锰元素化合价由+4变为+3,所以二氧化锰作正极,发生还原反应,故B错误;
正极上二氧化锰得电子发生还原反应,电极反应为MnO2+e-+H2O
===MnO(OH)+OH-,故C正确;
电子从负极沿导线流向正极,不经过电解质溶液,故D错误。
5.(2022·广州高一期中)手机使用的锂电池以质量轻、能量高而备受关注,目前已成功研制出多种锂电池。某种锂电池的总反应是Li+MnO2===
LiMnO2。下列说法中正确的是
A.MnO2是负极,电极反应式为MnO2+e-===
B.电池工作时,电子由正极通过外电路流向负极
C.电池内部产生的 向锂电极移动
D.钠比锂更活泼,相同质量的钠作电极比锂提供的电能更多
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
由锂电池的总反应为Li+MnO2===LiMnO2可知Li失去电子,Li作负极,正极上MnO2得到电子,正极反应为MnO2+e-=== ,故A错误;
电池工作时,电子由负极通过外电路流向正极,故B错误;
电池内部产生的 向负极即锂电极移动,故C正确;
钠和锂为同主族元素,相同物质的量的Na和Li失电子数相同,Li的相对原子质量较小,则相同质量的钠作电极比锂失电子数少,提供的电能少,故D错误。
题组二 燃料电池
6.燃料电池是目前电池研究的热点之一。某课外小组自制的氢氧燃料电池如图所示,a、b均为惰性电极。下列叙述错误的是
A.a极是负极,该电极上发生氧化反应
B.b极发生的电极反应是2H2O+2e-===H2↑+2OH-
C.电池总反应为2H2+O2===2H2O
D.氢氧燃料电池是一种具有应用前景的绿色电源
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
A项,a极通入H2,为负极,电极反应式为2H2+4OH--4e-===4H2O,发生的是氧化反应,正确;
B项,b极通入O2,为正极,电极反应式为O2+2H2O+4e-===4OH-,错误;
C项,正、负极电极反应式相加可得,电池总反应为2H2+O2===2H2O,正确;
D项,氢氧燃料电池的能量高,且产物为水,对环境无污染,故是具有应用前景的绿色电源,正确。
7.一种直接铁燃料电池(电池反应为3Fe+2O2===Fe3O4)的装置如图所示,下列说法正确的是
A.Fe极为电池正极
B.KOH溶液为电池的电解质溶液
C.电子由多孔碳极沿导线移向Fe极
D.5.6 g Fe参与反应,导线中转移1.204
×1023个电子
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
该电池中铁失去电子,为电池负极,A项错误;
电子由Fe极沿导线移向多孔碳极,C项错误;
根据电池反应3Fe+2O2===Fe3O4,可知,3 mol铁参与反应时转移8 mol电子,故5.6 g Fe参与反应,导线中转移1.605×1023个电子,D项错误。
8.可用于电动汽车的铝-空气燃料电池,若以氢氧化钠溶液为电解质溶液,铝为负极,通入空气的电极为正极。下列说法正确的是
A.正极反应式为O2+2H2O+4e-===4OH-
B.负极反应式为Al+3OH--3e-===Al(OH)3
C.电池在工作过程中电解质溶液的碱性保持不变
D.电池工作时,电子通过外电路从正极流向负极
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
A对,通入空气的电极为正极,碱性条件下的正极反应式为O2+2H2O+4e-===4OH-;
B错,铝为负极,碱性条件下的负极反应式为Al+4OH--3e-===
+2H2O;
C错,该电池在碱性条件下消耗NaOH,总反应为4Al+4OH-+3O2===
+2H2O,则碱性不断减弱;
D错,电池工作时,电子从负极流出经过外电路流向正极。
题组三 电解在物质制备中的应用
9.下列说法错误的是
A.电解水可以制得氢气和氧气
B.电解饱和食盐水可以制得钠和氯气
C.电解熔融的氧化铝可以制得金属铝
D.手机充电时电能转化为化学能
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
电解饱和食盐水得到的是NaOH、H2和Cl2,电解熔融NaCl可以得到Na和Cl2,B项错误。
10.(2022·河南省洛阳市第一中学高一期中)下面是几种常见的化学电源示意图,有关说法不正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
A.上述电池分别属于一次电池、二次电池和燃料电池
B.干电池在长时间使用后,锌筒被破坏
C.铅蓄电池在工作中,负极每消耗1 mol铅,则硫酸中就转移2 mol电子
D.氢氧燃料电池是一种具有广阔应用前景的绿色电源
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
干电池是一次电池,铅蓄电池是可充电电池,属于二次电池,氢氧燃料电池属于燃料电池,故A正确;
在干电池中,Zn作负极,被氧化,故B正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
铅蓄电池工作过程中负极每消耗1 mol铅,则线路中会转移2 mol电子,硫酸中无电子转移,故C错误。
11.随着环保整治的逐渐推进,乙醇作为一种燃料逐渐走进人们的视野,如“乙醇汽油”“乙醇电池”等。如图是一种新型的乙醇电池的工作示意图,该电池总反应为C2H5OH+3O2===2CO2+3H2O。下列有关该电池的说法正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
A.a极为正极,b极为负极
B.负极反应式为C2H5OH+3H2O-12e-===2CO2↑+12H+
C.反应中转移6 mol电子时,正极消耗33.6 L O2
D.该燃料电池工作一段时间后,酸性增强
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
质子为H+,依据质子(H+)向正极移动,可确定a极为负极,b极为正极,A项错误;
在电池负极,C2H5OH在酸性电解质溶液中失电子,生成二氧化碳等 ,负极反应式为C2H5OH+3H2O-12e-===2CO2↑+12H+,B项正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
正极反应式为O2+4e-+4H+===2H2O,当反应中转移6 mol电子时,正极消耗1.5 mol O2,但由于温度、压强未知,所以O2的体积不一定是33.6 L,C项错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
由电池总反应C2H5OH+3O2===2CO2+3H2O可知,该燃料电池工作一段时间后,H+的物质的量不变,但溶剂的质量增加,所以溶液的酸性减弱,D项错误。
12.银制器皿表面日久因生成Ag2S而变黑,可进行如下处理:将表面发黑的银器浸入盛有食盐水的铝质容器中(如图),一段时间后黑色褪去。下列说法正确的是
A.该处理过程中电能转化为化学能
B.银器为正极,Ag2S还原为单质银
C.Ag2S溶于食盐水中生成了AgCl
D.铝质容器为阳极,其质量变轻
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
将表面发黑的银器浸入盛有食盐水的铝质容器中,形成原电池,能量变化是化学能转化为电能,故A错误;
依据原电池原理分析,铝和硫化银在食盐水中形成原电池,铝做负极,银器做正极,硫化银被还原为银,故B正确;
原电池反应中硫化银被还原为银单质,不是Ag2S溶于食盐水中生成了AgCl,故C错误;
铝在原电池中做负极,质量减轻,故D错误。
13.(2022·云南师大附中高一检测)锌-空气电池装置如图所示,该电池的核心是ORR反应和OER反应,KOH溶液为电解质溶液,放电时总反应为2Zn+O2+4OH-+2H2O=== ,下列有关说法正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
A.放电时电解质溶液中OH-向正极移动
B.放电时,电路中通过2 mol电子,消耗氧气11.2 L
C.发生OER反应的电极反应式为2H2O-4e-===O2↑+4H+
D.在电池放电过程中,空气进入电池,发生ORR反应,释放OH-
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
原电池中阴离子向负极移动,故放电时电解质溶液中OH-向负极移动,A错误;
没有说明是标况,不能计算氧气体积,B错误;
反应在碱性条件下进行,发生OER反应的电极反应式为4OH--4e-===O2↑+2H2O,C错误;
空气进入电池,氧气得到电子发生还原反应,ORR反应:O2+4e-+2H2O===4OH-,D正确。
14.(2021·山东威海高一期末)一种肼(N2H4)-空气碱性燃料电池工作原理如图所示。下列说法错误的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
A.a为空气,b为N2H4
B.M为正极,电极反应为O2+4e-+4H+===2H2O
C.电路中通过1 mol电子时,同时有1 mol OH-从左室通过阴离子交换膜
移到右室
D.当有16 g N2H4完全反应生成N2,消耗标准状况下11.2 L O2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
燃料电池通入燃料的一极为负极、电子从负极流出,故 b为N2H4,A正确;
此电池为碱性燃料电池,M为正极,则电极反应为O2+4e-+2H2O===4OH-,B不正确;
燃料电池中,阴离子移向负极,根据得失电子守恒,有关系式e-~OH-,则电路中通过1 mol电子时,同时有1 mol OH-从左室正极区通过阴离子交换膜移到右室负极区,C正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
负极反应式为N2H4-4e-+4OH-===N2+4H2O,正极电极反应为O2+4e-+2H2O===
4OH-,根据得失电子守恒,N2H4~4e-~O2,当有1 mol即32 g N2H4完全反应生成N2,消耗
1 mol O2,则当有16 g N2H4完全反应生成N2,消耗0.5 mol O2,即标准状况下11.2 L O2,D正确。
15.(2022·天津高一期中)(1)如图为氢氧燃料电池的构造示意图,根据电子运动方向可知,氧气从______(填“a”或“b”)口通入,X极为电池的______(填“正”或“负”)极。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
b
负
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
氢氧燃料电池中,电子从负极向正极移动,X是负极,Y是正极,氧气应通入正极。
(2)某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,两极上发生的电极反应分别为
A极:2H2+2O2--4e-===2H2O
B极:O2+4e-===2O2-
则A极是电池的____极;电子从该极______
(填“流入”或“流出”)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
负
流出
根据电极反应可知,A极发生氧化反应,应该是电池的负极,电子从该极流出。
(3)若将(1)中燃料电池改为甲烷-空气燃料电池,工作时,负极反应式为__________
______________________,电池总反应式为_________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
CH4-8e-
CH4+2O2+2KOH===K2CO3+3H2O
甲烷-空气燃料电池,通甲烷的一极(X)为负极,通空气的一极(Y)为正极,电池总反应式为CH4+2O2+2KOH===K2CO3+3H2O,负极反应式为CH4-8e-+10OH-=== +7H2O。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
16.(1)科研人员设想用如图甲所示装置生产硫酸。
①题述生产硫酸的总反应方程式为____________
________________,b是____极,b电极反应式为_________________________,生产过程中H+向____(填“a”或“b”)电极区域运动。
2SO2+O2+
2H2O===2H2SO4
正
O2+4e-+4H+===2H2O
b
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
根据装置图甲可知a电极通入SO2,SO2发生失去电子的氧化反应,O2从正极通入,因此上述生产硫酸的总反应方程式为2SO2+O2+2H2O===2H2SO4,b电极通入O2是正极,O2在酸性条件下得电子生成水,反应式为O2+4e-+4H+===2H2O,原电池中
阳离子向正极移动,则生产过程中H+向b电极区域运动。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
②该小组同学反思原电池的原理,其中观点正确的是_____(填字母)。
A.原电池反应的过程中可能没有电子发生转移
B.原电池装置一定需要两个活泼性不同的金属
电极
C.电极一定不能参加反应
D.氧化反应和还原反应可以拆开在两极发生
D
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
原电池反应的过程中一定有电子发生转移,A项错误;
原电池装置不一定需要两个活泼性不同的金属电极,例如燃料电池等 ,B项错误;
原电池中电极可以参加反应,例如铜、锌、稀硫酸组成的原电池中锌电极参加反应,C项错误;
原电池中氧化反应和还原反应可以拆开在两极发生,D项正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(2)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的原电池如图乙所示,质子交换膜(只允许H+通过)左右两侧的溶液均为1 L 2 mol·L-1
H2SO4溶液。电池总反应为2CH3OH+3O2===2CO2+4H2O,电极c为______(填“正极”或“负极”),c电极反应式为__________________
___________________。当电池中有1 mol e-发生转移时左右两侧溶液的质量之差为_____g (假设反应物耗尽,忽略气体的溶解)。
负极
CH3OH-6e-+
H2O===CO2↑+6H+
12
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
根据装置图乙可知电子从c电极流出,则c电极是负极,电池总反应为2CH3OH+3O2===2CO2
+4H2O,所以CH3OH在负极发生失去电子的氧化反应转化为CO2,则c电极反应式为CH3OH
-6e-+H2O===CO2↑+6H+;当转移1 mol电子时,左侧质量减轻 ×
(18-6) g=2 g,还有1 mol H+通过质子交换膜进入右侧,质量减少1 g,正极反应式为O2+4H++4e-===2H2O,右侧质量增加32 g× =8 g,加上转移过来的1 g H+,因此左右两侧溶液的质量之差为8 g+1 g+2 g+1 g=12 g。
返回
本课结束
专题6
