专题6 第一单元 第3课时 化学反应速率和限度的相关计算与图像分析 课件(共96张PPT)
文档属性
| 名称 | 专题6 第一单元 第3课时 化学反应速率和限度的相关计算与图像分析 课件(共96张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-08 15:51:04 | ||
图片预览








文档简介
(共96张PPT)
第3课时
DISANKESHI
化学反应速率及平衡的相关计算 / 化学反应速率和限度的图像分析 / 课时对点练
化学反应速率和限度的相关计算与图像分析
专题6
核心素养
发展目标
1.学会列“三段式”进行某物质“转化量”“平衡量”“化学反应速率”的计算。
2.学会分析及应用化学平衡图像。
内容索引
课时对点练
一、化学反应速率及平衡的相关计算
二、化学反应速率和限度的图像分析
化学反应速率及平衡的相关计算
一
1.列出一个模型——“三段式”思维模型
解答有关化学反应速率和化学平衡的计算题时,一般需要写出化学方程式,列出起始量、变化量及平衡量,再根据题设其他条件和定律列方程求解。如mA(g)+nB(g) pC(g)+qD(g),令A、B起始物质的量分别为a mol、b mol,达到平衡后消耗A的物质的量为mx mol。
mA(g)+nB(g) pC(g)+qD(g)
起始量/mol a b 0 0
变化量/mol mx nx px qx
平衡量/mol a-mx b-nx px qx
注意 (1)a、b也可指浓度或气体的体积、压强等。
(2)明确三个量的关系
①同一反应物:起始量-变化量=平衡量。
②同一生成物:起始量+变化量=平衡量。
③各变化量之比=各物质的化学计量数之比。
2.掌握四个公式——“三段式”应用
3.化学反应速率计算
(1)根据定义求化学反应速率v= 。
(2)根据关系式计算反应速率
对于同一个化学反应,用不同物质表示的化学反应速率之比等于相应物质在化学方程式中的化学计量数之比。例如:对于反应aA(g)+bB(g)
cC(g)+dD(g),有v(A)∶v(B)∶v(C)∶v(D)=a∶b∶c∶d。
应用体验
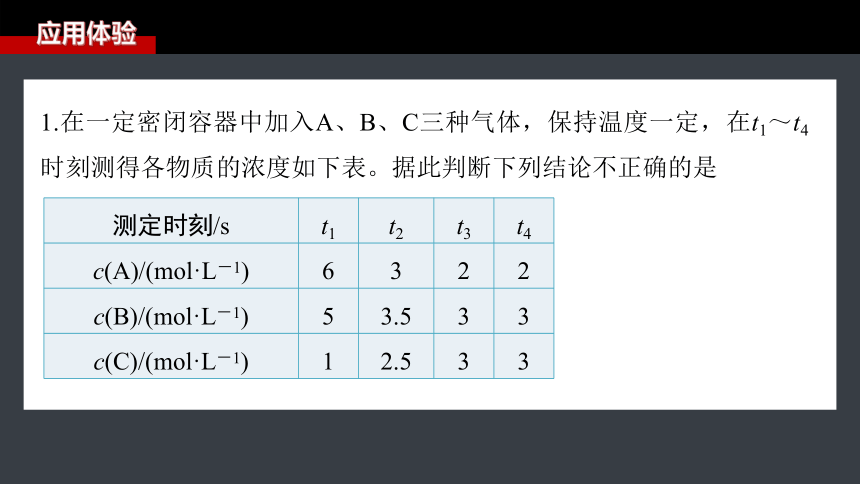
1.在一定密闭容器中加入A、B、C三种气体,保持温度一定,在t1~t4时刻测得各物质的浓度如下表。据此判断下列结论不正确的是
测定时刻/s t1 t2 t3 t4
c(A)/(mol·L-1) 6 3 2 2
c(B)/(mol·L-1) 5 3.5 3 3
c(C)/(mol·L-1) 1 2.5 3 3
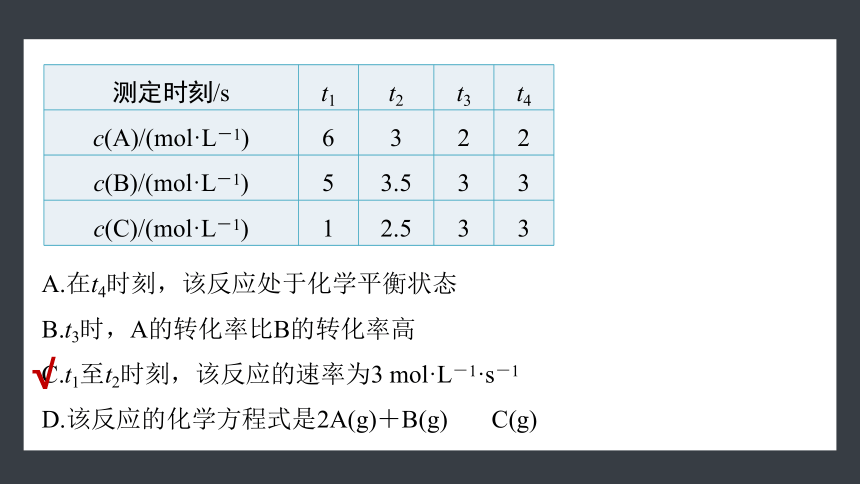
测定时刻/s t1 t2 t3 t4
c(A)/(mol·L-1) 6 3 2 2
c(B)/(mol·L-1) 5 3.5 3 3
c(C)/(mol·L-1) 1 2.5 3 3
A.在t4时刻,该反应处于化学平衡状态
B.t3时,A的转化率比B的转化率高
C.t1至t2时刻,该反应的速率为3 mol·L-1·s-1
D.该反应的化学方程式是2A(g)+B(g) C(g)
√
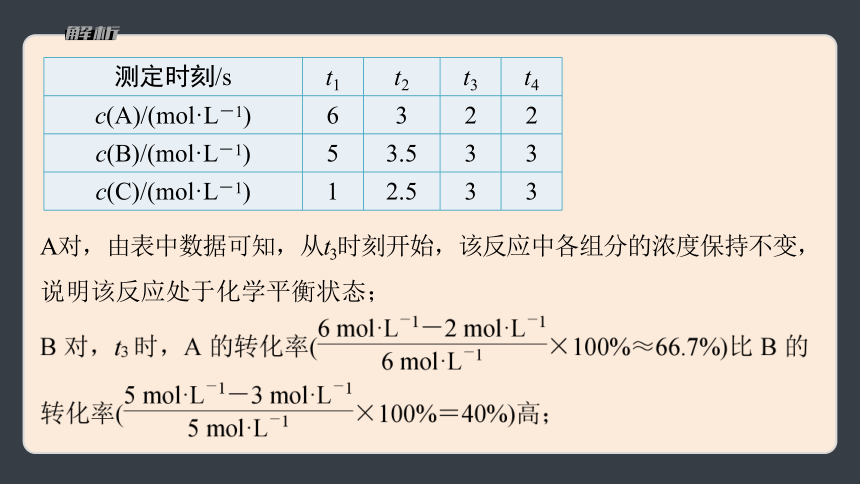
测定时刻/s t1 t2 t3 t4
c(A)/(mol·L-1) 6 3 2 2
c(B)/(mol·L-1) 5 3.5 3 3
c(C)/(mol·L-1) 1 2.5 3 3
A对,由表中数据可知,从t3时刻开始,该反应中各组分的浓度保持不变,说明该反应处于化学平衡状态;
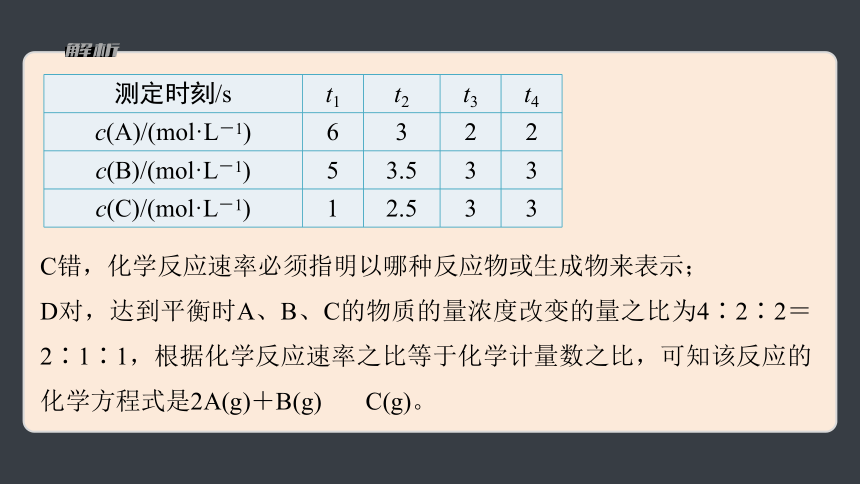
测定时刻/s t1 t2 t3 t4
c(A)/(mol·L-1) 6 3 2 2
c(B)/(mol·L-1) 5 3.5 3 3
c(C)/(mol·L-1) 1 2.5 3 3
C错,化学反应速率必须指明以哪种反应物或生成物来表示;
D对,达到平衡时A、B、C的物质的量浓度改变的量之比为4∶2∶2=2∶1∶1,根据化学反应速率之比等于化学计量数之比,可知该反应的化学方程式是2A(g)+B(g) C(g)。
2.373 K时把0.24 mol无色的N2O4气体通入体积为500 mL的密闭容器中,发生反应:N2O4 2NO2,容器中立即出现红棕色。反应进行到2 s时,测得生成NO2的物质的量为0.04 mol;反应进行到60 s时,容器内N2O4与NO2的物质的量相等。请计算:
(1)开始2 s内以N2O4表示的化学反应速率为________________。
0.02 mol·L-1·s-1
(2)反应进行到60 s时体系的压强与开始时体系的压强之比为______。
4∶3
设反应的N2O4的物质的量为x mol,运用“三段式”法进行计算:
N2O4 2NO2
起始/mol 0.24 0
反应/mol x 2x
60 s时/mol 0.24-x 2x
60 s时容器内N2O4与NO2的物质的量相等,因此0.24-x=2x,解得x=0.08,60 s时体系的压强与开始时体系的压强之比=60 s时气体的物质的量与开始时气体的物质的量之比=
(3)N2O4的转化率为________。
33.3%
3.恒温恒容下,将2 mol A气体和4 mol B气体通入体积为2 L的密闭容器中发生反应:2A(g)+B(g) xC(g)+2D(s),2 min达到平衡,测得平衡时A的物质的量为1.2 mol,C的浓度为0.8 mol·L-1。
(1)从开始反应至达到平衡状态,生成C的平均反应速率为_________________。
0.4 mol·L-1·min-1
(2)x=____。
4
根据三段式:2A(g)+B(g) xC(g)+2D(s)
起始/mol 2 4 0
转化/mol 0.8 0.4 2×0.8
平衡/mol 1.2 3.6 1.6
即Δn(A)∶Δn(C)=(0.8 mol)∶(1.6 mol)=2∶x,
解得x=4。
(3)A的转化率与B的转化率之比为_______。
4∶1
(4)下列各项可作为该反应达到平衡状态的标志的是_______(填字母)。
A.压强不再变化
B.气体密度不再变化
C.气体的平均相对分子质量不再变化
D.A的消耗速率与B的消耗速率之比为2∶1
ABC
反应前后气体分子数不同,当压强不再变化时,达到平衡状态,A正确;
反应有固体生成,当气体密度不变时达到平衡状态,B正确;
反应前后气体体积不同,当气体的平均相对分子质量不再变化时,达到平衡状态,C正确;
A和B的消耗速率均表示正反应速率,不能由此判断反应达到平衡状态,D错误。
返回
化学反应速率和限度的图像分析
二
1.简单的速率图像及应用
2.化学反应速率和反应限度的图像综合分析
“一看、二想、三判断”这三个步骤来分析解答
(1)“一看”——看图像
①看面:理解各坐标轴所代表量的意义及曲线所表示的是哪些量之间的关系。
②看线:分清正反应和逆反应,分清突变和渐变、小变和大变;理解曲线“平”与“陡”即斜率大小的意义;理解曲线的变化趋势并归纳出规律。若图中有拐点,可按照先拐先平的规律,即较早出现拐点的曲线所表示的反应先达到平衡,对应的温度高、压强大。
③看点:理解曲线上点的意义,特别是某些特殊点,如坐标轴的交点、几条曲线的交叉点、极值点、转折点等。分清反应物和生成物,浓度减小的是反应物,浓度增大的是生成物。
④看辅助线:做横轴或纵轴的垂直线(如等温线、等压线、平衡线等)。
⑤看量的变化:弄清楚是物质的量的变化、浓度的变化还是转化率的变化。
(2)“二想”——想规律
如各物质的转化量之比与化学计量数之比的关系、各物质的化学反应速率之比与化学计量数之比的关系、外界条件的改变对化学反应的影响以及对正、逆反应速率的影响规律等。
(3)“三判断”——利用有关规律,结合图像,通过对比分析,做出正确判断。
应用体验
1.如图是足量铝片(表面有氧化膜)和一定量稀硫酸反应,产生氢气的速率与反应时间的图像,下列有关描述错误的是
A.O→a段v(H2)为零,说明反应未进行
B.b→c段产生氢气的速率加快,可能是该反应为
放热反应
C.a→b段产生氢气的速率加快,可能是铝片表面的Al2O3薄膜逐渐溶解,
加快了反应速率
D.c点之后,产生氢气的速率下降,可能是c(H+)下降导致反应速率下降
√
表面有氧化膜的铝片和稀H2SO4反应,Al2O3和H2SO4首先反应生成Al2(SO4)3和H2O,无氢气生成,故O→a段并不是反应未进行,而是Al2O3和H2SO4反应,故A项错误;
随着反应进行,Al和H2SO4接触面积增大,而且Al和H2SO4反应为放热反应,故生成氢气的速率逐渐加快,故B、C项正确;
c点之后,H+浓度的减小成了影响产生氢气速率的主要因素,故随着H+浓度减小反应速率逐渐减慢,故D项正确。
2.在一密闭容器中加入A和B,各物质的物质的量浓度随反应的变化如图所示。下列说法不正确的是
A.该反应的化学方程式为5A+4B 4C
B.2 min前,正反应速率逐渐减小,逆反应速率
逐渐增大
C.用B的浓度变化表示2 min内的速率为2 mol·L-1·min-1
D.2 min时,该反应达到平衡,此时A、B、C的浓度之比为5∶4∶4
√
A对,由图可知,当(6-1) mol·L-1 A反应时,有(7-3) mol·L-1 B反应,生成4 mol·L-1 C,故该反应的化学方程式为5A+4B 4C;
B对,2 min前,反应物A和B减少,生成物C增多,所以正反应速率逐渐减小,逆反应速率逐渐增大;
D错,2 min时该反应达到平衡,此时A、B、C的浓度之比为1∶3∶4。
3.(2022·合肥高一月考)如图所示是425 ℃ 时,在1 L密闭容器中发生化学反应的浓度随时间的变化示意图。
下列叙述错误的是
A.图①中t0时,三种物质的物质的
量相同
B.图①中t0时,反应达到平衡状态
C.图②中的可逆反应为2HI(g) H2(g)+I2(g)
D.图①②中当c(HI)=3.16 mol·L-1时,反应达到平衡状态
√
图①中t0时,三种物质的物质的量浓度相等,由于体系恒容,所以三者的物质的量也相等,故A正确;
图①中t0时,三种物质的物质的量浓度相等,但t0后各物质的物质的量浓
度仍在变化,反应没有达到平衡状态,故B错误;
图①②中当c(HI)=3.16 mol·L-1时,各物质的物质的量浓度开始保持不变,说明反应均达到平衡状态,故D正确。
返回
课时对点练
题组一 化学反应速率的相关计算
1.(2022·南昌高一期中)在一定条件下,将3 mol A和1 mol B两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(g)。2 min末,测得生成0.8 mol C、0.4 mol D。下列判断正确的是
A.x=2
B.2 min末,A的浓度为1.2 mol·L-1
C.2 min内A的反应速率为0.3 mol·L-1·min-1
D.2 min内B的浓度的改变量为0.4 mol·L-1
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
物质的量变化量之比等于化学计量数之比,故0.8 mol∶0.4 mol=x∶2,解得x=4,列三段式:
3A(g)+B(g) 4C(g)+2D(g)
起始量/mol 3 1 0 0
变化量/mol 0.6 0.2 0.8 0.4
2 min末/mol 2.4 0.8 0.8 0.4
由上述分析可知x=4,A项错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
2.反应A(g)+3B(g)===2C(g)+2D(g)在四种不同情况下的反应速率分别为①v(A)=0.45 mol·L-1·min-1 ②v(B)=0.6 mol·L-1·s-1 ③v(C)=0.4 mol·L-1·s-1 ④v(D)=0.45 mol·L-1·s-1,下列有关反应速率的比较中正确的是
A.④<③=②<① B.④>③>②>①
C.④>③=②>① D.①>②>③>④
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
3.(2022·重庆高一月考)在一定温度时,将2 mol A和2 mol B放入容积为5 L的某密闭容器中发生反应2A(s)+2B(g) C(g)+2D(g),经5 min后测得容器内B的浓度减少了0.2 mol·L-1。下列叙述不正确的是
A.在5 min内,该反应用C的浓度变化表示的反应速率为0.02 mol·L-1·min-1
B.5 min时,容器内D的浓度为0.2 mol·L-1
C.当容器内压强保持恒定时,该可逆反应达到平衡状态
D.5 min时容器内气体总的物质的量为3 mol
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
由题意可建立如下三段式:
2A(s)+2B(g) C(g)+2D(g)
起始/(mol·L-1) 0.4 0 0
变化/(mol·L-1) 0.2 0.1 0.2
5 min末/(mol·L-1) 0.2 0.1 0.2
分析可知,在5 min内该反应用C的浓度变化表示的反应速率为
=0.02 mol·L-1·min-1,A项正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
5 min时,容器内D的浓度为0.2 mol·L-1,B项正确;
该反应是气体体积增大的反应,当容器内压强保持恒定时,说明正、逆反应速率相等,该可逆反应达到平衡状态,C项正确;
5 min时,容器内气体总的物质的量为(0.2+0.1+0.2)mol·L-1×5 L=2.5 mol,D项错误。
题组二 化学反应速率图像分析
4.CaCO3与稀盐酸反应(放热反应)生成CO2的物质的量
与反应时间的关系如图所示。下列结论不正确的是
A.反应开始4 min内温度对反应速率的影响比浓度大
B.一段时间后,反应速率减小的原因是c(H+)减小
C.反应在2~4 min内平均反应速率最大
D.反应在2~4 min内生成CO2的平均反应速率为v(CO2)=0.1 mol·L-1·min-1
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
随着反应的进行氢离子浓度降低,氢离子浓度变化使反应速率减小。由图像可知,开始生成的二氧化碳的反应速率是增大的,说明反应为放热反应,即反应开始4 min内温度对反应速率的影响比浓度大,A项正确;
由图可知反应速率先增大后减少,反应速率减小的原因是c(H+)减小,B项正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
由图可知0~2 min、2~4 min、4~6 min时间内,生成的CO2物质的量分别是0.1 mol、0.2 mol、0.05 mol,所以反应在2~4 min内平均反应速率最大,C项正确;
没有给出反应容器的体积,只有物质的量的变化,无法计算速率,D项错误。
5.鱼浮灵是一种化学增氧剂,主要成分为过氧碳酸钠(2Na2CO3·3H2O2),分别在等体积双氧水中加入少量Na2CO3、NaCl和NaOH固体探究鱼浮灵增氧原理,实验结果如图所示。下列说法不正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
A.Na2CO3对H2O2的分解有促进作用
B.加入NaCl后溶液溶解氧变化不明显
C.H2O2分解随pH增大而持续加快
D.鱼浮灵使用时应根据pH控制投放量
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
由图可知,加入Na2CO3后水中的溶解氧增多,故说明加入Na2CO3后促进了H2O2的分解,故A正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
在双氧水中加入氯化钠后,溶液中溶解氧不变,即加入氯化钠后对双氧水的分解无催化作用,故B正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
根据双氧水加NaOH固体图可知,随着溶液pH增大,溶解氧先增大后减小,故双氧水的分解并不是随pH的增大而持续加快,故C错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
根据双氧水加NaOH固体图可知,溶液pH对鱼浮灵中双氧水的分解速率有影响,故应根据溶液的pH来决定鱼浮灵的投放量,故D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
A.图中阴影部分的面积表示t1~t2时间内 的物质
的量的减少量
B.纵坐标为v(Cl-)的v-t曲线与图中曲线完全重合
C.反应开始时速率增大可能是c(H+)所致
D.后期反应速率下降的主要原因是反应物浓度减小
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
随着反应的进行,反应物的浓度减少,反应速率减小,所以后期反应速率下降的主要原因是反应物浓度减小,故D正确。
题组三 化学反应速率及平衡的综合计算
7.(2022·大连高一检测)一定条件下,体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g)+Y(g) Z(g)正反应为放热反应,经60 s达到平衡,生成0.3 mol Z。下列说法正确的是
A.在60 s内,用X浓度变化表示的反应速率为0.01 mol·L-1·s-1
B.任何条件下反应经过60 s时一定能达到化学平衡
C.反应放出的热量可用于提高反应速率
D.反应达到平衡时,n(X)∶n(Y)=1∶1
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
反应速率与外界条件有关,如升高温度、加入催化剂等,可增大反应速率,达到平衡所用时间减少,故B错误;
反应放出的热量可使体系温度升高,升高温度可增大反应速率,故C正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
达到平衡时n(Y)=(1-0.3) mol=0.7 mol,n(X)=(1-0.6 mol)=0.4 mol,可知平衡时X、Y的物质的量不相等,故D错误。
8.将4 mol A气体和2 mol B气体置于1 L的密闭容器中,混合后发生反应:2A(g)+B(g) 2C(g),若经2 s后测得C的浓度为1.2 mol·L-1,下列说法正确的是
A.用物质A表示2 s末的反应速率为0.6 mol·L-1·s-1
B.反应后的压强是开始时的1.2倍
C.2 s末物质A的转化率为70%
D.C的产率为30%
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
根据三段式分析:
2A(g)+B(g) 2C(g)
起始/(mol·L-1) 4 2 0
变化/(mol·L-1) 1.2 0.6 1.2
2 s末/(mol·L-1) 2.8 1.4 1.2
2 s内C的平均反应速率为 =0.6 mol·L-1·s-1,同一可逆反应中同一时间段内各物质的反应速率之比等于其化学计量数之比,则v(A)=v(C)=0.6 mol·L-1·s-1,化学反应速率是平均速率,不是瞬时速率,故A错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
恒温恒容时,气体的压强之比等于气体的物质的量之比,反应后气体的总物质的量等于2.8 mol+1.4 mol+1.2 mol=5.4 mol,反应前气体的总物质的量为4 mol+2 mol=6 mol,反应后的压强是开始时的0.9倍,故B错误;
2 s末参加反应的n(A)=1.2 mol,则A的转化率为 ×100%=30%,故C错误;
假设4 mol A气体和2 mol B气体完全反应生成C的物质的量应为4 mol,2 s末物质C的物质的量为1.2 mol,则C的产率为30%,故D正确。
题组四 化学反应速率和化学平衡图像综合分析
9.一定条件下,将3 mol A气体和1 mol B气体混合于固定容积为2 L的密闭容器中,发生反应:3A(g)+B(g) C(g)+2D(s)。2 min末该反应达到平衡,生成D的物质的量随时间的变化情况如图所示。下列判断正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
A.若混合气体的密度不再改变时,该反应不一定达到平衡状态
B.2 min后,加压会使正反应速率加快,逆反应速率变慢
C.反应过程中A和B的转化率之比为3∶1
D.开始到平衡,用A表示的化学反应速率为0.3 mol·L-1·min-1
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
生成物D为固体,随反应进行,气体质量减小,容器容积不变,故气体的密度减小,气体的密度不变说明反应达到平衡,故A错误;
增大压强,A、B、C的浓度都增大,故正、逆反应速率都增大,故B错误;
A、B按物质的量之比为3∶1反应,且二者起始物质的量分别为3 mol、1 mol,故二者转化率相等,故C错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
10.一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。下列描述正确的是
A.t min时该反应达到化学平衡状态
B.反应开始到10 min,用X表示的
反应速率为0.079 mol·L-1·min-1
C.反应开始到10 min时,Y的转化率
为79%
D.反应的化学方程式为X(g)+2Y(g) 3Z(g)
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
到10 min时该反应达到化学平衡状态,A错误;
反应进行到10 min时,X、Y均减少了0.79 mol,Z增加了1.58 mol,用X
表示的反应速率为 =0.039 5 mol·L-1·min-1,反应的化学
方程式为X(g)+Y(g) 2Z(g),B、D错误;
11.为了研究碳酸钙与盐酸反应的反应速率,某同学通过实验测定碳酸钙固体与足量稀盐酸反应生成CO2的体积随时间的变化情况,绘制出如图所示的曲线甲。下列有关说法不正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
A.在O~t1、t1~t2、t2~t3中,t1~t2生成的CO2气体最多
B.因反应放热,导致O~t1 内的反应速率逐渐增大
C.若用单位时间内CO2的体积变化来表示该反应的反应速率,则t2~t3
时间内的反应速率为
D.将碳酸钙固体研成粉末,则曲线甲将变成曲线乙
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
由图可知,t1~t2 生成的CO2气体最多,故A正确;
O~t1,随着反应的进行,反应物的浓度是减小的,反应速率增大说明该反应一定放热,温度升高,反应速率加快,故B正确;
由图知,若用单位时间内CO2的体积变化来表示该反应的反应速率,则t2~t3时间内的反应速率为 mL·s-1,故C正确;
将碳酸钙固体研成粉末,反应物的接触面积增大,反应速率加快,而曲线乙表示生成CO2的速率比曲线甲慢,故D错误。
12.一定温度下,已知反应N2O4(g) 2NO2(g)。现将1 mol N2O4充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
A.①③ B.②③
C.①④ D.②④
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
①恒压条件下,反应正向气体体积增大,气体的总质量不变,故密度是变量,其不变时反应达到平衡状态;
②恒压条件下,压强是恒量,不能作为判断平衡状态的标志;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
③题给反应充入1 mol N2O4,正反应速率是逐渐减小直到不变,不符合题意;
④随反应的进行,N2O4的转化率是变量,其不变证明达到平衡状态。
13.(2021·广东,14)反应X===2Z经历两步:①X→Y;②Y→2Z。反应体系中X、Y、Z的浓度c随时间t的变化曲线如图所示。下列说法不正确的是
A.a为c(X)随t的变化曲线
B.t1时,c(X)=c(Y)=c(Z)
C.t2时,Y的消耗速率大于生成速率
D.t3后,c(Z)=2c0-c(Y)
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
X是唯一的反应物,随着反应的发生,其浓度不断减小,因此,a为c(X)随t的变化曲线,A正确;
由图可知,分别代表3种不同物质的曲线相交于t1时刻,因此t1时,c(X)=c(Y)=c(Z),B正确;
由图中信息可知,t2时刻以后,Y的浓度仍在不断减小,说明t2时Y的消耗速率大于生成速率,C正确;
由图可知,t3时刻反应①完成,X完全转化为Y,若无反应②发生,则Y的浓度为c0,由于反应②Y→2Z的发生,t3时刻后Y的浓度的变化量为c0-c(Y),则生成的Z为c(Z)=2c0-2c(Y),D不正确。
14.一定温度和一定压强下,在2 L的密闭容器中合成氨气:N2+3H2
2NH3(一定条件),反应过程中反应物和生成物的物质的量随时间的变化如图所示。下列说法错误的是
A.10~20 min内,v(N2)∶v(H2)∶v(NH3)=1∶3∶2
B.0~10 min内,用NH3表示的平均反应速率为
0.005 mol·L-1·min-1
C.该反应在20 min时达到化学平衡状态
D.N2的平衡转化率与H2平衡转化率相等
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
在一个化学反应中,用不同物质表示的反应速率之比等于化学方程式中相应物质的化学计量数之比,故v(N2)∶v(H2)∶v(NH3)=1∶3∶2,A正确;
0~10 min内,NH3的物质的量变化为0.1 mol,容器
体积为2 L,所以NH3的物质的量浓度变化为0.05 mol·L-1,所以用NH3表示的平均反应速率为 =0.005 mol·L-1·min-1,B正确;
20 min时,各物质的物质的量不再变化,说明反应在20 min时达到了化学平衡状态,C正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
起始时加入的氮气和氢气的物质的量分别为0.4 mol和0.6 mol,而变化的氮气和氢气的物质的量之比为1∶3,所以N2的平衡转化率与H2的平衡转化率不相等,D错误。
15.在一定条件下发生反应:3A(g)+2B(g) mC(g)+2D(g)。在2 L的密闭容器中把4 mol A和2 mol B混合,2 min后反应达到平衡时生成1.6 mol C,又测得D的反应速率v(D)=0.2 mol·L-1·min-1。则下列说法不正确的是
A.m=4
B.平衡时气体压强是原来的
C.A的平衡浓度是1.4 mol·L-1
D.B的转化率是40%
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
3A(g)+2B(g) 4C(g)+2D(g)
起始量/mol 4 2 0 0
转化量/mol 1.2 0.8 1.6 0.8
平衡量/mol 2.8 1.2 1.6 0.8
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
16.(2022·沈阳高一期中)在2 L密闭容器内,等物质的量的A和B在600 ℃时发生反应:2A(g)+B(g) 2C(g)。体系中,n(A)随时间的变化如表:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
时间/s 0 1 2 3 4 5
n(A)/mol 0.20 0.10 0.08 0.07 0.07 0.07
(1)达到平衡的时间是____,理由是_______________________________。
3 s
3 s之后A的物质的量不再发生变化
由表中数据可知,3 s之后A的物质的量不再发生变化,说明3 s时反应达到平衡。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
(2)如图中表示C的浓度变化的曲线是________,用B表示从0~2 s内该反应的平均速率v=_________________,达到平衡时,B的转化率α(B)=________。
c
0.015 mol·L-1·s-1
32.5%
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
初始时,C的物质的量浓度为0,由表中数据可知,
物质A反应消耗的物质的量为0.2 mol-0.07 mol=
0.13 mol,根据化学方程式2A(g)+B(g) 2C(g)可知,生成C的物质的量为0.13 mol,其物质的量浓度为 =0.065 mol·L-1,所以C的浓度变化的曲线是c;
时间/s 0 1 2 3 4 5
n(A)/mol 0.20 0.10 0.08 0.07 0.07 0.07
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
0~2 s内,物质A反应消耗的物质的量为0.2 mol-
0.08 mol=0.12 mol,根据化学方程式2A(g)+B(g)
2C(g)可知,消耗B的物质的量为0.06 mol,则用B表示从0~2 s内该反应的平均速率v= =0.015 mol·L-1·s-1;
时间/s 0 1 2 3 4 5
n(A)/mol 0.20 0.10 0.08 0.07 0.07 0.07
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
平衡时,物质A反应消耗的物质的量为0.13 mol,则消耗B的物质的量为0.065 mol,B的转化率α(B)= ×100%=32.5%。
时间/s 0 1 2 3 4 5
n(A)/mol 0.20 0.10 0.08 0.07 0.07 0.07
(3)下列状态能说明该反应已达到平衡状态的是______(填字母,下同)。
a.v逆(C)=2v正(B)
b.容器内各物质的浓度保持不变时
c.c(A)=c(C)
d.容器内气体的密度不再变化时
e.气体的平均相对分子质量不再变化时
f.A与B的浓度之比不再变化时
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
abef
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
容器内各物质的浓度保持不变时,说明各物质的生成速率等于反应消耗速率,反应达到化学平衡,b正确;
c(A)=c(C),只能说明某一时刻A、C浓度关系,不能证明反应达到化学平衡,c错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
反应2A(g)+B(g) 2C(g)在2 L的容器中进行,反应前后总质量不变,密度不变,因此容器内气体的密度不再变化,不能说明反应达到化学平衡,d错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
反应2A(g)+B(g) 2C(g),反应前后气体分子数减小,由于反应前后总质量不变,当气体的平均相对分子质量不再变化时,即摩尔质量不再变化,此时气体的总物质的量不再变化,说明反应达到化学平衡,e正确;等物质的量的A和B在600 ℃时发生反应,A、B的化学计量数之比为2∶1,随着反应的进行,A、B的浓度之比逐渐变化,当A与B的浓度之比不再变化时,反应达到化学平衡,f正确。
(4)能增大该反应的反应速率的是______。
a.适当升高温度
b.向容器中充入1 mol Ne
c.增大B的浓度
d.选择高效催化剂
e.及时分离出C
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
acd
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
适当升高温度,化学反应速率加快,a正确;
向容器中充入1 mol Ne,反应物和生成物浓度不变,反应速率不变,b错误;
增大B的浓度,化学反应速率加快,c正确;
选择高效催化剂,化学反应速率加快,d正确;
及时分离出C,生成物浓度减小,化学反应速率减慢,e错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
17.T ℃时,向体积为1 L的恒容密闭容器中通入1 mol H2和1 mol Cl2,一定条件下发生反应:H2(g)+Cl2(g) 2HCl(g), HCl的物质的量随时间变化如图所示。
回答下列问题:
(1)tm时,v正_____(填“>”“<”或“=”)v逆。
>
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
根据图中信息,m点是正在建立平衡的阶段,因此tm时,v正>v逆。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
(2)0~tm内H2的平均反应速率v(H2)=__________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
(3)若要增大HCl的生成速率可以采取的措施有_________、__________
___________(填写两种措施)。
升高温度
增大H2(或
Cl2)的浓度
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
(4)达到平衡后,HCl的物质的量分数为________。
27.5%
返回
本课结束
专题6
第3课时
DISANKESHI
化学反应速率及平衡的相关计算 / 化学反应速率和限度的图像分析 / 课时对点练
化学反应速率和限度的相关计算与图像分析
专题6
核心素养
发展目标
1.学会列“三段式”进行某物质“转化量”“平衡量”“化学反应速率”的计算。
2.学会分析及应用化学平衡图像。
内容索引
课时对点练
一、化学反应速率及平衡的相关计算
二、化学反应速率和限度的图像分析
化学反应速率及平衡的相关计算
一
1.列出一个模型——“三段式”思维模型
解答有关化学反应速率和化学平衡的计算题时,一般需要写出化学方程式,列出起始量、变化量及平衡量,再根据题设其他条件和定律列方程求解。如mA(g)+nB(g) pC(g)+qD(g),令A、B起始物质的量分别为a mol、b mol,达到平衡后消耗A的物质的量为mx mol。
mA(g)+nB(g) pC(g)+qD(g)
起始量/mol a b 0 0
变化量/mol mx nx px qx
平衡量/mol a-mx b-nx px qx
注意 (1)a、b也可指浓度或气体的体积、压强等。
(2)明确三个量的关系
①同一反应物:起始量-变化量=平衡量。
②同一生成物:起始量+变化量=平衡量。
③各变化量之比=各物质的化学计量数之比。
2.掌握四个公式——“三段式”应用
3.化学反应速率计算
(1)根据定义求化学反应速率v= 。
(2)根据关系式计算反应速率
对于同一个化学反应,用不同物质表示的化学反应速率之比等于相应物质在化学方程式中的化学计量数之比。例如:对于反应aA(g)+bB(g)
cC(g)+dD(g),有v(A)∶v(B)∶v(C)∶v(D)=a∶b∶c∶d。
应用体验
1.在一定密闭容器中加入A、B、C三种气体,保持温度一定,在t1~t4时刻测得各物质的浓度如下表。据此判断下列结论不正确的是
测定时刻/s t1 t2 t3 t4
c(A)/(mol·L-1) 6 3 2 2
c(B)/(mol·L-1) 5 3.5 3 3
c(C)/(mol·L-1) 1 2.5 3 3
测定时刻/s t1 t2 t3 t4
c(A)/(mol·L-1) 6 3 2 2
c(B)/(mol·L-1) 5 3.5 3 3
c(C)/(mol·L-1) 1 2.5 3 3
A.在t4时刻,该反应处于化学平衡状态
B.t3时,A的转化率比B的转化率高
C.t1至t2时刻,该反应的速率为3 mol·L-1·s-1
D.该反应的化学方程式是2A(g)+B(g) C(g)
√
测定时刻/s t1 t2 t3 t4
c(A)/(mol·L-1) 6 3 2 2
c(B)/(mol·L-1) 5 3.5 3 3
c(C)/(mol·L-1) 1 2.5 3 3
A对,由表中数据可知,从t3时刻开始,该反应中各组分的浓度保持不变,说明该反应处于化学平衡状态;
测定时刻/s t1 t2 t3 t4
c(A)/(mol·L-1) 6 3 2 2
c(B)/(mol·L-1) 5 3.5 3 3
c(C)/(mol·L-1) 1 2.5 3 3
C错,化学反应速率必须指明以哪种反应物或生成物来表示;
D对,达到平衡时A、B、C的物质的量浓度改变的量之比为4∶2∶2=2∶1∶1,根据化学反应速率之比等于化学计量数之比,可知该反应的化学方程式是2A(g)+B(g) C(g)。
2.373 K时把0.24 mol无色的N2O4气体通入体积为500 mL的密闭容器中,发生反应:N2O4 2NO2,容器中立即出现红棕色。反应进行到2 s时,测得生成NO2的物质的量为0.04 mol;反应进行到60 s时,容器内N2O4与NO2的物质的量相等。请计算:
(1)开始2 s内以N2O4表示的化学反应速率为________________。
0.02 mol·L-1·s-1
(2)反应进行到60 s时体系的压强与开始时体系的压强之比为______。
4∶3
设反应的N2O4的物质的量为x mol,运用“三段式”法进行计算:
N2O4 2NO2
起始/mol 0.24 0
反应/mol x 2x
60 s时/mol 0.24-x 2x
60 s时容器内N2O4与NO2的物质的量相等,因此0.24-x=2x,解得x=0.08,60 s时体系的压强与开始时体系的压强之比=60 s时气体的物质的量与开始时气体的物质的量之比=
(3)N2O4的转化率为________。
33.3%
3.恒温恒容下,将2 mol A气体和4 mol B气体通入体积为2 L的密闭容器中发生反应:2A(g)+B(g) xC(g)+2D(s),2 min达到平衡,测得平衡时A的物质的量为1.2 mol,C的浓度为0.8 mol·L-1。
(1)从开始反应至达到平衡状态,生成C的平均反应速率为_________________。
0.4 mol·L-1·min-1
(2)x=____。
4
根据三段式:2A(g)+B(g) xC(g)+2D(s)
起始/mol 2 4 0
转化/mol 0.8 0.4 2×0.8
平衡/mol 1.2 3.6 1.6
即Δn(A)∶Δn(C)=(0.8 mol)∶(1.6 mol)=2∶x,
解得x=4。
(3)A的转化率与B的转化率之比为_______。
4∶1
(4)下列各项可作为该反应达到平衡状态的标志的是_______(填字母)。
A.压强不再变化
B.气体密度不再变化
C.气体的平均相对分子质量不再变化
D.A的消耗速率与B的消耗速率之比为2∶1
ABC
反应前后气体分子数不同,当压强不再变化时,达到平衡状态,A正确;
反应有固体生成,当气体密度不变时达到平衡状态,B正确;
反应前后气体体积不同,当气体的平均相对分子质量不再变化时,达到平衡状态,C正确;
A和B的消耗速率均表示正反应速率,不能由此判断反应达到平衡状态,D错误。
返回
化学反应速率和限度的图像分析
二
1.简单的速率图像及应用
2.化学反应速率和反应限度的图像综合分析
“一看、二想、三判断”这三个步骤来分析解答
(1)“一看”——看图像
①看面:理解各坐标轴所代表量的意义及曲线所表示的是哪些量之间的关系。
②看线:分清正反应和逆反应,分清突变和渐变、小变和大变;理解曲线“平”与“陡”即斜率大小的意义;理解曲线的变化趋势并归纳出规律。若图中有拐点,可按照先拐先平的规律,即较早出现拐点的曲线所表示的反应先达到平衡,对应的温度高、压强大。
③看点:理解曲线上点的意义,特别是某些特殊点,如坐标轴的交点、几条曲线的交叉点、极值点、转折点等。分清反应物和生成物,浓度减小的是反应物,浓度增大的是生成物。
④看辅助线:做横轴或纵轴的垂直线(如等温线、等压线、平衡线等)。
⑤看量的变化:弄清楚是物质的量的变化、浓度的变化还是转化率的变化。
(2)“二想”——想规律
如各物质的转化量之比与化学计量数之比的关系、各物质的化学反应速率之比与化学计量数之比的关系、外界条件的改变对化学反应的影响以及对正、逆反应速率的影响规律等。
(3)“三判断”——利用有关规律,结合图像,通过对比分析,做出正确判断。
应用体验
1.如图是足量铝片(表面有氧化膜)和一定量稀硫酸反应,产生氢气的速率与反应时间的图像,下列有关描述错误的是
A.O→a段v(H2)为零,说明反应未进行
B.b→c段产生氢气的速率加快,可能是该反应为
放热反应
C.a→b段产生氢气的速率加快,可能是铝片表面的Al2O3薄膜逐渐溶解,
加快了反应速率
D.c点之后,产生氢气的速率下降,可能是c(H+)下降导致反应速率下降
√
表面有氧化膜的铝片和稀H2SO4反应,Al2O3和H2SO4首先反应生成Al2(SO4)3和H2O,无氢气生成,故O→a段并不是反应未进行,而是Al2O3和H2SO4反应,故A项错误;
随着反应进行,Al和H2SO4接触面积增大,而且Al和H2SO4反应为放热反应,故生成氢气的速率逐渐加快,故B、C项正确;
c点之后,H+浓度的减小成了影响产生氢气速率的主要因素,故随着H+浓度减小反应速率逐渐减慢,故D项正确。
2.在一密闭容器中加入A和B,各物质的物质的量浓度随反应的变化如图所示。下列说法不正确的是
A.该反应的化学方程式为5A+4B 4C
B.2 min前,正反应速率逐渐减小,逆反应速率
逐渐增大
C.用B的浓度变化表示2 min内的速率为2 mol·L-1·min-1
D.2 min时,该反应达到平衡,此时A、B、C的浓度之比为5∶4∶4
√
A对,由图可知,当(6-1) mol·L-1 A反应时,有(7-3) mol·L-1 B反应,生成4 mol·L-1 C,故该反应的化学方程式为5A+4B 4C;
B对,2 min前,反应物A和B减少,生成物C增多,所以正反应速率逐渐减小,逆反应速率逐渐增大;
D错,2 min时该反应达到平衡,此时A、B、C的浓度之比为1∶3∶4。
3.(2022·合肥高一月考)如图所示是425 ℃ 时,在1 L密闭容器中发生化学反应的浓度随时间的变化示意图。
下列叙述错误的是
A.图①中t0时,三种物质的物质的
量相同
B.图①中t0时,反应达到平衡状态
C.图②中的可逆反应为2HI(g) H2(g)+I2(g)
D.图①②中当c(HI)=3.16 mol·L-1时,反应达到平衡状态
√
图①中t0时,三种物质的物质的量浓度相等,由于体系恒容,所以三者的物质的量也相等,故A正确;
图①中t0时,三种物质的物质的量浓度相等,但t0后各物质的物质的量浓
度仍在变化,反应没有达到平衡状态,故B错误;
图①②中当c(HI)=3.16 mol·L-1时,各物质的物质的量浓度开始保持不变,说明反应均达到平衡状态,故D正确。
返回
课时对点练
题组一 化学反应速率的相关计算
1.(2022·南昌高一期中)在一定条件下,将3 mol A和1 mol B两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(g)。2 min末,测得生成0.8 mol C、0.4 mol D。下列判断正确的是
A.x=2
B.2 min末,A的浓度为1.2 mol·L-1
C.2 min内A的反应速率为0.3 mol·L-1·min-1
D.2 min内B的浓度的改变量为0.4 mol·L-1
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
物质的量变化量之比等于化学计量数之比,故0.8 mol∶0.4 mol=x∶2,解得x=4,列三段式:
3A(g)+B(g) 4C(g)+2D(g)
起始量/mol 3 1 0 0
变化量/mol 0.6 0.2 0.8 0.4
2 min末/mol 2.4 0.8 0.8 0.4
由上述分析可知x=4,A项错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
2.反应A(g)+3B(g)===2C(g)+2D(g)在四种不同情况下的反应速率分别为①v(A)=0.45 mol·L-1·min-1 ②v(B)=0.6 mol·L-1·s-1 ③v(C)=0.4 mol·L-1·s-1 ④v(D)=0.45 mol·L-1·s-1,下列有关反应速率的比较中正确的是
A.④<③=②<① B.④>③>②>①
C.④>③=②>① D.①>②>③>④
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
3.(2022·重庆高一月考)在一定温度时,将2 mol A和2 mol B放入容积为5 L的某密闭容器中发生反应2A(s)+2B(g) C(g)+2D(g),经5 min后测得容器内B的浓度减少了0.2 mol·L-1。下列叙述不正确的是
A.在5 min内,该反应用C的浓度变化表示的反应速率为0.02 mol·L-1·min-1
B.5 min时,容器内D的浓度为0.2 mol·L-1
C.当容器内压强保持恒定时,该可逆反应达到平衡状态
D.5 min时容器内气体总的物质的量为3 mol
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
由题意可建立如下三段式:
2A(s)+2B(g) C(g)+2D(g)
起始/(mol·L-1) 0.4 0 0
变化/(mol·L-1) 0.2 0.1 0.2
5 min末/(mol·L-1) 0.2 0.1 0.2
分析可知,在5 min内该反应用C的浓度变化表示的反应速率为
=0.02 mol·L-1·min-1,A项正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
5 min时,容器内D的浓度为0.2 mol·L-1,B项正确;
该反应是气体体积增大的反应,当容器内压强保持恒定时,说明正、逆反应速率相等,该可逆反应达到平衡状态,C项正确;
5 min时,容器内气体总的物质的量为(0.2+0.1+0.2)mol·L-1×5 L=2.5 mol,D项错误。
题组二 化学反应速率图像分析
4.CaCO3与稀盐酸反应(放热反应)生成CO2的物质的量
与反应时间的关系如图所示。下列结论不正确的是
A.反应开始4 min内温度对反应速率的影响比浓度大
B.一段时间后,反应速率减小的原因是c(H+)减小
C.反应在2~4 min内平均反应速率最大
D.反应在2~4 min内生成CO2的平均反应速率为v(CO2)=0.1 mol·L-1·min-1
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
随着反应的进行氢离子浓度降低,氢离子浓度变化使反应速率减小。由图像可知,开始生成的二氧化碳的反应速率是增大的,说明反应为放热反应,即反应开始4 min内温度对反应速率的影响比浓度大,A项正确;
由图可知反应速率先增大后减少,反应速率减小的原因是c(H+)减小,B项正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
由图可知0~2 min、2~4 min、4~6 min时间内,生成的CO2物质的量分别是0.1 mol、0.2 mol、0.05 mol,所以反应在2~4 min内平均反应速率最大,C项正确;
没有给出反应容器的体积,只有物质的量的变化,无法计算速率,D项错误。
5.鱼浮灵是一种化学增氧剂,主要成分为过氧碳酸钠(2Na2CO3·3H2O2),分别在等体积双氧水中加入少量Na2CO3、NaCl和NaOH固体探究鱼浮灵增氧原理,实验结果如图所示。下列说法不正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
A.Na2CO3对H2O2的分解有促进作用
B.加入NaCl后溶液溶解氧变化不明显
C.H2O2分解随pH增大而持续加快
D.鱼浮灵使用时应根据pH控制投放量
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
由图可知,加入Na2CO3后水中的溶解氧增多,故说明加入Na2CO3后促进了H2O2的分解,故A正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
在双氧水中加入氯化钠后,溶液中溶解氧不变,即加入氯化钠后对双氧水的分解无催化作用,故B正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
根据双氧水加NaOH固体图可知,随着溶液pH增大,溶解氧先增大后减小,故双氧水的分解并不是随pH的增大而持续加快,故C错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
根据双氧水加NaOH固体图可知,溶液pH对鱼浮灵中双氧水的分解速率有影响,故应根据溶液的pH来决定鱼浮灵的投放量,故D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
A.图中阴影部分的面积表示t1~t2时间内 的物质
的量的减少量
B.纵坐标为v(Cl-)的v-t曲线与图中曲线完全重合
C.反应开始时速率增大可能是c(H+)所致
D.后期反应速率下降的主要原因是反应物浓度减小
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
随着反应的进行,反应物的浓度减少,反应速率减小,所以后期反应速率下降的主要原因是反应物浓度减小,故D正确。
题组三 化学反应速率及平衡的综合计算
7.(2022·大连高一检测)一定条件下,体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g)+Y(g) Z(g)正反应为放热反应,经60 s达到平衡,生成0.3 mol Z。下列说法正确的是
A.在60 s内,用X浓度变化表示的反应速率为0.01 mol·L-1·s-1
B.任何条件下反应经过60 s时一定能达到化学平衡
C.反应放出的热量可用于提高反应速率
D.反应达到平衡时,n(X)∶n(Y)=1∶1
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
反应速率与外界条件有关,如升高温度、加入催化剂等,可增大反应速率,达到平衡所用时间减少,故B错误;
反应放出的热量可使体系温度升高,升高温度可增大反应速率,故C正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
达到平衡时n(Y)=(1-0.3) mol=0.7 mol,n(X)=(1-0.6 mol)=0.4 mol,可知平衡时X、Y的物质的量不相等,故D错误。
8.将4 mol A气体和2 mol B气体置于1 L的密闭容器中,混合后发生反应:2A(g)+B(g) 2C(g),若经2 s后测得C的浓度为1.2 mol·L-1,下列说法正确的是
A.用物质A表示2 s末的反应速率为0.6 mol·L-1·s-1
B.反应后的压强是开始时的1.2倍
C.2 s末物质A的转化率为70%
D.C的产率为30%
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
根据三段式分析:
2A(g)+B(g) 2C(g)
起始/(mol·L-1) 4 2 0
变化/(mol·L-1) 1.2 0.6 1.2
2 s末/(mol·L-1) 2.8 1.4 1.2
2 s内C的平均反应速率为 =0.6 mol·L-1·s-1,同一可逆反应中同一时间段内各物质的反应速率之比等于其化学计量数之比,则v(A)=v(C)=0.6 mol·L-1·s-1,化学反应速率是平均速率,不是瞬时速率,故A错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
恒温恒容时,气体的压强之比等于气体的物质的量之比,反应后气体的总物质的量等于2.8 mol+1.4 mol+1.2 mol=5.4 mol,反应前气体的总物质的量为4 mol+2 mol=6 mol,反应后的压强是开始时的0.9倍,故B错误;
2 s末参加反应的n(A)=1.2 mol,则A的转化率为 ×100%=30%,故C错误;
假设4 mol A气体和2 mol B气体完全反应生成C的物质的量应为4 mol,2 s末物质C的物质的量为1.2 mol,则C的产率为30%,故D正确。
题组四 化学反应速率和化学平衡图像综合分析
9.一定条件下,将3 mol A气体和1 mol B气体混合于固定容积为2 L的密闭容器中,发生反应:3A(g)+B(g) C(g)+2D(s)。2 min末该反应达到平衡,生成D的物质的量随时间的变化情况如图所示。下列判断正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
A.若混合气体的密度不再改变时,该反应不一定达到平衡状态
B.2 min后,加压会使正反应速率加快,逆反应速率变慢
C.反应过程中A和B的转化率之比为3∶1
D.开始到平衡,用A表示的化学反应速率为0.3 mol·L-1·min-1
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
生成物D为固体,随反应进行,气体质量减小,容器容积不变,故气体的密度减小,气体的密度不变说明反应达到平衡,故A错误;
增大压强,A、B、C的浓度都增大,故正、逆反应速率都增大,故B错误;
A、B按物质的量之比为3∶1反应,且二者起始物质的量分别为3 mol、1 mol,故二者转化率相等,故C错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
10.一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。下列描述正确的是
A.t min时该反应达到化学平衡状态
B.反应开始到10 min,用X表示的
反应速率为0.079 mol·L-1·min-1
C.反应开始到10 min时,Y的转化率
为79%
D.反应的化学方程式为X(g)+2Y(g) 3Z(g)
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
到10 min时该反应达到化学平衡状态,A错误;
反应进行到10 min时,X、Y均减少了0.79 mol,Z增加了1.58 mol,用X
表示的反应速率为 =0.039 5 mol·L-1·min-1,反应的化学
方程式为X(g)+Y(g) 2Z(g),B、D错误;
11.为了研究碳酸钙与盐酸反应的反应速率,某同学通过实验测定碳酸钙固体与足量稀盐酸反应生成CO2的体积随时间的变化情况,绘制出如图所示的曲线甲。下列有关说法不正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
A.在O~t1、t1~t2、t2~t3中,t1~t2生成的CO2气体最多
B.因反应放热,导致O~t1 内的反应速率逐渐增大
C.若用单位时间内CO2的体积变化来表示该反应的反应速率,则t2~t3
时间内的反应速率为
D.将碳酸钙固体研成粉末,则曲线甲将变成曲线乙
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
由图可知,t1~t2 生成的CO2气体最多,故A正确;
O~t1,随着反应的进行,反应物的浓度是减小的,反应速率增大说明该反应一定放热,温度升高,反应速率加快,故B正确;
由图知,若用单位时间内CO2的体积变化来表示该反应的反应速率,则t2~t3时间内的反应速率为 mL·s-1,故C正确;
将碳酸钙固体研成粉末,反应物的接触面积增大,反应速率加快,而曲线乙表示生成CO2的速率比曲线甲慢,故D错误。
12.一定温度下,已知反应N2O4(g) 2NO2(g)。现将1 mol N2O4充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
A.①③ B.②③
C.①④ D.②④
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
①恒压条件下,反应正向气体体积增大,气体的总质量不变,故密度是变量,其不变时反应达到平衡状态;
②恒压条件下,压强是恒量,不能作为判断平衡状态的标志;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
③题给反应充入1 mol N2O4,正反应速率是逐渐减小直到不变,不符合题意;
④随反应的进行,N2O4的转化率是变量,其不变证明达到平衡状态。
13.(2021·广东,14)反应X===2Z经历两步:①X→Y;②Y→2Z。反应体系中X、Y、Z的浓度c随时间t的变化曲线如图所示。下列说法不正确的是
A.a为c(X)随t的变化曲线
B.t1时,c(X)=c(Y)=c(Z)
C.t2时,Y的消耗速率大于生成速率
D.t3后,c(Z)=2c0-c(Y)
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
X是唯一的反应物,随着反应的发生,其浓度不断减小,因此,a为c(X)随t的变化曲线,A正确;
由图可知,分别代表3种不同物质的曲线相交于t1时刻,因此t1时,c(X)=c(Y)=c(Z),B正确;
由图中信息可知,t2时刻以后,Y的浓度仍在不断减小,说明t2时Y的消耗速率大于生成速率,C正确;
由图可知,t3时刻反应①完成,X完全转化为Y,若无反应②发生,则Y的浓度为c0,由于反应②Y→2Z的发生,t3时刻后Y的浓度的变化量为c0-c(Y),则生成的Z为c(Z)=2c0-2c(Y),D不正确。
14.一定温度和一定压强下,在2 L的密闭容器中合成氨气:N2+3H2
2NH3(一定条件),反应过程中反应物和生成物的物质的量随时间的变化如图所示。下列说法错误的是
A.10~20 min内,v(N2)∶v(H2)∶v(NH3)=1∶3∶2
B.0~10 min内,用NH3表示的平均反应速率为
0.005 mol·L-1·min-1
C.该反应在20 min时达到化学平衡状态
D.N2的平衡转化率与H2平衡转化率相等
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
在一个化学反应中,用不同物质表示的反应速率之比等于化学方程式中相应物质的化学计量数之比,故v(N2)∶v(H2)∶v(NH3)=1∶3∶2,A正确;
0~10 min内,NH3的物质的量变化为0.1 mol,容器
体积为2 L,所以NH3的物质的量浓度变化为0.05 mol·L-1,所以用NH3表示的平均反应速率为 =0.005 mol·L-1·min-1,B正确;
20 min时,各物质的物质的量不再变化,说明反应在20 min时达到了化学平衡状态,C正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
起始时加入的氮气和氢气的物质的量分别为0.4 mol和0.6 mol,而变化的氮气和氢气的物质的量之比为1∶3,所以N2的平衡转化率与H2的平衡转化率不相等,D错误。
15.在一定条件下发生反应:3A(g)+2B(g) mC(g)+2D(g)。在2 L的密闭容器中把4 mol A和2 mol B混合,2 min后反应达到平衡时生成1.6 mol C,又测得D的反应速率v(D)=0.2 mol·L-1·min-1。则下列说法不正确的是
A.m=4
B.平衡时气体压强是原来的
C.A的平衡浓度是1.4 mol·L-1
D.B的转化率是40%
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
3A(g)+2B(g) 4C(g)+2D(g)
起始量/mol 4 2 0 0
转化量/mol 1.2 0.8 1.6 0.8
平衡量/mol 2.8 1.2 1.6 0.8
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
16.(2022·沈阳高一期中)在2 L密闭容器内,等物质的量的A和B在600 ℃时发生反应:2A(g)+B(g) 2C(g)。体系中,n(A)随时间的变化如表:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
时间/s 0 1 2 3 4 5
n(A)/mol 0.20 0.10 0.08 0.07 0.07 0.07
(1)达到平衡的时间是____,理由是_______________________________。
3 s
3 s之后A的物质的量不再发生变化
由表中数据可知,3 s之后A的物质的量不再发生变化,说明3 s时反应达到平衡。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
(2)如图中表示C的浓度变化的曲线是________,用B表示从0~2 s内该反应的平均速率v=_________________,达到平衡时,B的转化率α(B)=________。
c
0.015 mol·L-1·s-1
32.5%
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
初始时,C的物质的量浓度为0,由表中数据可知,
物质A反应消耗的物质的量为0.2 mol-0.07 mol=
0.13 mol,根据化学方程式2A(g)+B(g) 2C(g)可知,生成C的物质的量为0.13 mol,其物质的量浓度为 =0.065 mol·L-1,所以C的浓度变化的曲线是c;
时间/s 0 1 2 3 4 5
n(A)/mol 0.20 0.10 0.08 0.07 0.07 0.07
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
0~2 s内,物质A反应消耗的物质的量为0.2 mol-
0.08 mol=0.12 mol,根据化学方程式2A(g)+B(g)
2C(g)可知,消耗B的物质的量为0.06 mol,则用B表示从0~2 s内该反应的平均速率v= =0.015 mol·L-1·s-1;
时间/s 0 1 2 3 4 5
n(A)/mol 0.20 0.10 0.08 0.07 0.07 0.07
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
平衡时,物质A反应消耗的物质的量为0.13 mol,则消耗B的物质的量为0.065 mol,B的转化率α(B)= ×100%=32.5%。
时间/s 0 1 2 3 4 5
n(A)/mol 0.20 0.10 0.08 0.07 0.07 0.07
(3)下列状态能说明该反应已达到平衡状态的是______(填字母,下同)。
a.v逆(C)=2v正(B)
b.容器内各物质的浓度保持不变时
c.c(A)=c(C)
d.容器内气体的密度不再变化时
e.气体的平均相对分子质量不再变化时
f.A与B的浓度之比不再变化时
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
abef
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
容器内各物质的浓度保持不变时,说明各物质的生成速率等于反应消耗速率,反应达到化学平衡,b正确;
c(A)=c(C),只能说明某一时刻A、C浓度关系,不能证明反应达到化学平衡,c错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
反应2A(g)+B(g) 2C(g)在2 L的容器中进行,反应前后总质量不变,密度不变,因此容器内气体的密度不再变化,不能说明反应达到化学平衡,d错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
反应2A(g)+B(g) 2C(g),反应前后气体分子数减小,由于反应前后总质量不变,当气体的平均相对分子质量不再变化时,即摩尔质量不再变化,此时气体的总物质的量不再变化,说明反应达到化学平衡,e正确;等物质的量的A和B在600 ℃时发生反应,A、B的化学计量数之比为2∶1,随着反应的进行,A、B的浓度之比逐渐变化,当A与B的浓度之比不再变化时,反应达到化学平衡,f正确。
(4)能增大该反应的反应速率的是______。
a.适当升高温度
b.向容器中充入1 mol Ne
c.增大B的浓度
d.选择高效催化剂
e.及时分离出C
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
acd
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
适当升高温度,化学反应速率加快,a正确;
向容器中充入1 mol Ne,反应物和生成物浓度不变,反应速率不变,b错误;
增大B的浓度,化学反应速率加快,c正确;
选择高效催化剂,化学反应速率加快,d正确;
及时分离出C,生成物浓度减小,化学反应速率减慢,e错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
17.T ℃时,向体积为1 L的恒容密闭容器中通入1 mol H2和1 mol Cl2,一定条件下发生反应:H2(g)+Cl2(g) 2HCl(g), HCl的物质的量随时间变化如图所示。
回答下列问题:
(1)tm时,v正_____(填“>”“<”或“=”)v逆。
>
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
根据图中信息,m点是正在建立平衡的阶段,因此tm时,v正>v逆。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
(2)0~tm内H2的平均反应速率v(H2)=__________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
(3)若要增大HCl的生成速率可以采取的措施有_________、__________
___________(填写两种措施)。
升高温度
增大H2(或
Cl2)的浓度
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
(4)达到平衡后,HCl的物质的量分数为________。
27.5%
返回
本课结束
专题6
