专题7 氮与社会可持续发展 专题知识体系构建与核心素养提升 学案(含答案)
文档属性
| 名称 | 专题7 氮与社会可持续发展 专题知识体系构建与核心素养提升 学案(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 328.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-08 15:51:28 | ||
图片预览


文档简介
专题7 氮与社会可持续发展 专题知识体系构建与核心素养提升
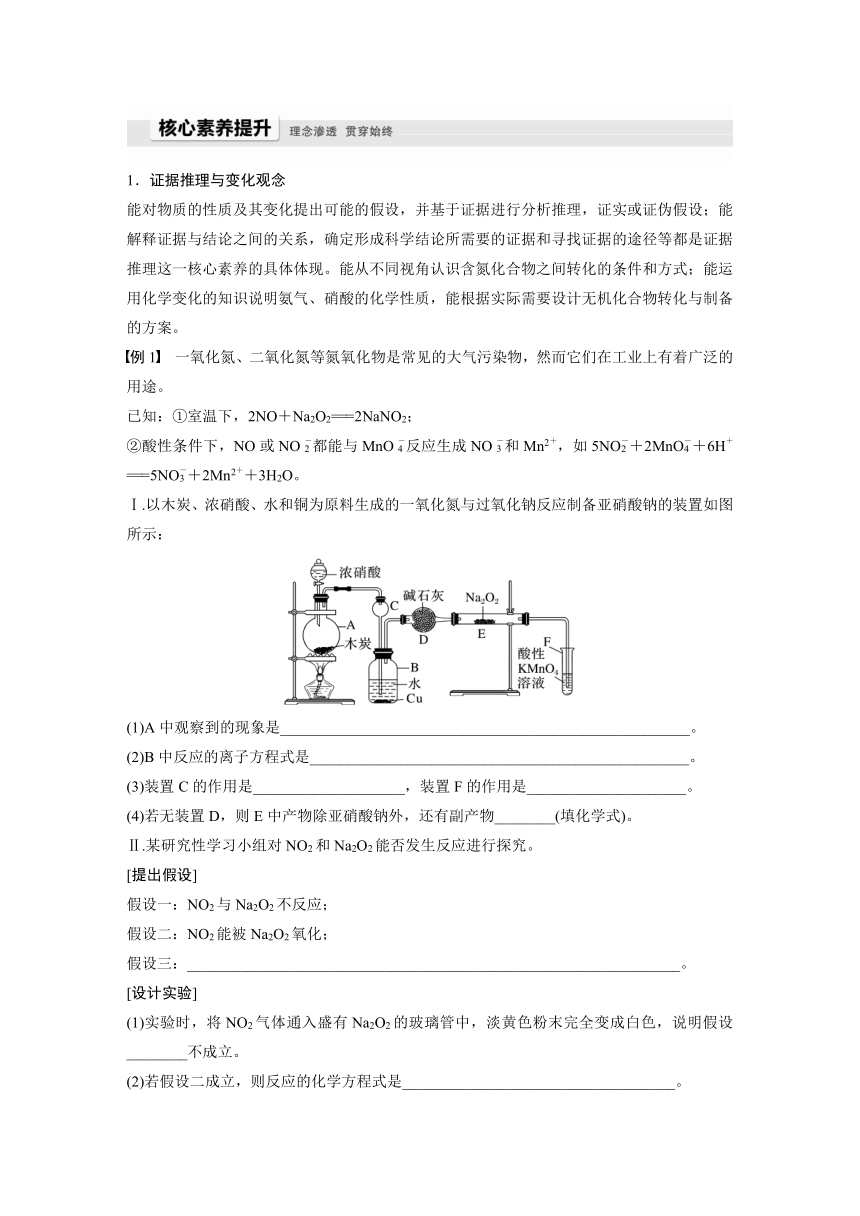
氮及其化合物的转化关系
方程式再书写
写出下列反应的化学方程式,是离子反应的写离子方程式。
(1)N2和H2的反应:
________________________________________________________________________。
(2)实验室利用NH4Cl固体、Ca(OH)2固体混合加热制备NH3:
________________________________________________________________________。
(3)NH3的催化氧化:
________________________________________________________________________。
(4)NO2溶于水:
________________________________________________________________________。
(5)把NH3通入水中:
________________________________________________________________________。
(6)Cu和稀HNO3的反应:
________________________________________________________________________。
(7)Cu和浓HNO3的反应:
________________________________________________________________________。
(8)C和浓HNO3的反应:
________________________________________________________________________。
(9)浓硝酸见光分解(化学方程式):
________________________________________________________________________。
1.证据推理与变化观念
能对物质的性质及其变化提出可能的假设,并基于证据进行分析推理,证实或证伪假设;能解释证据与结论之间的关系,确定形成科学结论所需要的证据和寻找证据的途径等都是证据推理这一核心素养的具体体现。能从不同视角认识含氮化合物之间转化的条件和方式;能运用化学变化的知识说明氨气、硝酸的化学性质,能根据实际需要设计无机化合物转化与制备的方案。
例1 一氧化氮、二氧化氮等氮氧化物是常见的大气污染物,然而它们在工业上有着广泛的用途。
已知:①室温下,2NO+Na2O2===2NaNO2;
②酸性条件下,NO或NO都能与MnO反应生成NO和Mn2+,如5NO+2MnO+6H+===5NO+2Mn2++3H2O。
Ⅰ.以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如图所示:
(1)A中观察到的现象是______________________________________________________。
(2)B中反应的离子方程式是__________________________________________________。
(3)装置C的作用是____________________,装置F的作用是_____________________。
(4)若无装置D,则E中产物除亚硝酸钠外,还有副产物________(填化学式)。
Ⅱ.某研究性学习小组对NO2和Na2O2能否发生反应进行探究。
[提出假设]
假设一:NO2与Na2O2不反应;
假设二:NO2能被Na2O2氧化;
假设三:_________________________________________________________________。
[设计实验]
(1)实验时,将NO2气体通入盛有Na2O2的玻璃管中,淡黄色粉末完全变成白色,说明假设________不成立。
(2)若假设二成立,则反应的化学方程式是____________________________________。
(3)为验证假设二是否成立,该小组同学进行如下定性实验研究,请完成下表内容。
实验步骤(不要求写具体操作过程,试剂、仪器任选) 预期的实验现象及结论
取适量的白色固体置于试管中,加蒸馏水溶解,________
2.科学探究与创新意识
发展物质性质及物质转化的实验探究能力,从单一物质的多角度性质探究到一组物质的多角度性质及物质转化的探究。
能针对物质性质及物质转化的探究问题,提出有依据的假设,选取试剂,设计实验方案并实施,基于实验事实得出结论。
例2 某化学实验小组探究浓硝酸、稀硝酸氧化性的相对强弱,设计如图装置进行实验(夹持仪器已略去)。
可选药品:N2、浓硝酸、稀硝酸(3 mol·L-1)、蒸馏水、浓硫酸、NaOH溶液。
已知:①浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。
②NaOH溶液不与NO反应,但能与NO2反应生成NaNO3和NaNO2。
回答下列问题:
(1)写出装置A发生反应的化学方程式:_______________________________________。
(2)实验开始前,要先通入一段时间的N2,然后再滴加浓硝酸,这样操作的目的是______。
(3)装置B中的试剂是________。D中发生反应的化学方程式是_____________________
____________________________________________________________________________。
(4)实验结论:浓硝酸的氧化性强于稀硝酸。得出该结论所依据的实验现象是__________
____________________________________________________________________________。
(5)实验结束后,同学们发现装置A中溶液呈绿色,而不显蓝色。小组同学产生两种猜想:
Ⅰ.溶液中硝酸铜的浓度较高所致; Ⅱ .溶液中溶解了生成的气体所致。
他们设计方案进行实验:
①验证方案Ⅰ:向盛有水的大试管中加入________________,振荡,至不再溶解,观察到溶液为蓝色。
②验证方案Ⅱ:取反应后的绿色溶液于试管中,________________,观察到溶液颜色由绿色逐渐变为蓝绿色,最终变为蓝色。
通过实验验证,发现猜想Ⅱ正确。
3.科学态度与社会责任
能应用物质性质及物质转化关系,分析和探讨某些化学过程对人类健康、社会可持续发展可能带来的双重影响,并对这些影响从多个方面进行评估,从而更加科学、合理地选择和应用物质及其变化。
例3 汽车尾气中的NO是造成大气污染的物质之一,但NO又是工业生产硝酸的中间产物,另外NO在人体的血管系统内又有传送信息的功能,有三位教授因此项研究成果而获得诺贝尔奖。
(1)汽车尾气中NO的来源是________(填字母)。
A.汽油、柴油中含氮,是其燃烧产物
B.是空气中的N2与汽油、柴油的反应产物
C.是空气中的N2与O2在汽车汽缸内的高温环境下的反应产物
D.是汽车高温尾气导致了空气中N2与O2的化合反应
(2)写出NO造成酸雨的两个化学方程式:__________________、_________________。
(3)控制或者减少城市汽车尾气污染的方法可以有________(填字母)。
A.开发氢能 B.使用电动车
C.使用含铅汽油 D.严禁车辆行驶
(4)为了降低汽车尾气对大气的污染,目前最有效的方法是给汽车安装尾气净化装置。它能将尾气中的CO和NO在催化剂作用下,发生反应转化为无害气体,其反应的化学方程式为________________________________________________________________________。
专题知识体系构建与核心素养提升
知识体系构建
(1)N2+3H22NH3 (2)2NH4Cl+Ca(OH)22NH3↑+2H2O+CaCl2 (3)4NH3+5O24NO+6H2O (4)3NO2+H2O===2H++2NO+NO (5)NH3+H2O??NH3·H2O??NH+OH- (6)3Cu+8H++2NO===3Cu2++2NO↑+4H2O (7)Cu+4H++2NO===Cu2++2NO2↑+2H2O (8)C+4HNO3(浓)CO2↑+4NO2↑+2H2O (9)4HNO34NO2↑+O2↑+2H2O
核心素养提升
例1 Ⅰ.(1)有红棕色气体生成 (2)3NO2+H2O===2H++2NO+NO、3Cu+8H++2NO===3Cu2++2NO↑+4H2O (3)防止倒吸 吸收未反应的NO (4)Na2CO3、NaOH
Ⅱ.NO2能被Na2O2还原 (1)一 (2)2NO2+Na2O2===2NaNO3 (3)再滴加稀硫酸酸化,最后滴加高锰酸钾溶液 若高锰酸钾溶液不褪色,则假设二成立;若高锰酸钾溶液褪色,则假设二不成立(其他合理答案也可)
解析 Ⅰ.(1)加热条件下木炭与浓硝酸反应生成CO2、NO2和水,所以A中观察到的现象是有红棕色气体生成。(2)二氧化氮溶于水生成硝酸和NO,硝酸具有强氧化性,能与金属铜反应,则B中反应的离子方程式是3NO2+H2O===2H++2NO+NO、3Cu+8H++2NO===3Cu2++2NO↑+4H2O。(3)二氧化氮易溶于水,所以装置C的作用是防止倒吸。反应后NO过量,NO是大气污染物,则装置F的作用是吸收未反应的NO。(4)碱石灰的作用是吸收NO中的水蒸气和二氧化碳,二者均与过氧化钠反应,所以若无装置D,则E中产物除亚硝酸钠外,还有副产物Na2CO3、NaOH。
Ⅱ.由于二氧化氮也具有氧化性,则假设三应该是NO2能被Na2O2还原。
(1)实验时,将NO2气体通入盛有Na2O2的玻璃管中,淡黄色粉末完全变成白色,说明发生了化学反应,因此假设一不成立。(2)若假设二成立,则二氧化氮被氧化为硝酸钠,反应的化学方程式是2NO2+Na2O2===2NaNO3。(3)要验证假设二是否成立,只需要检验是否产生亚硝酸钠即可,如果有亚硝酸钠生成,则假设二不成立。根据题干信息可知,亚硝酸根离子能使酸性高锰酸钾溶液褪色,所以实验操作是取适量的白色固体置于试管中,加蒸馏水溶解,再滴加稀硫酸酸化,最后滴加高锰酸钾溶液,如果高锰酸钾溶液不褪色,则假设二成立。
例2 (1)Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O
(2)排净装置内的空气
(3)蒸馏水 2NO2+2NaOH===NaNO3+NaNO2+H2O
(4)装置C中液面上方气体由无色变为红棕色,装置E中液面上方气体仍为无色
(5)①硝酸铜 ②加热(或向溶液中通入空气)
例3 (1)C (2)2NO+O2===2NO2 3NO2+H2O===2HNO3+NO (3)AB (4)2NO+2CON2+2CO2
解析 (4)由CO与NO反应生成可参与大气生态循环的无毒气体可知,该反应是以NO为氧化剂,将CO氧化为CO2,而本身被还原为N2,反应的化学方程式为2NO+2CO2CO2+N2。
氮及其化合物的转化关系
方程式再书写
写出下列反应的化学方程式,是离子反应的写离子方程式。
(1)N2和H2的反应:
________________________________________________________________________。
(2)实验室利用NH4Cl固体、Ca(OH)2固体混合加热制备NH3:
________________________________________________________________________。
(3)NH3的催化氧化:
________________________________________________________________________。
(4)NO2溶于水:
________________________________________________________________________。
(5)把NH3通入水中:
________________________________________________________________________。
(6)Cu和稀HNO3的反应:
________________________________________________________________________。
(7)Cu和浓HNO3的反应:
________________________________________________________________________。
(8)C和浓HNO3的反应:
________________________________________________________________________。
(9)浓硝酸见光分解(化学方程式):
________________________________________________________________________。
1.证据推理与变化观念
能对物质的性质及其变化提出可能的假设,并基于证据进行分析推理,证实或证伪假设;能解释证据与结论之间的关系,确定形成科学结论所需要的证据和寻找证据的途径等都是证据推理这一核心素养的具体体现。能从不同视角认识含氮化合物之间转化的条件和方式;能运用化学变化的知识说明氨气、硝酸的化学性质,能根据实际需要设计无机化合物转化与制备的方案。
例1 一氧化氮、二氧化氮等氮氧化物是常见的大气污染物,然而它们在工业上有着广泛的用途。
已知:①室温下,2NO+Na2O2===2NaNO2;
②酸性条件下,NO或NO都能与MnO反应生成NO和Mn2+,如5NO+2MnO+6H+===5NO+2Mn2++3H2O。
Ⅰ.以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如图所示:
(1)A中观察到的现象是______________________________________________________。
(2)B中反应的离子方程式是__________________________________________________。
(3)装置C的作用是____________________,装置F的作用是_____________________。
(4)若无装置D,则E中产物除亚硝酸钠外,还有副产物________(填化学式)。
Ⅱ.某研究性学习小组对NO2和Na2O2能否发生反应进行探究。
[提出假设]
假设一:NO2与Na2O2不反应;
假设二:NO2能被Na2O2氧化;
假设三:_________________________________________________________________。
[设计实验]
(1)实验时,将NO2气体通入盛有Na2O2的玻璃管中,淡黄色粉末完全变成白色,说明假设________不成立。
(2)若假设二成立,则反应的化学方程式是____________________________________。
(3)为验证假设二是否成立,该小组同学进行如下定性实验研究,请完成下表内容。
实验步骤(不要求写具体操作过程,试剂、仪器任选) 预期的实验现象及结论
取适量的白色固体置于试管中,加蒸馏水溶解,________
2.科学探究与创新意识
发展物质性质及物质转化的实验探究能力,从单一物质的多角度性质探究到一组物质的多角度性质及物质转化的探究。
能针对物质性质及物质转化的探究问题,提出有依据的假设,选取试剂,设计实验方案并实施,基于实验事实得出结论。
例2 某化学实验小组探究浓硝酸、稀硝酸氧化性的相对强弱,设计如图装置进行实验(夹持仪器已略去)。
可选药品:N2、浓硝酸、稀硝酸(3 mol·L-1)、蒸馏水、浓硫酸、NaOH溶液。
已知:①浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。
②NaOH溶液不与NO反应,但能与NO2反应生成NaNO3和NaNO2。
回答下列问题:
(1)写出装置A发生反应的化学方程式:_______________________________________。
(2)实验开始前,要先通入一段时间的N2,然后再滴加浓硝酸,这样操作的目的是______。
(3)装置B中的试剂是________。D中发生反应的化学方程式是_____________________
____________________________________________________________________________。
(4)实验结论:浓硝酸的氧化性强于稀硝酸。得出该结论所依据的实验现象是__________
____________________________________________________________________________。
(5)实验结束后,同学们发现装置A中溶液呈绿色,而不显蓝色。小组同学产生两种猜想:
Ⅰ.溶液中硝酸铜的浓度较高所致; Ⅱ .溶液中溶解了生成的气体所致。
他们设计方案进行实验:
①验证方案Ⅰ:向盛有水的大试管中加入________________,振荡,至不再溶解,观察到溶液为蓝色。
②验证方案Ⅱ:取反应后的绿色溶液于试管中,________________,观察到溶液颜色由绿色逐渐变为蓝绿色,最终变为蓝色。
通过实验验证,发现猜想Ⅱ正确。
3.科学态度与社会责任
能应用物质性质及物质转化关系,分析和探讨某些化学过程对人类健康、社会可持续发展可能带来的双重影响,并对这些影响从多个方面进行评估,从而更加科学、合理地选择和应用物质及其变化。
例3 汽车尾气中的NO是造成大气污染的物质之一,但NO又是工业生产硝酸的中间产物,另外NO在人体的血管系统内又有传送信息的功能,有三位教授因此项研究成果而获得诺贝尔奖。
(1)汽车尾气中NO的来源是________(填字母)。
A.汽油、柴油中含氮,是其燃烧产物
B.是空气中的N2与汽油、柴油的反应产物
C.是空气中的N2与O2在汽车汽缸内的高温环境下的反应产物
D.是汽车高温尾气导致了空气中N2与O2的化合反应
(2)写出NO造成酸雨的两个化学方程式:__________________、_________________。
(3)控制或者减少城市汽车尾气污染的方法可以有________(填字母)。
A.开发氢能 B.使用电动车
C.使用含铅汽油 D.严禁车辆行驶
(4)为了降低汽车尾气对大气的污染,目前最有效的方法是给汽车安装尾气净化装置。它能将尾气中的CO和NO在催化剂作用下,发生反应转化为无害气体,其反应的化学方程式为________________________________________________________________________。
专题知识体系构建与核心素养提升
知识体系构建
(1)N2+3H22NH3 (2)2NH4Cl+Ca(OH)22NH3↑+2H2O+CaCl2 (3)4NH3+5O24NO+6H2O (4)3NO2+H2O===2H++2NO+NO (5)NH3+H2O??NH3·H2O??NH+OH- (6)3Cu+8H++2NO===3Cu2++2NO↑+4H2O (7)Cu+4H++2NO===Cu2++2NO2↑+2H2O (8)C+4HNO3(浓)CO2↑+4NO2↑+2H2O (9)4HNO34NO2↑+O2↑+2H2O
核心素养提升
例1 Ⅰ.(1)有红棕色气体生成 (2)3NO2+H2O===2H++2NO+NO、3Cu+8H++2NO===3Cu2++2NO↑+4H2O (3)防止倒吸 吸收未反应的NO (4)Na2CO3、NaOH
Ⅱ.NO2能被Na2O2还原 (1)一 (2)2NO2+Na2O2===2NaNO3 (3)再滴加稀硫酸酸化,最后滴加高锰酸钾溶液 若高锰酸钾溶液不褪色,则假设二成立;若高锰酸钾溶液褪色,则假设二不成立(其他合理答案也可)
解析 Ⅰ.(1)加热条件下木炭与浓硝酸反应生成CO2、NO2和水,所以A中观察到的现象是有红棕色气体生成。(2)二氧化氮溶于水生成硝酸和NO,硝酸具有强氧化性,能与金属铜反应,则B中反应的离子方程式是3NO2+H2O===2H++2NO+NO、3Cu+8H++2NO===3Cu2++2NO↑+4H2O。(3)二氧化氮易溶于水,所以装置C的作用是防止倒吸。反应后NO过量,NO是大气污染物,则装置F的作用是吸收未反应的NO。(4)碱石灰的作用是吸收NO中的水蒸气和二氧化碳,二者均与过氧化钠反应,所以若无装置D,则E中产物除亚硝酸钠外,还有副产物Na2CO3、NaOH。
Ⅱ.由于二氧化氮也具有氧化性,则假设三应该是NO2能被Na2O2还原。
(1)实验时,将NO2气体通入盛有Na2O2的玻璃管中,淡黄色粉末完全变成白色,说明发生了化学反应,因此假设一不成立。(2)若假设二成立,则二氧化氮被氧化为硝酸钠,反应的化学方程式是2NO2+Na2O2===2NaNO3。(3)要验证假设二是否成立,只需要检验是否产生亚硝酸钠即可,如果有亚硝酸钠生成,则假设二不成立。根据题干信息可知,亚硝酸根离子能使酸性高锰酸钾溶液褪色,所以实验操作是取适量的白色固体置于试管中,加蒸馏水溶解,再滴加稀硫酸酸化,最后滴加高锰酸钾溶液,如果高锰酸钾溶液不褪色,则假设二成立。
例2 (1)Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O
(2)排净装置内的空气
(3)蒸馏水 2NO2+2NaOH===NaNO3+NaNO2+H2O
(4)装置C中液面上方气体由无色变为红棕色,装置E中液面上方气体仍为无色
(5)①硝酸铜 ②加热(或向溶液中通入空气)
例3 (1)C (2)2NO+O2===2NO2 3NO2+H2O===2HNO3+NO (3)AB (4)2NO+2CON2+2CO2
解析 (4)由CO与NO反应生成可参与大气生态循环的无毒气体可知,该反应是以NO为氧化剂,将CO氧化为CO2,而本身被还原为N2,反应的化学方程式为2NO+2CO2CO2+N2。
