专题7 第二单元 第1课时 氨气 学案(含答案)
文档属性
| 名称 | 专题7 第二单元 第1课时 氨气 学案(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 529.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-08 15:52:06 | ||
图片预览



文档简介
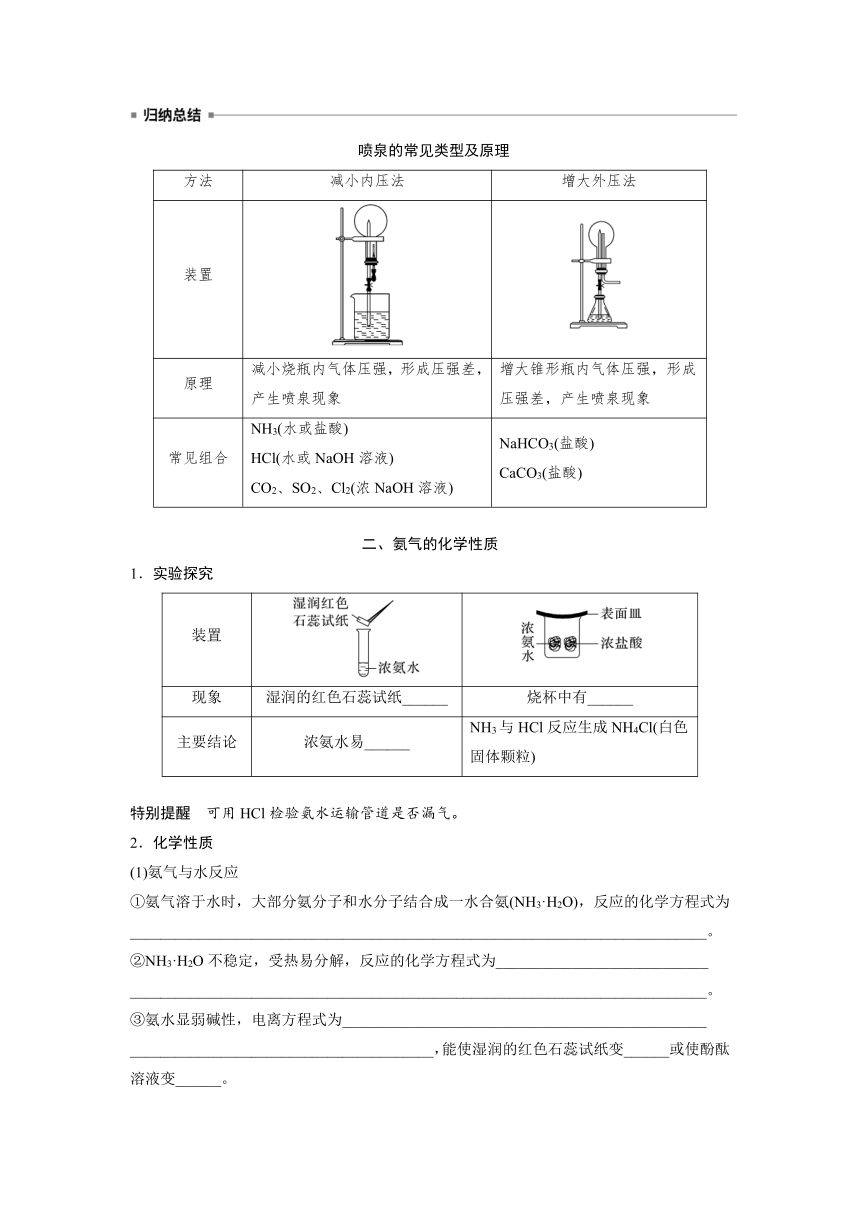
第二单元 重要的含氮化工原料
第1课时 氨气
[核心素养发展目标] 1.了解NH3的物理性质特点以及氨水显碱性的原因。2.能运用化学变化的知识说明氨气的化学性质。
一、氨气的物理性质和喷泉实验
1.氨气的物理性质
颜色状态 气味 密度 溶解性 沸点
_____气体 _____气味 ______空气 __________溶于水,常温常压下,1体积水大约能溶解____体积氨气 沸点低,易_____
2.实验探究:喷泉实验
实验试剂及装置
操作 打开止水夹,挤压胶头滴管
现象 烧杯中的溶液由玻璃管进入烧瓶,形成__________,瓶内液体呈________
结论
喷泉是一种常见的自然现象,其产生的原因是存在压强差。
(1)图1装置中的气体a可能为①氯气、②氢气、③氨气、④氯化氢、⑤二氧化碳。
打开装置中的止水夹,挤压胶头滴管,若液体b为水时,能产生喷泉现象的气体a可能是哪些?
若液体b为氢氧化钠浓溶液时,①②④⑤能产生喷泉现象的气体a可能是哪些?
(2)如果只提供如图2的装置(气体为氨气,液体为水),请说明引发喷泉的方法。
1.下列有关氨气的性质叙述不正确的是( )
A.常温下是无色无味的气体
B.氨气极易溶于水,可用来做喷泉实验
C.液态氨可用作制冷剂
D.可使湿润的红色石蕊试纸变蓝
2.如图是课外活动小组的同学设计的4个喷泉实验方案,下列有关操作不可能引发喷泉的是( )
A.挤压装置①的胶头滴管使CCl4全部进入烧瓶,片刻后打开止水夹
B.挤压装置②的胶头滴管使饱和NaHCO3溶液全部进入烧瓶,然后打开止水夹
C.用鼓气装置从装置③的a处不断鼓入空气并打开止水夹
D.在装置④的水槽中加入适量生石灰并打开止水夹
喷泉的常见类型及原理
方法 减小内压法 增大外压法
装置
原理 减小烧瓶内气体压强,形成压强差,产生喷泉现象 增大锥形瓶内气体压强,形成压强差,产生喷泉现象
常见组合 NH3(水或盐酸) HCl(水或NaOH溶液) CO2、SO2、Cl2(浓NaOH溶液) NaHCO3(盐酸) CaCO3(盐酸)
二、氨气的化学性质
1.实验探究
装置
现象 湿润的红色石蕊试纸______ 烧杯中有______
主要结论 浓氨水易______ NH3与HCl反应生成NH4Cl(白色固体颗粒)
特别提醒 可用HCl检验氨水运输管道是否漏气。
2.化学性质
(1)氨气与水反应
①氨气溶于水时,大部分氨分子和水分子结合成一水合氨(NH3·H2O),反应的化学方程式为____________________________________________________________________________。
②NH3·H2O不稳定,受热易分解,反应的化学方程式为____________________________
____________________________________________________________________________。
③氨水显弱碱性,电离方程式为________________________________________________
________________________________________,能使湿润的红色石蕊试纸变______或使酚酞溶液变______。
(2)氨气与酸反应
(3)从氮元素化合价预测NH3的性质
①NH3中N元素化合价为______价,处于______价态,因此NH3具有______________。
②写出下列转化的化学方程式:
a.氨气与氧气在加热和催化剂作用下生成NO:________________________________
__________________________________________________________________________。
b.氨气和氧化铜在加热条件下生成N2和Cu:_________________________________
_________________________________________________________________________。
3.氨气的用途
(1)应用于氮肥工业和硝酸工业。
(2)NH3易液化,常用作制冷剂。
1.液氨和氨水有什么区别?
2.“氨的催化氧化是工业制备硝酸的重要反应之一”,工业上由氨气制取硝酸有哪些反应步骤?写出反应过程的化学方程式。
(1)氨气是碱性气体,因此可用作制冷剂( )
(2)氨水呈碱性,是因为NH3溶于水发生反应:NH3+H2O??NH+OH-( )
(3)NH3中N元素为-3价,故NH3在氧化还原反应中只能作还原剂,不能作氧化剂( )
(4)蘸有浓氨水和浓硫酸的玻璃棒靠近,会在中间产生大量的白烟( )
1.下列关于氨水的说法不正确的是( )
A.氨水和液氨不同,氨水是由多种粒子构成的,液氨的组成中只有氨分子
B.氨水中物质的量浓度最大的粒子是NH3·H2O(除水外)
C.氨水显弱碱性,故通常保存在金属容器中
D.在1 mol·L-1氨水中,NH3·H2O、NH、NH3的物质的量浓度之和为1 mol·L-1
2.氨气是一种重要的工业原料。工业上利用反应3Cl2+8NH3===N2+6NH4Cl来检查氯气管道是否漏气。下列说法错误的是( )
A.若管道漏气,遇氨就会产生白烟
B.该反应利用了Cl2的强氧化性
C.该反应属于复分解反应
D.生成1 mol N2有6 mol电子转移
NH3还原性的表现
4NH3+5O24NO+6H2O(工业制HNO3);
4NH3+6NO5N2+6H2O(除NO毒气);
2NH3+3CuON2+3Cu+3H2O;
8NH3+3Cl2===N2+6NH4Cl(检查Cl2管道是否发生泄漏)。
1.在探究氨水成分的实验中,下列根据实验现象得出的结论不正确的是( )
A.氨水有刺激性气味,说明氨水中含有氨分子
B.向氨水中滴加酚酞试剂,溶液变红,说明氨水中含有OH-
C.加热浓氨水产生能使湿润的蓝色石蕊试纸变红的气体
D.浓氨水和浓盐酸靠近产生大量白烟,说明氨气与氯化氢容易反应
2.(2022·驻马店第一中学质检)如图装置中,干燥烧瓶内盛有某种气体,烧杯和滴管内盛放某种溶液。打开止水夹,挤压胶头滴管,下列与实验事实不相符的是( )
A.SO2(饱和NaHSO3溶液)/无色喷泉
B.NH3(CuSO4溶液)/蓝色喷泉
C.HCl(石蕊溶液)/红色喷泉
D.H2S(AgNO3溶液)/黑色喷泉
3.(2022·上海市洋泾中学高一期中)体积不相同的三个烧瓶中分别充满了NH3、HCl和NO2,将它们倒扣在水槽中充分溶解后,塞住瓶口取出,三个烧瓶内溶液的物质的量浓度之比为( )
A.1∶1∶1 B.2∶2∶3
C.3∶3∶2 D.无法判断
4.如图是NH3的两个性质实验,下列有关说法正确的是( )
A.两个实验均表现了NH3易溶于水
B.两个实验均表现了氨水易挥发
C.两个实验均表现了NH3是碱性气体
D.两个实验均表现了NH3是还原性气体
5.某实验小组设计了下列装置进行氨的催化氧化实验:
(1)盛放氨水的实验仪器的名称为_____________________________________________;
在加热条件下,硬质玻璃管中发生反应的化学方程式为_________________________。
(2)实验时发现:如果缺少乙处的干燥管,将反应后的气体直接通入烧瓶,则烧瓶中先产生白雾,随即产生白烟,其原因是_______________________________________________。
(3)烧杯中盛有氢氧化钠溶液的作用是_________________________________________。
第二单元 重要的含氮化工原料
第1课时 氨气
一、
1.无色 刺激性 小于 极易 700 液化
2.红色喷泉 红色 NH3极易溶于水,水溶液呈碱性
深度思考
(1)③④ ①④⑤
(2)打开止水夹,用热毛巾捂住圆底烧瓶至有气泡从水中冒出,移去热毛巾。
应用体验
1.A [常温下氨气是无色、有刺激性气味的气体,A错误;氨气极易溶于水,可做喷泉实验,B正确;氨气易液化,液态氨汽化时要吸收大量的热,使周围的温度急剧下降,故液态氨可用作制冷剂,C正确;氨气溶于水,溶液显碱性,可使湿润的红色石蕊试纸变蓝,D正确。]
2.B [Cl2易溶于CCl4且易和NaOH溶液反应,烧瓶内压强减小,形成喷泉,A项不符合题意;CO2在饱和NaHCO3溶液中溶解度很小,不能形成喷泉,B符合题意;从a处鼓入空气,打开止水夹,HCl和NaCl溶液接触,因为HCl极易溶于水,导致烧瓶内压强降低,可形成喷泉,C项不符合题意;加入生石灰,生石灰和水反应放出大量的热,导致锥形瓶内气压升高,打开止水夹,浓盐酸被压入烧瓶和NH3接触,NH3极易溶于水且和盐酸发生反应,可形成喷泉,D项不符合题意。]
二、
1.变蓝 白烟 挥发
2.(1)①NH3+H2O??NH3·H2O ②NH3·H2ONH3↑+H2O ③NH3·H2O??NH+OH- 蓝 红 (2)白烟 (3)①-3 最低 还原性 ②a.4NH3+5O24NO+6H2O b.2NH3+3CuON2+3Cu+3H2O
深度思考
1.液氨是氨气的液态,是纯净物,所含粒子为NH3;氨水是氨气的水溶液,是混合物,所含粒子有NH3、H2O、NH3·H2O、NH、OH-、H+。
2.①4NH3+5O24NO+6H2O,②2NO+O2===2NO2,③3NO2+H2O===2HNO3+NO。
正误判断
(1)× (2)× (3)× (4)×
应用体验
1.C [氨气溶于水时,大部分氨分子与水分子反应生成NH3·H2O,NH3·H2O有很小一部分电离成NH和OH-。氨水对许多金属有腐蚀作用,故一般情况下氨水存放在陶瓷坛,橡皮袋里面。]
2.C [此反应存在元素化合价的变化,一定为氧化还原反应,氧化还原反应不可能为复分解反应,C错误;Cl2在此反应中作氧化剂,体现强氧化性,B正确;反应生成了NH4Cl(白烟),A正确;2NH3N2,所以生成1 mol N2有6 mol电子转移,D正确。]
随堂演练 知识落实
1.C
2.A [SO2在饱和NaHSO3溶液中的溶解度很小,故不能形成喷泉,A项符合题意;NH3极易溶于水生成NH3·H2O,与CuSO4溶液反应生成Cu(OH)2蓝色沉淀,B项不符合题意;HCl极易溶于水,溶液呈酸性,使石蕊溶液呈红色,C项不符合题意;H2S和AgNO3反应生成Ag2S黑色沉淀,D项不符合题意。]
3.A [NH3、HCl极易溶于水,因此将充满NH3、HCl的烧瓶倒扣在水槽中充分溶解后,所得溶液会充满整个烧瓶,NO2溶于水发生反应3NO2+H2O===2HNO3+NO,根据反应的方程式可知,溶液会充满烧瓶的,假设三个烧瓶的体积分别为V1 L、V2 L、V3 L,该条件下气体摩尔体积为Vm,则n(NH3)= mol,n(HCl)= mol,n(HNO3)= mol,所得溶液的体积,氨水为V1 L,盐酸为V2 L,硝酸为V3 L,根据c=可得,三种溶液的浓度均为 mol·L-1,则三个烧瓶内溶液的物质的量浓度之比为1∶1∶1,故选A。]
4.C [实验Ⅰ体现了NH3易溶于水,且水溶液呈碱性,实验Ⅱ体现了氨水易挥发,挥发出的氨气分子和浓盐酸挥发出的氯化氢分子结合生成白色氯化铵固体小颗粒,也能证明氨气是碱性气体,所以两个实验均体现了NH3是碱性气体,故A、B错误,C正确;两个实验中都未发生氧化还原反应,所以无氧化性和还原性的体现,故D错误。]
5.(1)锥形瓶 4NH3+5O24NO+6H2O
(2)一氧化氮、氧气和水反应生成硝酸,硝酸吸收氨气生成硝酸铵
(3)吸收NH3等尾气,防止污染空气
解析 (1)盛放氨水的实验仪器为锥形瓶,氨催化氧化的反应为4NH3+5O24NO+6H2O。(2)一氧化氮、氧气和水反应生成硝酸:4NO+3O2+2H2O===4HNO3,硝酸吸收氨气生成硝酸铵:NH3+ HNO3===NH4NO3,所以如果缺少乙处的干燥管,将反应后的气体直接通入烧瓶,烧瓶中先产生白雾,随即产生白烟。(3)尾气中含有氮的氧化物、氨气等气体,直接排放会造成空气污染,通入氢氧化钠溶液中,可以吸收尾气,防止污染空气。
第1课时 氨气
[核心素养发展目标] 1.了解NH3的物理性质特点以及氨水显碱性的原因。2.能运用化学变化的知识说明氨气的化学性质。
一、氨气的物理性质和喷泉实验
1.氨气的物理性质
颜色状态 气味 密度 溶解性 沸点
_____气体 _____气味 ______空气 __________溶于水,常温常压下,1体积水大约能溶解____体积氨气 沸点低,易_____
2.实验探究:喷泉实验
实验试剂及装置
操作 打开止水夹,挤压胶头滴管
现象 烧杯中的溶液由玻璃管进入烧瓶,形成__________,瓶内液体呈________
结论
喷泉是一种常见的自然现象,其产生的原因是存在压强差。
(1)图1装置中的气体a可能为①氯气、②氢气、③氨气、④氯化氢、⑤二氧化碳。
打开装置中的止水夹,挤压胶头滴管,若液体b为水时,能产生喷泉现象的气体a可能是哪些?
若液体b为氢氧化钠浓溶液时,①②④⑤能产生喷泉现象的气体a可能是哪些?
(2)如果只提供如图2的装置(气体为氨气,液体为水),请说明引发喷泉的方法。
1.下列有关氨气的性质叙述不正确的是( )
A.常温下是无色无味的气体
B.氨气极易溶于水,可用来做喷泉实验
C.液态氨可用作制冷剂
D.可使湿润的红色石蕊试纸变蓝
2.如图是课外活动小组的同学设计的4个喷泉实验方案,下列有关操作不可能引发喷泉的是( )
A.挤压装置①的胶头滴管使CCl4全部进入烧瓶,片刻后打开止水夹
B.挤压装置②的胶头滴管使饱和NaHCO3溶液全部进入烧瓶,然后打开止水夹
C.用鼓气装置从装置③的a处不断鼓入空气并打开止水夹
D.在装置④的水槽中加入适量生石灰并打开止水夹
喷泉的常见类型及原理
方法 减小内压法 增大外压法
装置
原理 减小烧瓶内气体压强,形成压强差,产生喷泉现象 增大锥形瓶内气体压强,形成压强差,产生喷泉现象
常见组合 NH3(水或盐酸) HCl(水或NaOH溶液) CO2、SO2、Cl2(浓NaOH溶液) NaHCO3(盐酸) CaCO3(盐酸)
二、氨气的化学性质
1.实验探究
装置
现象 湿润的红色石蕊试纸______ 烧杯中有______
主要结论 浓氨水易______ NH3与HCl反应生成NH4Cl(白色固体颗粒)
特别提醒 可用HCl检验氨水运输管道是否漏气。
2.化学性质
(1)氨气与水反应
①氨气溶于水时,大部分氨分子和水分子结合成一水合氨(NH3·H2O),反应的化学方程式为____________________________________________________________________________。
②NH3·H2O不稳定,受热易分解,反应的化学方程式为____________________________
____________________________________________________________________________。
③氨水显弱碱性,电离方程式为________________________________________________
________________________________________,能使湿润的红色石蕊试纸变______或使酚酞溶液变______。
(2)氨气与酸反应
(3)从氮元素化合价预测NH3的性质
①NH3中N元素化合价为______价,处于______价态,因此NH3具有______________。
②写出下列转化的化学方程式:
a.氨气与氧气在加热和催化剂作用下生成NO:________________________________
__________________________________________________________________________。
b.氨气和氧化铜在加热条件下生成N2和Cu:_________________________________
_________________________________________________________________________。
3.氨气的用途
(1)应用于氮肥工业和硝酸工业。
(2)NH3易液化,常用作制冷剂。
1.液氨和氨水有什么区别?
2.“氨的催化氧化是工业制备硝酸的重要反应之一”,工业上由氨气制取硝酸有哪些反应步骤?写出反应过程的化学方程式。
(1)氨气是碱性气体,因此可用作制冷剂( )
(2)氨水呈碱性,是因为NH3溶于水发生反应:NH3+H2O??NH+OH-( )
(3)NH3中N元素为-3价,故NH3在氧化还原反应中只能作还原剂,不能作氧化剂( )
(4)蘸有浓氨水和浓硫酸的玻璃棒靠近,会在中间产生大量的白烟( )
1.下列关于氨水的说法不正确的是( )
A.氨水和液氨不同,氨水是由多种粒子构成的,液氨的组成中只有氨分子
B.氨水中物质的量浓度最大的粒子是NH3·H2O(除水外)
C.氨水显弱碱性,故通常保存在金属容器中
D.在1 mol·L-1氨水中,NH3·H2O、NH、NH3的物质的量浓度之和为1 mol·L-1
2.氨气是一种重要的工业原料。工业上利用反应3Cl2+8NH3===N2+6NH4Cl来检查氯气管道是否漏气。下列说法错误的是( )
A.若管道漏气,遇氨就会产生白烟
B.该反应利用了Cl2的强氧化性
C.该反应属于复分解反应
D.生成1 mol N2有6 mol电子转移
NH3还原性的表现
4NH3+5O24NO+6H2O(工业制HNO3);
4NH3+6NO5N2+6H2O(除NO毒气);
2NH3+3CuON2+3Cu+3H2O;
8NH3+3Cl2===N2+6NH4Cl(检查Cl2管道是否发生泄漏)。
1.在探究氨水成分的实验中,下列根据实验现象得出的结论不正确的是( )
A.氨水有刺激性气味,说明氨水中含有氨分子
B.向氨水中滴加酚酞试剂,溶液变红,说明氨水中含有OH-
C.加热浓氨水产生能使湿润的蓝色石蕊试纸变红的气体
D.浓氨水和浓盐酸靠近产生大量白烟,说明氨气与氯化氢容易反应
2.(2022·驻马店第一中学质检)如图装置中,干燥烧瓶内盛有某种气体,烧杯和滴管内盛放某种溶液。打开止水夹,挤压胶头滴管,下列与实验事实不相符的是( )
A.SO2(饱和NaHSO3溶液)/无色喷泉
B.NH3(CuSO4溶液)/蓝色喷泉
C.HCl(石蕊溶液)/红色喷泉
D.H2S(AgNO3溶液)/黑色喷泉
3.(2022·上海市洋泾中学高一期中)体积不相同的三个烧瓶中分别充满了NH3、HCl和NO2,将它们倒扣在水槽中充分溶解后,塞住瓶口取出,三个烧瓶内溶液的物质的量浓度之比为( )
A.1∶1∶1 B.2∶2∶3
C.3∶3∶2 D.无法判断
4.如图是NH3的两个性质实验,下列有关说法正确的是( )
A.两个实验均表现了NH3易溶于水
B.两个实验均表现了氨水易挥发
C.两个实验均表现了NH3是碱性气体
D.两个实验均表现了NH3是还原性气体
5.某实验小组设计了下列装置进行氨的催化氧化实验:
(1)盛放氨水的实验仪器的名称为_____________________________________________;
在加热条件下,硬质玻璃管中发生反应的化学方程式为_________________________。
(2)实验时发现:如果缺少乙处的干燥管,将反应后的气体直接通入烧瓶,则烧瓶中先产生白雾,随即产生白烟,其原因是_______________________________________________。
(3)烧杯中盛有氢氧化钠溶液的作用是_________________________________________。
第二单元 重要的含氮化工原料
第1课时 氨气
一、
1.无色 刺激性 小于 极易 700 液化
2.红色喷泉 红色 NH3极易溶于水,水溶液呈碱性
深度思考
(1)③④ ①④⑤
(2)打开止水夹,用热毛巾捂住圆底烧瓶至有气泡从水中冒出,移去热毛巾。
应用体验
1.A [常温下氨气是无色、有刺激性气味的气体,A错误;氨气极易溶于水,可做喷泉实验,B正确;氨气易液化,液态氨汽化时要吸收大量的热,使周围的温度急剧下降,故液态氨可用作制冷剂,C正确;氨气溶于水,溶液显碱性,可使湿润的红色石蕊试纸变蓝,D正确。]
2.B [Cl2易溶于CCl4且易和NaOH溶液反应,烧瓶内压强减小,形成喷泉,A项不符合题意;CO2在饱和NaHCO3溶液中溶解度很小,不能形成喷泉,B符合题意;从a处鼓入空气,打开止水夹,HCl和NaCl溶液接触,因为HCl极易溶于水,导致烧瓶内压强降低,可形成喷泉,C项不符合题意;加入生石灰,生石灰和水反应放出大量的热,导致锥形瓶内气压升高,打开止水夹,浓盐酸被压入烧瓶和NH3接触,NH3极易溶于水且和盐酸发生反应,可形成喷泉,D项不符合题意。]
二、
1.变蓝 白烟 挥发
2.(1)①NH3+H2O??NH3·H2O ②NH3·H2ONH3↑+H2O ③NH3·H2O??NH+OH- 蓝 红 (2)白烟 (3)①-3 最低 还原性 ②a.4NH3+5O24NO+6H2O b.2NH3+3CuON2+3Cu+3H2O
深度思考
1.液氨是氨气的液态,是纯净物,所含粒子为NH3;氨水是氨气的水溶液,是混合物,所含粒子有NH3、H2O、NH3·H2O、NH、OH-、H+。
2.①4NH3+5O24NO+6H2O,②2NO+O2===2NO2,③3NO2+H2O===2HNO3+NO。
正误判断
(1)× (2)× (3)× (4)×
应用体验
1.C [氨气溶于水时,大部分氨分子与水分子反应生成NH3·H2O,NH3·H2O有很小一部分电离成NH和OH-。氨水对许多金属有腐蚀作用,故一般情况下氨水存放在陶瓷坛,橡皮袋里面。]
2.C [此反应存在元素化合价的变化,一定为氧化还原反应,氧化还原反应不可能为复分解反应,C错误;Cl2在此反应中作氧化剂,体现强氧化性,B正确;反应生成了NH4Cl(白烟),A正确;2NH3N2,所以生成1 mol N2有6 mol电子转移,D正确。]
随堂演练 知识落实
1.C
2.A [SO2在饱和NaHSO3溶液中的溶解度很小,故不能形成喷泉,A项符合题意;NH3极易溶于水生成NH3·H2O,与CuSO4溶液反应生成Cu(OH)2蓝色沉淀,B项不符合题意;HCl极易溶于水,溶液呈酸性,使石蕊溶液呈红色,C项不符合题意;H2S和AgNO3反应生成Ag2S黑色沉淀,D项不符合题意。]
3.A [NH3、HCl极易溶于水,因此将充满NH3、HCl的烧瓶倒扣在水槽中充分溶解后,所得溶液会充满整个烧瓶,NO2溶于水发生反应3NO2+H2O===2HNO3+NO,根据反应的方程式可知,溶液会充满烧瓶的,假设三个烧瓶的体积分别为V1 L、V2 L、V3 L,该条件下气体摩尔体积为Vm,则n(NH3)= mol,n(HCl)= mol,n(HNO3)= mol,所得溶液的体积,氨水为V1 L,盐酸为V2 L,硝酸为V3 L,根据c=可得,三种溶液的浓度均为 mol·L-1,则三个烧瓶内溶液的物质的量浓度之比为1∶1∶1,故选A。]
4.C [实验Ⅰ体现了NH3易溶于水,且水溶液呈碱性,实验Ⅱ体现了氨水易挥发,挥发出的氨气分子和浓盐酸挥发出的氯化氢分子结合生成白色氯化铵固体小颗粒,也能证明氨气是碱性气体,所以两个实验均体现了NH3是碱性气体,故A、B错误,C正确;两个实验中都未发生氧化还原反应,所以无氧化性和还原性的体现,故D错误。]
5.(1)锥形瓶 4NH3+5O24NO+6H2O
(2)一氧化氮、氧气和水反应生成硝酸,硝酸吸收氨气生成硝酸铵
(3)吸收NH3等尾气,防止污染空气
解析 (1)盛放氨水的实验仪器为锥形瓶,氨催化氧化的反应为4NH3+5O24NO+6H2O。(2)一氧化氮、氧气和水反应生成硝酸:4NO+3O2+2H2O===4HNO3,硝酸吸收氨气生成硝酸铵:NH3+ HNO3===NH4NO3,所以如果缺少乙处的干燥管,将反应后的气体直接通入烧瓶,烧瓶中先产生白雾,随即产生白烟。(3)尾气中含有氮的氧化物、氨气等气体,直接排放会造成空气污染,通入氢氧化钠溶液中,可以吸收尾气,防止污染空气。
