专题7 第三单元 含氮化合物的合理使用 学案(含答案)
文档属性
| 名称 | 专题7 第三单元 含氮化合物的合理使用 学案(含答案) |
|
|
| 格式 | docx | ||
| 文件大小 | 797.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-08 15:53:30 | ||
图片预览




文档简介
第三单元 含氮化合物的合理使用
[核心素养发展目标] 1.能从物质的类别、氮元素价态的角度,预测铵盐的性质与转化,掌握铵盐的物理性质和化学性质,提高宏观辨识与模型认知能力。2.能够根据铵盐的性质提出探究问题,并会设计实验探究氨气的制法、铵根离子的检验等,培养科学探究与创新意识。3.理解氮氧化物(NO、NO2)的来源和性质,认识氮氧化物对人体健康、社会可持续发展可能带来的双重影响。
一、铵盐的性质
1.铵盐的性质
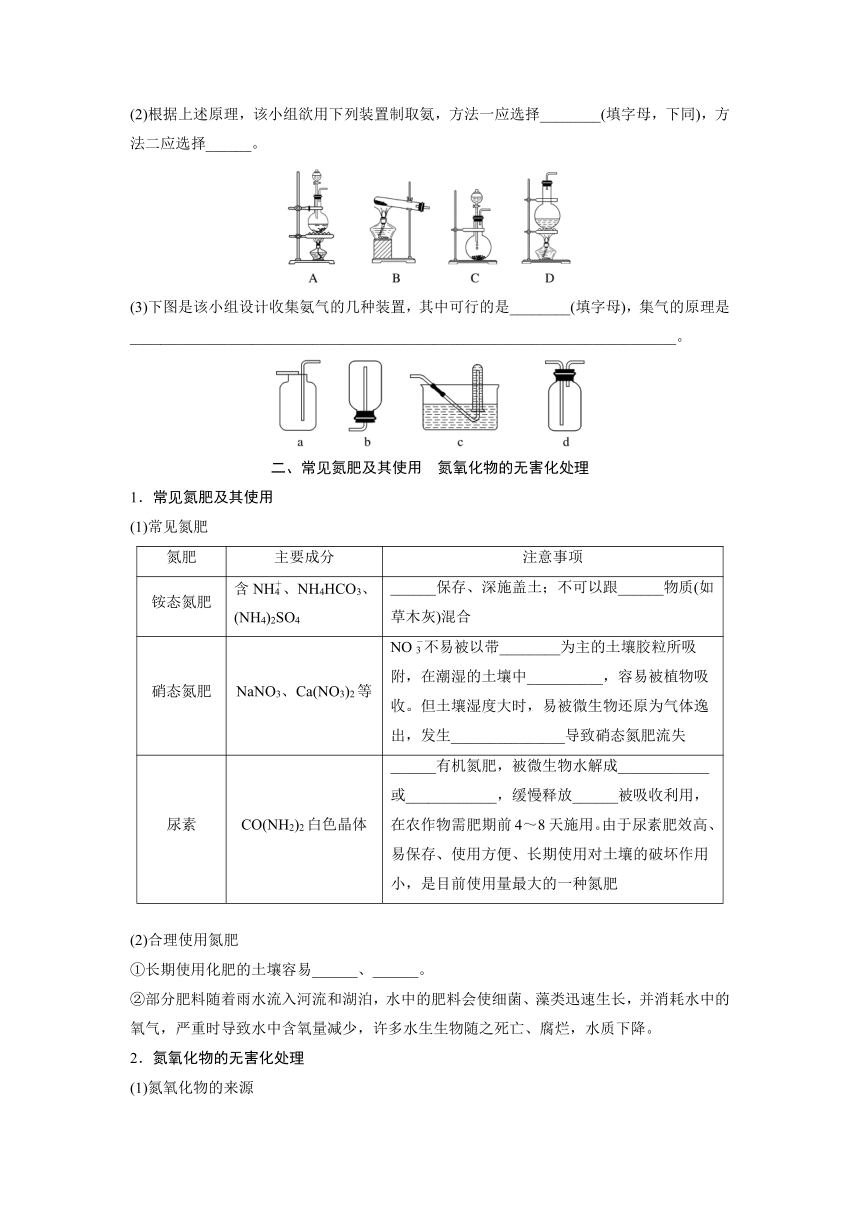
通常把由______离子与______离子形成的______化合物称为铵盐,大多为无色、易溶于水的晶体。
(1)实验探究
实验装置及操作
现象 试管中固体________,试纸变蓝 固体__________,产生______________气体,试管口有_______生成 试管中__________,试纸变蓝
结论 NH4HCO3分解产生____ ________ NH4Cl分解产生_______ NH4Cl和NaOH反应生成__________
(2)铵盐的化学性质
(3)NH的检验
①原理
②操作方法
取少量固体样品(或溶液)于试管中,加入______________溶液,加热,用_____________靠近试管口(或将蘸有____________的玻璃棒靠近试管口),试纸________(或产生白烟),则证明固体样品(或溶液中)含有NH。
2.氨气的实验室制法
(1)氨气的实验室制法
①制备原理
铵盐(NH4Cl)与强碱[Ca(OH)2]反应生成NH3,其化学方程式________________________
___________________________________________________________________________。
②实验装置
固体+固体→气体
或
③收集和验满
收集:NH3极易溶于水,密度比空气小,可以用________________收集。
验满:利用NH3的性质检验是否收集满。
把湿润的红色石蕊试纸置于试管口,试纸变______;或将蘸有浓盐酸的玻璃棒置于试管口,有______产生。
特别提醒 ①因为NH3为碱性气体,且能与CaCl2反应生成CaCl2·8NH3,所以不能用浓硫酸、无水氯化钙、P2O5等代替碱石灰干燥NH3。②收集NH3时,试管口处的棉花可减缓NH3与空气的对流。
(2)氨气的简易制法
方法及装置 原理及化学方程式
氨水具有__________和__________,受热易分解。 化学方程式为_______________________________
NaOH固体具有吸水性,溶于水放出大量的热,促使氨水分解。 CaO与水反应,使溶剂(水)减少;反应放热,促使氨水分解。化学方程式为____________________________ ______________________________________________
(1)加热盛有NH4Cl的试管,试管底部固体消失,试管口有晶体凝结,说明NH4Cl固体可以升华( )
(2)NH4Cl受热分解,所以可用加热的方法分离NH4Cl和NaCl( )
(3)某同学根据铵盐受热分解的性质,认为可以采用加热NH4Cl的方法来制取氨( )
(4)由于氨极易溶于水,所以多余的氨可以用导管直接插入水中进行吸收( )
(5)氨可以用浓硫酸来进行干燥( )
1.铵盐受热分解都能放出氨气,对吗?
2.试设计一个简单的实验,证明某白色固体是铵盐。
1.下列关于铵盐的叙述正确的是________(填序号)。
①所有铵盐中,氮元素化合价都是-3;②绝大多数铵盐都易溶于水;③铵态氮肥不宜与碱性肥料混合施用;④铵盐都是由离子构成的化合物;⑤铵盐都能与碱反应,不能与酸反应;⑥铵盐受热分解一定都会产生氨气
2.氨是化学实验室常需制取的气体。实验室也可以用下列两种方法快速制备NH3:
方法一:加热浓氨水。
方法二:将浓氨水滴入生石灰(或碱石灰)固体中。
(1)请写出上述两方法中发生反应的化学方程式(原理)。
(2)根据上述原理,该小组欲用下列装置制取氨,方法一应选择________(填字母,下同),方法二应选择______。
(3)下图是该小组设计收集氨气的几种装置,其中可行的是________(填字母),集气的原理是________________________________________________________________________。
二、常见氮肥及其使用 氮氧化物的无害化处理
1.常见氮肥及其使用
(1)常见氮肥
氮肥 主要成分 注意事项
铵态氮肥 含NH、NH4HCO3、(NH4)2SO4 ______保存、深施盖土;不可以跟______物质(如草木灰)混合
硝态氮肥 NaNO3、Ca(NO3)2等 NO不易被以带________为主的土壤胶粒所吸附,在潮湿的土壤中__________,容易被植物吸收。但土壤湿度大时,易被微生物还原为气体逸出,发生_______________导致硝态氮肥流失
尿素 CO(NH2)2白色晶体 ______有机氮肥,被微生物水解成____________或____________,缓慢释放______被吸收利用,在农作物需肥期前4~8天施用。由于尿素肥效高、易保存、使用方便、长期使用对土壤的破坏作用小,是目前使用量最大的一种氮肥
(2)合理使用氮肥
①长期使用化肥的土壤容易______、______。
②部分肥料随着雨水流入河流和湖泊,水中的肥料会使细菌、藻类迅速生长,并消耗水中的氧气,严重时导致水中含氧量减少,许多水生生物随之死亡、腐烂,水质下降。
2.氮氧化物的无害化处理
(1)氮氧化物的来源
氮氧化物(NOx)是大气污染物,主要包括:____________、____________。__________的燃烧、________生产等工业废气,机动车的尾气等都产生大量的氮氧化物产生大气污染。
(2)氮氧化物的危害
①酸雨:NO2HNO3,随雨水降落的硝酸会危害动植物和建筑物等。
②光化学烟雾:臭氧与氮氧化物和一些______________在紫外线照射下发生反应形成光化学烟雾。具有特殊气味,刺激眼睛,对人体健康和植物生长有很大危害。
(3)预防和控制氮氧化物的污染
①减少化石燃料使用并进行脱硝处理,积极寻找替代能源。
②合理处理工业废气,减少有害气体排放。
③汽车尾气:以甲醇、液化气代替汽油,安装汽车尾气净化装置。如:2NO+2CON2+CO2,使用液化天然气或高效燃料电池等方法,减少汽车尾气的排放。
(1)草木灰含钾元素和铵态氮肥混用效果更好( )
(2)目前广泛使用的肥料有尿素、复合化肥( )
(3)尿素是目前固态氮肥中含氮量最高的一种化肥( )
(4)汽车尾气中的氮氧化物和碳氢化合物是造成光化学烟雾的元凶( )
(5)“温室效应”加剧所带来的环境问题是形成光化学烟雾( )
(6)严格控制汽车尾气的排放,可有效减少氮氧化物对大气的污染( )
请根据氮肥的特性回答下列问题:
(1)为什么硝态氮肥不宜在高温天气、多雨的水田区施用,而多用于冷凉的旱地?
(2)为什么适应在pH较高的石灰性土壤中生长的植物优先使用硝态氮肥,而适应在酸性土壤中生长的植物优先使用铵态氮肥?
1.施用氮肥能促进作物生长,并能提高作物中蛋白质的含量。下列关于氮肥的说法错误的是( )
A.尿素[CO(NH2)2]是一种氮肥
B.储存碳酸氢铵时,应密封并置于阴凉通风处
C.铵态氮肥不能与碱性物质如草木灰等混合使用
D.氮肥溶于水,其中的氮元素均以铵根离子形式存在
2.(1)在一定条件下氨气亦可用来将氮氧化物转化为无污染的物质。写出氨气和二氧化氮在一定条件下反应的化学方程式:________________________________________________。
(2)若某工厂排出废气中NO2的含量为0.5%(体积分数),则处理1.0×103 m3(标准状况)这种废气,需要________ kg氨气(计算结果保留2位小数)。
1.中办、国办在第二轮中央生态环保督察启动之际印发了《中央生态环境保护督察工作规定》。可见国家对环境保护的重视程度。
下列环境问题与产生的主要原因不相符的是( )
①“光化学烟雾”主要是由汽车排放的氮氧化物所引起的
②“酸雨”主要是由空气中CO2的浓度增大引起的
③“温室效应”主要是由空气中CO2的浓度增大引起的
④“赤潮”主要是由于水体中N、P等元素含量过高而引起的
A.只有①② B.只有②③
C.全部 D.只有②
2.下列关于铵盐的叙述中不正确的是( )
A.常温下,大多都是易溶于水的晶体
B.可用作氮肥
C.热稳定性差,加热分解时一定产生NH3和酸
D.跟强碱共热时,有氨气放出
3.(2022·山东郓城县第一中学月考)下列氮肥属于复合肥料的是( )
A.CO(NH2)2 B.(NH4)2SO4
C.NH3·H2O D.KNO3
4.在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示。下列说法错误的是( )
A.NO2是该过程的中间产物
B.汽车尾气的主要污染成分包括CO和NO
C.NO和O2必须在催化剂表面才能反应
D.催化转化总反应式为2NO+O2+4CO4CO2+N2
5.氨气是化学实验室常需制取的气体。实验室制取氨气通常有两种方法:①用固体氢氧化钙与氯化铵共热;②在常温下用固体氢氧化钠与浓氨水反应。
(1)下面的制取装置图中,方法①应选用装置____(填“A”或“B”,下同),方法②应选用装置________。
(2)在制取后,如果要干燥氨气,应选用的干燥剂是______(填字母)。
A.浓硫酸
B.固体氢氧化钠
C.五氧化二磷
(3)检验集气瓶中是否收集满氨气的方法是_______________________________________
___________________________________________________________________________。
第三单元 含氮化合物的合理使用
一、
1.铵根 酸根 离子 (1)逐渐减少 逐渐减少 有刺激性气味 白色固体 有刺激性气味气体产生 NH3 NH3 NH3 (2)NH4HCO3NH3↑+CO2↑+H2O NH4ClNH3↑+HCl↑ NaOH+NH4ClNH3↑+NaCl+H2O NH+OH-NH3↑+H2O (3)①变蓝 白烟 ②浓氢氧化钠 湿润的红色石蕊试纸 浓盐酸 变蓝
2.(1)①2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O ③向下排空气法 蓝色 白烟
(2)不稳定性 挥发性 NH3·H2ONH3↑+H2O NH3·H2O+CaO===NH3↑+Ca(OH)2
正误判断
(1)× (2)√ (3)× (4)× (5)×
深度思考
1.不对。有的铵盐受热分解不能放出氨气,如一定条件下NH4NO3受热分解成HNO3、N2和水。
2.取少量白色固体放在研钵中,再加入氢氧化钙固体,用研杵混合研磨,慢慢可以闻到刺激性气味,证明该固体为铵盐。
应用体验
1.②③④
解析 ①硝酸铵中氮元素既有-3价又有+5价,错误;②绝大多数铵盐都易溶于水,正确;③铵态氮肥中含有NH,能与OH-结合形成NH3·H2O,NH3·H2O受热分解产生氨并逸出,使铵态氮肥的肥效降低,因此不宜与碱性肥料混合施用,正确;④铵盐都是由铵根离子与酸根离子构成的,属于离子化合物,正确;⑤弱酸的铵盐(如碳酸铵等)能与酸反应,错误;⑥铵盐受热分解不一定生成氨气,如硝酸铵等,错误。
2.(1)方法一:NH3·H2ONH3↑+H2O;
方法二:NH3·H2O+CaO===NH3↑+Ca(OH)2。
(2)D C
(3)d 利用NH3的密度小于空气,采用短管进氨气,长管出空气的方法收集
二、
1.(1)低温 碱性 负电荷 流动性大 反硝化作用 中性 (NH4)2CO3 NH4HCO3 NH3 (2)①酸化 板结
2.(1)一氧化氮(NO) 二氧化氮(NO2) 化石燃料 硝酸 (2)②碳氢化合物
正误判断
(1)× (2)√ (3)√ (4)√ (5)× (6)√
深度思考
(1)硝态氮肥的特点:①易溶于水,②不易被土壤吸附,③湿度大的情况下易进行反硝化而损失,④受热易分解。
(2)硝态氮肥易溶于水,对作物吸收钙、镁、钾等养分无抑制作用,长期使用可有效改良碱性土壤。铵态氮肥在碱性环境中氨易挥发损失,作物吸收过量铵态氮对钙、钾的吸收有一定的抑制作用。
应用体验
1.D [尿素[CO(NH2)2]是一种常用的高效的氮肥,A正确;由于碳酸氢铵在温度较高时易分解,则储存碳酸氢铵时,应密封并置于阴凉通风处,B正确;铵态氮肥水解呈酸性,碳酸钾水解呈碱性,二者混合可相互促进水解生成氨气而降低肥效,C正确;氮元素在尿素中以分子形式存在,不是铵根离子,硝态氮肥中氮元素以NO形式存在,D错误。]
2.(1)8NH3+6NO27N2+12H2O
(2)5.06
解析 (2)尾气中二氧化氮含量为1.0×106 L×0.5%=0.5×104 L,设需要氨气x mol,
6NO2 + 8NH3 7N2+ 12H2O
6×22.4 L 8 mol
0.5×104 L x mol
解得x≈297.62,则氨气的质量为297.62×17×10-3 kg≈5.06 kg。
随堂演练 知识落实
1.D [“酸雨”主要是由空气中SO2或NOx的浓度增大引起的。]
2.C [铵盐的共性:大多都易溶于水;与强碱加热反应生成氨气;受热易分解,但分解不一定都产生氨气;含有氮元素,可做氮肥;分析可知C不正确。]
3.D [复合肥料是指同时含有两种或两种以上营养元素的肥料,KNO3含有钾元素和氮元素,属于复合肥料。]
4.C [由题图可知:2NO+O2===2NO2,2NO2+4CO4CO2+N2,NO2是该过程的中间产物,A项正确;汽车尾气的主要污染成分为有毒的CO和NO,B项正确;NO和O2在常温下就能反应生成NO2,C项错误;由图示可知,该反应过程分两步进行:2NO+O2===2NO2、2NO2+4CO4CO2+N2,总反应为2NO+O2+4CO4CO2+N2,D项正确。]
5.(1)A B (2)B
(3)将湿润的红色石蕊试纸放在集气瓶口,如试纸变蓝,说明气体已收集满
解析 A装置适用于固体与固体加热制气体,B装置适用于液体与固体(或液体)不加热制气体。NH3为碱性气体,只能用碱性干燥剂。检验NH3一般用湿润的红色石蕊试纸。
[核心素养发展目标] 1.能从物质的类别、氮元素价态的角度,预测铵盐的性质与转化,掌握铵盐的物理性质和化学性质,提高宏观辨识与模型认知能力。2.能够根据铵盐的性质提出探究问题,并会设计实验探究氨气的制法、铵根离子的检验等,培养科学探究与创新意识。3.理解氮氧化物(NO、NO2)的来源和性质,认识氮氧化物对人体健康、社会可持续发展可能带来的双重影响。
一、铵盐的性质
1.铵盐的性质
通常把由______离子与______离子形成的______化合物称为铵盐,大多为无色、易溶于水的晶体。
(1)实验探究
实验装置及操作
现象 试管中固体________,试纸变蓝 固体__________,产生______________气体,试管口有_______生成 试管中__________,试纸变蓝
结论 NH4HCO3分解产生____ ________ NH4Cl分解产生_______ NH4Cl和NaOH反应生成__________
(2)铵盐的化学性质
(3)NH的检验
①原理
②操作方法
取少量固体样品(或溶液)于试管中,加入______________溶液,加热,用_____________靠近试管口(或将蘸有____________的玻璃棒靠近试管口),试纸________(或产生白烟),则证明固体样品(或溶液中)含有NH。
2.氨气的实验室制法
(1)氨气的实验室制法
①制备原理
铵盐(NH4Cl)与强碱[Ca(OH)2]反应生成NH3,其化学方程式________________________
___________________________________________________________________________。
②实验装置
固体+固体→气体
或
③收集和验满
收集:NH3极易溶于水,密度比空气小,可以用________________收集。
验满:利用NH3的性质检验是否收集满。
把湿润的红色石蕊试纸置于试管口,试纸变______;或将蘸有浓盐酸的玻璃棒置于试管口,有______产生。
特别提醒 ①因为NH3为碱性气体,且能与CaCl2反应生成CaCl2·8NH3,所以不能用浓硫酸、无水氯化钙、P2O5等代替碱石灰干燥NH3。②收集NH3时,试管口处的棉花可减缓NH3与空气的对流。
(2)氨气的简易制法
方法及装置 原理及化学方程式
氨水具有__________和__________,受热易分解。 化学方程式为_______________________________
NaOH固体具有吸水性,溶于水放出大量的热,促使氨水分解。 CaO与水反应,使溶剂(水)减少;反应放热,促使氨水分解。化学方程式为____________________________ ______________________________________________
(1)加热盛有NH4Cl的试管,试管底部固体消失,试管口有晶体凝结,说明NH4Cl固体可以升华( )
(2)NH4Cl受热分解,所以可用加热的方法分离NH4Cl和NaCl( )
(3)某同学根据铵盐受热分解的性质,认为可以采用加热NH4Cl的方法来制取氨( )
(4)由于氨极易溶于水,所以多余的氨可以用导管直接插入水中进行吸收( )
(5)氨可以用浓硫酸来进行干燥( )
1.铵盐受热分解都能放出氨气,对吗?
2.试设计一个简单的实验,证明某白色固体是铵盐。
1.下列关于铵盐的叙述正确的是________(填序号)。
①所有铵盐中,氮元素化合价都是-3;②绝大多数铵盐都易溶于水;③铵态氮肥不宜与碱性肥料混合施用;④铵盐都是由离子构成的化合物;⑤铵盐都能与碱反应,不能与酸反应;⑥铵盐受热分解一定都会产生氨气
2.氨是化学实验室常需制取的气体。实验室也可以用下列两种方法快速制备NH3:
方法一:加热浓氨水。
方法二:将浓氨水滴入生石灰(或碱石灰)固体中。
(1)请写出上述两方法中发生反应的化学方程式(原理)。
(2)根据上述原理,该小组欲用下列装置制取氨,方法一应选择________(填字母,下同),方法二应选择______。
(3)下图是该小组设计收集氨气的几种装置,其中可行的是________(填字母),集气的原理是________________________________________________________________________。
二、常见氮肥及其使用 氮氧化物的无害化处理
1.常见氮肥及其使用
(1)常见氮肥
氮肥 主要成分 注意事项
铵态氮肥 含NH、NH4HCO3、(NH4)2SO4 ______保存、深施盖土;不可以跟______物质(如草木灰)混合
硝态氮肥 NaNO3、Ca(NO3)2等 NO不易被以带________为主的土壤胶粒所吸附,在潮湿的土壤中__________,容易被植物吸收。但土壤湿度大时,易被微生物还原为气体逸出,发生_______________导致硝态氮肥流失
尿素 CO(NH2)2白色晶体 ______有机氮肥,被微生物水解成____________或____________,缓慢释放______被吸收利用,在农作物需肥期前4~8天施用。由于尿素肥效高、易保存、使用方便、长期使用对土壤的破坏作用小,是目前使用量最大的一种氮肥
(2)合理使用氮肥
①长期使用化肥的土壤容易______、______。
②部分肥料随着雨水流入河流和湖泊,水中的肥料会使细菌、藻类迅速生长,并消耗水中的氧气,严重时导致水中含氧量减少,许多水生生物随之死亡、腐烂,水质下降。
2.氮氧化物的无害化处理
(1)氮氧化物的来源
氮氧化物(NOx)是大气污染物,主要包括:____________、____________。__________的燃烧、________生产等工业废气,机动车的尾气等都产生大量的氮氧化物产生大气污染。
(2)氮氧化物的危害
①酸雨:NO2HNO3,随雨水降落的硝酸会危害动植物和建筑物等。
②光化学烟雾:臭氧与氮氧化物和一些______________在紫外线照射下发生反应形成光化学烟雾。具有特殊气味,刺激眼睛,对人体健康和植物生长有很大危害。
(3)预防和控制氮氧化物的污染
①减少化石燃料使用并进行脱硝处理,积极寻找替代能源。
②合理处理工业废气,减少有害气体排放。
③汽车尾气:以甲醇、液化气代替汽油,安装汽车尾气净化装置。如:2NO+2CON2+CO2,使用液化天然气或高效燃料电池等方法,减少汽车尾气的排放。
(1)草木灰含钾元素和铵态氮肥混用效果更好( )
(2)目前广泛使用的肥料有尿素、复合化肥( )
(3)尿素是目前固态氮肥中含氮量最高的一种化肥( )
(4)汽车尾气中的氮氧化物和碳氢化合物是造成光化学烟雾的元凶( )
(5)“温室效应”加剧所带来的环境问题是形成光化学烟雾( )
(6)严格控制汽车尾气的排放,可有效减少氮氧化物对大气的污染( )
请根据氮肥的特性回答下列问题:
(1)为什么硝态氮肥不宜在高温天气、多雨的水田区施用,而多用于冷凉的旱地?
(2)为什么适应在pH较高的石灰性土壤中生长的植物优先使用硝态氮肥,而适应在酸性土壤中生长的植物优先使用铵态氮肥?
1.施用氮肥能促进作物生长,并能提高作物中蛋白质的含量。下列关于氮肥的说法错误的是( )
A.尿素[CO(NH2)2]是一种氮肥
B.储存碳酸氢铵时,应密封并置于阴凉通风处
C.铵态氮肥不能与碱性物质如草木灰等混合使用
D.氮肥溶于水,其中的氮元素均以铵根离子形式存在
2.(1)在一定条件下氨气亦可用来将氮氧化物转化为无污染的物质。写出氨气和二氧化氮在一定条件下反应的化学方程式:________________________________________________。
(2)若某工厂排出废气中NO2的含量为0.5%(体积分数),则处理1.0×103 m3(标准状况)这种废气,需要________ kg氨气(计算结果保留2位小数)。
1.中办、国办在第二轮中央生态环保督察启动之际印发了《中央生态环境保护督察工作规定》。可见国家对环境保护的重视程度。
下列环境问题与产生的主要原因不相符的是( )
①“光化学烟雾”主要是由汽车排放的氮氧化物所引起的
②“酸雨”主要是由空气中CO2的浓度增大引起的
③“温室效应”主要是由空气中CO2的浓度增大引起的
④“赤潮”主要是由于水体中N、P等元素含量过高而引起的
A.只有①② B.只有②③
C.全部 D.只有②
2.下列关于铵盐的叙述中不正确的是( )
A.常温下,大多都是易溶于水的晶体
B.可用作氮肥
C.热稳定性差,加热分解时一定产生NH3和酸
D.跟强碱共热时,有氨气放出
3.(2022·山东郓城县第一中学月考)下列氮肥属于复合肥料的是( )
A.CO(NH2)2 B.(NH4)2SO4
C.NH3·H2O D.KNO3
4.在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示。下列说法错误的是( )
A.NO2是该过程的中间产物
B.汽车尾气的主要污染成分包括CO和NO
C.NO和O2必须在催化剂表面才能反应
D.催化转化总反应式为2NO+O2+4CO4CO2+N2
5.氨气是化学实验室常需制取的气体。实验室制取氨气通常有两种方法:①用固体氢氧化钙与氯化铵共热;②在常温下用固体氢氧化钠与浓氨水反应。
(1)下面的制取装置图中,方法①应选用装置____(填“A”或“B”,下同),方法②应选用装置________。
(2)在制取后,如果要干燥氨气,应选用的干燥剂是______(填字母)。
A.浓硫酸
B.固体氢氧化钠
C.五氧化二磷
(3)检验集气瓶中是否收集满氨气的方法是_______________________________________
___________________________________________________________________________。
第三单元 含氮化合物的合理使用
一、
1.铵根 酸根 离子 (1)逐渐减少 逐渐减少 有刺激性气味 白色固体 有刺激性气味气体产生 NH3 NH3 NH3 (2)NH4HCO3NH3↑+CO2↑+H2O NH4ClNH3↑+HCl↑ NaOH+NH4ClNH3↑+NaCl+H2O NH+OH-NH3↑+H2O (3)①变蓝 白烟 ②浓氢氧化钠 湿润的红色石蕊试纸 浓盐酸 变蓝
2.(1)①2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O ③向下排空气法 蓝色 白烟
(2)不稳定性 挥发性 NH3·H2ONH3↑+H2O NH3·H2O+CaO===NH3↑+Ca(OH)2
正误判断
(1)× (2)√ (3)× (4)× (5)×
深度思考
1.不对。有的铵盐受热分解不能放出氨气,如一定条件下NH4NO3受热分解成HNO3、N2和水。
2.取少量白色固体放在研钵中,再加入氢氧化钙固体,用研杵混合研磨,慢慢可以闻到刺激性气味,证明该固体为铵盐。
应用体验
1.②③④
解析 ①硝酸铵中氮元素既有-3价又有+5价,错误;②绝大多数铵盐都易溶于水,正确;③铵态氮肥中含有NH,能与OH-结合形成NH3·H2O,NH3·H2O受热分解产生氨并逸出,使铵态氮肥的肥效降低,因此不宜与碱性肥料混合施用,正确;④铵盐都是由铵根离子与酸根离子构成的,属于离子化合物,正确;⑤弱酸的铵盐(如碳酸铵等)能与酸反应,错误;⑥铵盐受热分解不一定生成氨气,如硝酸铵等,错误。
2.(1)方法一:NH3·H2ONH3↑+H2O;
方法二:NH3·H2O+CaO===NH3↑+Ca(OH)2。
(2)D C
(3)d 利用NH3的密度小于空气,采用短管进氨气,长管出空气的方法收集
二、
1.(1)低温 碱性 负电荷 流动性大 反硝化作用 中性 (NH4)2CO3 NH4HCO3 NH3 (2)①酸化 板结
2.(1)一氧化氮(NO) 二氧化氮(NO2) 化石燃料 硝酸 (2)②碳氢化合物
正误判断
(1)× (2)√ (3)√ (4)√ (5)× (6)√
深度思考
(1)硝态氮肥的特点:①易溶于水,②不易被土壤吸附,③湿度大的情况下易进行反硝化而损失,④受热易分解。
(2)硝态氮肥易溶于水,对作物吸收钙、镁、钾等养分无抑制作用,长期使用可有效改良碱性土壤。铵态氮肥在碱性环境中氨易挥发损失,作物吸收过量铵态氮对钙、钾的吸收有一定的抑制作用。
应用体验
1.D [尿素[CO(NH2)2]是一种常用的高效的氮肥,A正确;由于碳酸氢铵在温度较高时易分解,则储存碳酸氢铵时,应密封并置于阴凉通风处,B正确;铵态氮肥水解呈酸性,碳酸钾水解呈碱性,二者混合可相互促进水解生成氨气而降低肥效,C正确;氮元素在尿素中以分子形式存在,不是铵根离子,硝态氮肥中氮元素以NO形式存在,D错误。]
2.(1)8NH3+6NO27N2+12H2O
(2)5.06
解析 (2)尾气中二氧化氮含量为1.0×106 L×0.5%=0.5×104 L,设需要氨气x mol,
6NO2 + 8NH3 7N2+ 12H2O
6×22.4 L 8 mol
0.5×104 L x mol
解得x≈297.62,则氨气的质量为297.62×17×10-3 kg≈5.06 kg。
随堂演练 知识落实
1.D [“酸雨”主要是由空气中SO2或NOx的浓度增大引起的。]
2.C [铵盐的共性:大多都易溶于水;与强碱加热反应生成氨气;受热易分解,但分解不一定都产生氨气;含有氮元素,可做氮肥;分析可知C不正确。]
3.D [复合肥料是指同时含有两种或两种以上营养元素的肥料,KNO3含有钾元素和氮元素,属于复合肥料。]
4.C [由题图可知:2NO+O2===2NO2,2NO2+4CO4CO2+N2,NO2是该过程的中间产物,A项正确;汽车尾气的主要污染成分为有毒的CO和NO,B项正确;NO和O2在常温下就能反应生成NO2,C项错误;由图示可知,该反应过程分两步进行:2NO+O2===2NO2、2NO2+4CO4CO2+N2,总反应为2NO+O2+4CO4CO2+N2,D项正确。]
5.(1)A B (2)B
(3)将湿润的红色石蕊试纸放在集气瓶口,如试纸变蓝,说明气体已收集满
解析 A装置适用于固体与固体加热制气体,B装置适用于液体与固体(或液体)不加热制气体。NH3为碱性气体,只能用碱性干燥剂。检验NH3一般用湿润的红色石蕊试纸。
