专题7 氮与社会可持续发展 第三单元 阶段重点突破练(三) (含答案)
文档属性
| 名称 | 专题7 氮与社会可持续发展 第三单元 阶段重点突破练(三) (含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 550.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-08 16:49:26 | ||
图片预览

文档简介
专题7 氮与社会可持续发展 阶段重点突破练(三)
一、氮及其氧化物的重要性质及相关计算
1.下列具有氮的固定作用的化学反应是( )
A.氮气与氢气在一定条件下反应生成氨气
B.一氧化氮与氧气反应生成二氧化氮
C.氨气经催化氧化生成一氧化氮
D.由氨气制碳酸氢铵和硫酸铵
2.下列关于氮及其化合物的说法正确的是( )
A.N2化学性质稳定,可用作保护气
B.NO、NO2均为大气污染气体,在大气中可稳定存在
C.NO、NO2均易溶于水
D.NO、NO2均能与水发生反应
3.(2022·江苏金湖中学高一期中)下列关于NO2的制取、净化、收集及尾气处理的装置和原理不能达到实验目的的是( )
A B C D
制取NO2 净化NO2 收集NO2 尾气处理
4.反应3NO2+H2O===2HNO3+NO中,当有6 mol e-发生转移时,被氧化的物质与被还原的物质的物质的量之比为( )
A.1∶1 B.1∶2 C.2∶1 D.3∶1
5.将a mL NO、b mL NO2和c mL O2混合于同一试管中,将试管倒置于水中,充分反应后,试管内气体全部消失,则a∶b∶c不可能是( )
A.1∶1∶1 B.2∶1∶1
C.3∶7∶4 D.1∶5∶2
二、氨及铵盐
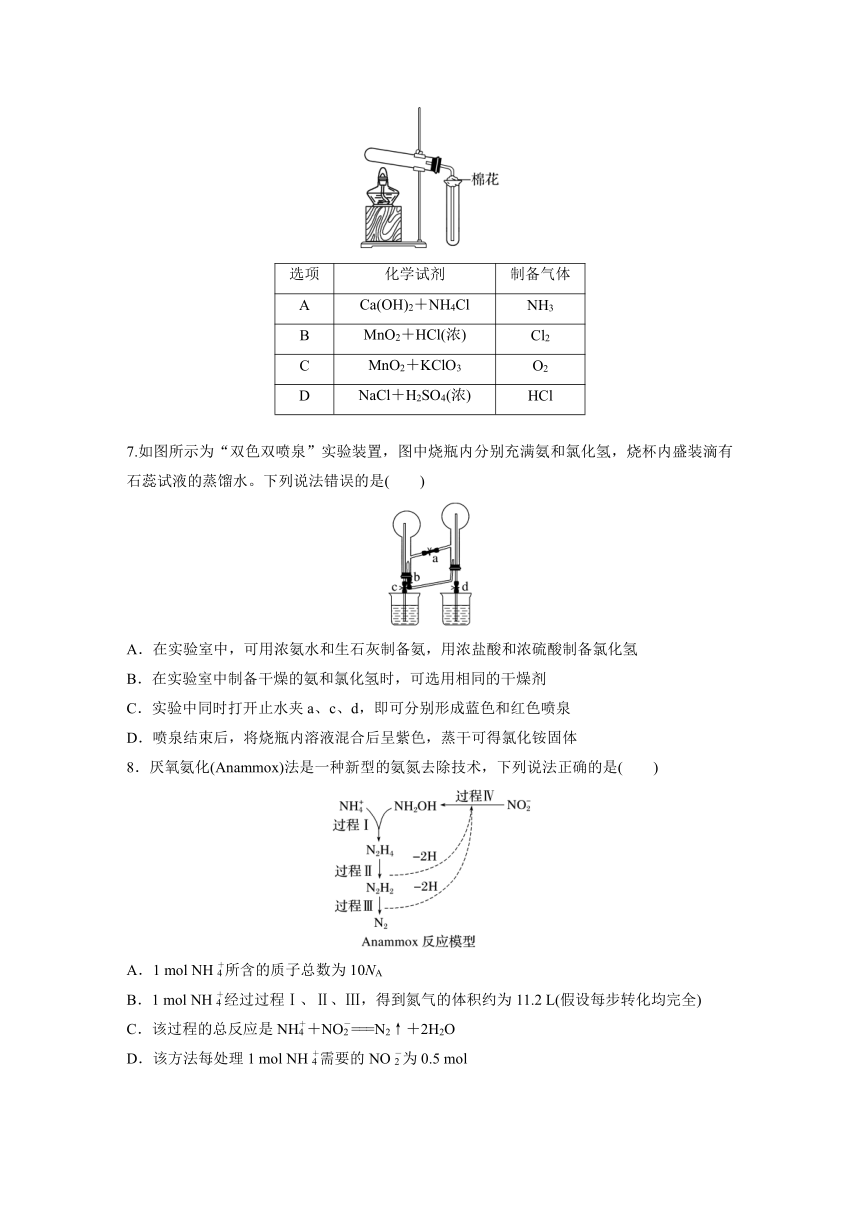
6.(2021·全国乙卷,8)在实验室采用如图装置制备气体,合理的是( )
选项 化学试剂 制备气体
A Ca(OH)2+NH4Cl NH3
B MnO2+HCl(浓) Cl2
C MnO2+KClO3 O2
D NaCl+H2SO4(浓) HCl
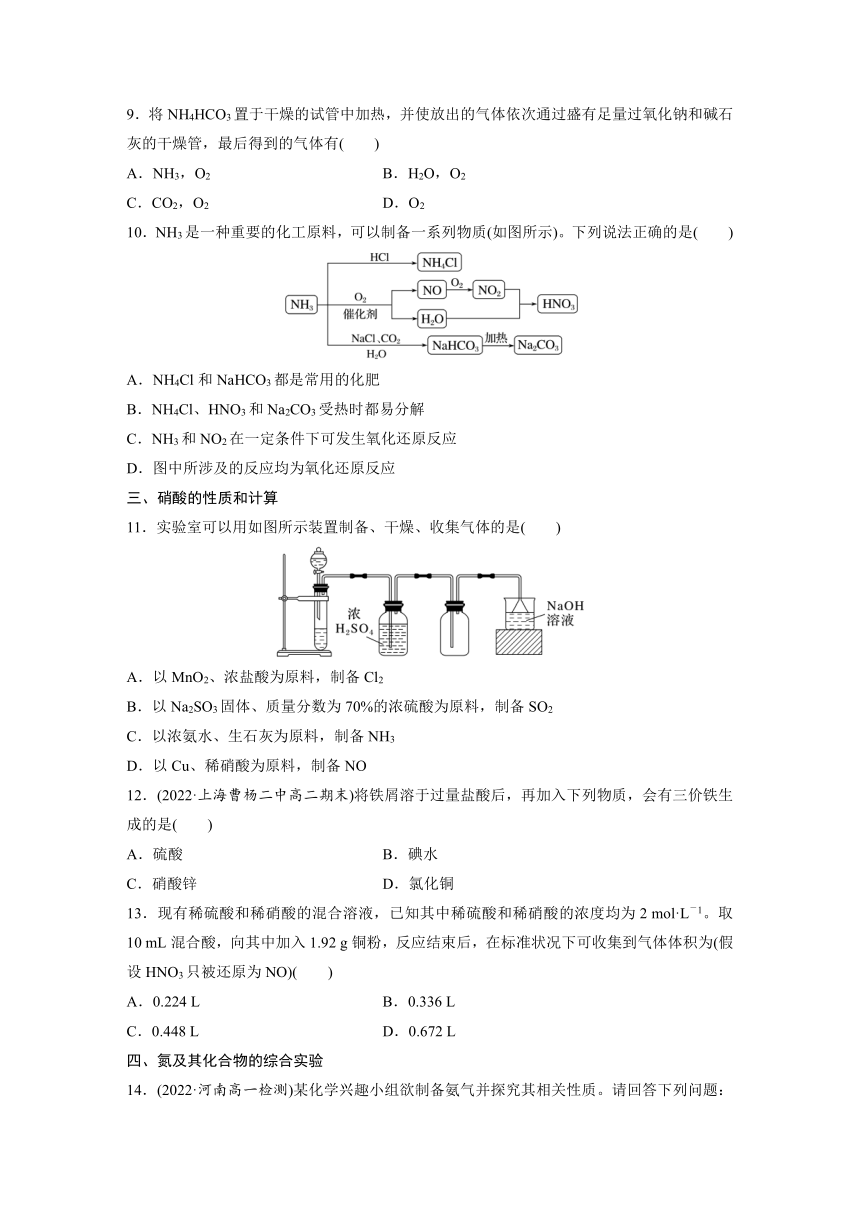
7.如图所示为“双色双喷泉”实验装置,图中烧瓶内分别充满氨和氯化氢,烧杯内盛装滴有石蕊试液的蒸馏水。下列说法错误的是( )
A.在实验室中,可用浓氨水和生石灰制备氨,用浓盐酸和浓硫酸制备氯化氢
B.在实验室中制备干燥的氨和氯化氢时,可选用相同的干燥剂
C.实验中同时打开止水夹a、c、d,即可分别形成蓝色和红色喷泉
D.喷泉结束后,将烧瓶内溶液混合后呈紫色,蒸干可得氯化铵固体
8.厌氧氨化(Anammox)法是一种新型的氨氮去除技术,下列说法正确的是( )
A.1 mol NH所含的质子总数为10NA
B.1 mol NH经过过程Ⅰ、Ⅱ、Ⅲ,得到氮气的体积约为11.2 L(假设每步转化均完全)
C.该过程的总反应是NH+NO===N2↑+2H2O
D.该方法每处理1 mol NH需要的NO为0.5 mol
9.将NH4HCO3置于干燥的试管中加热,并使放出的气体依次通过盛有足量过氧化钠和碱石灰的干燥管,最后得到的气体有( )
A.NH3,O2 B.H2O,O2
C.CO2,O2 D.O2
10.NH3是一种重要的化工原料,可以制备一系列物质(如图所示)。下列说法正确的是( )
A.NH4Cl和NaHCO3都是常用的化肥
B.NH4Cl、HNO3和Na2CO3受热时都易分解
C.NH3和NO2在一定条件下可发生氧化还原反应
D.图中所涉及的反应均为氧化还原反应
三、硝酸的性质和计算
11.实验室可以用如图所示装置制备、干燥、收集气体的是( )
A.以MnO2、浓盐酸为原料,制备Cl2
B.以Na2SO3固体、质量分数为70%的浓硫酸为原料,制备SO2
C.以浓氨水、生石灰为原料,制备NH3
D.以Cu、稀硝酸为原料,制备NO
12.(2022·上海曹杨二中高二期末)将铁屑溶于过量盐酸后,再加入下列物质,会有三价铁生成的是( )
A.硫酸 B.碘水
C.硝酸锌 D.氯化铜
13.现有稀硫酸和稀硝酸的混合溶液,已知其中稀硫酸和稀硝酸的浓度均为2 mol·L-1。取10 mL混合酸,向其中加入1.92 g铜粉,反应结束后,在标准状况下可收集到气体体积为(假设HNO3只被还原为NO)( )
A.0.224 L B.0.336 L
C.0.448 L D.0.672 L
四、氮及其化合物的综合实验
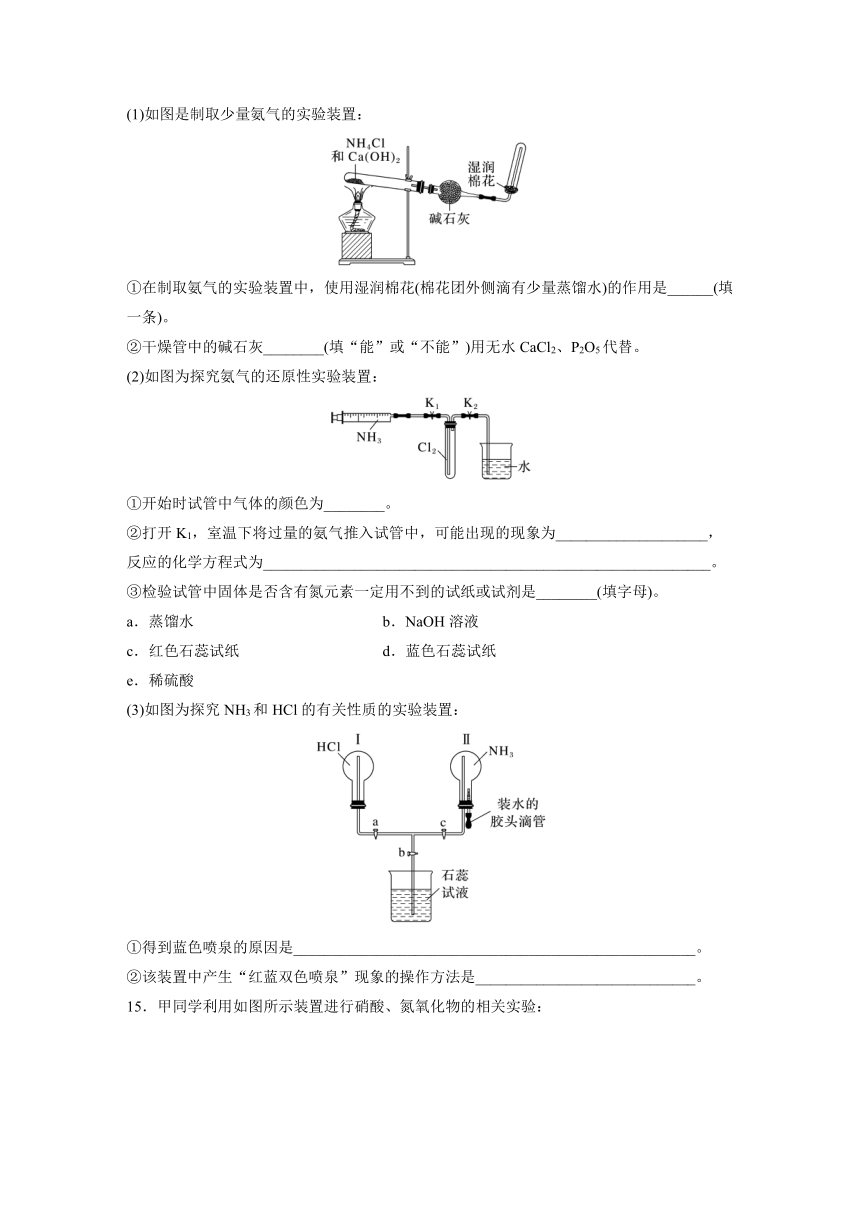
14.(2022·河南高一检测)某化学兴趣小组欲制备氨气并探究其相关性质。请回答下列问题:
(1)如图是制取少量氨气的实验装置:
①在制取氨气的实验装置中,使用湿润棉花(棉花团外侧滴有少量蒸馏水)的作用是______(填一条)。
②干燥管中的碱石灰________(填“能”或“不能”)用无水CaCl2、P2O5代替。
(2)如图为探究氨气的还原性实验装置:
①开始时试管中气体的颜色为________。
②打开K1,室温下将过量的氨气推入试管中,可能出现的现象为____________________,
反应的化学方程式为___________________________________________________________。
③检验试管中固体是否含有氮元素一定用不到的试纸或试剂是________(填字母)。
a.蒸馏水 b.NaOH溶液
c.红色石蕊试纸 d.蓝色石蕊试纸
e.稀硫酸
(3)如图为探究NH3和HCl的有关性质的实验装置:
①得到蓝色喷泉的原因是_____________________________________________________。
②该装置中产生“红蓝双色喷泉”现象的操作方法是_____________________________。
15.甲同学利用如图所示装置进行硝酸、氮氧化物的相关实验:
实验Ⅰ:将铜片放入烧杯A后,立即用烧杯B盖住
(1)烧杯A液体上方出现大量红棕色气体,该反应的化学方程式为___________________。
(2)一段时间后,红棕色气体消失,烧杯C中的液体变成蓝色,甲同学分析出现蓝色的原因,认为其中涉及到两个反应:
①红棕色气体消失,该化学方程式为____________________________________________。
②配平溶液出现蓝色的离子方程式,并用单线桥法标出电子转移的方向和数目:_______I-+_______NO+________H+===________I2+________NO↑+______H2O。
(3)打开烧杯B,A中液体上方又出现淡红棕色,该反应的化学方程式为______________。
实验Ⅱ:因为有其他同学对淀粉-KI溶液变蓝的原因提出异议,甲同学将铜片换成铁片放入烧杯A后,立即用烧杯B盖住。
(4)实验前甲同学认为换为铁片后不应出现红棕色气体,淀粉-KI溶液不会变为蓝色,其理由是________________________________________________________________________。
(5)实验开始后,发现确实无红棕色气体生成,但过一段时间后,淀粉-KI溶液仍然变为蓝色,请你帮忙分析其中的原因____________________________________________________。
16.某课外活动小组为了探究木炭与浓硝酸反应后的气态生成物,设计如下实验。
(1)甲同学设计实验如图甲。
红热木炭未进入试管前,浓硝酸上方并无明显变化。当按图甲装置进行实验后,浓硝酸液面上方有明显的红棕色气体产生,且沾有澄清石灰水的玻璃片出现浑浊,后浑浊消失。
①液面上方出现红棕色气体,说明浓硝酸具有________(填字母)。
a.酸性 b.挥发性 c.不稳定性
②沾有澄清石灰水的玻璃片出现浑浊,________(填“能”或“不能”)说明木炭与浓硝酸发生了反应,是因为_____________________________________________________________。
(2)乙同学设计实验如图乙。
按图乙装置进行实验后,浓硝酸液面上方有明显的红棕色气体产生,且沾有澄清石灰水的玻璃片无明显变化。沾有澄清石灰水的玻璃片无明显变化,________(填“能”或“不能”)说明木炭与浓硝酸未反应,是因为________________________________________________
____________________________________________________________________________。
(3)丙同学克服了甲、乙同学设计上的缺点,设计实验如图丙。已知酸性高锰酸钾溶液能将NO、NO2氧化成NO,MnO被还原为Mn2+。
①如图连接装置后,需进行的实验操作为__________________;加热木炭与浓硝酸前需先通一段时间N2,目的是________________________________。
②装置A中木炭与浓硝酸反应的化学方程式为____________________________________
____________________________________________________________________________。
③能证明木炭被氧化的实验现象为______________________________________________
____________________________________________________________________________。
④D装置中发生反应的离子方程式为____________________________________________
____________________________________________________________________________。
阶段重点突破练(三)
1.A 2.A 3.B 4.C 5.B 6.C 7.D
8.C [1 mol NH所含的质子总数为11NA,A错误;由图可知,该过程的总反应是NH+NO===N2↑+2H2O,每处理1 mol NH,需要的NO为1 mol,C正确、D错误。]
9.A [NH4HCO3分解生成NH3、CO2和H2O,将混合气体通过足量Na2O2,CO2和H2O分别和Na2O2反应生成O2,再通过碱石灰干燥,最终剩余气体为NH3和O2,故选A。]
10.C [NH4Cl是氮肥,NaHCO3不是化肥,A项错误;NH4Cl、HNO3受热易分解,而Na2CO3受热不易分解,B项错误;NO2与NH3可以发生反应:6NO2+8NH37N2+12H2O,该反应是氧化还原反应,C项正确;碳酸氢钠受热分解生成碳酸钠、CO2和H2O,该反应是非氧化还原反应,D项错误。]
11.B [A项,MnO2和浓盐酸反应,需要加热,此装置图中缺少加热装置,错误;B项,Na2SO3与70%的浓硫酸反应产生SO2,通过浓硫酸进行干燥,因为SO2的密度大于空气,因此用向上排空气法收集,SO2有毒,必须进行尾气处理,正确;C项,NH3能与浓硫酸反应,不能用浓硫酸进行干燥,因为NH3的密度小于空气,因此用向下排空气法收集,错误;D项,NO能与空气中的氧气反应,因此用排水法收集,错误。]
12.C [铁和过量的盐酸反应生成氯化亚铁,氯化亚铁具有还原性,溶液中氢离子过量,酸性条件下的硝酸根离子具有强氧化性,可将Fe2+氧化为Fe3+,故选C。]
13.B [10 mL混合酸中:n(H+)=0.01 L×2×2 mol·L-1+0.01 L×2 mol·L-1=0.06 mol,n(NO)=0.01 L×2 mol·L-1=0.02 mol。1.92 g Cu的物质的量为=0.03 mol,
3Cu + 2NO + 8H+===3Cu2++2NO↑+4H2O
3 2 8
0.03 mol 0.02 mol 0.08 mol
0.03 mol Cu完全反应消耗0.02 mol NO、0.08 mol H+,消耗H+物质的量大于0.06 mol,故
H+不足,由离子方程式可知生成NO为0.06 mol×=0.015 mol,标况下生成NO的体积为0.015 mol×22.4 L·mol-1=0.336 L。]
14.(1)①吸收多余的NH3(或防止空气对流,使NH3充满试管) ②不能 (2)①黄绿色 ②生成大量白烟,试管内黄绿色气体颜色逐渐变浅至褪去 3Cl2+2NH3===6HCl+N2、HCl+NH3===NH4Cl(或3Cl2+8NH3===6NH4Cl+N2) ③de
(3)①氨气极易溶于水,且氨水呈碱性 ②先打开a、c活塞,再挤压胶头滴管,片刻后,再打开b活塞
15.(1)Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O
(2)①3NO2+H2O===2HNO3+NO
②+8H+===3I2+2NO↑+4H2O
(3)2NO+O2===2NO2
(4)常温时铁在浓硝酸中发生钝化(或生成氧化膜,合理即可)
(5)硝酸挥发到淀粉-KI溶液中,将KI氧化为I2
解析 (1)烧杯A液体上方出现大量红棕色气体,是由于浓硝酸被铜还原生成二氧化氮:Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O。(2)①二氧化氮溶于水生成硝酸和NO,因此红棕色气体消失,该化学方程式为3NO2+H2O===2HNO3+NO。②反应中碘元素化合价从-1价升高到0价,失去1个电子,氮元素化合价从+5价降低到+2价,得到3个电子,根据得失电子守恒、原子守恒以及电荷守恒可知配平后的离子方程式为6I-+2NO+8H+===3I2+2NO↑+4H2O。(3)打开烧杯B,NO与空气中的氧气反应生成二氧化氮,故A中液体上方又出现淡红棕色。(4)由于常温时铁在浓硝酸中发生钝化,不会产生二氧化氮,因此换为铁片后不应出现红棕色气体,淀粉-KI溶液不会变为蓝色。(5)由于浓硝酸易挥发,硝酸挥发到淀粉-KI溶液中,将KI氧化为I2,因此溶液仍然变为蓝色。
16.(1)①bc ②不能 木炭与空气中的氧气反应也能生成CO2,使澄清石灰水变浑浊
(2)不能 挥发出的硝酸和生成的NO2消耗了石灰水
(3)①检查装置气密性 排尽装置中的空气
②C+4HNO3(浓)CO2↑+4NO2↑+2H2O
③C中澄清石灰水变浑浊
④5NO+3MnO+4H+===5NO+3Mn2++2H2O
解析 (1)①木炭未伸入浓硝酸中,液面上方出现红棕色气体,说明试管内含有硝酸蒸气,证明浓硝酸具有挥发性;气体可能是由硝酸分解产生的,因此可以证明浓硝酸化学性质不稳定性,故选b、c。
②木炭和空气中的O2反应也能生成CO2,因此沾有澄清石灰水的玻璃片出现浑浊,并不能证明木炭与浓硝酸发生了反应。
(2)挥发出的硝酸和反应生成的NO2都能与石灰水反应,因此沾有澄清石灰水的玻璃片无明显变化,并不能证明木炭与浓硝酸没有反应。
(3)①装置中涉及气体制备的实验,因此实验开始前要检查装置气密性;为防止空气对实验的干扰,反应前需先通一段时间N2,排尽装置中的空气。
③若澄清石灰水变浑浊,则可以证明木炭被氧化为CO2,因此能证明木炭被氧化的实验现象为C中澄清石灰水变浑浊。
④D装置中NO被氧化为NO,MnO被还原为Mn2+,发生反应的离子方程式为5NO+3MnO+4H+===5NO+3Mn2++2H2O。
一、氮及其氧化物的重要性质及相关计算
1.下列具有氮的固定作用的化学反应是( )
A.氮气与氢气在一定条件下反应生成氨气
B.一氧化氮与氧气反应生成二氧化氮
C.氨气经催化氧化生成一氧化氮
D.由氨气制碳酸氢铵和硫酸铵
2.下列关于氮及其化合物的说法正确的是( )
A.N2化学性质稳定,可用作保护气
B.NO、NO2均为大气污染气体,在大气中可稳定存在
C.NO、NO2均易溶于水
D.NO、NO2均能与水发生反应
3.(2022·江苏金湖中学高一期中)下列关于NO2的制取、净化、收集及尾气处理的装置和原理不能达到实验目的的是( )
A B C D
制取NO2 净化NO2 收集NO2 尾气处理
4.反应3NO2+H2O===2HNO3+NO中,当有6 mol e-发生转移时,被氧化的物质与被还原的物质的物质的量之比为( )
A.1∶1 B.1∶2 C.2∶1 D.3∶1
5.将a mL NO、b mL NO2和c mL O2混合于同一试管中,将试管倒置于水中,充分反应后,试管内气体全部消失,则a∶b∶c不可能是( )
A.1∶1∶1 B.2∶1∶1
C.3∶7∶4 D.1∶5∶2
二、氨及铵盐
6.(2021·全国乙卷,8)在实验室采用如图装置制备气体,合理的是( )
选项 化学试剂 制备气体
A Ca(OH)2+NH4Cl NH3
B MnO2+HCl(浓) Cl2
C MnO2+KClO3 O2
D NaCl+H2SO4(浓) HCl
7.如图所示为“双色双喷泉”实验装置,图中烧瓶内分别充满氨和氯化氢,烧杯内盛装滴有石蕊试液的蒸馏水。下列说法错误的是( )
A.在实验室中,可用浓氨水和生石灰制备氨,用浓盐酸和浓硫酸制备氯化氢
B.在实验室中制备干燥的氨和氯化氢时,可选用相同的干燥剂
C.实验中同时打开止水夹a、c、d,即可分别形成蓝色和红色喷泉
D.喷泉结束后,将烧瓶内溶液混合后呈紫色,蒸干可得氯化铵固体
8.厌氧氨化(Anammox)法是一种新型的氨氮去除技术,下列说法正确的是( )
A.1 mol NH所含的质子总数为10NA
B.1 mol NH经过过程Ⅰ、Ⅱ、Ⅲ,得到氮气的体积约为11.2 L(假设每步转化均完全)
C.该过程的总反应是NH+NO===N2↑+2H2O
D.该方法每处理1 mol NH需要的NO为0.5 mol
9.将NH4HCO3置于干燥的试管中加热,并使放出的气体依次通过盛有足量过氧化钠和碱石灰的干燥管,最后得到的气体有( )
A.NH3,O2 B.H2O,O2
C.CO2,O2 D.O2
10.NH3是一种重要的化工原料,可以制备一系列物质(如图所示)。下列说法正确的是( )
A.NH4Cl和NaHCO3都是常用的化肥
B.NH4Cl、HNO3和Na2CO3受热时都易分解
C.NH3和NO2在一定条件下可发生氧化还原反应
D.图中所涉及的反应均为氧化还原反应
三、硝酸的性质和计算
11.实验室可以用如图所示装置制备、干燥、收集气体的是( )
A.以MnO2、浓盐酸为原料,制备Cl2
B.以Na2SO3固体、质量分数为70%的浓硫酸为原料,制备SO2
C.以浓氨水、生石灰为原料,制备NH3
D.以Cu、稀硝酸为原料,制备NO
12.(2022·上海曹杨二中高二期末)将铁屑溶于过量盐酸后,再加入下列物质,会有三价铁生成的是( )
A.硫酸 B.碘水
C.硝酸锌 D.氯化铜
13.现有稀硫酸和稀硝酸的混合溶液,已知其中稀硫酸和稀硝酸的浓度均为2 mol·L-1。取10 mL混合酸,向其中加入1.92 g铜粉,反应结束后,在标准状况下可收集到气体体积为(假设HNO3只被还原为NO)( )
A.0.224 L B.0.336 L
C.0.448 L D.0.672 L
四、氮及其化合物的综合实验
14.(2022·河南高一检测)某化学兴趣小组欲制备氨气并探究其相关性质。请回答下列问题:
(1)如图是制取少量氨气的实验装置:
①在制取氨气的实验装置中,使用湿润棉花(棉花团外侧滴有少量蒸馏水)的作用是______(填一条)。
②干燥管中的碱石灰________(填“能”或“不能”)用无水CaCl2、P2O5代替。
(2)如图为探究氨气的还原性实验装置:
①开始时试管中气体的颜色为________。
②打开K1,室温下将过量的氨气推入试管中,可能出现的现象为____________________,
反应的化学方程式为___________________________________________________________。
③检验试管中固体是否含有氮元素一定用不到的试纸或试剂是________(填字母)。
a.蒸馏水 b.NaOH溶液
c.红色石蕊试纸 d.蓝色石蕊试纸
e.稀硫酸
(3)如图为探究NH3和HCl的有关性质的实验装置:
①得到蓝色喷泉的原因是_____________________________________________________。
②该装置中产生“红蓝双色喷泉”现象的操作方法是_____________________________。
15.甲同学利用如图所示装置进行硝酸、氮氧化物的相关实验:
实验Ⅰ:将铜片放入烧杯A后,立即用烧杯B盖住
(1)烧杯A液体上方出现大量红棕色气体,该反应的化学方程式为___________________。
(2)一段时间后,红棕色气体消失,烧杯C中的液体变成蓝色,甲同学分析出现蓝色的原因,认为其中涉及到两个反应:
①红棕色气体消失,该化学方程式为____________________________________________。
②配平溶液出现蓝色的离子方程式,并用单线桥法标出电子转移的方向和数目:_______I-+_______NO+________H+===________I2+________NO↑+______H2O。
(3)打开烧杯B,A中液体上方又出现淡红棕色,该反应的化学方程式为______________。
实验Ⅱ:因为有其他同学对淀粉-KI溶液变蓝的原因提出异议,甲同学将铜片换成铁片放入烧杯A后,立即用烧杯B盖住。
(4)实验前甲同学认为换为铁片后不应出现红棕色气体,淀粉-KI溶液不会变为蓝色,其理由是________________________________________________________________________。
(5)实验开始后,发现确实无红棕色气体生成,但过一段时间后,淀粉-KI溶液仍然变为蓝色,请你帮忙分析其中的原因____________________________________________________。
16.某课外活动小组为了探究木炭与浓硝酸反应后的气态生成物,设计如下实验。
(1)甲同学设计实验如图甲。
红热木炭未进入试管前,浓硝酸上方并无明显变化。当按图甲装置进行实验后,浓硝酸液面上方有明显的红棕色气体产生,且沾有澄清石灰水的玻璃片出现浑浊,后浑浊消失。
①液面上方出现红棕色气体,说明浓硝酸具有________(填字母)。
a.酸性 b.挥发性 c.不稳定性
②沾有澄清石灰水的玻璃片出现浑浊,________(填“能”或“不能”)说明木炭与浓硝酸发生了反应,是因为_____________________________________________________________。
(2)乙同学设计实验如图乙。
按图乙装置进行实验后,浓硝酸液面上方有明显的红棕色气体产生,且沾有澄清石灰水的玻璃片无明显变化。沾有澄清石灰水的玻璃片无明显变化,________(填“能”或“不能”)说明木炭与浓硝酸未反应,是因为________________________________________________
____________________________________________________________________________。
(3)丙同学克服了甲、乙同学设计上的缺点,设计实验如图丙。已知酸性高锰酸钾溶液能将NO、NO2氧化成NO,MnO被还原为Mn2+。
①如图连接装置后,需进行的实验操作为__________________;加热木炭与浓硝酸前需先通一段时间N2,目的是________________________________。
②装置A中木炭与浓硝酸反应的化学方程式为____________________________________
____________________________________________________________________________。
③能证明木炭被氧化的实验现象为______________________________________________
____________________________________________________________________________。
④D装置中发生反应的离子方程式为____________________________________________
____________________________________________________________________________。
阶段重点突破练(三)
1.A 2.A 3.B 4.C 5.B 6.C 7.D
8.C [1 mol NH所含的质子总数为11NA,A错误;由图可知,该过程的总反应是NH+NO===N2↑+2H2O,每处理1 mol NH,需要的NO为1 mol,C正确、D错误。]
9.A [NH4HCO3分解生成NH3、CO2和H2O,将混合气体通过足量Na2O2,CO2和H2O分别和Na2O2反应生成O2,再通过碱石灰干燥,最终剩余气体为NH3和O2,故选A。]
10.C [NH4Cl是氮肥,NaHCO3不是化肥,A项错误;NH4Cl、HNO3受热易分解,而Na2CO3受热不易分解,B项错误;NO2与NH3可以发生反应:6NO2+8NH37N2+12H2O,该反应是氧化还原反应,C项正确;碳酸氢钠受热分解生成碳酸钠、CO2和H2O,该反应是非氧化还原反应,D项错误。]
11.B [A项,MnO2和浓盐酸反应,需要加热,此装置图中缺少加热装置,错误;B项,Na2SO3与70%的浓硫酸反应产生SO2,通过浓硫酸进行干燥,因为SO2的密度大于空气,因此用向上排空气法收集,SO2有毒,必须进行尾气处理,正确;C项,NH3能与浓硫酸反应,不能用浓硫酸进行干燥,因为NH3的密度小于空气,因此用向下排空气法收集,错误;D项,NO能与空气中的氧气反应,因此用排水法收集,错误。]
12.C [铁和过量的盐酸反应生成氯化亚铁,氯化亚铁具有还原性,溶液中氢离子过量,酸性条件下的硝酸根离子具有强氧化性,可将Fe2+氧化为Fe3+,故选C。]
13.B [10 mL混合酸中:n(H+)=0.01 L×2×2 mol·L-1+0.01 L×2 mol·L-1=0.06 mol,n(NO)=0.01 L×2 mol·L-1=0.02 mol。1.92 g Cu的物质的量为=0.03 mol,
3Cu + 2NO + 8H+===3Cu2++2NO↑+4H2O
3 2 8
0.03 mol 0.02 mol 0.08 mol
0.03 mol Cu完全反应消耗0.02 mol NO、0.08 mol H+,消耗H+物质的量大于0.06 mol,故
H+不足,由离子方程式可知生成NO为0.06 mol×=0.015 mol,标况下生成NO的体积为0.015 mol×22.4 L·mol-1=0.336 L。]
14.(1)①吸收多余的NH3(或防止空气对流,使NH3充满试管) ②不能 (2)①黄绿色 ②生成大量白烟,试管内黄绿色气体颜色逐渐变浅至褪去 3Cl2+2NH3===6HCl+N2、HCl+NH3===NH4Cl(或3Cl2+8NH3===6NH4Cl+N2) ③de
(3)①氨气极易溶于水,且氨水呈碱性 ②先打开a、c活塞,再挤压胶头滴管,片刻后,再打开b活塞
15.(1)Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O
(2)①3NO2+H2O===2HNO3+NO
②+8H+===3I2+2NO↑+4H2O
(3)2NO+O2===2NO2
(4)常温时铁在浓硝酸中发生钝化(或生成氧化膜,合理即可)
(5)硝酸挥发到淀粉-KI溶液中,将KI氧化为I2
解析 (1)烧杯A液体上方出现大量红棕色气体,是由于浓硝酸被铜还原生成二氧化氮:Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O。(2)①二氧化氮溶于水生成硝酸和NO,因此红棕色气体消失,该化学方程式为3NO2+H2O===2HNO3+NO。②反应中碘元素化合价从-1价升高到0价,失去1个电子,氮元素化合价从+5价降低到+2价,得到3个电子,根据得失电子守恒、原子守恒以及电荷守恒可知配平后的离子方程式为6I-+2NO+8H+===3I2+2NO↑+4H2O。(3)打开烧杯B,NO与空气中的氧气反应生成二氧化氮,故A中液体上方又出现淡红棕色。(4)由于常温时铁在浓硝酸中发生钝化,不会产生二氧化氮,因此换为铁片后不应出现红棕色气体,淀粉-KI溶液不会变为蓝色。(5)由于浓硝酸易挥发,硝酸挥发到淀粉-KI溶液中,将KI氧化为I2,因此溶液仍然变为蓝色。
16.(1)①bc ②不能 木炭与空气中的氧气反应也能生成CO2,使澄清石灰水变浑浊
(2)不能 挥发出的硝酸和生成的NO2消耗了石灰水
(3)①检查装置气密性 排尽装置中的空气
②C+4HNO3(浓)CO2↑+4NO2↑+2H2O
③C中澄清石灰水变浑浊
④5NO+3MnO+4H+===5NO+3Mn2++2H2O
解析 (1)①木炭未伸入浓硝酸中,液面上方出现红棕色气体,说明试管内含有硝酸蒸气,证明浓硝酸具有挥发性;气体可能是由硝酸分解产生的,因此可以证明浓硝酸化学性质不稳定性,故选b、c。
②木炭和空气中的O2反应也能生成CO2,因此沾有澄清石灰水的玻璃片出现浑浊,并不能证明木炭与浓硝酸发生了反应。
(2)挥发出的硝酸和反应生成的NO2都能与石灰水反应,因此沾有澄清石灰水的玻璃片无明显变化,并不能证明木炭与浓硝酸没有反应。
(3)①装置中涉及气体制备的实验,因此实验开始前要检查装置气密性;为防止空气对实验的干扰,反应前需先通一段时间N2,排尽装置中的空气。
③若澄清石灰水变浑浊,则可以证明木炭被氧化为CO2,因此能证明木炭被氧化的实验现象为C中澄清石灰水变浑浊。
④D装置中NO被氧化为NO,MnO被还原为Mn2+,发生反应的离子方程式为5NO+3MnO+4H+===5NO+3Mn2++2H2O。
