专题7 第二单元 第1课时 氨气 课后巩固练习(含答案)
文档属性
| 名称 | 专题7 第二单元 第1课时 氨气 课后巩固练习(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 384.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-08 16:50:17 | ||
图片预览


文档简介
第二单元 重要的含氮化工原料
第1课时 氨气
题组一 氨及氨水的性质
1.我国清代《本草纲目拾遗》中记载药物“鼻冲水”,写道:“贮以玻璃瓶,紧塞其口,勿使泄气,则药力不减,气甚辛烈,触人脑,非有病不可嗅……虚弱者忌之。宜外用,勿服……”。这里的“鼻冲水”是指( )
A.氨水 B.氯水 C.醋 D.卤水
2.下列关于氨气的说法不正确的是(已知NH3难溶于CCl4)( )
A.氨气易液化,液氨汽化时吸热,可用作制冷剂
B.氨气可以用浓硫酸干燥
C.用水吸收氨气可用图1的装置防止倒吸
D.氨气的密度比空气的密度小,可用图2收集NH3
3.如图,利用培养皿探究氨的性质。实验时向NaOH固体上滴几滴浓氨水,立即用另一个表面皿扣在上面,如表中对实验现象所做的解释正确的是( )
选项 实验现象 解释
A 浓盐酸附近产生白烟 NH3与浓盐酸挥发的HCl气体反应生成了NH4Cl固体
B 浓硫酸附近无明显现象 NH3与浓硫酸不发生反应
C 氯化物溶液变浑浊 该溶液一定是AlCl3溶液
D 干燥的红色石蕊试纸不变色,湿润的红色石蕊试纸变蓝 NH3是一种可溶性碱
题组二 喷泉实验
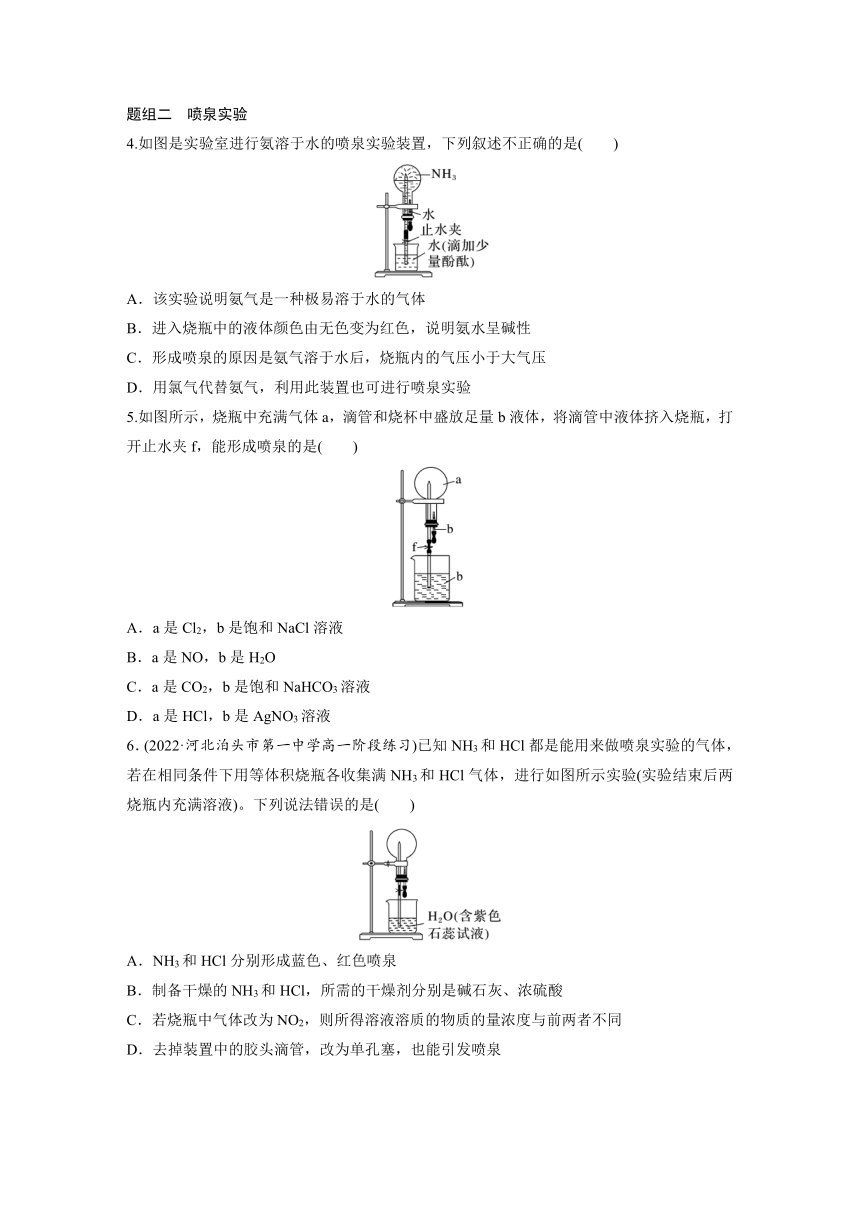
4.如图是实验室进行氨溶于水的喷泉实验装置,下列叙述不正确的是( )
A.该实验说明氨气是一种极易溶于水的气体
B.进入烧瓶中的液体颜色由无色变为红色,说明氨水呈碱性
C.形成喷泉的原因是氨气溶于水后,烧瓶内的气压小于大气压
D.用氯气代替氨气,利用此装置也可进行喷泉实验
5.如图所示,烧瓶中充满气体a,滴管和烧杯中盛放足量b液体,将滴管中液体挤入烧瓶,打开止水夹f,能形成喷泉的是( )
A.a是Cl2,b是饱和NaCl溶液
B.a是NO,b是H2O
C.a是CO2,b是饱和NaHCO3溶液
D.a是HCl,b是AgNO3溶液
6.(2022·河北泊头市第一中学高一阶段练习)已知NH3和HCl都是能用来做喷泉实验的气体,若在相同条件下用等体积烧瓶各收集满NH3和HCl气体,进行如图所示实验(实验结束后两烧瓶内充满溶液)。下列说法错误的是( )
A.NH3和HCl分别形成蓝色、红色喷泉
B.制备干燥的NH3和HCl,所需的干燥剂分别是碱石灰、浓硫酸
C.若烧瓶中气体改为NO2,则所得溶液溶质的物质的量浓度与前两者不同
D.去掉装置中的胶头滴管,改为单孔塞,也能引发喷泉
题组三 氨的催化氧化
7.下列有关氨的叙述不正确的是( )
A.氨分子中氮元素的化合价只能升高,氨具有还原性
B.氨的催化氧化反应的化学方程式是4NH3+5O24NO+6H2O
C.氨的催化氧化反应中若氧气过量则有红棕色气体生成
D.氨的催化氧化属于人工固氮
8.氨能被氧气氧化,经一系列反应得到硝酸。分析如图实验所得结论错误的是( )
A.浓氨水具有挥发性
B.浓氨水中含有NH3·H2O
C.若Pt丝始终保持红热,则该反应放热,催化剂是Pt
D.锥形瓶口有少量红棕色气体出现,图中反应为4NH3+7O2===4NO2+6H2O
9.(2022·上海市吴淞中学高一期中)已知三角锥形分子E和直线形分子G反应,生成两种直线形分子L和M(组成E、G、L、M分子的元素原子序数均小于10)如图,则下列判断错误的是( )
A.G是最活泼的非金属单质
B.L是分子晶体
C.E能使紫色石蕊试液变蓝色
D.M的化学性质活泼
10.实验小组同学探究NH3与Cl2的反应,装置如图所示。常温常压下,将氨收集在薄膜保鲜袋(无弹性)中,氯气收集在反应管中,关闭K,按图连接好装置;将氨压入反应管,充分反应后打开K,下列说法错误的是( )
A.反应开始后,保鲜袋逐渐被吸入反应管
B.反应过程中,反应管中产生白烟
C.打开K后,水会倒吸入反应管
D.上述反应原理可用于检验输送氯气的管道是否泄漏
11.某同学仿照“喷泉”实验的原理,在实验室中做了一个“喷烟”实验,如图所示。他在甲、乙两个烧瓶中分别充入X、Y两种无色气体,胶头滴管中盛有含酚酞的NaOH溶液,实验时将胶头滴管内的液体挤入甲烧瓶内,然后打开止水夹,便可看到甲烧瓶中的导管口喷出白色的烟,同时甲烧瓶中的溶液颜色逐渐变浅。若已知X、Y是HCl、NH3、Cl2、O2、CO2、H2、NO七种气体中的两种,则下列判断中,正确的是( )
A.X是NH3,Y是HCl B.X是Cl2,Y是H2
C.X是CO2,Y是O2 D.X是NO,Y是O2
12.在研究合成氨方法的历史上,不同的研究者曾3次获得诺贝尔化学奖。氨是氮肥工业及制取硝酸、炸药等的原料。下列说法正确的是( )
A.N2和H2在点燃或光照条件下可合成NH3
B.NH3和HNO3溶于水后都能导电,故二者都是电解质
C.NH3遇到浓硝酸会发生反应产生大量白烟
D.由NH3制HNO3的过程中,氮元素被还原
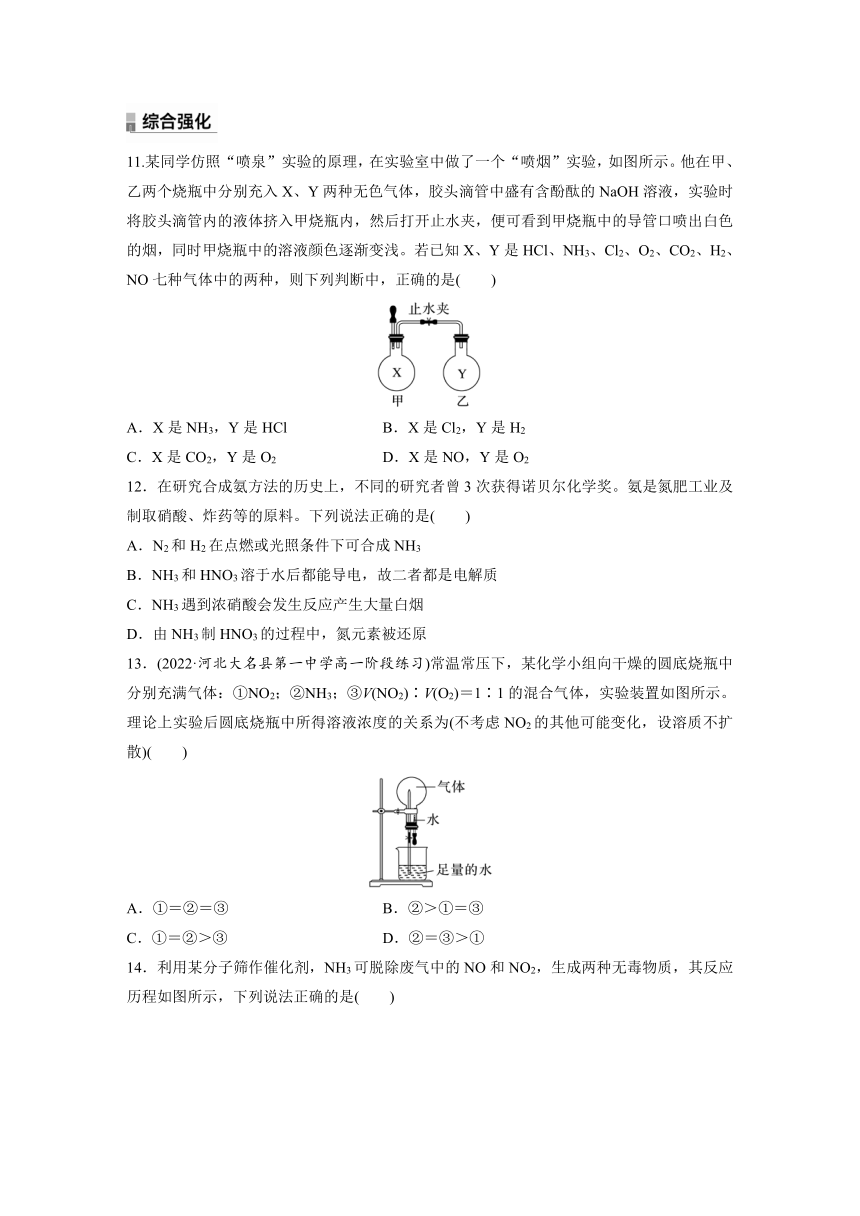
13.(2022·河北大名县第一中学高一阶段练习)常温常压下,某化学小组向干燥的圆底烧瓶中分别充满气体:①NO2;②NH3;③V(NO2)∶V(O2)=1∶1的混合气体,实验装置如图所示。理论上实验后圆底烧瓶中所得溶液浓度的关系为(不考虑NO2的其他可能变化,设溶质不扩散)( )
A.①=②=③ B.②>①=③
C.①=②>③ D.②=③>①
14.利用某分子筛作催化剂,NH3可脱除废气中的NO和NO2,生成两种无毒物质,其反应历程如图所示,下列说法正确的是( )
A.反应过程中NO2、NH之间的反应是氧化还原反应
B.上述历程的总反应为2NH3+NO+NO22N2+3H2O
C.X是HNO2,是还原产物
D.[(NH4)(HNO2)]+是反应过程中的催化剂
15.某化学兴趣小组利用下列图示装置探究氨气的性质。
(1)①中湿润的红色石蕊试纸变蓝;说明氨气水溶液呈________性,化学方程式为________________________________。
(2)向②中滴入浓盐酸,现象为________________________,反应的化学方程式:______________________________。
(3)将灼热的铂丝伸入③中锥形瓶,可观察到铂丝保持红热,有红棕色气体及少量白烟生成。该过程会同时发生多个反应,写出NH3和O2催化氧化反应的化学方程式:___________
____________________________________________________________________________,
该反应为________(填“吸热”或“放热”)反应,锥形瓶中出现白烟,该物质的化学式为____________,瓶中红棕色气体为________(填化学式)。
16.已知A、B、C为化合物,X为单质。其中,A是一种能使湿润的红色石蕊试纸变蓝的气体;X为双原子分子,其原子的最外层电子数为内层的3倍。A、B、C、X之间存在如下转化关系:
请回答:
(1)X的化学式为__________________。
(2)B转化为C的化学方程式为_________________________________________________。
C是一种____________色气体。
(3)工业上以NH3、空气、水为原料生产硝酸:
①NH3→NO反应的化学方程式为______________________________________________;
②NO→NO2反应的实验现象是________________________________________________。
(4)若要实现NH3→N2,从原理上看,下列试剂可行的是________(填字母)。
A.O2 B.Na C.NH4Cl D.NO2
第二单元 重要的含氮化工原料
第1课时 氨气
1.A 2.B 3.A 4.D 5.D
6.C [氨气和氯化氢都是极易溶于水的气体,氨气溶于水显碱性,遇到紫色石蕊试液变蓝色,氯化氢溶于水显酸性遇到紫色石蕊试液变红色,NH3和HCl分别形成蓝色、红色喷泉,A正确;氨气是碱性气体,氯化氢是酸性气体,制备干燥的NH3和HCl,所需的干燥剂分别是碱石灰、浓硫酸,B正确;设二氧化氮体积为V1 L,根据反应的化学方程式:3NO2+H2O===2HNO3+NO,可知反应产生硝酸物质的量n(HNO3)=n(NO2)=× mol,溶液的体积为HNO3的体积,所以HNO3的物质的量浓度c(HNO3)=== mol·L-1,设氨气或氯化氢体积为V1 L,氨气和氯化氢气体形成喷泉实验形成的溶液浓度== mol·L-1,若改为NO2气体,所得溶液溶质的物质的量浓度与前两者相同,C错误;去掉装置中的胶头滴管,改为单孔塞,用双手捂住烧瓶,待导气管气泡冒出后,冷却烧瓶也会引发喷泉,D正确。]
7.D [氨分子中氮元素的化合价为最低价,只能升高不能降低,氨具有还原性;氨的催化氧化产生的一氧化氮与过量的氧气反应生成红棕色的二氧化氮气体;氨的催化氧化不属于氮的固定。]
8.D [浓氨水易挥发出氨气,在红热的铂丝表面反应,故A正确;浓氨水的主要成分为NH3·H2O,故B正确;若Pt丝始终保持红热,则证明该反应为放热反应,催化剂是Pt,故C正确;锥形瓶口有少量红棕色气体出现,证明氨气催化氧化生成一氧化氮,反应的化学方程式:4NH3+5O24NO+6H2O,故D错误。]
9.D [G(F2)是最活泼的非金属单质,故A正确;L(HF)只含有共价键,是共价化合物,属于分子晶体,故B正确;氨气是碱性气体,因此E能使紫色石蕊试液变蓝色,故C正确;氮气含有氮氮三键,键能大,性质稳定,因此M的化学性质不活泼,故D错误。]
10.C [反应过程中,反应管中生成NH4Cl固体,悬浮于气体中,从而产生白烟,故B正确;利用上述反应原理,可将蘸有浓氨水的玻璃棒靠近输送氯气的管道,根据有无白烟产生,判断管道是否泄漏,故D正确。]
11.A [X必须是一种易溶于NaOH溶液的气体,或能与NaOH溶液反应的气体,才能使甲烧瓶内气压减小,导致乙中的气体进入甲,可排除D项;乙中的气体进入甲后反应产生白烟,因Cl2与H2在光照条件下能反应但无白烟产生,CO2与O2不反应,可排除B项、C项。]
12.C [N2和H2合成氨的条件是高温、高压、催化剂,在点燃或光照条件下,N2和H2不发生反应,故A项错误;氨水能导电是因为NH3溶于水生成一水合氨,一水合氨电离出自由移动的离子,NH3自身不能电离,因此NH3不是电解质,HNO3属于电解质,故B项错误;浓硝酸易挥发,NH3与挥发出的硝酸反应生成NH4NO3固体,现象为产生大量的白烟,故C项正确;用氨制备硝酸的过程中,发生反应的化学方程式依次为4NH3+5O24NO+6H2O、2NO+O2===2NO2、4NO2+O2+2H2O===4HNO3,N元素的化合价由-3价升高至+5价,被氧化,故D项错误。]
13.C [设圆底烧瓶的体积为V,常温常压下的气体摩尔体积为Vm′,①中所得溶液的体积为V,溶液中溶质的物质的量为,其浓度为=;②气体溶解,液体充满圆底烧瓶,所得溶液中溶质的浓度为=;③得到的溶液的体积为+×=V,溶液中溶质的物质的量为=,其浓度为=,故①=②>③,故选C。]
14.B [反应过程中NO2、NH之间反应生成[(NH4)2(NO2)]2+,没有化合价的变化,不是氧化还原反应,故A错误;由反应历程图可知,氨、二氧化氮和一氧化氮是反应物,氮气与水是生成物,所以总反应为2NH3+NO+NO22N2+3H2O,故B正确;图示反应可以生成X的反应为[(NH4)2(NO2)]2++NO===[(NH4)(HNO2)]++X+H+,根据原子守恒判断X为N2和H2O,故C错误;[(NH4)(HNO2)]+反应前没有,反应后没有,为反应的中间产物,不是反应过程中的催化剂,故D错误。]
15.(1)碱 NH3+H2O??NH3·H2O??NH+OH-
(2)产生白烟 NH3+HCl===NH4Cl
(3)4NH3+5O24NO+6H2O 放热 NH4NO3 NO2
解析 (3)NH3和O2反应能使铂丝保持红热,说明反应为放热反应,生成的NO和O2反应再生成NO2,NO2又和H2O反应生成HNO3,HNO3遇到NH3反应生成NH4NO3小颗粒,故白烟成分为NH4NO3,红棕色气体为NO2。
16.(1)O2 (2)2NO+O2===2NO2 红棕
(3)①4NH3+5O24NO+6H2O ②气体由无色变成红棕色 (4)AD
第1课时 氨气
题组一 氨及氨水的性质
1.我国清代《本草纲目拾遗》中记载药物“鼻冲水”,写道:“贮以玻璃瓶,紧塞其口,勿使泄气,则药力不减,气甚辛烈,触人脑,非有病不可嗅……虚弱者忌之。宜外用,勿服……”。这里的“鼻冲水”是指( )
A.氨水 B.氯水 C.醋 D.卤水
2.下列关于氨气的说法不正确的是(已知NH3难溶于CCl4)( )
A.氨气易液化,液氨汽化时吸热,可用作制冷剂
B.氨气可以用浓硫酸干燥
C.用水吸收氨气可用图1的装置防止倒吸
D.氨气的密度比空气的密度小,可用图2收集NH3
3.如图,利用培养皿探究氨的性质。实验时向NaOH固体上滴几滴浓氨水,立即用另一个表面皿扣在上面,如表中对实验现象所做的解释正确的是( )
选项 实验现象 解释
A 浓盐酸附近产生白烟 NH3与浓盐酸挥发的HCl气体反应生成了NH4Cl固体
B 浓硫酸附近无明显现象 NH3与浓硫酸不发生反应
C 氯化物溶液变浑浊 该溶液一定是AlCl3溶液
D 干燥的红色石蕊试纸不变色,湿润的红色石蕊试纸变蓝 NH3是一种可溶性碱
题组二 喷泉实验
4.如图是实验室进行氨溶于水的喷泉实验装置,下列叙述不正确的是( )
A.该实验说明氨气是一种极易溶于水的气体
B.进入烧瓶中的液体颜色由无色变为红色,说明氨水呈碱性
C.形成喷泉的原因是氨气溶于水后,烧瓶内的气压小于大气压
D.用氯气代替氨气,利用此装置也可进行喷泉实验
5.如图所示,烧瓶中充满气体a,滴管和烧杯中盛放足量b液体,将滴管中液体挤入烧瓶,打开止水夹f,能形成喷泉的是( )
A.a是Cl2,b是饱和NaCl溶液
B.a是NO,b是H2O
C.a是CO2,b是饱和NaHCO3溶液
D.a是HCl,b是AgNO3溶液
6.(2022·河北泊头市第一中学高一阶段练习)已知NH3和HCl都是能用来做喷泉实验的气体,若在相同条件下用等体积烧瓶各收集满NH3和HCl气体,进行如图所示实验(实验结束后两烧瓶内充满溶液)。下列说法错误的是( )
A.NH3和HCl分别形成蓝色、红色喷泉
B.制备干燥的NH3和HCl,所需的干燥剂分别是碱石灰、浓硫酸
C.若烧瓶中气体改为NO2,则所得溶液溶质的物质的量浓度与前两者不同
D.去掉装置中的胶头滴管,改为单孔塞,也能引发喷泉
题组三 氨的催化氧化
7.下列有关氨的叙述不正确的是( )
A.氨分子中氮元素的化合价只能升高,氨具有还原性
B.氨的催化氧化反应的化学方程式是4NH3+5O24NO+6H2O
C.氨的催化氧化反应中若氧气过量则有红棕色气体生成
D.氨的催化氧化属于人工固氮
8.氨能被氧气氧化,经一系列反应得到硝酸。分析如图实验所得结论错误的是( )
A.浓氨水具有挥发性
B.浓氨水中含有NH3·H2O
C.若Pt丝始终保持红热,则该反应放热,催化剂是Pt
D.锥形瓶口有少量红棕色气体出现,图中反应为4NH3+7O2===4NO2+6H2O
9.(2022·上海市吴淞中学高一期中)已知三角锥形分子E和直线形分子G反应,生成两种直线形分子L和M(组成E、G、L、M分子的元素原子序数均小于10)如图,则下列判断错误的是( )
A.G是最活泼的非金属单质
B.L是分子晶体
C.E能使紫色石蕊试液变蓝色
D.M的化学性质活泼
10.实验小组同学探究NH3与Cl2的反应,装置如图所示。常温常压下,将氨收集在薄膜保鲜袋(无弹性)中,氯气收集在反应管中,关闭K,按图连接好装置;将氨压入反应管,充分反应后打开K,下列说法错误的是( )
A.反应开始后,保鲜袋逐渐被吸入反应管
B.反应过程中,反应管中产生白烟
C.打开K后,水会倒吸入反应管
D.上述反应原理可用于检验输送氯气的管道是否泄漏
11.某同学仿照“喷泉”实验的原理,在实验室中做了一个“喷烟”实验,如图所示。他在甲、乙两个烧瓶中分别充入X、Y两种无色气体,胶头滴管中盛有含酚酞的NaOH溶液,实验时将胶头滴管内的液体挤入甲烧瓶内,然后打开止水夹,便可看到甲烧瓶中的导管口喷出白色的烟,同时甲烧瓶中的溶液颜色逐渐变浅。若已知X、Y是HCl、NH3、Cl2、O2、CO2、H2、NO七种气体中的两种,则下列判断中,正确的是( )
A.X是NH3,Y是HCl B.X是Cl2,Y是H2
C.X是CO2,Y是O2 D.X是NO,Y是O2
12.在研究合成氨方法的历史上,不同的研究者曾3次获得诺贝尔化学奖。氨是氮肥工业及制取硝酸、炸药等的原料。下列说法正确的是( )
A.N2和H2在点燃或光照条件下可合成NH3
B.NH3和HNO3溶于水后都能导电,故二者都是电解质
C.NH3遇到浓硝酸会发生反应产生大量白烟
D.由NH3制HNO3的过程中,氮元素被还原
13.(2022·河北大名县第一中学高一阶段练习)常温常压下,某化学小组向干燥的圆底烧瓶中分别充满气体:①NO2;②NH3;③V(NO2)∶V(O2)=1∶1的混合气体,实验装置如图所示。理论上实验后圆底烧瓶中所得溶液浓度的关系为(不考虑NO2的其他可能变化,设溶质不扩散)( )
A.①=②=③ B.②>①=③
C.①=②>③ D.②=③>①
14.利用某分子筛作催化剂,NH3可脱除废气中的NO和NO2,生成两种无毒物质,其反应历程如图所示,下列说法正确的是( )
A.反应过程中NO2、NH之间的反应是氧化还原反应
B.上述历程的总反应为2NH3+NO+NO22N2+3H2O
C.X是HNO2,是还原产物
D.[(NH4)(HNO2)]+是反应过程中的催化剂
15.某化学兴趣小组利用下列图示装置探究氨气的性质。
(1)①中湿润的红色石蕊试纸变蓝;说明氨气水溶液呈________性,化学方程式为________________________________。
(2)向②中滴入浓盐酸,现象为________________________,反应的化学方程式:______________________________。
(3)将灼热的铂丝伸入③中锥形瓶,可观察到铂丝保持红热,有红棕色气体及少量白烟生成。该过程会同时发生多个反应,写出NH3和O2催化氧化反应的化学方程式:___________
____________________________________________________________________________,
该反应为________(填“吸热”或“放热”)反应,锥形瓶中出现白烟,该物质的化学式为____________,瓶中红棕色气体为________(填化学式)。
16.已知A、B、C为化合物,X为单质。其中,A是一种能使湿润的红色石蕊试纸变蓝的气体;X为双原子分子,其原子的最外层电子数为内层的3倍。A、B、C、X之间存在如下转化关系:
请回答:
(1)X的化学式为__________________。
(2)B转化为C的化学方程式为_________________________________________________。
C是一种____________色气体。
(3)工业上以NH3、空气、水为原料生产硝酸:
①NH3→NO反应的化学方程式为______________________________________________;
②NO→NO2反应的实验现象是________________________________________________。
(4)若要实现NH3→N2,从原理上看,下列试剂可行的是________(填字母)。
A.O2 B.Na C.NH4Cl D.NO2
第二单元 重要的含氮化工原料
第1课时 氨气
1.A 2.B 3.A 4.D 5.D
6.C [氨气和氯化氢都是极易溶于水的气体,氨气溶于水显碱性,遇到紫色石蕊试液变蓝色,氯化氢溶于水显酸性遇到紫色石蕊试液变红色,NH3和HCl分别形成蓝色、红色喷泉,A正确;氨气是碱性气体,氯化氢是酸性气体,制备干燥的NH3和HCl,所需的干燥剂分别是碱石灰、浓硫酸,B正确;设二氧化氮体积为V1 L,根据反应的化学方程式:3NO2+H2O===2HNO3+NO,可知反应产生硝酸物质的量n(HNO3)=n(NO2)=× mol,溶液的体积为HNO3的体积,所以HNO3的物质的量浓度c(HNO3)=== mol·L-1,设氨气或氯化氢体积为V1 L,氨气和氯化氢气体形成喷泉实验形成的溶液浓度== mol·L-1,若改为NO2气体,所得溶液溶质的物质的量浓度与前两者相同,C错误;去掉装置中的胶头滴管,改为单孔塞,用双手捂住烧瓶,待导气管气泡冒出后,冷却烧瓶也会引发喷泉,D正确。]
7.D [氨分子中氮元素的化合价为最低价,只能升高不能降低,氨具有还原性;氨的催化氧化产生的一氧化氮与过量的氧气反应生成红棕色的二氧化氮气体;氨的催化氧化不属于氮的固定。]
8.D [浓氨水易挥发出氨气,在红热的铂丝表面反应,故A正确;浓氨水的主要成分为NH3·H2O,故B正确;若Pt丝始终保持红热,则证明该反应为放热反应,催化剂是Pt,故C正确;锥形瓶口有少量红棕色气体出现,证明氨气催化氧化生成一氧化氮,反应的化学方程式:4NH3+5O24NO+6H2O,故D错误。]
9.D [G(F2)是最活泼的非金属单质,故A正确;L(HF)只含有共价键,是共价化合物,属于分子晶体,故B正确;氨气是碱性气体,因此E能使紫色石蕊试液变蓝色,故C正确;氮气含有氮氮三键,键能大,性质稳定,因此M的化学性质不活泼,故D错误。]
10.C [反应过程中,反应管中生成NH4Cl固体,悬浮于气体中,从而产生白烟,故B正确;利用上述反应原理,可将蘸有浓氨水的玻璃棒靠近输送氯气的管道,根据有无白烟产生,判断管道是否泄漏,故D正确。]
11.A [X必须是一种易溶于NaOH溶液的气体,或能与NaOH溶液反应的气体,才能使甲烧瓶内气压减小,导致乙中的气体进入甲,可排除D项;乙中的气体进入甲后反应产生白烟,因Cl2与H2在光照条件下能反应但无白烟产生,CO2与O2不反应,可排除B项、C项。]
12.C [N2和H2合成氨的条件是高温、高压、催化剂,在点燃或光照条件下,N2和H2不发生反应,故A项错误;氨水能导电是因为NH3溶于水生成一水合氨,一水合氨电离出自由移动的离子,NH3自身不能电离,因此NH3不是电解质,HNO3属于电解质,故B项错误;浓硝酸易挥发,NH3与挥发出的硝酸反应生成NH4NO3固体,现象为产生大量的白烟,故C项正确;用氨制备硝酸的过程中,发生反应的化学方程式依次为4NH3+5O24NO+6H2O、2NO+O2===2NO2、4NO2+O2+2H2O===4HNO3,N元素的化合价由-3价升高至+5价,被氧化,故D项错误。]
13.C [设圆底烧瓶的体积为V,常温常压下的气体摩尔体积为Vm′,①中所得溶液的体积为V,溶液中溶质的物质的量为,其浓度为=;②气体溶解,液体充满圆底烧瓶,所得溶液中溶质的浓度为=;③得到的溶液的体积为+×=V,溶液中溶质的物质的量为=,其浓度为=,故①=②>③,故选C。]
14.B [反应过程中NO2、NH之间反应生成[(NH4)2(NO2)]2+,没有化合价的变化,不是氧化还原反应,故A错误;由反应历程图可知,氨、二氧化氮和一氧化氮是反应物,氮气与水是生成物,所以总反应为2NH3+NO+NO22N2+3H2O,故B正确;图示反应可以生成X的反应为[(NH4)2(NO2)]2++NO===[(NH4)(HNO2)]++X+H+,根据原子守恒判断X为N2和H2O,故C错误;[(NH4)(HNO2)]+反应前没有,反应后没有,为反应的中间产物,不是反应过程中的催化剂,故D错误。]
15.(1)碱 NH3+H2O??NH3·H2O??NH+OH-
(2)产生白烟 NH3+HCl===NH4Cl
(3)4NH3+5O24NO+6H2O 放热 NH4NO3 NO2
解析 (3)NH3和O2反应能使铂丝保持红热,说明反应为放热反应,生成的NO和O2反应再生成NO2,NO2又和H2O反应生成HNO3,HNO3遇到NH3反应生成NH4NO3小颗粒,故白烟成分为NH4NO3,红棕色气体为NO2。
16.(1)O2 (2)2NO+O2===2NO2 红棕
(3)①4NH3+5O24NO+6H2O ②气体由无色变成红棕色 (4)AD
