2023年中考化学人教版专题强化--溶液(含答案)
文档属性
| 名称 | 2023年中考化学人教版专题强化--溶液(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 138.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-09 14:24:41 | ||
图片预览



文档简介
2023年中考化学人教版专题强化--溶液
一、单选题
1.室温下,向一定量的氯化钠溶液中加入10g氯化钠,充分搅拌后,尚有部分固体未溶解,加入10g水后,固体全部溶解。下列说法正确的是( )
A.加水前可能是不饱和溶液 B.加水前一定是饱和溶液
C.加水后一定是饱和溶液 D.加水后一定是不饱和溶液
2.已知:(1)20℃时,溶解度在10克以上的物质称为易溶物质;溶解度在1~10克的物质为可溶物质;溶解度在0.01~1克为微溶物质;溶解度小于0.01克的物质为难溶物质。
(2)20℃时几种物质的溶解度如下
物质名称 氯化钠 氢氧化钙 氯酸钾 硝酸钾
溶解度(克) 36.0 0.165 7.4 31.6
下列说法正确的是A.20℃时氢氧化钙是难溶物质
B.20℃时可以配制出20%的硝酸钾溶液
C.20℃时氯酸钾是易溶物质
D.20℃时硝酸钾的溶解度比氯化钠大
3.关于饱和溶液和不饱和溶液的有关说法正确的是
A.只要是饱和溶液就不能继续溶解任何溶质
B.降温一定能使接近饱和的溶液变成饱和溶液
C.加水可以使饱和溶液变成不饱和溶液
D.饱和溶液的浓度一定比不饱和溶液大
4.下列关于溶液的说法正确的是( )
A.从一杯质量分数为10%的食盐溶液中倒出一半,余下的溶液质量分数为5%
B.某饱和溶液降温后析出晶体,此时它就变成不饱和溶液
C.向某物质的饱和溶液中加少量该物质,恒温下放置一定时间后,溶液中的溶质质量分数变大
D.稀溶液可能是饱和溶液,浓溶液也可能是不饱和溶液
5.甲、乙两种固体的溶解度曲线如图所示,下列说法正确的是
A.甲的溶解度大于乙的溶解度
B.t1℃时,甲和乙的溶液中溶质的质量分数相等
C.t2℃时,60g甲的饱和溶液稀释到20%需加水40g
D.将t1℃时相等质量的甲、乙的饱和溶液升温到t2℃,溶液中溶质的质量甲大于乙
6.在实验室中用氯化钠和水配制100g质量分数为16%的氯化钠溶液并装瓶备用。下列说法不正确的是
A.通过计算可知所需氯化钠的质量为16g
B.所需玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管、试剂瓶
C.实验的主要步骤是计算、称量、量取、溶解、装瓶
D.用量筒量取水时仰视读数,所配得溶液的溶质质量分数偏大
7.实验室配制 50g 质量分数为 6%的氯化钠溶液时,下列说法正确的是
A.配制该溶液需要称量 3g 氯化钠,量取 50mL 蒸馏水
B.称量氯化钠时,只需在盛放氯化钠的右盘垫一张纸
C.用玻璃棒搅拌是为了增大氯化钠的溶解度
D.量取蒸馏水时俯视读数,所配溶液溶质质量分数偏大
8.下列物质中,常温下易溶于水的是
A.氢气 B.粉笔灰 C.蔗糖 D.植物油
9.化学与生产、生活密切相关,对下列现象或事实的解释错误的是
现象或事实 解释
A 洗涤剂能除去衣服上的油污 洗涤剂具有乳化作用
B 墙内开花墙外香 分子是不停运动的
C 气体往往容易被压缩,固体和液体不易被压缩 气体分子间的间隔较大,易被压缩,固体和液体分子间的间隔小,不易被压缩
D 打开汽水瓶盖时,汽水会自动喷出来 气体的溶解度随压强的减小而增大
A.A B.B C.C D.D
10.关于溶液,下列说法正确的是
A.将20毫升汽油放入烧杯中,加50毫升水搅拌,得到溶液 B.凡是均一的、稳定的液体一定是溶液
C.溶液中的溶质可以是气体、液体或固体 D.氢氧化钠溶于水形成溶液时,温度下降
11.下面四个图像的变化趋势,分别对应四种操作过程,其中正确的是
A. A图:等质量的铁片、铝片分别与足量且质量分数相同的稀硫酸反应
B. B图:FeCl3催化H2O2溶液的分解
C. C图:向盐酸和氯化钙的混合溶液中逐滴加入纯碱溶液至过量
D. D图:一定质量的碳和氧化铜在密闭容器中充分反应
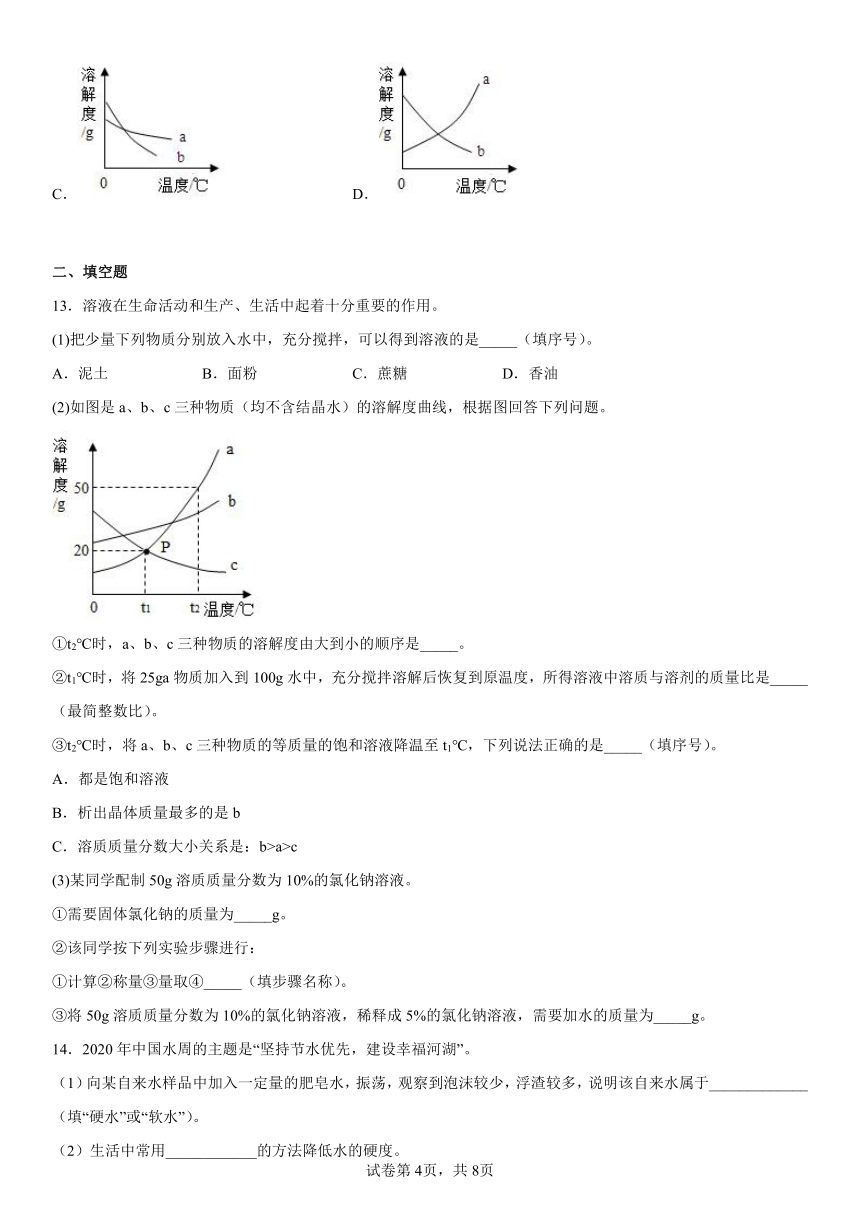
12.现有a,b两种物质在室温下的饱和溶液,升高温度后,a的溶液有晶体析出,而b的溶液还可以再溶解b晶体。则能正确表示a,b两种物质溶解度曲线的是。
A. B.
C. D.
二、填空题
13.溶液在生命活动和生产、生活中起着十分重要的作用。
(1)把少量下列物质分别放入水中,充分搅拌,可以得到溶液的是_____(填序号)。
A.泥土 B.面粉 C.蔗糖 D.香油
(2)如图是a、b、c三种物质(均不含结晶水)的溶解度曲线,根据图回答下列问题。
①t2℃时,a、b、c三种物质的溶解度由大到小的顺序是_____。
②t1℃时,将25ga物质加入到100g水中,充分搅拌溶解后恢复到原温度,所得溶液中溶质与溶剂的质量比是_____(最简整数比)。
③t2℃时,将a、b、c三种物质的等质量的饱和溶液降温至t1℃,下列说法正确的是_____(填序号)。
A.都是饱和溶液
B.析出晶体质量最多的是b
C.溶质质量分数大小关系是:b>a>c
(3)某同学配制50g溶质质量分数为10%的氯化钠溶液。
①需要固体氯化钠的质量为_____g。
②该同学按下列实验步骤进行:
①计算②称量③量取④_____(填步骤名称)。
③将50g溶质质量分数为10%的氯化钠溶液,稀释成5%的氯化钠溶液,需要加水的质量为_____g。
14.2020年中国水周的主题是“坚持节水优先,建设幸福河湖”。
(1)向某自来水样品中加入一定量的肥皂水,振荡,观察到泡沫较少,浮渣较多,说明该自来水属于_____________(填“硬水”或“软水”)。
(2)生活中常用____________的方法降低水的硬度。
(3)用洗剂清洗餐具上的油污,利用了洗涤剂对油污的_____________作用。
(4)珍惜水资源是每个公民应尽的责任和义务。下列做法有利于保护水资源的是__________(填字母序号)。
A实验室的废液经处理达标后排放
B洗净试管后,忘记关闭水龙头
C在实验室中安装节水的水龙头
15.化学兴趣小组的同学在整理实验室化学药品时,发现一瓶硫酸溶液的标签残缺不全,部分数据损坏,如图所示。为了补充完整该标签上被毁坏的硫酸溶液的质量分数,他们用100g该硫酸溶液与13g金属锌刚好完全反应,并通过计算就可以得知其质量分数。
(1)在实验室稀释浓硫酸时,要规范操作,小心谨慎,因为浓硫酸具有强烈的_____,稀释时溶液的温度会明显_____,要防止溶液飞溅。
(2)计算该标签中稀硫酸的质量分数是_______?
16.洗洁精能去油污是利用其_______作用,可用作制冷剂和人工降雨的是_______。能和人体内的血红蛋白结合,使人发生中毒的是_______。
17.甲、乙两种物质的溶解度曲线如图所示。请回答下列问题:
(1)t1℃时甲、乙的饱和溶液分别升温至t2℃,所得溶液中溶质的质量分数大小关系是:甲___________乙(填“>”“<”或“=”)
(2)甲中含有少量的乙杂质,要提纯甲物质,可采用___________结晶方法(填“蒸发”或“降温”)。
18.如图是a、b、c三种物质(均不含结晶水)的溶解度曲线,根据右图回答下列问题。
(1)P点的含义是______。
(2)t2°C时,a、b、c三种物质的溶解度由大到小的顺序是______。
(3)t1℃时,将25ga物质加入到100g水中,充分搅拌溶解后恢复到原温度,所得溶液中溶质与溶剂的质量比是______(最简整数比)。
(4)t2℃时,将a、b、c三种物质的等质量的饱和溶液降温至t1℃,下列说法正确的是______。
A都是饱和溶液 B溶质质量分数大小关系是:b>a>c C析出晶体质量最多的是a
三、推断题
19.碳酸钾广泛应用于玻璃、纺织印染和肥皂生产等领域,制取碳酸钾的工艺流程示意图如图:
温度/℃ 0 10 20 30 40 60 80 100
K2CO3的溶解度/g 107.0 109.0 111.0 114.0 117.0 126.0 139.0 156.0
KCl的溶解度/g 28 31 34 37 40 45 51 56
根据如图图表信息,回答下列问题:
(1)生成碳酸钾的化学方程式为______。
(2)上述流程中可循环使用的物质是______,NH4Cl在农业上可用作______。
(3)得到K2CO3晶浆的结晶方法是______。
(4)上述流程中洗涤K2CO3晶体应选用______(填序号)。
①NH4Cl溶液 ②热水 ③饱和K2CO3溶液
(5)往40℃700g氯化钾饱和溶液中,不断通入氨气和二氧化碳,控制温度在60~80℃之间,充分吸收混合。在有机萃取后,冷却至20℃时,理论上能得到K2CO3晶体______g。(忽略实验过程中的水分蒸发,结果保留整数)
(6)某CaCl2中混有KCl杂质,简述提纯该CaCl2的实验操作:______。
20.下图中,甲是相对分子质量为16的有机物;乙是最常见的溶剂;丁是白色难溶固体,其中金属元素的质量分数为40%。甲的化学式为____;③的化学方程式为____;丙的一种用途是____。
四、实验题
21.科学兴趣小组的同学做粗盐(只含有难溶性杂质)提纯实验,并用所得的精盐配制50g6%的氯化钠溶液。回答下列问题:
实验一:粗盐提纯
(1)上图中操作有错误的是______(填数字序号)。
(2)操作⑥中,当观察到蒸发皿中_____时,停止加热。
(3)海水晒盐采用上图操作⑥的原理,不采用冷却氯化钠浓溶液的方法,原因是氯化钠的溶解度_____。
实验二:用提纯得到的精盐配制50g6%的氯化钠溶液
(1)计算。需要氯化钠_____g,蒸馏水______mL。
(2)称量、量取。量取水的体积时,若仰视读数,所配溶液的溶质质量分数会______6%(填“>”“<”或“=”)。
(3)溶解。用玻璃棒搅拌的目的是_______。
(4)装瓶、贴标签。
22.实验室配制50g溶质质量分数为3%的NaCl溶液,操作示意图如下。请回答:
(1)配制50g溶质质量分数为3%的NaCl溶液,需要NaCl的质量为___________。
(2)图示中正确的操作顺序为___________(填序号)。
(3)溶解时用玻璃棒搅拌的目的是__________。
五、计算题
23.某工厂利用废硫酸溶液与铁反应生产铁的化合物。98t废硫酸溶液中的硫酸与5.6t铁恰好完全反应。
求:(1)该废硫酸溶液中溶质的质量分数。
(2)生成铁的化合物的质量(精确到0.1t)。
24.白铜(Cu-Ni)是工业上常用的一种合金,金属镍(Ni)的金属活泼性与铁相似,且化合价显+2价。为测定20g某白铜样品中镍的质量,设计了如下实验:
试问:(1)将白铜研碎的目的是 。
(2)白铜样品中镍的质量 g。
(3)所用稀硫酸中溶质的质量分数。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
2.B
3.C
4.D
5.C
6.D
7.D
8.C
9.D
10.C
11.C
12.B
13.(1)C
(2) abca﹥b﹥c 1:5 C
(3) 5 溶解 50
14. 硬水 煮沸 乳化 AC
15. 腐蚀性 升高 该标签中稀硫酸的质量分数是19.6%
16. 乳化 干冰升华吸热,使空气中的水蒸气遇冷凝结 一氧化碳
17.(1)=
(2)降温
18. t1℃时,a、c两物质的溶解度相等(都为20g) a>b>c 1:5 BC
19.(1)
(2) 有机萃剂 氮肥
(3)蒸发结晶
(4)③
(5)185
(6)加入足量的碳酸钾,过滤、洗涤,往滤渣中加入适量的稀盐酸,蒸发结晶的氯化钙
20. CH4 气体肥料、灭火等
21. ⑤ 有较多的固体出现时 随温度变化不大 3g 47mL < 加速溶解
22.(1)1.5g
(2)②①⑤③④
(3)加速溶解
23.(1)10%(2)15.2
解:设硫酸溶液中溶质的质量为x,生成硫酸亚铁的质量为y,则有
废硫酸溶液中溶质的质量分数为×100%=10%;
答:废硫酸溶液中溶质的质量分数10%;生成铁的化合物的质量15.2t。
24.(1)增大白铜与稀硫酸的接触面积,使反应更快、更充分(2)2.95(3)9.8%
答案第1页,共2页
答案第1页,共2页
一、单选题
1.室温下,向一定量的氯化钠溶液中加入10g氯化钠,充分搅拌后,尚有部分固体未溶解,加入10g水后,固体全部溶解。下列说法正确的是( )
A.加水前可能是不饱和溶液 B.加水前一定是饱和溶液
C.加水后一定是饱和溶液 D.加水后一定是不饱和溶液
2.已知:(1)20℃时,溶解度在10克以上的物质称为易溶物质;溶解度在1~10克的物质为可溶物质;溶解度在0.01~1克为微溶物质;溶解度小于0.01克的物质为难溶物质。
(2)20℃时几种物质的溶解度如下
物质名称 氯化钠 氢氧化钙 氯酸钾 硝酸钾
溶解度(克) 36.0 0.165 7.4 31.6
下列说法正确的是A.20℃时氢氧化钙是难溶物质
B.20℃时可以配制出20%的硝酸钾溶液
C.20℃时氯酸钾是易溶物质
D.20℃时硝酸钾的溶解度比氯化钠大
3.关于饱和溶液和不饱和溶液的有关说法正确的是
A.只要是饱和溶液就不能继续溶解任何溶质
B.降温一定能使接近饱和的溶液变成饱和溶液
C.加水可以使饱和溶液变成不饱和溶液
D.饱和溶液的浓度一定比不饱和溶液大
4.下列关于溶液的说法正确的是( )
A.从一杯质量分数为10%的食盐溶液中倒出一半,余下的溶液质量分数为5%
B.某饱和溶液降温后析出晶体,此时它就变成不饱和溶液
C.向某物质的饱和溶液中加少量该物质,恒温下放置一定时间后,溶液中的溶质质量分数变大
D.稀溶液可能是饱和溶液,浓溶液也可能是不饱和溶液
5.甲、乙两种固体的溶解度曲线如图所示,下列说法正确的是
A.甲的溶解度大于乙的溶解度
B.t1℃时,甲和乙的溶液中溶质的质量分数相等
C.t2℃时,60g甲的饱和溶液稀释到20%需加水40g
D.将t1℃时相等质量的甲、乙的饱和溶液升温到t2℃,溶液中溶质的质量甲大于乙
6.在实验室中用氯化钠和水配制100g质量分数为16%的氯化钠溶液并装瓶备用。下列说法不正确的是
A.通过计算可知所需氯化钠的质量为16g
B.所需玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管、试剂瓶
C.实验的主要步骤是计算、称量、量取、溶解、装瓶
D.用量筒量取水时仰视读数,所配得溶液的溶质质量分数偏大
7.实验室配制 50g 质量分数为 6%的氯化钠溶液时,下列说法正确的是
A.配制该溶液需要称量 3g 氯化钠,量取 50mL 蒸馏水
B.称量氯化钠时,只需在盛放氯化钠的右盘垫一张纸
C.用玻璃棒搅拌是为了增大氯化钠的溶解度
D.量取蒸馏水时俯视读数,所配溶液溶质质量分数偏大
8.下列物质中,常温下易溶于水的是
A.氢气 B.粉笔灰 C.蔗糖 D.植物油
9.化学与生产、生活密切相关,对下列现象或事实的解释错误的是
现象或事实 解释
A 洗涤剂能除去衣服上的油污 洗涤剂具有乳化作用
B 墙内开花墙外香 分子是不停运动的
C 气体往往容易被压缩,固体和液体不易被压缩 气体分子间的间隔较大,易被压缩,固体和液体分子间的间隔小,不易被压缩
D 打开汽水瓶盖时,汽水会自动喷出来 气体的溶解度随压强的减小而增大
A.A B.B C.C D.D
10.关于溶液,下列说法正确的是
A.将20毫升汽油放入烧杯中,加50毫升水搅拌,得到溶液 B.凡是均一的、稳定的液体一定是溶液
C.溶液中的溶质可以是气体、液体或固体 D.氢氧化钠溶于水形成溶液时,温度下降
11.下面四个图像的变化趋势,分别对应四种操作过程,其中正确的是
A. A图:等质量的铁片、铝片分别与足量且质量分数相同的稀硫酸反应
B. B图:FeCl3催化H2O2溶液的分解
C. C图:向盐酸和氯化钙的混合溶液中逐滴加入纯碱溶液至过量
D. D图:一定质量的碳和氧化铜在密闭容器中充分反应
12.现有a,b两种物质在室温下的饱和溶液,升高温度后,a的溶液有晶体析出,而b的溶液还可以再溶解b晶体。则能正确表示a,b两种物质溶解度曲线的是。
A. B.
C. D.
二、填空题
13.溶液在生命活动和生产、生活中起着十分重要的作用。
(1)把少量下列物质分别放入水中,充分搅拌,可以得到溶液的是_____(填序号)。
A.泥土 B.面粉 C.蔗糖 D.香油
(2)如图是a、b、c三种物质(均不含结晶水)的溶解度曲线,根据图回答下列问题。
①t2℃时,a、b、c三种物质的溶解度由大到小的顺序是_____。
②t1℃时,将25ga物质加入到100g水中,充分搅拌溶解后恢复到原温度,所得溶液中溶质与溶剂的质量比是_____(最简整数比)。
③t2℃时,将a、b、c三种物质的等质量的饱和溶液降温至t1℃,下列说法正确的是_____(填序号)。
A.都是饱和溶液
B.析出晶体质量最多的是b
C.溶质质量分数大小关系是:b>a>c
(3)某同学配制50g溶质质量分数为10%的氯化钠溶液。
①需要固体氯化钠的质量为_____g。
②该同学按下列实验步骤进行:
①计算②称量③量取④_____(填步骤名称)。
③将50g溶质质量分数为10%的氯化钠溶液,稀释成5%的氯化钠溶液,需要加水的质量为_____g。
14.2020年中国水周的主题是“坚持节水优先,建设幸福河湖”。
(1)向某自来水样品中加入一定量的肥皂水,振荡,观察到泡沫较少,浮渣较多,说明该自来水属于_____________(填“硬水”或“软水”)。
(2)生活中常用____________的方法降低水的硬度。
(3)用洗剂清洗餐具上的油污,利用了洗涤剂对油污的_____________作用。
(4)珍惜水资源是每个公民应尽的责任和义务。下列做法有利于保护水资源的是__________(填字母序号)。
A实验室的废液经处理达标后排放
B洗净试管后,忘记关闭水龙头
C在实验室中安装节水的水龙头
15.化学兴趣小组的同学在整理实验室化学药品时,发现一瓶硫酸溶液的标签残缺不全,部分数据损坏,如图所示。为了补充完整该标签上被毁坏的硫酸溶液的质量分数,他们用100g该硫酸溶液与13g金属锌刚好完全反应,并通过计算就可以得知其质量分数。
(1)在实验室稀释浓硫酸时,要规范操作,小心谨慎,因为浓硫酸具有强烈的_____,稀释时溶液的温度会明显_____,要防止溶液飞溅。
(2)计算该标签中稀硫酸的质量分数是_______?
16.洗洁精能去油污是利用其_______作用,可用作制冷剂和人工降雨的是_______。能和人体内的血红蛋白结合,使人发生中毒的是_______。
17.甲、乙两种物质的溶解度曲线如图所示。请回答下列问题:
(1)t1℃时甲、乙的饱和溶液分别升温至t2℃,所得溶液中溶质的质量分数大小关系是:甲___________乙(填“>”“<”或“=”)
(2)甲中含有少量的乙杂质,要提纯甲物质,可采用___________结晶方法(填“蒸发”或“降温”)。
18.如图是a、b、c三种物质(均不含结晶水)的溶解度曲线,根据右图回答下列问题。
(1)P点的含义是______。
(2)t2°C时,a、b、c三种物质的溶解度由大到小的顺序是______。
(3)t1℃时,将25ga物质加入到100g水中,充分搅拌溶解后恢复到原温度,所得溶液中溶质与溶剂的质量比是______(最简整数比)。
(4)t2℃时,将a、b、c三种物质的等质量的饱和溶液降温至t1℃,下列说法正确的是______。
A都是饱和溶液 B溶质质量分数大小关系是:b>a>c C析出晶体质量最多的是a
三、推断题
19.碳酸钾广泛应用于玻璃、纺织印染和肥皂生产等领域,制取碳酸钾的工艺流程示意图如图:
温度/℃ 0 10 20 30 40 60 80 100
K2CO3的溶解度/g 107.0 109.0 111.0 114.0 117.0 126.0 139.0 156.0
KCl的溶解度/g 28 31 34 37 40 45 51 56
根据如图图表信息,回答下列问题:
(1)生成碳酸钾的化学方程式为______。
(2)上述流程中可循环使用的物质是______,NH4Cl在农业上可用作______。
(3)得到K2CO3晶浆的结晶方法是______。
(4)上述流程中洗涤K2CO3晶体应选用______(填序号)。
①NH4Cl溶液 ②热水 ③饱和K2CO3溶液
(5)往40℃700g氯化钾饱和溶液中,不断通入氨气和二氧化碳,控制温度在60~80℃之间,充分吸收混合。在有机萃取后,冷却至20℃时,理论上能得到K2CO3晶体______g。(忽略实验过程中的水分蒸发,结果保留整数)
(6)某CaCl2中混有KCl杂质,简述提纯该CaCl2的实验操作:______。
20.下图中,甲是相对分子质量为16的有机物;乙是最常见的溶剂;丁是白色难溶固体,其中金属元素的质量分数为40%。甲的化学式为____;③的化学方程式为____;丙的一种用途是____。
四、实验题
21.科学兴趣小组的同学做粗盐(只含有难溶性杂质)提纯实验,并用所得的精盐配制50g6%的氯化钠溶液。回答下列问题:
实验一:粗盐提纯
(1)上图中操作有错误的是______(填数字序号)。
(2)操作⑥中,当观察到蒸发皿中_____时,停止加热。
(3)海水晒盐采用上图操作⑥的原理,不采用冷却氯化钠浓溶液的方法,原因是氯化钠的溶解度_____。
实验二:用提纯得到的精盐配制50g6%的氯化钠溶液
(1)计算。需要氯化钠_____g,蒸馏水______mL。
(2)称量、量取。量取水的体积时,若仰视读数,所配溶液的溶质质量分数会______6%(填“>”“<”或“=”)。
(3)溶解。用玻璃棒搅拌的目的是_______。
(4)装瓶、贴标签。
22.实验室配制50g溶质质量分数为3%的NaCl溶液,操作示意图如下。请回答:
(1)配制50g溶质质量分数为3%的NaCl溶液,需要NaCl的质量为___________。
(2)图示中正确的操作顺序为___________(填序号)。
(3)溶解时用玻璃棒搅拌的目的是__________。
五、计算题
23.某工厂利用废硫酸溶液与铁反应生产铁的化合物。98t废硫酸溶液中的硫酸与5.6t铁恰好完全反应。
求:(1)该废硫酸溶液中溶质的质量分数。
(2)生成铁的化合物的质量(精确到0.1t)。
24.白铜(Cu-Ni)是工业上常用的一种合金,金属镍(Ni)的金属活泼性与铁相似,且化合价显+2价。为测定20g某白铜样品中镍的质量,设计了如下实验:
试问:(1)将白铜研碎的目的是 。
(2)白铜样品中镍的质量 g。
(3)所用稀硫酸中溶质的质量分数。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
2.B
3.C
4.D
5.C
6.D
7.D
8.C
9.D
10.C
11.C
12.B
13.(1)C
(2) abca﹥b﹥c 1:5 C
(3) 5 溶解 50
14. 硬水 煮沸 乳化 AC
15. 腐蚀性 升高 该标签中稀硫酸的质量分数是19.6%
16. 乳化 干冰升华吸热,使空气中的水蒸气遇冷凝结 一氧化碳
17.(1)=
(2)降温
18. t1℃时,a、c两物质的溶解度相等(都为20g) a>b>c 1:5 BC
19.(1)
(2) 有机萃剂 氮肥
(3)蒸发结晶
(4)③
(5)185
(6)加入足量的碳酸钾,过滤、洗涤,往滤渣中加入适量的稀盐酸,蒸发结晶的氯化钙
20. CH4 气体肥料、灭火等
21. ⑤ 有较多的固体出现时 随温度变化不大 3g 47mL < 加速溶解
22.(1)1.5g
(2)②①⑤③④
(3)加速溶解
23.(1)10%(2)15.2
解:设硫酸溶液中溶质的质量为x,生成硫酸亚铁的质量为y,则有
废硫酸溶液中溶质的质量分数为×100%=10%;
答:废硫酸溶液中溶质的质量分数10%;生成铁的化合物的质量15.2t。
24.(1)增大白铜与稀硫酸的接触面积,使反应更快、更充分(2)2.95(3)9.8%
答案第1页,共2页
答案第1页,共2页
同课章节目录
