化学人教版(2019)选择性必修1 3.4.1 沉淀溶解平衡及应用(共30张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 3.4.1 沉淀溶解平衡及应用(共30张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 3.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-09 09:11:46 | ||
图片预览










文档简介
(共30张PPT)
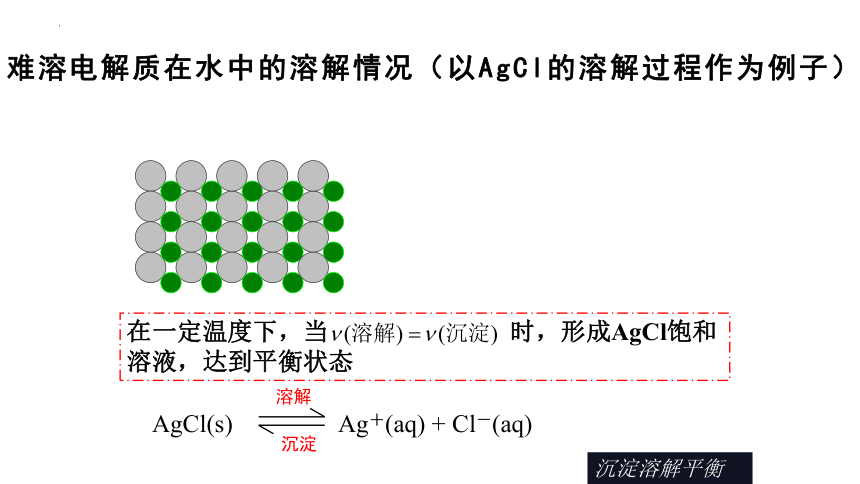
难溶电解质在水中的溶解情况(以AgCl的溶解过程作为例子)
在水分子的作用下,少量的Ag+和Cl-脱离AgCl表面进入水中(溶解过程)
沉淀溶解平衡
在水分子的作用下,少量的Ag+和Cl-脱离AgCl表面进入水中(溶解过程);另一方面,溶液中的Ag+和Cl-也会回到AgCl表面析出(沉淀过程)。
沉淀溶解平衡
难溶电解质在水中的溶解情况(以AgCl的溶解过程作为例子)
在一定温度下,当 时,形成AgCl饱和溶液,达到平衡状态
溶解
AgCl(s) Ag+(aq) + Cl-(aq)
沉淀
沉淀溶解平衡
难溶电解质在水中的溶解情况(以AgCl的溶解过程作为例子)
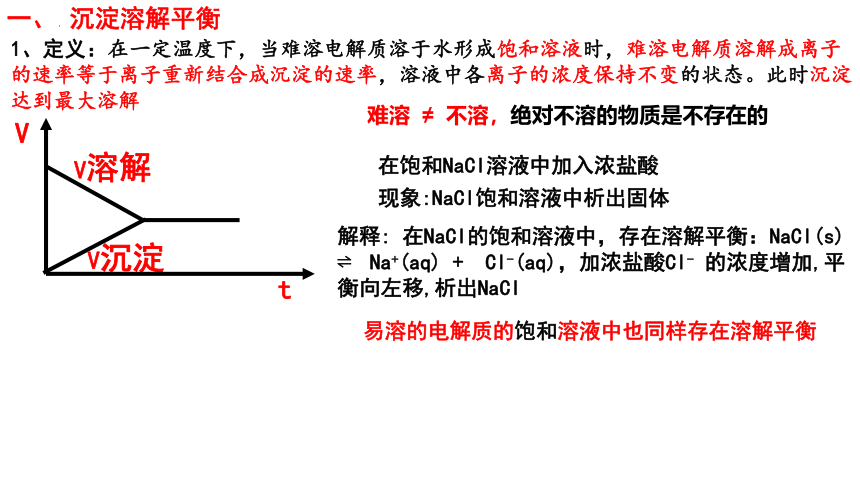
一、 沉淀溶解平衡
1、定义:在一定温度下,当难溶电解质溶于水形成饱和溶液时,难溶电解质溶解成离子的速率等于离子重新结合成沉淀的速率,溶液中各离子的浓度保持不变的状态。此时沉淀达到最大溶解
V沉淀
V
t
V溶解
在饱和NaCl溶液中加入浓盐酸
现象:NaCl饱和溶液中析出固体
解释: 在NaCl的饱和溶液中,存在溶解平衡:NaCl(s) Na+(aq) + Cl-(aq),加浓盐酸Cl- 的浓度增加,平衡向左移,析出NaCl
易溶的电解质的饱和溶液中也同样存在溶解平衡
难溶 ≠ 不溶,绝对不溶的物质是不存在的
一 、沉淀溶解平衡
书写沉淀溶解平衡表达式要标上状态,难溶电解质用“s”,溶液中的离子用“aq”,并用“ ”连接
沉淀溶解平衡表达式:AmBn(s) mAn+(aq)+nBm-(aq)
练习:写出CaCO3, BaSO4 ,Fe(OH)3的沉淀溶解平衡表示式和电离方程式
微溶或难溶的强电解质在水溶液中不存在电离平衡,只存在溶解平衡
微溶或难溶的弱电解质在水溶液中既存在电离平衡,也存在溶解平衡
二、溶度积常数(简称溶度积)
定义:在一定条件下,难溶性电解质形成饱和溶液,达到溶解平衡,其溶解平衡常数叫做溶度积常数或简称溶度积.符号Ksp
Ksp ( AmBn ) =cm ( An+) · cn(Bm-)
写出AgBr、Fe(OH)3的溶解平衡表达式和溶度积表达式
AgBr(s) Ag+(aq) + Br-(aq) Ksp = c(Ag+) . c(Br-)
Fe(OH)3(s) Fe3+(aq) + 3OH- (aq) Ksp = c(Fe3+) . c3(OH-)
化学平衡常数 水的离子积 电离平衡常数 难溶电解质溶度积常数
符号 K KW Ka或Kb Ksp
反应举例 mA(g)+nB(g) pC(g)+qD(g) H2O H++OH- HA A- + H+ MOH M+ + OH- AmBn(s) mAn+(aq)+nBm-(aq)
表达式 K= KW =c(H+)·c(OH-) Kb= Ksp ( AmBn ) =cm ( An+) · cn(Bm-)
适用范围 可逆反应平衡体系 水、酸、碱、盐的稀溶液 弱电解质的电离平衡体系 难溶电解质或易溶的电解质的饱和溶液
影响因素 只与温度有关
吸热反应:T↑,K↑ 放热反应:T↑,K↓ 电离吸热:T↑,KW↑,Ka↑,Kb↑ 绝大多数难溶盐的溶解是吸热过程:T↑,Ksp↑
特例:T↑,KspCa(OH)2↓
规律 遵循平衡移动原理,T不变,K不变
注意 固体和纯液体浓度视为常数,不列入平衡常数的表达式,且带入平衡常数的表达式的数值必须是平衡时的数值
意义 K越大,正反应进行程度越大 KW越大,水的电离程度越大 Ka(或Kb)越大,弱电解质的酸性(或碱性)越大 相同类型的难溶电解质,Ksp越大,溶解度越大
难溶物 Ksp(25℃) c(Mn+)(mol·L-1) 溶解度(g)
CaCO3 5.0×10-9 7.07×10-5 7.1×10-4
AgCl 1.8×10-10 1.34×10-5 1.5×10-4
AgBr 5.4×10-13 7.35×10-7 8.4×10-6
AgI 8.5×10-17 9.23×10-9 2.1×10-7
Ag2CrO4 1.1×10-12 1.30×10-4 2.2×10-3
BaSO4 1.1×10-10 1.05×10-5 2.4×10-4
Ksp 与溶解度的关系:对于同种类型的难溶电解质,Ksp越大,溶解度越大
若为不同类型的难溶电解质,则Ksp与溶解度无此关系
阳离子相同,且都为AB型:Ksp(AgCl)>Ksp(AgBr)>Ksp(AgI)
溶解度:AgCl>AgBr>AgI
特点:Ksp 只与温度有关,绝大多数难溶盐的溶解是吸热过程,升高温度,Ksp↑,平衡向沉淀溶解方向移动
特殊:Ca(OH)2随着温度升高,溶解度降低,Ksp减小,平衡向沉淀生成方向移动
意义:Ksp的大小反映了物质在水中的溶解能力
离子积(浓度商)
AgCl(s) Ag+(aq) + Cl-(aq)
Qc= C(Ag+) C(Cl-) ,Qc称为离子积,其表达式中离子浓度是任意的
(1)Qc > Ksp时:溶液过饱和,平衡向生成沉淀方向移动,有沉淀从溶液中析出,体系中不断析出沉淀,直至达到平衡
(2)Qc = Ksp时:溶液饱和,平衡不移动,沉淀与溶解处于平衡状态,可能有沉淀,可能没有沉淀
(3)Qc < Ksp时:溶液不饱和,无沉淀生成,平衡向溶解方向移动,此时若加入过量难溶电解质,难溶电解质会溶解直至达到平衡
a→c 曲线上变化,增大c(SO42-)
b→c 加入1×10-5mol·L-1Na2SO4溶液(加水不行)
d→c 加入BaCl2固体(忽略溶液的体积变化)
c→a 曲线上变化,增大c(Ba2+)
曲线上方的点表示有沉淀生成;曲线下方的点表示不饱和溶液
已知Ksp(MgCO3)=6.82×10-6(25℃),将4×10-3mol·L-1的MgCl2溶液与4×10-3mol·L-1的Na2CO3溶液等体积混合,此时Mg2+ 和CO32- 能否产生沉淀?
Qc(MgCO3)=c(Mg2+) c(CO32—)
=2×10-3mol·L-1×2×10-3mol·L-1
=4×10-6∴Mg2+ 和CO32- 不能产生沉淀
25℃时,Ksp[Mg(OH)2]= 5.6×10-12mol3·L-3,求Mg(OH)2 的饱和溶液中的c(Mg2+)和PH值;若往此饱和溶液中滴入无色酚酞则溶液呈什么颜色?
解:设饱和溶液中Mg2+的浓度为X
Ksp=c(Mg2+)c2(OH-)
=X(2X)2= 5.6×10-12mol3·L-3
得 X=1.12×10-4mol·L-1
c(OH-)=2.24×10-4mol·L-1,25℃时,C(H+)=4.46×10-11mol·L-1,PH=10.4
酚酞在pH>10时显红色
判断两者能否生成沉淀:Qc≥Ksp,且所代入的离子浓度一定是混合溶液中的离子浓度
求M(OH)n饱和溶液pH:Ksp ( M(OH)n ) =c ( Mn+) · cn(OH-)
,nc ( Mn+) = c(OH-)
Ksp ( M(OH)n ) =c ( Mn+) ·[nc ( Mn+)]n
②外因:浓度、温度
Mg(OH)2(s) Mg2+ (aq) + 2OH-(aq)
影响沉淀溶解平衡的因素
①内因:电解质本身的性质
改变条件 平衡移动方向 C(Mg2+) C(OH-) 溶解度 Ksp
升高温度 → ↑ ↑ ↑ ↑ T↑,Ksp↑,溶解度↑;Ca(OH)2相反
加水稀释 → 不变 不变 不变 不变 加水稀释c离子:澄清饱和溶液:↓;悬浊液:不变
如无特殊说明,一般认为饱和溶液加水稀释平衡向溶解的方向移动,但离子浓度不变,溶解度不变
MgCl2(s) ← ↑ ↓ ↓ 加入相同离子(同离子效应),平衡向沉淀方向移动,溶解度减小,溶液中析出沉淀
NaOH(s) ← ↓ ↑
HCl(g) → ↑ ↓ ↑ 加入可与体系中离子反应生成更难溶或更难电离或气体的物质,平衡向溶解的方向移动,溶解度增大
NH4Cl(s) → ↑ ↓
Mg(OH)2(s) 平衡不移动 不变 不变 不变 对于饱和溶液,再加入该难溶物固体不再溶解,平衡不移动,溶解度不变
一定温度下,不能再溶解溶质的溶液叫饱和溶液,溶解度S:在一定温度下,某固态物质在100克溶剂里达到饱和状态时所溶解的质量
沉淀溶解平衡的应用
1.沉淀的生成——分离提纯某些离子(1)调节pH法——调pH使杂质形成氢氧化物沉淀而除去
如除去NH4Cl溶液中的FeCl3杂质,可加入氨水调节pH至7~8,离子方程式为:Fe3++3NH3·H2O == Fe(OH)3↓+3NH4+
Cu2+(Fe3+):加Cu2(OH)2CO3、CuO、CuCO3、Cu(OH)2
Mg2+(Fe3+):加Mg粉、MgO、MgCO3、Mg(OH)2
原理:Fe3+ + 3H2O Fe(OH)3 + 3H+,加入物质消耗H+,促进Fe3+水解平衡右移生成沉淀Fe(OH)3而除去
先把Fe2+氧化成Fe3+,然后调pH至3.2-4.7使Fe3+转化为Fe(OH)3 沉淀,过滤除去沉淀。
此题可用:氯气、双氧水、氧气等(不引入杂质)
此题可用:氧化铜、碳酸铜等(不引入杂质)
(1)常用氧化剂:硝酸、高锰酸钾、氯气、氧气、双氧水等
(2)调pH可用:氨水、氢氧化钠、氧化铜、碳酸铜
开始沉淀时的pH 沉淀完全时的pH
Fe3+ 1.9 3.2
Fe2+ 7.0 9.0
Cu2+ 4.7 6.7
腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol/L,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤 。
①通入足量氯气将Fe2+氧化成Fe3+;
②加入CuO调节溶液的pH至3.2-4.7;
③过滤(除去Fe(OH)3)
一般来说,除去溶液中杂质Fe2+,都是先将Fe2+氧化为Fe3+,再加入除杂剂调节pH至3到4将Fe3+转化为Fe(OH)3沉淀而除去
若某溶液中Fe3+和Mg2+的浓度均为0.10 mol/L, 使Fe3+完全沉淀而使Mg2+不沉淀的pH条件是什么 ( Ksp(Fe(OH)3)= 4×10-39 Ksp(Mg(OH)2)= 1.8×10-11)
pOH = 10.8 , pH = 3.2
Mg2+开始沉淀的pH值为:
pOH = 4.9, pH =9.1
因此, 只要控制pH值在3.2 - 9.1之间即可使Fe3+定量沉淀而使Mg2+不沉淀
告诉Ksp,求调节pH范围:对于沉淀溶解平衡:M(OH)n(s) Mn+(aq)+nOH-(aq),Ksp ( M(OH)n ) =c ( Mn+) · cn(OH-)
开始沉淀时的pH求法:c(OH-)=,c(H+)=,从而确定pH
沉淀完全时的pH求法:当该离子的浓度小于1.0×10-5 mol·L-1时,认为已经沉淀完全
c(OH-)= mol·L-1,c(H+)=,从而确定pH
解: Fe(OH)3 Fe3+ + 3OH-
Fe3+ 沉淀完全时的pH为:
已知Ksp(MgCO3)=6.82×10-6(25℃),将6×10-3mol·L-1的MgCl2溶液与8×10-3mol·L-1的Na2CO3溶液等体积混合,此时Mg2+是否完全沉淀?
对于两溶液混合生成沉淀,判断某离子是否完全沉淀(以BaCl2与Na2SO4生成BaSO4为例):若要判断Ba2+是否沉淀完全,先确定能生成沉淀再写出反应判断过量,若Ba2+过量,则算出生成沉淀后剩余c(Ba2+),若其<1.0×10-5 mol·L-1时,则Ba2+已经沉淀完全;若SO42-过量,则算出生成沉淀后剩余c(SO42-),c(Ba2+)=若其<1.0×10-5 mol·L-1时,则Ba2+已经沉淀完全
某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体(NiSO4·7H2O):
溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
金属离子 Ni2+ Al3+ Fe3+ Fe2+
开始沉淀时(c=0.01 mol·L-1)的pH 7.2 3.7 2.2 7.5
沉淀完全时(c=1.0×10-5 mol·L-1)的pH 8.7 4.7 3.2 9.0
(4)利用上述表格数据,计算Ni(OH)2的Ksp=________________________________________________________________________________________________________(列出计算式)。如果“转化”后的溶液中Ni2+浓度为1.0 mol·L-1,则“调pH”应控制的pH范围是________。
告诉沉淀时的pH,求调节pH范围 pH→c(OH-)=
先求M(OH)nKsp:KspM(OH)n=开始沉淀时的Mn+浓度(0.01)×cn(OH-)或KspM(OH)n=完全沉淀时的Mn+浓度(1.0×10-5)×cn(OH-)
杂质完全沉淀pH≤pH<产物开始沉淀pH
(2)沉淀剂法①用沉淀剂Na2S除去废水中的Cu2+、Hg2+,其离子方程式分别为Cu2++S2- == CuS↓、
Hg2++S2- == HgS↓
向1×10-3 mol L-1 的K2CrO4溶液中滴加AgNO3溶液,求开始有Ag2CrO4沉淀生成时的C(Ag+ )= CrO42-沉淀完全时, C(Ag+ )= 已知:Ksp(Ag2CrO4)=9.0×10-13
解:Ag2CrO4 2Ag+ + CrO42-
Ksp = C2(Ag+) · C(CrO42-)
开始沉淀:
CrO42-沉淀完全时的浓度为1.0 ×10-5 mol/L,
故有
②除去某溶液中SO42-,用钡盐而不用钙盐的原因是SO42-与钡盐生成的BaSO4比与钙盐生成的CaSO4更难溶,SO42-剩余的浓度更小
沉淀生成时沉淀剂的选择原则
①使生成沉淀的反应进行得越完全越好(被沉淀离子形成沉淀的Ksp尽可能地小,即沉淀溶解度越小越好)
如除去废水中的Cu2+,可以使Cu2+转化成CuCO3、Cu(OH)2或CuS,依据三者溶解度的大小可知,应选择沉淀剂使废水中的Cu2+转化成溶解度最小的CuS
②不能影响其他离子的存在,由沉淀剂引入溶液的杂质离子要便于除去或不引入新的杂质离子
③同离子效应法
硫酸中c(SO42-) 大,使平衡向沉淀的方向移动
为什么硫酸钡在硫酸中的溶解度比在纯水中小?
将足量AgCl分别加入下列溶液中,AgCl溶解度由大到小的顺序是( )
①20ml0.01mol∕LKCl溶液 ②20ml0.02mol∕LCaCl2溶液
③20ml蒸馏水 ④20ml0.03mol∕LHCl溶液
⑤20ml0.05mol∕L AgNO3溶液
A.①>②>④>③>⑤ B.③>①>④>②>⑤
C.⑤>③>②>①>④ D.③>④>⑤>②>①
B
用等体积的蒸馏水和0.010mol/L稀硫酸洗涤BaSO4沉淀,用水洗涤造成BaSO4的损失量大于用稀硫酸洗涤的损失量
沉淀溶解平衡溶解度问题(饱和溶液)
T↑,溶解度↑;Ca(OH)2相反
加入相同离子(同离子效应),溶解度减小,加入离子浓度↑,溶解度↓
加入可与体系中离子反应生成更难溶或更难电离或气体的物质,溶解度增大,加入反应离子浓度↑,溶解度↑
再加入该难溶物固体或加水稀释,溶解度不变
洗涤沉淀,要用沉淀难溶的溶剂去洗涤
2.沉淀的溶解
根据平衡移动原理,设法不断地移去平衡体系中的相应离子,使平衡向沉淀溶解的方向移动。(1)CaCO3溶于盐酸①过程:CaCO3(s) CO32-(aq)+Ca2+(aq)
HCO3-(aq) H2CO3―→CO2↑+H2O
H+
H+
②解释:溶解过程中CO32-生成CO2气体,c(CO32-)减小,CO32-与Ca2+的离子积Q(2)Mg(OH)2溶于盐酸、NH4Cl溶液的离子方程式分别为Mg(OH)2+2H+ == Mg2++2H2O、Mg(OH)2+2NH4+ == Mg2++2NH3·H2O;若有足量铵盐,沉淀可以完全溶解
Mg(OH)2(s) Mg2+ + 2OH-
2NH4Cl == 2Cl- + 2NH4+
2NH3·H2O
+
步骤 1mLNaCl和10滴AgNO3溶液混合 向所得固液混合物中滴加10滴KI溶液 向新得固液混合物中滴加10滴Na2S溶液
现象 有白色沉淀析出 白色沉淀转化为黄色 黄色沉淀转化为黑色
AgCl
AgI
Ag2S
KI
Na2S
3、沉淀的转化
(1)AgNO3 AgCl AgI Ag2S
NaCl
KI
Na2S
AgNO3 + NaCl == AgCl↓ + NaNO3
AgCl + KI == AgI + KCl
2AgI + Na2S == Ag2S + 2NaI
KI
Na2S
[思考与交流]:从实验中可以得到什么结论?
物质 溶解度/g
AgCl 1.5×10-4
AgI 9.6×10-9
Ag2S 1.3×10-16
实验说明:沉淀可以从溶解度小的向溶解度更小的方向转化,两者差别越大,转化越容易
逆向进行,有何现象
步骤 1mLNa2S 和10滴AgNO3溶液混合 向所得固液混合物中滴加10滴KI溶液 向新得固液混合物中滴加10滴NaCl 溶
现象
有黑色沉淀析出
黑色沉淀没变化
黑色沉淀没变化
转化原理:AgCl(s)→→AgI(s)
解释:AgCl沉淀中加入KI溶液时,溶液中Ag+和I-的Q(AgI)>Ksp(AgI),Ag+与I-生成AgI沉淀,导致AgCl逐渐转化为AgI
I-
2AgI(s) + S2- == Ag2S(s) + 2I-
沉淀转化常数K= = = 若沉淀转化常数K>1×105,则认为反应完全,用“==”连接,例:AgCl + I- == AgI + Cl-;2AgI + S2- == Ag2S + 2I-
(2)ZnS沉淀中滴加CuSO4溶液得到CuS沉淀的离子方程式为ZnS(s)+Cu2+(aq) == CuS(s)+Zn2+(aq) Ksp(ZnS)=1.6×10-24>Ksp(CuS)=6.3×10-36
物质 Ksp
AgCl 1.8×10-10
AgI 8.5×10-17
Ag2S 6.3×10-50
向MgCl2溶液中滴加NaOH溶液
向有白色沉淀的溶液中滴加FeCl3溶液
生成白色沉淀
静置
白色沉淀转变为红褐色
红褐色沉淀析出,溶液变无色
Ksp[Mg(OH)2]>Ksp[Fe(OH)3]
(3)Mg(OH)2转化为Fe(OH)3
分步沉淀
1、定义如果一种溶液中同时含有I-和Cl-,当慢慢滴入AgNO3溶液时,刚开始只生成AgI沉淀;加入的AgNO3到一定量时才出现AgCl沉淀,这种先后沉淀的现象称为分步沉淀。2、原理在含有同浓度I-和Cl-的溶液中,加入AgNO3溶液,之所以AgI沉淀先生成,是因为Ksp(AgI)比Ksp(AgCl)小,假定溶液中c(I-)=c(Cl-)=0.01 mol·L-1,=,Ksp(AgCl)=1.8×10-10,刚开始生成AgI和AgCl沉淀时所需要的Ag+浓度分别是:c(Ag+)AgI== mol·L-1=9.3×10-15 mol·L-1c(Ag+)AgCl== mol·L-1=1.8×10-8 mol·L-1可见沉淀I-所需要的c(Ag+)要小的多,所以AgI先沉淀,继续滴加AgNO3,当c(Ag+)=1.8×10-8 mol·L-1时,AgCl沉淀也开始生成,这时c(I-)、c(Cl-)和c(Ag+)同时平衡:c(Ag+)·c(I-)=Ksp(AgI)=9.3×10-17c(Ag+)·c(Cl-)=Ksp(AgCl)=1.8×10-10两式相除得:==1.9×106如果溶液中c(Cl-)>1.9×106c(I-),向其中滴加AgNO3溶液时,则要先生成AgCl沉淀
判断沉淀的顺序【典例精析】将0.001 mol·L-1 AgNO3溶液逐滴滴入0.001 mol·L-1 KCl和0.001 mol·L-1 K2CrO4的混合溶液中,先产生哪种沉淀?能否分步沉淀?[已知该温度下,Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1.12×10-12]
沉淀转化规律
1、一般来说,溶解度大的沉淀容易转化为溶解度小的沉淀,沉淀的溶解度差别越大,转化越容易
2、当一种试剂能沉淀溶液中的几种离子时,生成沉淀时所需试剂离子浓度越小的越先沉淀(对于同类型且含有相同离子的沉淀,溶度积Ksp越小,沉淀越先生成;若为不同类型沉淀且且含有相同离子的沉淀,则生成沉淀时所需该相同离子浓度越小,越先生成沉淀)
3、Ksp相差不大时,Ksp小的物质可以转化为Ksp大的物质;如Ksp(BaCO3)=5.1×10-9>Ksp(BaSO4)=1.1×10-10,但相差不大可转化:BaSO4 + CO32- BaCO3 + SO42-
在BaSO4的饱和溶液中加入高浓度的Na2CO3溶液,可以生成溶解度较大的 BaCO3沉淀
判断沉淀的转化:根据原沉淀饱和求出相同离子的浓度,带入新沉淀Qc,≥新沉淀Ksp,则能转化
解:在ZnS饱和浓度中:ZnS(s) S2-(aq)+Zn2+(aq)
即c(S2-)=c(Zn2+)=(Ksp)1/2=(1.6×10-24)1/2=1.26×10-12(mol/L)
Qc(CuS)=c(Cu2+)c(S2-)=1.0×10-3×1.26×10-12 =1.26×10-15
Qc(CuS) > Ksp(CuS),所以ZnS沉淀会转化为CuS沉淀
在ZnS沉淀中加入10mL0.001mol/L的CuSO4溶液是否有CuS沉淀生成?已知:Ksp(ZnS)=1.6×10-24 Ksp(CuS)=1.3×10-36
沉淀溶解平衡的应用1.锅炉除垢:用Na2CO3溶液处理,将CaSO4转化为CaCO3,离子方程式为CaSO4(s)+CO32-(aq) CaCO3(s)+SO42-(aq),再加入盐酸或饱和氯化铵溶液除去水垢
涉及反应:CaSO4+CO32- CaCO3+SO42-
CaCO3+2H+ == Ca2++CO2↑+H2O
Mg(OH)2+2H+ == Mg2++2H2O
2.矿物转化:CuSO4溶液遇PbS转化为CuS,离子方程式为Cu2+(aq)+PbS(s) == CuS(s)+Pb2+(aq)
3.医学上常用BaSO4作为内服造影剂“钡餐”,而不用BaCO3作为内服造影剂“钡餐”
已知:人体内胃酸的酸性pH=0.9~1.5,BaSO4 和BaCO3的沉淀溶解平衡分别为:
BaSO4(s) Ba2+(aq) + SO42- (aq) ,BaCO3 (s) Ba2+(aq) + CO32-(aq)
如果服下BaCO3,胃酸会与CO32-反应生成CO2和水,使CO32-浓度降低,使BaCO3的沉淀溶解平衡向右移动,使体内的Ba2+浓度增大而引起人体重金属中毒;而SO42-不与H+结合生成硫酸,胃酸中的H+对BaSO4的溶解平衡没有影响,Ba2+浓度保持在安全浓度标准下,所以用BaSO4 作“钡餐”
龋齿的形成
1. 牙釉质:主要成分为Ca5(PO4)3OH(羟基磷灰石);是一种难溶电解质。
2. 残留在牙齿上的糖发酵会产生H+。
沉淀的溶解
Ca5(PO4)3OH 5Ca2++ 3PO43- + OH-
3H+
3HPO42-
+
+
H+
H2O
龋齿的预防
使用含氟牙膏,氟离子会与 Ca5(PO4)3OH (羟基磷灰石)反应生成Ca5(PO4)3F (氟磷灰石)
Ca5(PO4)3OH+F- Ca5(PO4)3F + OH-
沉淀的转化
4.水滴石穿和钟乳石的形成
石头主要成分是CaCO3,CO2溶于水形成酸性环境,c(CO32-)减小,CaCO3沉淀溶解平衡向溶解方向进行
发生化学反应:CaCO3 +CO2+H2O == Ca(HCO3)2
当溶有Ca(HCO3)2的地下水再次滴入洞中时,由于环境中压力、温度的变化,使水中的二氧化碳逸出,从而转化为CaCO3,Ca(HCO3)2== CaCO3↓ +CO2+H2O,长时间的累积就会形成一根根形态各异的石钟乳、石柱和石笋
沉淀溶解平衡实例:虽然溶洞都是十分坚硬的碳酸盐质岩石,但由于长期沉浸在地下水中被溶解,特别是当水中含有二氧化碳时,其溶解速度更加迅速。这样一年又一年,坚硬的岩层就会被溶蚀出一个个洞穴。当溶有石灰质的地下水再次滴入洞中时,由于环境中压力、温度的变化,使水中的二氧化碳逸出,从而降低了水对石灰质的溶解力,这样原本溶解在水中的部分石灰质,会因为过于饱和而沉淀析出,长时间的累积就会形成一根根形态各异的石钟乳、石柱和石笋
难溶电解质在水中的溶解情况(以AgCl的溶解过程作为例子)
在水分子的作用下,少量的Ag+和Cl-脱离AgCl表面进入水中(溶解过程)
沉淀溶解平衡
在水分子的作用下,少量的Ag+和Cl-脱离AgCl表面进入水中(溶解过程);另一方面,溶液中的Ag+和Cl-也会回到AgCl表面析出(沉淀过程)。
沉淀溶解平衡
难溶电解质在水中的溶解情况(以AgCl的溶解过程作为例子)
在一定温度下,当 时,形成AgCl饱和溶液,达到平衡状态
溶解
AgCl(s) Ag+(aq) + Cl-(aq)
沉淀
沉淀溶解平衡
难溶电解质在水中的溶解情况(以AgCl的溶解过程作为例子)
一、 沉淀溶解平衡
1、定义:在一定温度下,当难溶电解质溶于水形成饱和溶液时,难溶电解质溶解成离子的速率等于离子重新结合成沉淀的速率,溶液中各离子的浓度保持不变的状态。此时沉淀达到最大溶解
V沉淀
V
t
V溶解
在饱和NaCl溶液中加入浓盐酸
现象:NaCl饱和溶液中析出固体
解释: 在NaCl的饱和溶液中,存在溶解平衡:NaCl(s) Na+(aq) + Cl-(aq),加浓盐酸Cl- 的浓度增加,平衡向左移,析出NaCl
易溶的电解质的饱和溶液中也同样存在溶解平衡
难溶 ≠ 不溶,绝对不溶的物质是不存在的
一 、沉淀溶解平衡
书写沉淀溶解平衡表达式要标上状态,难溶电解质用“s”,溶液中的离子用“aq”,并用“ ”连接
沉淀溶解平衡表达式:AmBn(s) mAn+(aq)+nBm-(aq)
练习:写出CaCO3, BaSO4 ,Fe(OH)3的沉淀溶解平衡表示式和电离方程式
微溶或难溶的强电解质在水溶液中不存在电离平衡,只存在溶解平衡
微溶或难溶的弱电解质在水溶液中既存在电离平衡,也存在溶解平衡
二、溶度积常数(简称溶度积)
定义:在一定条件下,难溶性电解质形成饱和溶液,达到溶解平衡,其溶解平衡常数叫做溶度积常数或简称溶度积.符号Ksp
Ksp ( AmBn ) =cm ( An+) · cn(Bm-)
写出AgBr、Fe(OH)3的溶解平衡表达式和溶度积表达式
AgBr(s) Ag+(aq) + Br-(aq) Ksp = c(Ag+) . c(Br-)
Fe(OH)3(s) Fe3+(aq) + 3OH- (aq) Ksp = c(Fe3+) . c3(OH-)
化学平衡常数 水的离子积 电离平衡常数 难溶电解质溶度积常数
符号 K KW Ka或Kb Ksp
反应举例 mA(g)+nB(g) pC(g)+qD(g) H2O H++OH- HA A- + H+ MOH M+ + OH- AmBn(s) mAn+(aq)+nBm-(aq)
表达式 K= KW =c(H+)·c(OH-) Kb= Ksp ( AmBn ) =cm ( An+) · cn(Bm-)
适用范围 可逆反应平衡体系 水、酸、碱、盐的稀溶液 弱电解质的电离平衡体系 难溶电解质或易溶的电解质的饱和溶液
影响因素 只与温度有关
吸热反应:T↑,K↑ 放热反应:T↑,K↓ 电离吸热:T↑,KW↑,Ka↑,Kb↑ 绝大多数难溶盐的溶解是吸热过程:T↑,Ksp↑
特例:T↑,KspCa(OH)2↓
规律 遵循平衡移动原理,T不变,K不变
注意 固体和纯液体浓度视为常数,不列入平衡常数的表达式,且带入平衡常数的表达式的数值必须是平衡时的数值
意义 K越大,正反应进行程度越大 KW越大,水的电离程度越大 Ka(或Kb)越大,弱电解质的酸性(或碱性)越大 相同类型的难溶电解质,Ksp越大,溶解度越大
难溶物 Ksp(25℃) c(Mn+)(mol·L-1) 溶解度(g)
CaCO3 5.0×10-9 7.07×10-5 7.1×10-4
AgCl 1.8×10-10 1.34×10-5 1.5×10-4
AgBr 5.4×10-13 7.35×10-7 8.4×10-6
AgI 8.5×10-17 9.23×10-9 2.1×10-7
Ag2CrO4 1.1×10-12 1.30×10-4 2.2×10-3
BaSO4 1.1×10-10 1.05×10-5 2.4×10-4
Ksp 与溶解度的关系:对于同种类型的难溶电解质,Ksp越大,溶解度越大
若为不同类型的难溶电解质,则Ksp与溶解度无此关系
阳离子相同,且都为AB型:Ksp(AgCl)>Ksp(AgBr)>Ksp(AgI)
溶解度:AgCl>AgBr>AgI
特点:Ksp 只与温度有关,绝大多数难溶盐的溶解是吸热过程,升高温度,Ksp↑,平衡向沉淀溶解方向移动
特殊:Ca(OH)2随着温度升高,溶解度降低,Ksp减小,平衡向沉淀生成方向移动
意义:Ksp的大小反映了物质在水中的溶解能力
离子积(浓度商)
AgCl(s) Ag+(aq) + Cl-(aq)
Qc= C(Ag+) C(Cl-) ,Qc称为离子积,其表达式中离子浓度是任意的
(1)Qc > Ksp时:溶液过饱和,平衡向生成沉淀方向移动,有沉淀从溶液中析出,体系中不断析出沉淀,直至达到平衡
(2)Qc = Ksp时:溶液饱和,平衡不移动,沉淀与溶解处于平衡状态,可能有沉淀,可能没有沉淀
(3)Qc < Ksp时:溶液不饱和,无沉淀生成,平衡向溶解方向移动,此时若加入过量难溶电解质,难溶电解质会溶解直至达到平衡
a→c 曲线上变化,增大c(SO42-)
b→c 加入1×10-5mol·L-1Na2SO4溶液(加水不行)
d→c 加入BaCl2固体(忽略溶液的体积变化)
c→a 曲线上变化,增大c(Ba2+)
曲线上方的点表示有沉淀生成;曲线下方的点表示不饱和溶液
已知Ksp(MgCO3)=6.82×10-6(25℃),将4×10-3mol·L-1的MgCl2溶液与4×10-3mol·L-1的Na2CO3溶液等体积混合,此时Mg2+ 和CO32- 能否产生沉淀?
Qc(MgCO3)=c(Mg2+) c(CO32—)
=2×10-3mol·L-1×2×10-3mol·L-1
=4×10-6
25℃时,Ksp[Mg(OH)2]= 5.6×10-12mol3·L-3,求Mg(OH)2 的饱和溶液中的c(Mg2+)和PH值;若往此饱和溶液中滴入无色酚酞则溶液呈什么颜色?
解:设饱和溶液中Mg2+的浓度为X
Ksp=c(Mg2+)c2(OH-)
=X(2X)2= 5.6×10-12mol3·L-3
得 X=1.12×10-4mol·L-1
c(OH-)=2.24×10-4mol·L-1,25℃时,C(H+)=4.46×10-11mol·L-1,PH=10.4
酚酞在pH>10时显红色
判断两者能否生成沉淀:Qc≥Ksp,且所代入的离子浓度一定是混合溶液中的离子浓度
求M(OH)n饱和溶液pH:Ksp ( M(OH)n ) =c ( Mn+) · cn(OH-)
,nc ( Mn+) = c(OH-)
Ksp ( M(OH)n ) =c ( Mn+) ·[nc ( Mn+)]n
②外因:浓度、温度
Mg(OH)2(s) Mg2+ (aq) + 2OH-(aq)
影响沉淀溶解平衡的因素
①内因:电解质本身的性质
改变条件 平衡移动方向 C(Mg2+) C(OH-) 溶解度 Ksp
升高温度 → ↑ ↑ ↑ ↑ T↑,Ksp↑,溶解度↑;Ca(OH)2相反
加水稀释 → 不变 不变 不变 不变 加水稀释c离子:澄清饱和溶液:↓;悬浊液:不变
如无特殊说明,一般认为饱和溶液加水稀释平衡向溶解的方向移动,但离子浓度不变,溶解度不变
MgCl2(s) ← ↑ ↓ ↓ 加入相同离子(同离子效应),平衡向沉淀方向移动,溶解度减小,溶液中析出沉淀
NaOH(s) ← ↓ ↑
HCl(g) → ↑ ↓ ↑ 加入可与体系中离子反应生成更难溶或更难电离或气体的物质,平衡向溶解的方向移动,溶解度增大
NH4Cl(s) → ↑ ↓
Mg(OH)2(s) 平衡不移动 不变 不变 不变 对于饱和溶液,再加入该难溶物固体不再溶解,平衡不移动,溶解度不变
一定温度下,不能再溶解溶质的溶液叫饱和溶液,溶解度S:在一定温度下,某固态物质在100克溶剂里达到饱和状态时所溶解的质量
沉淀溶解平衡的应用
1.沉淀的生成——分离提纯某些离子(1)调节pH法——调pH使杂质形成氢氧化物沉淀而除去
如除去NH4Cl溶液中的FeCl3杂质,可加入氨水调节pH至7~8,离子方程式为:Fe3++3NH3·H2O == Fe(OH)3↓+3NH4+
Cu2+(Fe3+):加Cu2(OH)2CO3、CuO、CuCO3、Cu(OH)2
Mg2+(Fe3+):加Mg粉、MgO、MgCO3、Mg(OH)2
原理:Fe3+ + 3H2O Fe(OH)3 + 3H+,加入物质消耗H+,促进Fe3+水解平衡右移生成沉淀Fe(OH)3而除去
先把Fe2+氧化成Fe3+,然后调pH至3.2-4.7使Fe3+转化为Fe(OH)3 沉淀,过滤除去沉淀。
此题可用:氯气、双氧水、氧气等(不引入杂质)
此题可用:氧化铜、碳酸铜等(不引入杂质)
(1)常用氧化剂:硝酸、高锰酸钾、氯气、氧气、双氧水等
(2)调pH可用:氨水、氢氧化钠、氧化铜、碳酸铜
开始沉淀时的pH 沉淀完全时的pH
Fe3+ 1.9 3.2
Fe2+ 7.0 9.0
Cu2+ 4.7 6.7
腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol/L,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤 。
①通入足量氯气将Fe2+氧化成Fe3+;
②加入CuO调节溶液的pH至3.2-4.7;
③过滤(除去Fe(OH)3)
一般来说,除去溶液中杂质Fe2+,都是先将Fe2+氧化为Fe3+,再加入除杂剂调节pH至3到4将Fe3+转化为Fe(OH)3沉淀而除去
若某溶液中Fe3+和Mg2+的浓度均为0.10 mol/L, 使Fe3+完全沉淀而使Mg2+不沉淀的pH条件是什么 ( Ksp(Fe(OH)3)= 4×10-39 Ksp(Mg(OH)2)= 1.8×10-11)
pOH = 10.8 , pH = 3.2
Mg2+开始沉淀的pH值为:
pOH = 4.9, pH =9.1
因此, 只要控制pH值在3.2 - 9.1之间即可使Fe3+定量沉淀而使Mg2+不沉淀
告诉Ksp,求调节pH范围:对于沉淀溶解平衡:M(OH)n(s) Mn+(aq)+nOH-(aq),Ksp ( M(OH)n ) =c ( Mn+) · cn(OH-)
开始沉淀时的pH求法:c(OH-)=,c(H+)=,从而确定pH
沉淀完全时的pH求法:当该离子的浓度小于1.0×10-5 mol·L-1时,认为已经沉淀完全
c(OH-)= mol·L-1,c(H+)=,从而确定pH
解: Fe(OH)3 Fe3+ + 3OH-
Fe3+ 沉淀完全时的pH为:
已知Ksp(MgCO3)=6.82×10-6(25℃),将6×10-3mol·L-1的MgCl2溶液与8×10-3mol·L-1的Na2CO3溶液等体积混合,此时Mg2+是否完全沉淀?
对于两溶液混合生成沉淀,判断某离子是否完全沉淀(以BaCl2与Na2SO4生成BaSO4为例):若要判断Ba2+是否沉淀完全,先确定能生成沉淀再写出反应判断过量,若Ba2+过量,则算出生成沉淀后剩余c(Ba2+),若其<1.0×10-5 mol·L-1时,则Ba2+已经沉淀完全;若SO42-过量,则算出生成沉淀后剩余c(SO42-),c(Ba2+)=若其<1.0×10-5 mol·L-1时,则Ba2+已经沉淀完全
某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体(NiSO4·7H2O):
溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
金属离子 Ni2+ Al3+ Fe3+ Fe2+
开始沉淀时(c=0.01 mol·L-1)的pH 7.2 3.7 2.2 7.5
沉淀完全时(c=1.0×10-5 mol·L-1)的pH 8.7 4.7 3.2 9.0
(4)利用上述表格数据,计算Ni(OH)2的Ksp=________________________________________________________________________________________________________(列出计算式)。如果“转化”后的溶液中Ni2+浓度为1.0 mol·L-1,则“调pH”应控制的pH范围是________。
告诉沉淀时的pH,求调节pH范围 pH→c(OH-)=
先求M(OH)nKsp:KspM(OH)n=开始沉淀时的Mn+浓度(0.01)×cn(OH-)或KspM(OH)n=完全沉淀时的Mn+浓度(1.0×10-5)×cn(OH-)
杂质完全沉淀pH≤pH<产物开始沉淀pH
(2)沉淀剂法①用沉淀剂Na2S除去废水中的Cu2+、Hg2+,其离子方程式分别为Cu2++S2- == CuS↓、
Hg2++S2- == HgS↓
向1×10-3 mol L-1 的K2CrO4溶液中滴加AgNO3溶液,求开始有Ag2CrO4沉淀生成时的C(Ag+ )= CrO42-沉淀完全时, C(Ag+ )= 已知:Ksp(Ag2CrO4)=9.0×10-13
解:Ag2CrO4 2Ag+ + CrO42-
Ksp = C2(Ag+) · C(CrO42-)
开始沉淀:
CrO42-沉淀完全时的浓度为1.0 ×10-5 mol/L,
故有
②除去某溶液中SO42-,用钡盐而不用钙盐的原因是SO42-与钡盐生成的BaSO4比与钙盐生成的CaSO4更难溶,SO42-剩余的浓度更小
沉淀生成时沉淀剂的选择原则
①使生成沉淀的反应进行得越完全越好(被沉淀离子形成沉淀的Ksp尽可能地小,即沉淀溶解度越小越好)
如除去废水中的Cu2+,可以使Cu2+转化成CuCO3、Cu(OH)2或CuS,依据三者溶解度的大小可知,应选择沉淀剂使废水中的Cu2+转化成溶解度最小的CuS
②不能影响其他离子的存在,由沉淀剂引入溶液的杂质离子要便于除去或不引入新的杂质离子
③同离子效应法
硫酸中c(SO42-) 大,使平衡向沉淀的方向移动
为什么硫酸钡在硫酸中的溶解度比在纯水中小?
将足量AgCl分别加入下列溶液中,AgCl溶解度由大到小的顺序是( )
①20ml0.01mol∕LKCl溶液 ②20ml0.02mol∕LCaCl2溶液
③20ml蒸馏水 ④20ml0.03mol∕LHCl溶液
⑤20ml0.05mol∕L AgNO3溶液
A.①>②>④>③>⑤ B.③>①>④>②>⑤
C.⑤>③>②>①>④ D.③>④>⑤>②>①
B
用等体积的蒸馏水和0.010mol/L稀硫酸洗涤BaSO4沉淀,用水洗涤造成BaSO4的损失量大于用稀硫酸洗涤的损失量
沉淀溶解平衡溶解度问题(饱和溶液)
T↑,溶解度↑;Ca(OH)2相反
加入相同离子(同离子效应),溶解度减小,加入离子浓度↑,溶解度↓
加入可与体系中离子反应生成更难溶或更难电离或气体的物质,溶解度增大,加入反应离子浓度↑,溶解度↑
再加入该难溶物固体或加水稀释,溶解度不变
洗涤沉淀,要用沉淀难溶的溶剂去洗涤
2.沉淀的溶解
根据平衡移动原理,设法不断地移去平衡体系中的相应离子,使平衡向沉淀溶解的方向移动。(1)CaCO3溶于盐酸①过程:CaCO3(s) CO32-(aq)+Ca2+(aq)
HCO3-(aq) H2CO3―→CO2↑+H2O
H+
H+
②解释:溶解过程中CO32-生成CO2气体,c(CO32-)减小,CO32-与Ca2+的离子积Q
Mg(OH)2(s) Mg2+ + 2OH-
2NH4Cl == 2Cl- + 2NH4+
2NH3·H2O
+
步骤 1mLNaCl和10滴AgNO3溶液混合 向所得固液混合物中滴加10滴KI溶液 向新得固液混合物中滴加10滴Na2S溶液
现象 有白色沉淀析出 白色沉淀转化为黄色 黄色沉淀转化为黑色
AgCl
AgI
Ag2S
KI
Na2S
3、沉淀的转化
(1)AgNO3 AgCl AgI Ag2S
NaCl
KI
Na2S
AgNO3 + NaCl == AgCl↓ + NaNO3
AgCl + KI == AgI + KCl
2AgI + Na2S == Ag2S + 2NaI
KI
Na2S
[思考与交流]:从实验中可以得到什么结论?
物质 溶解度/g
AgCl 1.5×10-4
AgI 9.6×10-9
Ag2S 1.3×10-16
实验说明:沉淀可以从溶解度小的向溶解度更小的方向转化,两者差别越大,转化越容易
逆向进行,有何现象
步骤 1mLNa2S 和10滴AgNO3溶液混合 向所得固液混合物中滴加10滴KI溶液 向新得固液混合物中滴加10滴NaCl 溶
现象
有黑色沉淀析出
黑色沉淀没变化
黑色沉淀没变化
转化原理:AgCl(s)→→AgI(s)
解释:AgCl沉淀中加入KI溶液时,溶液中Ag+和I-的Q(AgI)>Ksp(AgI),Ag+与I-生成AgI沉淀,导致AgCl逐渐转化为AgI
I-
2AgI(s) + S2- == Ag2S(s) + 2I-
沉淀转化常数K= = = 若沉淀转化常数K>1×105,则认为反应完全,用“==”连接,例:AgCl + I- == AgI + Cl-;2AgI + S2- == Ag2S + 2I-
(2)ZnS沉淀中滴加CuSO4溶液得到CuS沉淀的离子方程式为ZnS(s)+Cu2+(aq) == CuS(s)+Zn2+(aq) Ksp(ZnS)=1.6×10-24>Ksp(CuS)=6.3×10-36
物质 Ksp
AgCl 1.8×10-10
AgI 8.5×10-17
Ag2S 6.3×10-50
向MgCl2溶液中滴加NaOH溶液
向有白色沉淀的溶液中滴加FeCl3溶液
生成白色沉淀
静置
白色沉淀转变为红褐色
红褐色沉淀析出,溶液变无色
Ksp[Mg(OH)2]>Ksp[Fe(OH)3]
(3)Mg(OH)2转化为Fe(OH)3
分步沉淀
1、定义如果一种溶液中同时含有I-和Cl-,当慢慢滴入AgNO3溶液时,刚开始只生成AgI沉淀;加入的AgNO3到一定量时才出现AgCl沉淀,这种先后沉淀的现象称为分步沉淀。2、原理在含有同浓度I-和Cl-的溶液中,加入AgNO3溶液,之所以AgI沉淀先生成,是因为Ksp(AgI)比Ksp(AgCl)小,假定溶液中c(I-)=c(Cl-)=0.01 mol·L-1,=,Ksp(AgCl)=1.8×10-10,刚开始生成AgI和AgCl沉淀时所需要的Ag+浓度分别是:c(Ag+)AgI== mol·L-1=9.3×10-15 mol·L-1c(Ag+)AgCl== mol·L-1=1.8×10-8 mol·L-1可见沉淀I-所需要的c(Ag+)要小的多,所以AgI先沉淀,继续滴加AgNO3,当c(Ag+)=1.8×10-8 mol·L-1时,AgCl沉淀也开始生成,这时c(I-)、c(Cl-)和c(Ag+)同时平衡:c(Ag+)·c(I-)=Ksp(AgI)=9.3×10-17c(Ag+)·c(Cl-)=Ksp(AgCl)=1.8×10-10两式相除得:==1.9×106如果溶液中c(Cl-)>1.9×106c(I-),向其中滴加AgNO3溶液时,则要先生成AgCl沉淀
判断沉淀的顺序【典例精析】将0.001 mol·L-1 AgNO3溶液逐滴滴入0.001 mol·L-1 KCl和0.001 mol·L-1 K2CrO4的混合溶液中,先产生哪种沉淀?能否分步沉淀?[已知该温度下,Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1.12×10-12]
沉淀转化规律
1、一般来说,溶解度大的沉淀容易转化为溶解度小的沉淀,沉淀的溶解度差别越大,转化越容易
2、当一种试剂能沉淀溶液中的几种离子时,生成沉淀时所需试剂离子浓度越小的越先沉淀(对于同类型且含有相同离子的沉淀,溶度积Ksp越小,沉淀越先生成;若为不同类型沉淀且且含有相同离子的沉淀,则生成沉淀时所需该相同离子浓度越小,越先生成沉淀)
3、Ksp相差不大时,Ksp小的物质可以转化为Ksp大的物质;如Ksp(BaCO3)=5.1×10-9>Ksp(BaSO4)=1.1×10-10,但相差不大可转化:BaSO4 + CO32- BaCO3 + SO42-
在BaSO4的饱和溶液中加入高浓度的Na2CO3溶液,可以生成溶解度较大的 BaCO3沉淀
判断沉淀的转化:根据原沉淀饱和求出相同离子的浓度,带入新沉淀Qc,≥新沉淀Ksp,则能转化
解:在ZnS饱和浓度中:ZnS(s) S2-(aq)+Zn2+(aq)
即c(S2-)=c(Zn2+)=(Ksp)1/2=(1.6×10-24)1/2=1.26×10-12(mol/L)
Qc(CuS)=c(Cu2+)c(S2-)=1.0×10-3×1.26×10-12 =1.26×10-15
Qc(CuS) > Ksp(CuS),所以ZnS沉淀会转化为CuS沉淀
在ZnS沉淀中加入10mL0.001mol/L的CuSO4溶液是否有CuS沉淀生成?已知:Ksp(ZnS)=1.6×10-24 Ksp(CuS)=1.3×10-36
沉淀溶解平衡的应用1.锅炉除垢:用Na2CO3溶液处理,将CaSO4转化为CaCO3,离子方程式为CaSO4(s)+CO32-(aq) CaCO3(s)+SO42-(aq),再加入盐酸或饱和氯化铵溶液除去水垢
涉及反应:CaSO4+CO32- CaCO3+SO42-
CaCO3+2H+ == Ca2++CO2↑+H2O
Mg(OH)2+2H+ == Mg2++2H2O
2.矿物转化:CuSO4溶液遇PbS转化为CuS,离子方程式为Cu2+(aq)+PbS(s) == CuS(s)+Pb2+(aq)
3.医学上常用BaSO4作为内服造影剂“钡餐”,而不用BaCO3作为内服造影剂“钡餐”
已知:人体内胃酸的酸性pH=0.9~1.5,BaSO4 和BaCO3的沉淀溶解平衡分别为:
BaSO4(s) Ba2+(aq) + SO42- (aq) ,BaCO3 (s) Ba2+(aq) + CO32-(aq)
如果服下BaCO3,胃酸会与CO32-反应生成CO2和水,使CO32-浓度降低,使BaCO3的沉淀溶解平衡向右移动,使体内的Ba2+浓度增大而引起人体重金属中毒;而SO42-不与H+结合生成硫酸,胃酸中的H+对BaSO4的溶解平衡没有影响,Ba2+浓度保持在安全浓度标准下,所以用BaSO4 作“钡餐”
龋齿的形成
1. 牙釉质:主要成分为Ca5(PO4)3OH(羟基磷灰石);是一种难溶电解质。
2. 残留在牙齿上的糖发酵会产生H+。
沉淀的溶解
Ca5(PO4)3OH 5Ca2++ 3PO43- + OH-
3H+
3HPO42-
+
+
H+
H2O
龋齿的预防
使用含氟牙膏,氟离子会与 Ca5(PO4)3OH (羟基磷灰石)反应生成Ca5(PO4)3F (氟磷灰石)
Ca5(PO4)3OH+F- Ca5(PO4)3F + OH-
沉淀的转化
4.水滴石穿和钟乳石的形成
石头主要成分是CaCO3,CO2溶于水形成酸性环境,c(CO32-)减小,CaCO3沉淀溶解平衡向溶解方向进行
发生化学反应:CaCO3 +CO2+H2O == Ca(HCO3)2
当溶有Ca(HCO3)2的地下水再次滴入洞中时,由于环境中压力、温度的变化,使水中的二氧化碳逸出,从而转化为CaCO3,Ca(HCO3)2== CaCO3↓ +CO2+H2O,长时间的累积就会形成一根根形态各异的石钟乳、石柱和石笋
沉淀溶解平衡实例:虽然溶洞都是十分坚硬的碳酸盐质岩石,但由于长期沉浸在地下水中被溶解,特别是当水中含有二氧化碳时,其溶解速度更加迅速。这样一年又一年,坚硬的岩层就会被溶蚀出一个个洞穴。当溶有石灰质的地下水再次滴入洞中时,由于环境中压力、温度的变化,使水中的二氧化碳逸出,从而降低了水对石灰质的溶解力,这样原本溶解在水中的部分石灰质,会因为过于饱和而沉淀析出,长时间的累积就会形成一根根形态各异的石钟乳、石柱和石笋
