第5节 物质的溶解(课件 80张ppt)
文档属性
| 名称 | 第5节 物质的溶解(课件 80张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 9.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-02-09 00:00:00 | ||
图片预览








文档简介
(共80张PPT)
第1章
第5节 物质的溶解
学习目标
1.了解不同的物质具有不同的溶解性。
2.知道物质溶解时既可能放出热量,也可能吸收热量。
3.理解饱和溶液的含义;掌握饱和溶液与不饱和溶液之间的转化方法。
4.理解溶解度的意义。
5.会运用溶液中溶质的质量分数公式,能配制一定溶质质量分数的溶液。
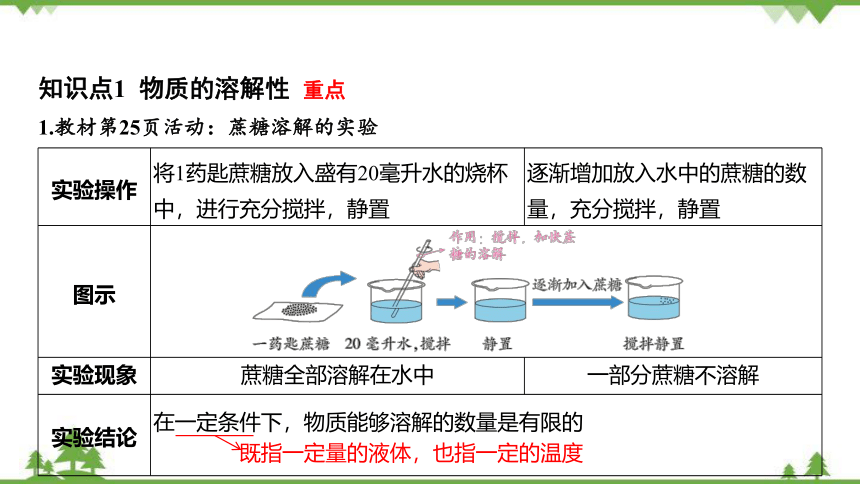
知识点1 物质的溶解性 重点
1.教材第25页活动:蔗糖溶解的实验
实验操作 将1药匙蔗糖放入盛有20毫升水的烧杯中,进行充分搅拌,静置 逐渐增加放入水中的蔗糖的数量,充分搅拌,静置
图示
实验现象 蔗糖全部溶解在水中 一部分蔗糖不溶解
实验结论 在一定条件下,物质能够溶解的数量是有限的 既指一定量的液体,也指一定的温度
2.溶解性的定义:溶解性是指一种物质溶解在另一种物质里的能力。
物质的物理性质
3.教材第25页探究:影响物质溶解性的因素
我们知道,溶液是由溶质和溶剂组成的,不同的溶质在同一种溶剂里的溶解性不同。例如,高锰酸钾易溶于水,而泥沙就难溶于水。
提出问题 还有哪些因素会影响物质的溶解性呢?
实验药品 固体药品选用硫酸铜白色粉末,溶剂选用水、酒精
建立假设 根据已有知识和经验,我们知道一定量的水中只能溶解一定量的硫酸铜。当硫酸铜超过一定量后,总会有一部分不能在该条件下再继续溶解。我们可建立如下假设:(1)将溶液加热,可以使未溶解的硫酸铜继续溶解。(2)换一种溶剂,可以使未溶解的硫酸铜继续溶解。
设计并进行实验 采用控制变量法设计对比实验进行探究
解释数据,表达与交流 要比较不同物质的溶解性,必须在相同的温度、相同的溶剂并且质量也相等的情况下,该溶质不能再继续溶解时进行比较
续表
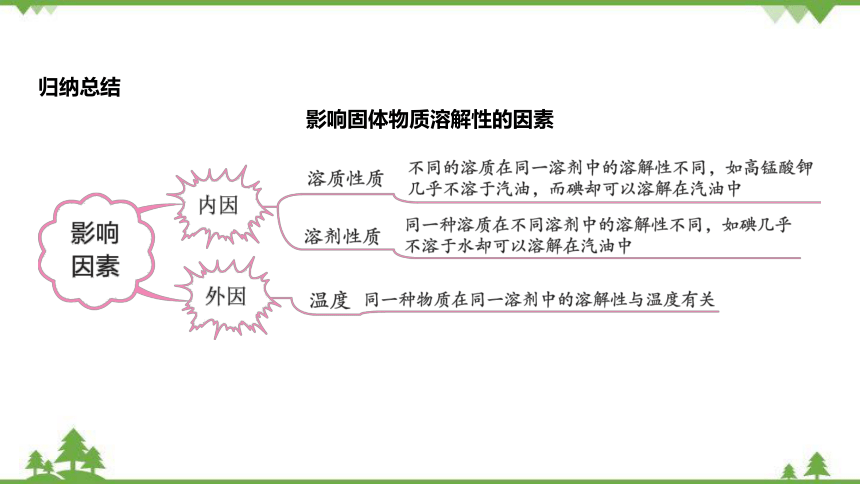
归纳总结
影响固体物质溶解性的因素
典例1 在进行硝酸钾与氯化钠溶解性比较的实验时,下列条件控制合理的是( @1@ )
①温度;②溶质颗粒大小;③溶质质量;④溶剂质量;⑤溶剂种类;⑥是否搅拌
A.①② B.①④⑤ C.①③④⑤ D.①②⑤⑥
B
[解析] 在进行硝酸钾与氯化钠溶解性比较的实验时,需要控制温度相同、溶剂质量相同、溶剂种类相同,根据溶解的最大质量,可以比较硝酸钾与氯化钠溶解性的大小,溶解性与是否搅拌、溶质颗粒大小无关;通过比较溶质在溶液中溶解的最大质量比较溶解性的大小,溶质的质量不需要相同,故①④⑤需要控制。
拓展培优
影响固体物质溶解速率的因素
溶解速率是指一种物质在另一种物质里溶解的快慢,影响固体物质溶解速率的因素如下:
影响因素 影响情况 解释
温度 一般情况下,温度越高,溶质的溶解速率越快 升温能加快溶质和溶剂微粒的运动,使微粒的扩散速率加快
溶质颗粒大小 溶质颗粒越小,溶质的溶解速率越快 溶质颗粒越小,与溶剂接触面积越大,溶质扩散到溶剂中的速率越快,溶质溶解速率越快
搅拌 搅拌可以加快溶质的溶解速率 搅拌可以使溶质微粒的运动速率加快
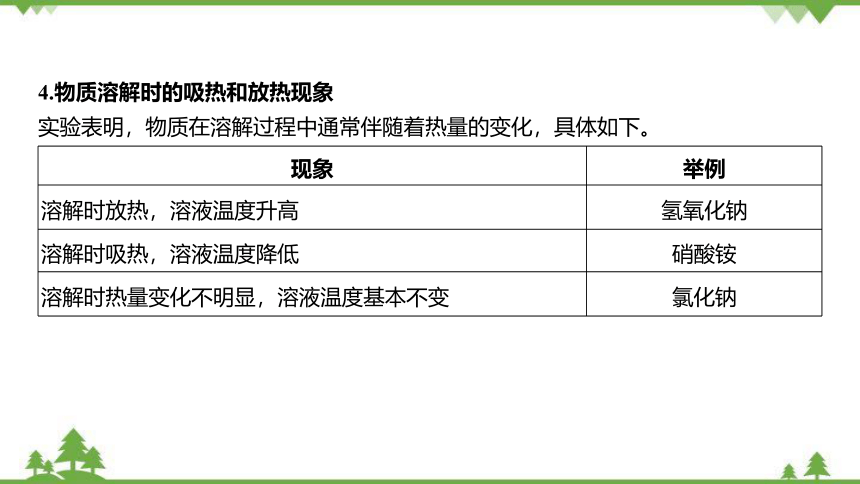
4.物质溶解时的吸热和放热现象
实验表明,物质在溶解过程中通常伴随着热量的变化,具体如下。
现象 举例
溶解时放热,溶液温度升高 氢氧化钠
溶解时吸热,溶液温度降低 硝酸铵
溶解时热量变化不明显,溶液温度基本不变 氯化钠
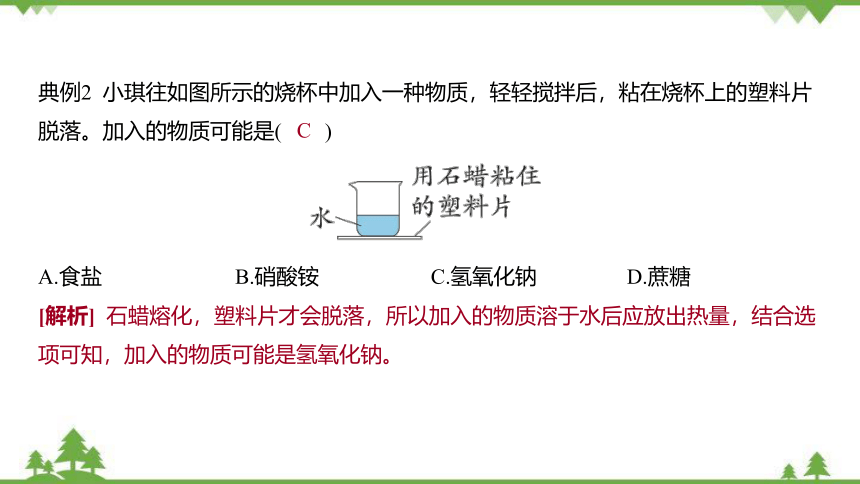
典例2 小琪往如图所示的烧杯中加入一种物质,轻轻搅拌后,粘在烧杯上的塑料片脱落。加入的物质可能是( @3@ )
A.食盐 B.硝酸铵 C.氢氧化钠 D.蔗糖
C
[解析] 石蜡熔化,塑料片才会脱落,所以加入的物质溶于水后应放出热量,结合选项可知,加入的物质可能是氢氧化钠。
知识点2 饱和溶液 重难点
我们已经通过蔗糖溶解的实验知道,在一定的温度下,在一定量的溶剂中,物质能够溶解的量是有限的。
1.饱和溶液与不饱和溶液的定义
饱和溶液 在一定温度下,在一定量的溶剂里不能继续溶解某种溶质的溶液,称为这种溶质的饱和溶液
不饱和溶液 在一定温度下,在一定量的溶剂里还能继续溶解某种溶质的溶液,称为这种溶质的不饱和溶液
对饱和溶液与不饱和溶液的理解
溶液是否饱和具有条件性和暂时性 只有指明“在一定温度下”和“在一定量的溶剂里”,溶液的“饱和”与“不饱和”才有确定的意义。因为当改变温度和溶剂的量时,饱和溶液与不饱和溶液可以相互转化
溶液是否饱和具有相对性 “饱和”与“不饱和”是针对“某种溶质”而言的,因为一定条件下的某物质的饱和溶液,不能继续溶解该物质却可能继续溶解其他物质 示例:在一定条件下,不能继续溶解食盐的溶液,可继续溶解蔗糖,此时的溶液是食盐的饱和溶液,但对蔗糖来说就是不饱和溶液。因此,在说明“饱和”和“不饱和”溶液时,必须指明是哪种溶质的饱和溶液或不饱和溶液
不存在酒精的饱和水溶液 一定温度下,大多数物质在一定量的溶剂中都能形成其饱和溶液,但酒精能与水以任意比例互溶,所以不存在酒精的饱和水溶液
2.判断溶液是否饱和的方法
注意:溶液中没有固态溶质存在,溶液可能饱和,也可能不饱和。
3.饱和溶液与不饱和溶液的相互转化
饱和溶液与不饱和溶液在一定条件下可以相互转化,大多数固体物质的饱和溶液与不饱和溶液的转化关系如下:
说明
一般性 上述转化关系对大多数固体物质来说是适用的,因为大多数固体物质在一定量水中溶解的最大量随温度的升高而增大,随温度的降低而减小
特殊性 氢氧化钙在一定量的水中溶解的最大量随温度的升高而减小,因此,若把氢氧化钙的不饱和溶液转化为饱和溶液,在改变温度时应是升高温度,若把其饱和溶液转化为不饱和溶液,在改变温度时应是降低温度
4.浓溶液和稀溶液:为粗略地表示溶液中溶质含量的多少,常把溶液分为浓溶液和稀溶液。浓溶液和稀溶液是一组相对概念。在一定量的溶液中含溶质的量相对较多的是浓溶液,含溶质的量相对较少的是稀溶液。
易混辨析
饱和溶液、不饱和溶液与浓溶液、稀溶液的关系
饱和溶液与不饱和溶液 浓溶液与稀溶液
区别 含义不同 溶液是否饱和取决于溶质在一定温度下、一定量溶剂里的含量是否达到最大限度 溶液的浓与稀取决于溶质在一定量的溶液里含量的相对多少
温度影响 受温度影响,必须指明温度 与温度无关
饱和溶液与不饱和溶液 浓溶液与稀溶液
关系 (1)溶液的饱和和不饱和与溶液的浓和稀没有必然 的关系。 (2)饱和溶液不一定是浓溶液,不饱和溶液不一定 是稀溶液;浓溶液不一定是饱和溶液,稀溶液不一定 是不饱和溶液。 (3)在相同温度下,同种溶剂、同种溶质的饱和溶液 要比其不饱和溶液的浓度大
续表
典例3 下列有关溶液(溶剂为水)的说法正确的是( @5@ )
A.一定温度下,一定量溶剂里某溶质的饱和溶液一定是浓溶液
B.一定温度下,同种溶质的饱和溶液一定是稀溶液
C.一定温度下,一定量溶剂里某溶质的不饱和溶液一定是稀溶液
D.一定温度下,同种溶质的饱和溶液可能是浓溶液
D
例题点拨
不能根据溶液的饱和与不饱和判断溶液的浓与稀,两者之间没有必然联系。
知识点3 物质的溶解度 重难点
1.溶解度:在相同的条件下,不同物质的溶解性是不同的。我们通常用溶解度来定量地表示物质的溶解性。
(1)溶解度的概念:在一定的温度下,某物质在100克溶剂中达到饱和状态时所溶解的质量为该物质在这种溶剂里的溶解度。溶解度越大,表明该温度下物质的溶解性越强。
如果不指明溶剂,通常所说的溶解度是指物质在水里的溶解度
(2)溶解度概念中的“四要素”
四要素 解释
条件 在一定温度下 物质的溶解度会随温度的变化而变化,不指明温度时,溶解度没有意义
标准 在100克溶剂里 这是概念中规定的标准,物质溶解量的多少与溶剂量的多少成正比,要比较物质溶解度的大小,必须要设定等量的溶剂
状态 达到饱和状态 只有在一定量(100克)溶剂中,溶液达到饱和状态(溶解溶质的量最大)时,所溶解的溶质的量才是一个确定的值,这个值能够代表该物质在确定温度下,溶解能力的强弱
单位 以“克”为单位 溶解度实质上是100克溶剂中溶解溶质的最大质量
(3)溶解度的含义
含义 示例
某物质在一定温度下的溶解度是指该物质在该温度下,在100克溶剂里达到饱和状态时所溶解的质量
通过溶解度可得到该温度下的该物质的饱和溶液中,溶质、溶剂和饱和溶液之间的质量关系,即溶质、溶剂和饱和溶液三者质量之比为溶解度 :100 克 : (100克+溶解度) 20℃ 时,氯化钠的溶解度为36克,则在 20℃ 时,任意质量的氯化钠饱和溶液中,氯化钠、水、氯化钠饱和溶液三者的质量之比为 36:100:136
A
2.溶解度与溶解性的关系
(1)溶解度与溶解性:溶解度是衡量某种物质在某种溶剂里溶解性大小的尺度,是溶解性的定量表示方法;溶解性只是定性地说明某种物质在某种溶剂里溶解能力的大小,是物质的一种物理性质。
溶解性 难溶(不溶) 微溶 可溶 易溶
举例 氯化银、碳酸钙 氢氧化钙 氯酸钾 硝酸钾、氯化钠
(2)溶解度与溶解性的关系
注意:绝对不溶于水的物质是不存在的,习惯上把难溶物质叫做“不溶”物质。
3.溶解度随温度变化的情况
许多物质的溶解度随温度的变化而变化,举例如下:
硝酸钾在不同温度时的溶解度
0 10 20 30 40 50 60 70 80 90 100
溶解度/克 13.3 20.9 31.6 45.8 63.9 85.5 110 138 169 202 246
氢氧化钙在不同温度时的溶解度
0 20 40 100
溶解度/克 0.173 0.165 0.121 0.076
归纳总结
大部分固体物质的溶解度随温度的升高而增大,个别固体物质的溶解度随温度的升高而减小。气体物质的溶解度随温度的升高而减小。
拓展
气体溶解度
2.气体溶解度的影响因素:
(1)内因为气体和溶剂的性质。
(2)外因为温度和压强。气体的溶解度随温度升高(或降低)而减小(或增大),随压强增大(或减小)而增大(或减小)。
典例5 氯化钾与硝酸钾在不同温度时的溶解度数据如下表所示,下列说法正确的是
( @9@ )
10 20 30 40 50
氯化钾/克 31.2 34.2 37.2 40.1 42.6
硝酸钾/克 20.9 31.6 45.8 63.9 85.5
B
[解析]
选项 分析 结论
未指明温度,不能比较两物质的溶解度大小 ×
√
硝酸钾的溶解度随温度的升高而增大,故升高温度不可以使接近饱和的硝酸钾溶液变饱和 ×
×
拓展培优
溶解度曲线
(1)溶解度曲线的绘制
概况 用横坐标表示温度,纵坐标表示溶解度,根据实验测得的某物质在不同温度下的溶解度数据,在直角坐标系上描点并用平滑的曲线连接起来,即可绘制出溶解度随温度变化的曲线,这种曲线叫做溶解度曲线
内容 表示意义
点 曲线上的点 表示某物质在该点对应温度下的溶解度
两曲线的交点 表示两物质在该点对应温度下的溶解度相等
线 表示某物质在不同温度下的溶解度以及溶解度随温度的变化规律
示例
续表
知识点4 溶液的配制 重难点
1.溶质质量分数
概念 溶质的质量分数是指溶液中溶质的质量与溶液的质量之比,通常用小数或百分数表示
公式
意义 溶质的质量分数越大,溶液中的溶质相对含量就越大,溶液的浓度也越大
特别提醒
D
[解析]
选项 分析 结论
×
×
温度升高,氯化铵的溶解度增大,所以溶液的溶质质量分数会变大 ×
若加水使烧杯中的固体全部溶解,当溶液恰好饱和时,则溶液的溶质质量分数不变,当溶液变成不饱和溶液时,则溶液的溶质质量分数减小 √
2.有关溶质质量分数的计算
类型(1) 已知溶质和溶剂的质量或溶质和溶液的质量,求溶质的质量分数
计算依据
关于溶质质量分数的计算有以下四种类型:
典例7 从一瓶氯化钾溶液中取出20克溶液。蒸干后得到2.8克氯化钾固体,则这瓶溶液中溶质的质量分数是多少?
类型(2) 计算配制一定溶质的质量分数的溶液所需溶质和溶剂的质量
计算依据
类型(3) 溶解度与此温度下饱和溶液中溶质的质量分数的计算
计算依据
类型(4) 溶液稀释或浓缩和配制问题的计算
计算依据 抓住溶液稀释或浓缩前后,溶质的质量总是不变,即浓溶液的质量×浓溶液中溶质的质量分数=稀溶液的质量×稀溶液中溶质的质量分数
密度/(克/毫升) 1.01 1.07 1.14 1.22 1.30 1.40 1.50 1.61 1.73 1.81 1.84
1 10 20 30 40 50 60 70 80 90 98
3.教材第30页活动:配制一定溶质质量分数的溶液
实验目的
实验仪器 托盘天平、烧杯、量筒、玻璃棒、药匙
实验步骤 计算
称量和量取 用托盘天平称量5克氯化钠,放入烧杯中。用量筒量取45毫升水
实验步骤 溶解 将用量筒量取的水,倒入盛有氯化钠的烧杯中,用玻璃棒搅拌。待氯化钠完全溶解
图示
续表
误差原因 影响
溶质的质量 溶剂的质量 溶质的质量分数
药品含杂质 偏小 不变 偏小
误差原因 影响
溶质的质量 溶剂的质量 溶质的质量分数
称量 药品与砝码放反 未使用游码 不变 不变 不变
使用游码 偏小 不变 偏小
称量前天平未调平衡 指针偏右 偏大 不变 偏大
指针偏左 偏小 不变 偏小
砝码生锈(未脱落) 偏大 不变 偏大
量取 仰视读数 不变 偏大 偏小
俯视读数 不变 偏小 偏大
续表
误差原因 影响
溶质的质量 溶剂的质量 溶质的质量分数
溶解 称量好的溶质未全部转移至烧杯中 偏小 不变 偏小
往烧杯中倒水时,有少量水溅出 不变 偏小 偏大
溶解用的烧杯未干燥 不变 偏大 偏小
装瓶 少量溶液溅出 同比例减小 不变
试剂瓶事先用水洗涤,未干燥 不变 偏大 偏小
续表
(1) 正确配制该溶液的操作顺序为_____________(用图中序号表示)。
③②④⑤①
(2) 用托盘天平称量所需的氯化钠时,发现托盘天平的指针偏向左盘,应_@20@___(填字母)。
A.适量增加氯化钠固体 B.适量减少氯化钠固体
C.调节游码 D.添加砝码
B
(4) 对配制的溶液进行检测时发现溶质的质量分数偏小,原因可能是_@24@_____(填字母)。
A.称量时,药品与砝码放反了
B.量取水的体积时,仰视读数
C.装瓶时,有少量液体洒出
AB
40
10
(3) 溶解过程中,玻璃棒的作用是_________________。
搅拌,加速溶解
(2) 托盘天平指针偏向左盘,说明左盘物体偏重,应适量减少氯化钠固体。
(3)略。
[解析] (1)正确操作顺序:取出药品,称量药品,放入烧杯中,量取水倒入烧杯中,利用玻璃棒搅拌使药品溶解。
题型1 物质的溶解性及其影响因素
角度1 对物质溶解性的理解 ★★
典例12 下列对物质的溶解性的描述中,错误的是( @28@ )
A.在一定条件下,物质能够溶解的数量是有限的
B.相同条件下,不同物质的溶解能力是不同的
C.气体也能溶解在液体中,且温度越高,气体溶解能力越强
D.物质的溶解性是指一种物质在另一种物质中的溶解能力
C
角度2 物质溶解性影响因素的确定 ★★★
典例13 为了探究影响物质溶解性的因素,设计了如表所示的实验方案,该实验无法探究的因素是( @30@ )
实验序号 溶质 溶剂 温度
1 蔗糖 水
2 蔗糖 水
3 食盐 水
4 食盐 植物油
A.溶质种类 B.溶剂种类 C.温度 D.颗粒粗细
D
[解析]
对比实验 实验变量 实验目的
1和2 温度 探究温度对物质溶解性的影响
2和3 溶质种类 探究溶质种类对物质溶解性的影响
3和4 溶剂种类 探究溶剂种类对物质溶解性的影响
易知实验中没有颗粒粗细这一变量,因此该实验无法探究颗粒粗细对物质溶解性的影响。
角度3 物质溶解性影响因素的探究实验 ★★★★
典例14 为了探究相同条件下同种溶质在不同溶剂中的溶解性,某兴趣小组进行了如下实验。(提示:本实验中汽油与碘不发生化学反应;碘溶于汽油,溶液呈紫红色)
(1)图丙所示的试管中液体分层,上层紫红色溶液的名称是_______________;由图乙、丙可知,碘在汽油中的溶解性比在水中_____(选填“强”或“弱”)。
碘的汽油溶液
强
[解析] (1)碘溶于汽油得到碘的汽油溶液;对比图乙、丙可知,碘在汽油中的溶解性比在水中强。
(2)碘易溶于酒精。若实验中汽油用酒精代替,振荡后静置,最终所得液体_________(选填“分层”或“不分层”)。
不分层
(2)酒精和水可以互溶,用酒精代替汽油,最终所得液体不会出现分层现象。
题型2 饱和溶液与不饱和溶液
角度1 对饱和溶液与不饱和溶液概念的理解(易错) ★★★
典例15 下列关于饱和溶液的说法中,正确的是( @38@ )
A.在一定温度下,向硝酸钾饱和溶液中加硝酸钾固体,溶液质量增大
B.饱和溶液是指在任何条件下都不能再溶解同种溶质的溶液
C.在一定温度下,饱和的氯化钠溶液中不能再溶解其他物质
D.改变条件,可以使硝酸钾的不饱和溶液变成饱和溶液
D
[解析]
选项 分析 结论
×
某溶质的饱和溶液是指在一定温度下,一定量的溶剂中不能继续溶解原溶质的溶液,若温度、溶剂的量发生改变,饱和溶液可能变成不饱和溶液,可继续溶解原溶质 ×
饱和溶液是一定条件下某物质的饱和溶液,对其他物质来讲,可能是不饱和溶液,如在一定温度下,饱和的氯化钠溶液中能再溶解蔗糖 ×
增加硝酸钾固体、降低温度或蒸发溶剂都可将硝酸钾的不饱和溶液变成饱和溶液 √
变式训练
1.“对比实验”是科学探究的重要方法,根据下列所示的实验示意图回答问题。
溶剂的种类(或溶剂的性质)
溶质的种类(或溶质的性质)
角度2 饱和溶液与不饱和溶液的判断 ★★★
典例16 (原创题)北京2022年冬奥会和冬残奥会主题口号是“一起向未来”。“一起向未来”是态度、是倡议、更是行动方案,倡导追求团结、和平、进步、包容的共同目标,是更快、更高、更强、更团结的奥林匹克精神的中国宣扬,表达了世界需要携手走向美好未来的共同愿望。小科是北京冬奥会的一名志愿者,每天回家后总会给自己制备一杯白糖水喝。下列操作或现象能说明糖水一定是饱和溶液的是( @44@ )
A.制备白糖水时进行了充分搅拌 B.糖水热的时候白糖全部溶解
C.凉的糖水中有剩余的白糖 D.喝糖水时感到很甜
C
[解析] 凉的糖水中有剩余的白糖,说明此时水中能溶解的白糖已经达到了最大限度,能说明糖水一定是饱和溶液。
方法点拨
判断溶液为饱和溶液的依据
(1)溶液底部有溶质剩余,且不再减少。
(2)往溶液中加溶质,溶质不再减少。
二者均能作为判定一定条件下的溶液为饱和溶液的依据。
角度3 饱和溶液与不饱和溶液的相互转化 ★★
典例17 欲使某物质的不饱和溶液转化为饱和溶液,最可靠的方法是( @46@ )
A.升高温度 B.降低温度 C.再加入该溶质 D.倒出一些液体
C
方法点拨
“增加溶质,没有限制”
将不饱和溶液转化为饱和溶液,最简单的方法是增加原溶质,且该方法适用于任何溶液。
角度4 浓溶液、稀溶液与饱和溶液、不饱和溶液的关系 ★★★
D
易错警示
(1)误认为饱和溶液是浓溶液,不饱和溶液是稀溶液:溶液的浓与稀取决于溶质在一定量的溶液里含量多少;溶液是否饱和取决于溶质在一定温度下、一定量溶剂里能否继续溶解;饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液。
(2)误认为同种溶质的饱和溶液一定比不饱和溶液浓:同种溶质的饱和溶液比不饱和溶液浓有两个前提条件,一是相同温度下,二是溶剂相同(与溶剂质量多少无关)。
题型3 物质溶解时的吸、放热现象 ★★
典例19 [2022·杭州滨江区期中] 小明课外自制了一个化学“冰箱”,如图所示。当水袋破裂时,水与固体碎块混合,箱内食物温度明显下降,制造此化学冰箱的固体碎块可选用( @50@ )
A.硝酸铵 B.食盐 C.蔗糖 D.氢氧化钠
A
[解析] 由水与固体碎块混合,箱内食物温度明显下降知,该固体溶于水时吸热,结合选项可知,A正确。
知识回顾
现象 举例
溶于水放热 氢氧化钠,浓硫酸等
溶于水吸热 硝酸铵等
溶于水热量变化不明显 食盐、蔗糖等
题型4 溶解度及其相关计算
角度1 溶解度的概念及含义 ★★★
典例20 [2022·丽水期中] 下表是不同温度下硝酸钾在水中的溶解度,下列有关说法正确的是( @52@ )
0 20 40 60 80 100
溶解度/克 13.3 31.6 63.9 110 169 246
C
[解析]
选项 分析 结论
×
×
√
没有说明水的质量,也没有说明溶液是否饱和,无法比较 ×
归纳总结
(1)理解固体物质溶解度的概念,必须明确四要素,缺一不可,四要素简记为“定温、定量、定状态、定单位”。
(2)固体物质的溶解度受溶质性质、溶剂性质和温度的影响,与溶质多少无关。
变式训练
D
角度2 有关溶解度的计算 ★★★★
A
角度3 溶解度曲线的意义(培优) ★★★★★
典例22 如图是甲、乙、丙三种物质的溶解度曲线,下列说法正确的是( @58@ )
D
[解析]
选项 分析 结论
比较不同物质的溶解度大小时,要指明温度,否则没有意义 ×
×
×
√
方法点拨
溶解度曲线的“两看”
一看点 溶解度曲线上的点表示对应温度下该物质的溶解度,可定量判断溶液是否饱和,两曲线的交点可表示对应温度下两溶质的溶解度相等
二看线 溶解度曲线表示溶解度随温度变化的规律,可由温度的变化判断溶解度的变化,进而分析溶液的变化(饱和溶液与不饱和溶液之间的转化)
易错警示
通过分析溶解度曲线进行解题时,需注意以下几点:
(1)比较溶解度大小需指明温度;
(2)利用溶解度比较析出固体质量的多少需指明是等质量的饱和溶液。
题型5 溶质质量分数的计算与应用
角度1 判断溶质质量分数的变化情况 ★★★★
典例23 [杭州中考] 如图所示为蒸发氯化钠溶液的实验过程,其中①→②→③为恒温蒸发过程,③→④为升温蒸发过程,②溶液恰好为饱和状态,分析实验过程,可以作出的正确判断是( @60@ )
D
A.在①→②过程中,氯化钠的质量分数保持不变
B.在②→③过程中,氯化钠的溶解度不断增大
C.在③→④过程中,水的质量分数不断增大
D.在②→④过程中,氯化钠的质量分数先不变后增大
方法点拨
角度2 溶质质量分数的计算(易错) ★★★
A
易错警示
角度3 配制一定溶质质量分数的溶液 ★★★
(1) 计算:需要氯化钠的质量为_______。
量筒
搅拌,加速固体溶解
(4) 用已调节平衡的天平称固体时,发现指针偏右,接下来的操作是_____________。
继续添加固体
(4)发现指针偏右,说明砝码重,也就是药品少,所以要加药品;
(2)略。提示:使用托盘天平时应左物右码,量筒读数时应使视线与凹液面的最低处保持水平;
(5) 反思:若称取的氯化钠中含有水分,则所配制的溶液中的溶质质量分数会_______;若量水时仰视读数,则所配制的溶液中的溶质质量分数会_______。(选填“偏大”“偏小”或“无影响”)
偏小
偏小
(5)若称取的氯化钠中含有水分,则氯化钠的实际质量偏小,所以所配制的溶液中溶质的质量分数会偏小,若仰视读数,则量取的水偏多,而溶质的质量不变,溶液的质量增加,所以所配制的溶液中的溶质质量分数会偏小。
变式训练
B
第1章
第5节 物质的溶解
学习目标
1.了解不同的物质具有不同的溶解性。
2.知道物质溶解时既可能放出热量,也可能吸收热量。
3.理解饱和溶液的含义;掌握饱和溶液与不饱和溶液之间的转化方法。
4.理解溶解度的意义。
5.会运用溶液中溶质的质量分数公式,能配制一定溶质质量分数的溶液。
知识点1 物质的溶解性 重点
1.教材第25页活动:蔗糖溶解的实验
实验操作 将1药匙蔗糖放入盛有20毫升水的烧杯中,进行充分搅拌,静置 逐渐增加放入水中的蔗糖的数量,充分搅拌,静置
图示
实验现象 蔗糖全部溶解在水中 一部分蔗糖不溶解
实验结论 在一定条件下,物质能够溶解的数量是有限的 既指一定量的液体,也指一定的温度
2.溶解性的定义:溶解性是指一种物质溶解在另一种物质里的能力。
物质的物理性质
3.教材第25页探究:影响物质溶解性的因素
我们知道,溶液是由溶质和溶剂组成的,不同的溶质在同一种溶剂里的溶解性不同。例如,高锰酸钾易溶于水,而泥沙就难溶于水。
提出问题 还有哪些因素会影响物质的溶解性呢?
实验药品 固体药品选用硫酸铜白色粉末,溶剂选用水、酒精
建立假设 根据已有知识和经验,我们知道一定量的水中只能溶解一定量的硫酸铜。当硫酸铜超过一定量后,总会有一部分不能在该条件下再继续溶解。我们可建立如下假设:(1)将溶液加热,可以使未溶解的硫酸铜继续溶解。(2)换一种溶剂,可以使未溶解的硫酸铜继续溶解。
设计并进行实验 采用控制变量法设计对比实验进行探究
解释数据,表达与交流 要比较不同物质的溶解性,必须在相同的温度、相同的溶剂并且质量也相等的情况下,该溶质不能再继续溶解时进行比较
续表
归纳总结
影响固体物质溶解性的因素
典例1 在进行硝酸钾与氯化钠溶解性比较的实验时,下列条件控制合理的是( @1@ )
①温度;②溶质颗粒大小;③溶质质量;④溶剂质量;⑤溶剂种类;⑥是否搅拌
A.①② B.①④⑤ C.①③④⑤ D.①②⑤⑥
B
[解析] 在进行硝酸钾与氯化钠溶解性比较的实验时,需要控制温度相同、溶剂质量相同、溶剂种类相同,根据溶解的最大质量,可以比较硝酸钾与氯化钠溶解性的大小,溶解性与是否搅拌、溶质颗粒大小无关;通过比较溶质在溶液中溶解的最大质量比较溶解性的大小,溶质的质量不需要相同,故①④⑤需要控制。
拓展培优
影响固体物质溶解速率的因素
溶解速率是指一种物质在另一种物质里溶解的快慢,影响固体物质溶解速率的因素如下:
影响因素 影响情况 解释
温度 一般情况下,温度越高,溶质的溶解速率越快 升温能加快溶质和溶剂微粒的运动,使微粒的扩散速率加快
溶质颗粒大小 溶质颗粒越小,溶质的溶解速率越快 溶质颗粒越小,与溶剂接触面积越大,溶质扩散到溶剂中的速率越快,溶质溶解速率越快
搅拌 搅拌可以加快溶质的溶解速率 搅拌可以使溶质微粒的运动速率加快
4.物质溶解时的吸热和放热现象
实验表明,物质在溶解过程中通常伴随着热量的变化,具体如下。
现象 举例
溶解时放热,溶液温度升高 氢氧化钠
溶解时吸热,溶液温度降低 硝酸铵
溶解时热量变化不明显,溶液温度基本不变 氯化钠
典例2 小琪往如图所示的烧杯中加入一种物质,轻轻搅拌后,粘在烧杯上的塑料片脱落。加入的物质可能是( @3@ )
A.食盐 B.硝酸铵 C.氢氧化钠 D.蔗糖
C
[解析] 石蜡熔化,塑料片才会脱落,所以加入的物质溶于水后应放出热量,结合选项可知,加入的物质可能是氢氧化钠。
知识点2 饱和溶液 重难点
我们已经通过蔗糖溶解的实验知道,在一定的温度下,在一定量的溶剂中,物质能够溶解的量是有限的。
1.饱和溶液与不饱和溶液的定义
饱和溶液 在一定温度下,在一定量的溶剂里不能继续溶解某种溶质的溶液,称为这种溶质的饱和溶液
不饱和溶液 在一定温度下,在一定量的溶剂里还能继续溶解某种溶质的溶液,称为这种溶质的不饱和溶液
对饱和溶液与不饱和溶液的理解
溶液是否饱和具有条件性和暂时性 只有指明“在一定温度下”和“在一定量的溶剂里”,溶液的“饱和”与“不饱和”才有确定的意义。因为当改变温度和溶剂的量时,饱和溶液与不饱和溶液可以相互转化
溶液是否饱和具有相对性 “饱和”与“不饱和”是针对“某种溶质”而言的,因为一定条件下的某物质的饱和溶液,不能继续溶解该物质却可能继续溶解其他物质 示例:在一定条件下,不能继续溶解食盐的溶液,可继续溶解蔗糖,此时的溶液是食盐的饱和溶液,但对蔗糖来说就是不饱和溶液。因此,在说明“饱和”和“不饱和”溶液时,必须指明是哪种溶质的饱和溶液或不饱和溶液
不存在酒精的饱和水溶液 一定温度下,大多数物质在一定量的溶剂中都能形成其饱和溶液,但酒精能与水以任意比例互溶,所以不存在酒精的饱和水溶液
2.判断溶液是否饱和的方法
注意:溶液中没有固态溶质存在,溶液可能饱和,也可能不饱和。
3.饱和溶液与不饱和溶液的相互转化
饱和溶液与不饱和溶液在一定条件下可以相互转化,大多数固体物质的饱和溶液与不饱和溶液的转化关系如下:
说明
一般性 上述转化关系对大多数固体物质来说是适用的,因为大多数固体物质在一定量水中溶解的最大量随温度的升高而增大,随温度的降低而减小
特殊性 氢氧化钙在一定量的水中溶解的最大量随温度的升高而减小,因此,若把氢氧化钙的不饱和溶液转化为饱和溶液,在改变温度时应是升高温度,若把其饱和溶液转化为不饱和溶液,在改变温度时应是降低温度
4.浓溶液和稀溶液:为粗略地表示溶液中溶质含量的多少,常把溶液分为浓溶液和稀溶液。浓溶液和稀溶液是一组相对概念。在一定量的溶液中含溶质的量相对较多的是浓溶液,含溶质的量相对较少的是稀溶液。
易混辨析
饱和溶液、不饱和溶液与浓溶液、稀溶液的关系
饱和溶液与不饱和溶液 浓溶液与稀溶液
区别 含义不同 溶液是否饱和取决于溶质在一定温度下、一定量溶剂里的含量是否达到最大限度 溶液的浓与稀取决于溶质在一定量的溶液里含量的相对多少
温度影响 受温度影响,必须指明温度 与温度无关
饱和溶液与不饱和溶液 浓溶液与稀溶液
关系 (1)溶液的饱和和不饱和与溶液的浓和稀没有必然 的关系。 (2)饱和溶液不一定是浓溶液,不饱和溶液不一定 是稀溶液;浓溶液不一定是饱和溶液,稀溶液不一定 是不饱和溶液。 (3)在相同温度下,同种溶剂、同种溶质的饱和溶液 要比其不饱和溶液的浓度大
续表
典例3 下列有关溶液(溶剂为水)的说法正确的是( @5@ )
A.一定温度下,一定量溶剂里某溶质的饱和溶液一定是浓溶液
B.一定温度下,同种溶质的饱和溶液一定是稀溶液
C.一定温度下,一定量溶剂里某溶质的不饱和溶液一定是稀溶液
D.一定温度下,同种溶质的饱和溶液可能是浓溶液
D
例题点拨
不能根据溶液的饱和与不饱和判断溶液的浓与稀,两者之间没有必然联系。
知识点3 物质的溶解度 重难点
1.溶解度:在相同的条件下,不同物质的溶解性是不同的。我们通常用溶解度来定量地表示物质的溶解性。
(1)溶解度的概念:在一定的温度下,某物质在100克溶剂中达到饱和状态时所溶解的质量为该物质在这种溶剂里的溶解度。溶解度越大,表明该温度下物质的溶解性越强。
如果不指明溶剂,通常所说的溶解度是指物质在水里的溶解度
(2)溶解度概念中的“四要素”
四要素 解释
条件 在一定温度下 物质的溶解度会随温度的变化而变化,不指明温度时,溶解度没有意义
标准 在100克溶剂里 这是概念中规定的标准,物质溶解量的多少与溶剂量的多少成正比,要比较物质溶解度的大小,必须要设定等量的溶剂
状态 达到饱和状态 只有在一定量(100克)溶剂中,溶液达到饱和状态(溶解溶质的量最大)时,所溶解的溶质的量才是一个确定的值,这个值能够代表该物质在确定温度下,溶解能力的强弱
单位 以“克”为单位 溶解度实质上是100克溶剂中溶解溶质的最大质量
(3)溶解度的含义
含义 示例
某物质在一定温度下的溶解度是指该物质在该温度下,在100克溶剂里达到饱和状态时所溶解的质量
通过溶解度可得到该温度下的该物质的饱和溶液中,溶质、溶剂和饱和溶液之间的质量关系,即溶质、溶剂和饱和溶液三者质量之比为溶解度 :100 克 : (100克+溶解度) 20℃ 时,氯化钠的溶解度为36克,则在 20℃ 时,任意质量的氯化钠饱和溶液中,氯化钠、水、氯化钠饱和溶液三者的质量之比为 36:100:136
A
2.溶解度与溶解性的关系
(1)溶解度与溶解性:溶解度是衡量某种物质在某种溶剂里溶解性大小的尺度,是溶解性的定量表示方法;溶解性只是定性地说明某种物质在某种溶剂里溶解能力的大小,是物质的一种物理性质。
溶解性 难溶(不溶) 微溶 可溶 易溶
举例 氯化银、碳酸钙 氢氧化钙 氯酸钾 硝酸钾、氯化钠
(2)溶解度与溶解性的关系
注意:绝对不溶于水的物质是不存在的,习惯上把难溶物质叫做“不溶”物质。
3.溶解度随温度变化的情况
许多物质的溶解度随温度的变化而变化,举例如下:
硝酸钾在不同温度时的溶解度
0 10 20 30 40 50 60 70 80 90 100
溶解度/克 13.3 20.9 31.6 45.8 63.9 85.5 110 138 169 202 246
氢氧化钙在不同温度时的溶解度
0 20 40 100
溶解度/克 0.173 0.165 0.121 0.076
归纳总结
大部分固体物质的溶解度随温度的升高而增大,个别固体物质的溶解度随温度的升高而减小。气体物质的溶解度随温度的升高而减小。
拓展
气体溶解度
2.气体溶解度的影响因素:
(1)内因为气体和溶剂的性质。
(2)外因为温度和压强。气体的溶解度随温度升高(或降低)而减小(或增大),随压强增大(或减小)而增大(或减小)。
典例5 氯化钾与硝酸钾在不同温度时的溶解度数据如下表所示,下列说法正确的是
( @9@ )
10 20 30 40 50
氯化钾/克 31.2 34.2 37.2 40.1 42.6
硝酸钾/克 20.9 31.6 45.8 63.9 85.5
B
[解析]
选项 分析 结论
未指明温度,不能比较两物质的溶解度大小 ×
√
硝酸钾的溶解度随温度的升高而增大,故升高温度不可以使接近饱和的硝酸钾溶液变饱和 ×
×
拓展培优
溶解度曲线
(1)溶解度曲线的绘制
概况 用横坐标表示温度,纵坐标表示溶解度,根据实验测得的某物质在不同温度下的溶解度数据,在直角坐标系上描点并用平滑的曲线连接起来,即可绘制出溶解度随温度变化的曲线,这种曲线叫做溶解度曲线
内容 表示意义
点 曲线上的点 表示某物质在该点对应温度下的溶解度
两曲线的交点 表示两物质在该点对应温度下的溶解度相等
线 表示某物质在不同温度下的溶解度以及溶解度随温度的变化规律
示例
续表
知识点4 溶液的配制 重难点
1.溶质质量分数
概念 溶质的质量分数是指溶液中溶质的质量与溶液的质量之比,通常用小数或百分数表示
公式
意义 溶质的质量分数越大,溶液中的溶质相对含量就越大,溶液的浓度也越大
特别提醒
D
[解析]
选项 分析 结论
×
×
温度升高,氯化铵的溶解度增大,所以溶液的溶质质量分数会变大 ×
若加水使烧杯中的固体全部溶解,当溶液恰好饱和时,则溶液的溶质质量分数不变,当溶液变成不饱和溶液时,则溶液的溶质质量分数减小 √
2.有关溶质质量分数的计算
类型(1) 已知溶质和溶剂的质量或溶质和溶液的质量,求溶质的质量分数
计算依据
关于溶质质量分数的计算有以下四种类型:
典例7 从一瓶氯化钾溶液中取出20克溶液。蒸干后得到2.8克氯化钾固体,则这瓶溶液中溶质的质量分数是多少?
类型(2) 计算配制一定溶质的质量分数的溶液所需溶质和溶剂的质量
计算依据
类型(3) 溶解度与此温度下饱和溶液中溶质的质量分数的计算
计算依据
类型(4) 溶液稀释或浓缩和配制问题的计算
计算依据 抓住溶液稀释或浓缩前后,溶质的质量总是不变,即浓溶液的质量×浓溶液中溶质的质量分数=稀溶液的质量×稀溶液中溶质的质量分数
密度/(克/毫升) 1.01 1.07 1.14 1.22 1.30 1.40 1.50 1.61 1.73 1.81 1.84
1 10 20 30 40 50 60 70 80 90 98
3.教材第30页活动:配制一定溶质质量分数的溶液
实验目的
实验仪器 托盘天平、烧杯、量筒、玻璃棒、药匙
实验步骤 计算
称量和量取 用托盘天平称量5克氯化钠,放入烧杯中。用量筒量取45毫升水
实验步骤 溶解 将用量筒量取的水,倒入盛有氯化钠的烧杯中,用玻璃棒搅拌。待氯化钠完全溶解
图示
续表
误差原因 影响
溶质的质量 溶剂的质量 溶质的质量分数
药品含杂质 偏小 不变 偏小
误差原因 影响
溶质的质量 溶剂的质量 溶质的质量分数
称量 药品与砝码放反 未使用游码 不变 不变 不变
使用游码 偏小 不变 偏小
称量前天平未调平衡 指针偏右 偏大 不变 偏大
指针偏左 偏小 不变 偏小
砝码生锈(未脱落) 偏大 不变 偏大
量取 仰视读数 不变 偏大 偏小
俯视读数 不变 偏小 偏大
续表
误差原因 影响
溶质的质量 溶剂的质量 溶质的质量分数
溶解 称量好的溶质未全部转移至烧杯中 偏小 不变 偏小
往烧杯中倒水时,有少量水溅出 不变 偏小 偏大
溶解用的烧杯未干燥 不变 偏大 偏小
装瓶 少量溶液溅出 同比例减小 不变
试剂瓶事先用水洗涤,未干燥 不变 偏大 偏小
续表
(1) 正确配制该溶液的操作顺序为_____________(用图中序号表示)。
③②④⑤①
(2) 用托盘天平称量所需的氯化钠时,发现托盘天平的指针偏向左盘,应_@20@___(填字母)。
A.适量增加氯化钠固体 B.适量减少氯化钠固体
C.调节游码 D.添加砝码
B
(4) 对配制的溶液进行检测时发现溶质的质量分数偏小,原因可能是_@24@_____(填字母)。
A.称量时,药品与砝码放反了
B.量取水的体积时,仰视读数
C.装瓶时,有少量液体洒出
AB
40
10
(3) 溶解过程中,玻璃棒的作用是_________________。
搅拌,加速溶解
(2) 托盘天平指针偏向左盘,说明左盘物体偏重,应适量减少氯化钠固体。
(3)略。
[解析] (1)正确操作顺序:取出药品,称量药品,放入烧杯中,量取水倒入烧杯中,利用玻璃棒搅拌使药品溶解。
题型1 物质的溶解性及其影响因素
角度1 对物质溶解性的理解 ★★
典例12 下列对物质的溶解性的描述中,错误的是( @28@ )
A.在一定条件下,物质能够溶解的数量是有限的
B.相同条件下,不同物质的溶解能力是不同的
C.气体也能溶解在液体中,且温度越高,气体溶解能力越强
D.物质的溶解性是指一种物质在另一种物质中的溶解能力
C
角度2 物质溶解性影响因素的确定 ★★★
典例13 为了探究影响物质溶解性的因素,设计了如表所示的实验方案,该实验无法探究的因素是( @30@ )
实验序号 溶质 溶剂 温度
1 蔗糖 水
2 蔗糖 水
3 食盐 水
4 食盐 植物油
A.溶质种类 B.溶剂种类 C.温度 D.颗粒粗细
D
[解析]
对比实验 实验变量 实验目的
1和2 温度 探究温度对物质溶解性的影响
2和3 溶质种类 探究溶质种类对物质溶解性的影响
3和4 溶剂种类 探究溶剂种类对物质溶解性的影响
易知实验中没有颗粒粗细这一变量,因此该实验无法探究颗粒粗细对物质溶解性的影响。
角度3 物质溶解性影响因素的探究实验 ★★★★
典例14 为了探究相同条件下同种溶质在不同溶剂中的溶解性,某兴趣小组进行了如下实验。(提示:本实验中汽油与碘不发生化学反应;碘溶于汽油,溶液呈紫红色)
(1)图丙所示的试管中液体分层,上层紫红色溶液的名称是_______________;由图乙、丙可知,碘在汽油中的溶解性比在水中_____(选填“强”或“弱”)。
碘的汽油溶液
强
[解析] (1)碘溶于汽油得到碘的汽油溶液;对比图乙、丙可知,碘在汽油中的溶解性比在水中强。
(2)碘易溶于酒精。若实验中汽油用酒精代替,振荡后静置,最终所得液体_________(选填“分层”或“不分层”)。
不分层
(2)酒精和水可以互溶,用酒精代替汽油,最终所得液体不会出现分层现象。
题型2 饱和溶液与不饱和溶液
角度1 对饱和溶液与不饱和溶液概念的理解(易错) ★★★
典例15 下列关于饱和溶液的说法中,正确的是( @38@ )
A.在一定温度下,向硝酸钾饱和溶液中加硝酸钾固体,溶液质量增大
B.饱和溶液是指在任何条件下都不能再溶解同种溶质的溶液
C.在一定温度下,饱和的氯化钠溶液中不能再溶解其他物质
D.改变条件,可以使硝酸钾的不饱和溶液变成饱和溶液
D
[解析]
选项 分析 结论
×
某溶质的饱和溶液是指在一定温度下,一定量的溶剂中不能继续溶解原溶质的溶液,若温度、溶剂的量发生改变,饱和溶液可能变成不饱和溶液,可继续溶解原溶质 ×
饱和溶液是一定条件下某物质的饱和溶液,对其他物质来讲,可能是不饱和溶液,如在一定温度下,饱和的氯化钠溶液中能再溶解蔗糖 ×
增加硝酸钾固体、降低温度或蒸发溶剂都可将硝酸钾的不饱和溶液变成饱和溶液 √
变式训练
1.“对比实验”是科学探究的重要方法,根据下列所示的实验示意图回答问题。
溶剂的种类(或溶剂的性质)
溶质的种类(或溶质的性质)
角度2 饱和溶液与不饱和溶液的判断 ★★★
典例16 (原创题)北京2022年冬奥会和冬残奥会主题口号是“一起向未来”。“一起向未来”是态度、是倡议、更是行动方案,倡导追求团结、和平、进步、包容的共同目标,是更快、更高、更强、更团结的奥林匹克精神的中国宣扬,表达了世界需要携手走向美好未来的共同愿望。小科是北京冬奥会的一名志愿者,每天回家后总会给自己制备一杯白糖水喝。下列操作或现象能说明糖水一定是饱和溶液的是( @44@ )
A.制备白糖水时进行了充分搅拌 B.糖水热的时候白糖全部溶解
C.凉的糖水中有剩余的白糖 D.喝糖水时感到很甜
C
[解析] 凉的糖水中有剩余的白糖,说明此时水中能溶解的白糖已经达到了最大限度,能说明糖水一定是饱和溶液。
方法点拨
判断溶液为饱和溶液的依据
(1)溶液底部有溶质剩余,且不再减少。
(2)往溶液中加溶质,溶质不再减少。
二者均能作为判定一定条件下的溶液为饱和溶液的依据。
角度3 饱和溶液与不饱和溶液的相互转化 ★★
典例17 欲使某物质的不饱和溶液转化为饱和溶液,最可靠的方法是( @46@ )
A.升高温度 B.降低温度 C.再加入该溶质 D.倒出一些液体
C
方法点拨
“增加溶质,没有限制”
将不饱和溶液转化为饱和溶液,最简单的方法是增加原溶质,且该方法适用于任何溶液。
角度4 浓溶液、稀溶液与饱和溶液、不饱和溶液的关系 ★★★
D
易错警示
(1)误认为饱和溶液是浓溶液,不饱和溶液是稀溶液:溶液的浓与稀取决于溶质在一定量的溶液里含量多少;溶液是否饱和取决于溶质在一定温度下、一定量溶剂里能否继续溶解;饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液。
(2)误认为同种溶质的饱和溶液一定比不饱和溶液浓:同种溶质的饱和溶液比不饱和溶液浓有两个前提条件,一是相同温度下,二是溶剂相同(与溶剂质量多少无关)。
题型3 物质溶解时的吸、放热现象 ★★
典例19 [2022·杭州滨江区期中] 小明课外自制了一个化学“冰箱”,如图所示。当水袋破裂时,水与固体碎块混合,箱内食物温度明显下降,制造此化学冰箱的固体碎块可选用( @50@ )
A.硝酸铵 B.食盐 C.蔗糖 D.氢氧化钠
A
[解析] 由水与固体碎块混合,箱内食物温度明显下降知,该固体溶于水时吸热,结合选项可知,A正确。
知识回顾
现象 举例
溶于水放热 氢氧化钠,浓硫酸等
溶于水吸热 硝酸铵等
溶于水热量变化不明显 食盐、蔗糖等
题型4 溶解度及其相关计算
角度1 溶解度的概念及含义 ★★★
典例20 [2022·丽水期中] 下表是不同温度下硝酸钾在水中的溶解度,下列有关说法正确的是( @52@ )
0 20 40 60 80 100
溶解度/克 13.3 31.6 63.9 110 169 246
C
[解析]
选项 分析 结论
×
×
√
没有说明水的质量,也没有说明溶液是否饱和,无法比较 ×
归纳总结
(1)理解固体物质溶解度的概念,必须明确四要素,缺一不可,四要素简记为“定温、定量、定状态、定单位”。
(2)固体物质的溶解度受溶质性质、溶剂性质和温度的影响,与溶质多少无关。
变式训练
D
角度2 有关溶解度的计算 ★★★★
A
角度3 溶解度曲线的意义(培优) ★★★★★
典例22 如图是甲、乙、丙三种物质的溶解度曲线,下列说法正确的是( @58@ )
D
[解析]
选项 分析 结论
比较不同物质的溶解度大小时,要指明温度,否则没有意义 ×
×
×
√
方法点拨
溶解度曲线的“两看”
一看点 溶解度曲线上的点表示对应温度下该物质的溶解度,可定量判断溶液是否饱和,两曲线的交点可表示对应温度下两溶质的溶解度相等
二看线 溶解度曲线表示溶解度随温度变化的规律,可由温度的变化判断溶解度的变化,进而分析溶液的变化(饱和溶液与不饱和溶液之间的转化)
易错警示
通过分析溶解度曲线进行解题时,需注意以下几点:
(1)比较溶解度大小需指明温度;
(2)利用溶解度比较析出固体质量的多少需指明是等质量的饱和溶液。
题型5 溶质质量分数的计算与应用
角度1 判断溶质质量分数的变化情况 ★★★★
典例23 [杭州中考] 如图所示为蒸发氯化钠溶液的实验过程,其中①→②→③为恒温蒸发过程,③→④为升温蒸发过程,②溶液恰好为饱和状态,分析实验过程,可以作出的正确判断是( @60@ )
D
A.在①→②过程中,氯化钠的质量分数保持不变
B.在②→③过程中,氯化钠的溶解度不断增大
C.在③→④过程中,水的质量分数不断增大
D.在②→④过程中,氯化钠的质量分数先不变后增大
方法点拨
角度2 溶质质量分数的计算(易错) ★★★
A
易错警示
角度3 配制一定溶质质量分数的溶液 ★★★
(1) 计算:需要氯化钠的质量为_______。
量筒
搅拌,加速固体溶解
(4) 用已调节平衡的天平称固体时,发现指针偏右,接下来的操作是_____________。
继续添加固体
(4)发现指针偏右,说明砝码重,也就是药品少,所以要加药品;
(2)略。提示:使用托盘天平时应左物右码,量筒读数时应使视线与凹液面的最低处保持水平;
(5) 反思:若称取的氯化钠中含有水分,则所配制的溶液中的溶质质量分数会_______;若量水时仰视读数,则所配制的溶液中的溶质质量分数会_______。(选填“偏大”“偏小”或“无影响”)
偏小
偏小
(5)若称取的氯化钠中含有水分,则氯化钠的实际质量偏小,所以所配制的溶液中溶质的质量分数会偏小,若仰视读数,则量取的水偏多,而溶质的质量不变,溶液的质量增加,所以所配制的溶液中的溶质质量分数会偏小。
变式训练
B
同课章节目录
- 第1章 水和水的溶液
- 第1节 地球上的水
- 第2节 水的组成
- 第3节 水的浮力
- 第4节 物质在水中的分散状况
- 第5节 物质的溶解
- 第6节 物质的分离
- 第7节 水资源的利用、开发和保护
- 第2章 天气与气候
- 第1节 大气层
- 第2节 气温
- 第3节 大气的压强
- 第4节 风和降水
- 第5节 天气预报
- 第6节 气候和影响气候的因素
- 第7节 我国的气候特征与主要气象灾害
- 第3章 生命活动的调节
- 第1节 植物生命活动的调节
- 第2节 人体的激素调节
- 第3节 神经调节
- 第4节 动物的行为
- 第5节 体温的控制
- 第4章 电路探秘
- 第1节 电荷与电流
- 第2节 电流的测量
- 第3节 物质的导电性与电阻
- 第4节 变阻器
- 第5节 电压的测量
- 第6节 电流与电压、电阻的关系
- 第7节 电路分析与应用
- 研究性学习课题
- 一 测定本地区的“酸雨”情况及分析原因
- 二 太阳黑子活动与本地区降水的关系
- 三 训练小动物建立某种条件反射
- 四 调查在自然界或生命活动中的电现象
