人教版九年级化学下册《酸和碱的中和反应》第1课时课件(26页)
文档属性
| 名称 | 人教版九年级化学下册《酸和碱的中和反应》第1课时课件(26页) |

|
|
| 格式 | pptx | ||
| 文件大小 | 46.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-09 15:12:14 | ||
图片预览






文档简介
(共26张PPT)
课题2 酸和碱的中和反应
第十单元 酸和碱
(第1课时)
1.认识酸和碱之间发生的中和反应。
2.知道中和反应在实际生活中的应用。
学习目标
一、情景引入,导入新知
H+
OH-
酸溶液中都含有大量的H+,表现出酸性;碱溶液中都含有大量的OH,表现出碱性。那么,酸与碱能发生反应吗?
Part 01
1 中和反应
二、自主学习,发现疑问
思考:
1.通过观察现象,能否判断NaOH与稀盐酸是否发生了反应?
2.若NaOH与稀盐酸发生了反应,可借助什么试剂来帮助判断?
无法判断。
酸碱指示剂。
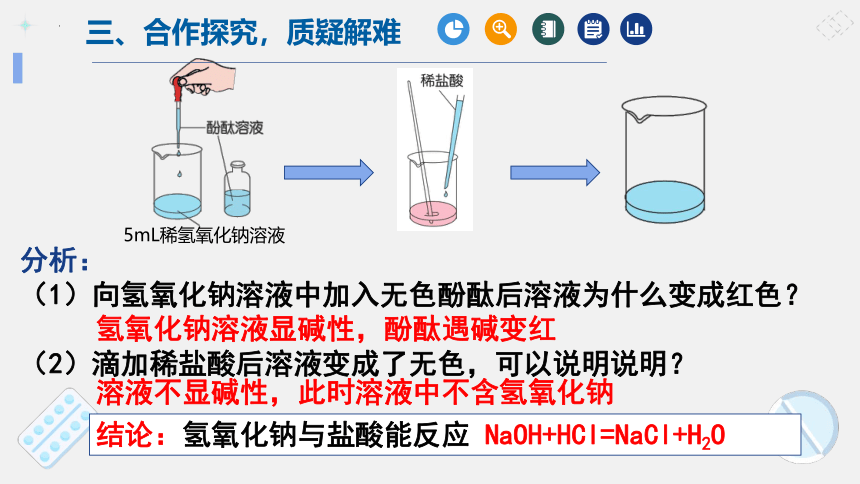
在烧杯中加入5ml氢氧化钠溶液,滴入足量稀盐酸,观察现象。
1 中和反应
实验 10 – 8
氢氧化钠溶液
与稀盐酸反应
二、自主学习,发现疑问
5mL稀氢氧化钠溶液
分析:
(1)向氢氧化钠溶液中加入无色酚酞后溶液为什么变成红色?
(2)滴加稀盐酸后溶液变成了无色,可以说明说明?
氢氧化钠溶液显碱性,酚酞遇碱变红
溶液不显碱性,此时溶液中不含氢氧化钠
结论:氢氧化钠与盐酸能反应 NaOH+HCl=NaCl+H2O
三、合作探究,质疑解难
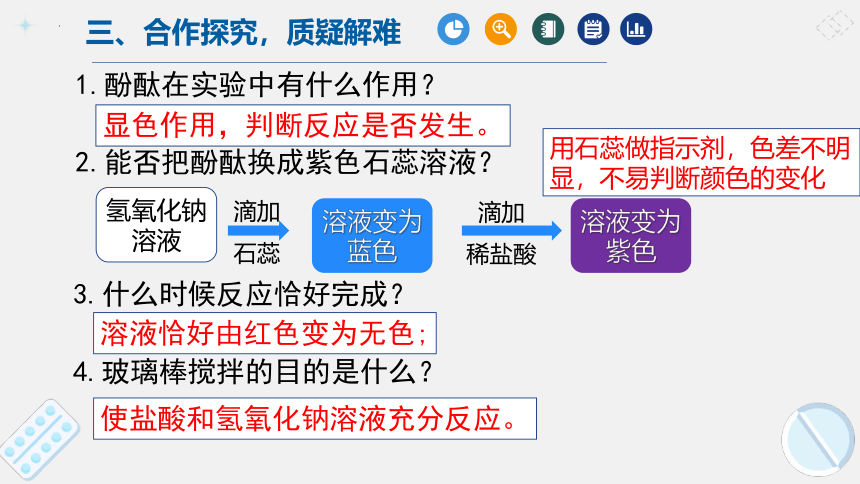
1.酚酞在实验中有什么作用?
2.能否把酚酞换成紫色石蕊溶液?
3.什么时候反应恰好完成?
4.玻璃棒搅拌的目的是什么?
使盐酸和氢氧化钠溶液充分反应。
溶液恰好由红色变为无色;
显色作用,判断反应是否发生。
氢氧化钠
溶液
溶液变为
蓝色
溶液变为
紫色
滴加
石蕊
滴加
稀盐酸
用石蕊做指示剂,色差不明显,不易判断颜色的变化
三、合作探究,质疑解难
实验结论
实验现象
氢氧化钠和稀盐酸发生了反应
氢氧化钠溶液呈 性(酸或碱或中性)滴加酚酞后溶液呈 色;随着盐酸的加入,溶液颜色逐渐变 ,当溶液恰好变无色时溶液变成 性,此时代表氢氧化钠和盐酸恰好完全反应。如果继续加入过量盐酸溶液为 性。
碱
红
中
酸
解释与结论:
溶液由红色变为无色。
浅
三、合作探究,质疑解难
分析:HCl在溶液中离解出 和 ,NaOH在溶液中离解出 和 ,而在反应后的溶液中, 和 消失了,变成了水分子,而 和 仍然以离子的形式存在。所以酸碱中和反应的实质是H+和OH-反应生成了 。
图10-14 氢氧化钠与盐酸反应的示意图
Na+
OH-
H+
Cl-
H+
OH-
Na+
Cl-
三、合作探究,质疑解难
Na+ + Cl- + H2O
H+ + Cl-
+
Na+ + OH-
=
反应中,只有氢离子和氢氧根离子发生反应,而钠离子和氯离子并没有反应;
中和反应的实质是H+ + OH- = H2O
酸中的氢离子和碱中的氢氧根离子,结合成了水分子
三、合作探究,质疑解难
盐:由金属离子(或铵根离子)和酸根离子组成的化合物
中和反应:酸和碱作用生成盐和水的反应叫中和反应;
酸 + 碱 → 盐 + 水
中和反应的实质是:酸中的氢离子和碱中的氢氧根离子,结合成了水分子(H++OH-=H2O)
三、合作探究,质疑解难
三、合作探究,质疑解难
思考:有人说:凡是生成盐和水的反应就是中和反应,请问对不对?
答:不正确。因为能生成盐和水的反应有3种
酸 + 金属氧化物 = 盐 + 水
如:2HCl+CuO=CuCl2+H2O
酸 + 碱 = 盐 + 水
如:HCl+NaOH=NaCl+H2O
碱 + 非金属氧化物 = 盐 + 水
如:2NaOH+CO2=Na2CO3+H2O
part 02
中和反应的应用
中和反应的应用
用于医药
处理工业废水
改良土壤的酸碱性
调整溶液的酸碱性
二、中和反应在实际中的应用
三、合作探究,质疑解难
1.改良土壤的酸碱性
加入酸 性物质
中性土壤
中性土壤
酸性土壤
熟石灰
Ca(OH)2
盐碱地
碱性土壤
(用熟石灰改良酸性土壤)
三、合作探究,质疑解难
⑴ 为什么向酸性土壤中加入熟石灰,而不可以加入氢氧化钠粉末?
答:因为氢氧化钠的腐蚀性太强,影响作物生长。
答:是酸雨或化肥。
⑵ 导致土壤显酸性的主要原因是什么?
讨论:
三、合作探究,质疑解难
2.处理工厂的废水
某硫酸厂排出的废水中含有硫酸等杂质,严重危害当地的生态环境,你会怎样处理这些废水呢?
应在排放前用碱性物质(例如熟石灰)进行中和处理。
你能写出化学方程式吗?
Ca(OH)2+H2SO4 = CaSO4 + 2H2O
用CaO来中和污水行不行?
CaO + H2O =Ca(OH)2
三、合作探究,质疑解难
3. 用于医药
⑴ 中和胃酸过多
用含有氢氧化铝的胃药中和胃酸中过多的盐酸。
化学方程式:
Al(OH)3 + 3HCl=AlCl3 + 3H2O
⑵ 中和蚁酸
思考:可不可以用NaOH来中和胃酸、蚁酸?为什么?
蚊虫能分泌出蚁酸,人被一些蚊虫叮咬后可在叮咬处涂一些含有碱性物质的溶液,如稀氨水、肥皂液等,可减轻痛痒。
答:不可以。因为NaOH的碱性太强,具有强的腐蚀性。
三、合作探究,质疑解难
4.调配食物:
添加食醋(CH3COOH)
食用松花蛋时加入食醋可以将其中的碱性物质中和,从而消除其涩味,使松花蛋变得可口。
三、合作探究,质疑解难
1.中和反应:酸与碱作用生成盐和水的反应。
实质: H+ + OH- = H2O
2.盐:由金属离子(或氨根离子)和酸根离子构成的化合物。
3.中和反应在日常生活和工农业生产中有广泛的应用:
改良酸性土壤;处理酸性废水;
用于医药:治疗胃酸过多;处理蚊虫叮咬。
四、展示归纳,点拨提升
五、目标检测,检查效果升
01
练习一
1. 下列物质属于盐的是( )
A. CuO B. Ba(OH)2 C. FeSO4 D. HCl
2. 下列反应属于中和反应的是( )
A. Zn+2HCl == ZnCl2+2H2↑
B. Cu(OH)2+H2SO4 == CuSO4+2H2O
C. CuSO4+Fe == FeSO4+Cu
D. CO2+Ca(OH)2 == CaCO3↓+H2O
C
B
01
练习二
五、目标检测,检查效果升
01
练习三
3. 下列化学反应属于中和反应的是( )
A. 盐酸与氧化镁
B. 硫酸与锌
C. 氢氧化钠与二氧化碳
D. 氢氧化钡与稀硫酸
D
五、目标检测,检查效果升
01
练习四
4. 下列实际应用中,利用了中和反应的是( )
①用稀硫酸除铁锈②用熟石灰改良酸性土壤③用碳酸氢钠治疗胃酸过多④用氢氧化钠溶液洗去石油产品中的残余硫酸⑤用稀氨水涂抹在蚊子叮咬处(分泌出蚁酸)止痒
A. ②④⑤ B. ②③⑤ C. ①②④ D. ②③④⑤
A
五、目标检测,检查效果升
01
练习五
5. 根据图10-2-2回答下列问题:
(1)在烧杯中加入5 mL的氢氧化钠溶液,滴入几滴酚酞溶液,此时溶液呈________色。
(2)加入稀盐酸至过量能观察到的现象是__________________,写出该反应的化学方程式:____________________________。
红
溶液由红色变为无色
NaOH+HCl == H2O+NaCl
五、目标检测,检查效果升
01
练习五
(3)反应中,数目减少的离子是___________(填离子符号)。
(4)验证反应后溶液中稀盐酸有剩余,下列操作可行的是________(多选)。
A. 取样,加入CuO粉末
B. 取样,滴加Fe铁粉
C. 取样,加入CaCO3粉末
H+、OH-
ABC
课题2 酸和碱的中和反应
第十单元 酸和碱
(第1课时)
1.认识酸和碱之间发生的中和反应。
2.知道中和反应在实际生活中的应用。
学习目标
一、情景引入,导入新知
H+
OH-
酸溶液中都含有大量的H+,表现出酸性;碱溶液中都含有大量的OH,表现出碱性。那么,酸与碱能发生反应吗?
Part 01
1 中和反应
二、自主学习,发现疑问
思考:
1.通过观察现象,能否判断NaOH与稀盐酸是否发生了反应?
2.若NaOH与稀盐酸发生了反应,可借助什么试剂来帮助判断?
无法判断。
酸碱指示剂。
在烧杯中加入5ml氢氧化钠溶液,滴入足量稀盐酸,观察现象。
1 中和反应
实验 10 – 8
氢氧化钠溶液
与稀盐酸反应
二、自主学习,发现疑问
5mL稀氢氧化钠溶液
分析:
(1)向氢氧化钠溶液中加入无色酚酞后溶液为什么变成红色?
(2)滴加稀盐酸后溶液变成了无色,可以说明说明?
氢氧化钠溶液显碱性,酚酞遇碱变红
溶液不显碱性,此时溶液中不含氢氧化钠
结论:氢氧化钠与盐酸能反应 NaOH+HCl=NaCl+H2O
三、合作探究,质疑解难
1.酚酞在实验中有什么作用?
2.能否把酚酞换成紫色石蕊溶液?
3.什么时候反应恰好完成?
4.玻璃棒搅拌的目的是什么?
使盐酸和氢氧化钠溶液充分反应。
溶液恰好由红色变为无色;
显色作用,判断反应是否发生。
氢氧化钠
溶液
溶液变为
蓝色
溶液变为
紫色
滴加
石蕊
滴加
稀盐酸
用石蕊做指示剂,色差不明显,不易判断颜色的变化
三、合作探究,质疑解难
实验结论
实验现象
氢氧化钠和稀盐酸发生了反应
氢氧化钠溶液呈 性(酸或碱或中性)滴加酚酞后溶液呈 色;随着盐酸的加入,溶液颜色逐渐变 ,当溶液恰好变无色时溶液变成 性,此时代表氢氧化钠和盐酸恰好完全反应。如果继续加入过量盐酸溶液为 性。
碱
红
中
酸
解释与结论:
溶液由红色变为无色。
浅
三、合作探究,质疑解难
分析:HCl在溶液中离解出 和 ,NaOH在溶液中离解出 和 ,而在反应后的溶液中, 和 消失了,变成了水分子,而 和 仍然以离子的形式存在。所以酸碱中和反应的实质是H+和OH-反应生成了 。
图10-14 氢氧化钠与盐酸反应的示意图
Na+
OH-
H+
Cl-
H+
OH-
Na+
Cl-
三、合作探究,质疑解难
Na+ + Cl- + H2O
H+ + Cl-
+
Na+ + OH-
=
反应中,只有氢离子和氢氧根离子发生反应,而钠离子和氯离子并没有反应;
中和反应的实质是H+ + OH- = H2O
酸中的氢离子和碱中的氢氧根离子,结合成了水分子
三、合作探究,质疑解难
盐:由金属离子(或铵根离子)和酸根离子组成的化合物
中和反应:酸和碱作用生成盐和水的反应叫中和反应;
酸 + 碱 → 盐 + 水
中和反应的实质是:酸中的氢离子和碱中的氢氧根离子,结合成了水分子(H++OH-=H2O)
三、合作探究,质疑解难
三、合作探究,质疑解难
思考:有人说:凡是生成盐和水的反应就是中和反应,请问对不对?
答:不正确。因为能生成盐和水的反应有3种
酸 + 金属氧化物 = 盐 + 水
如:2HCl+CuO=CuCl2+H2O
酸 + 碱 = 盐 + 水
如:HCl+NaOH=NaCl+H2O
碱 + 非金属氧化物 = 盐 + 水
如:2NaOH+CO2=Na2CO3+H2O
part 02
中和反应的应用
中和反应的应用
用于医药
处理工业废水
改良土壤的酸碱性
调整溶液的酸碱性
二、中和反应在实际中的应用
三、合作探究,质疑解难
1.改良土壤的酸碱性
加入酸 性物质
中性土壤
中性土壤
酸性土壤
熟石灰
Ca(OH)2
盐碱地
碱性土壤
(用熟石灰改良酸性土壤)
三、合作探究,质疑解难
⑴ 为什么向酸性土壤中加入熟石灰,而不可以加入氢氧化钠粉末?
答:因为氢氧化钠的腐蚀性太强,影响作物生长。
答:是酸雨或化肥。
⑵ 导致土壤显酸性的主要原因是什么?
讨论:
三、合作探究,质疑解难
2.处理工厂的废水
某硫酸厂排出的废水中含有硫酸等杂质,严重危害当地的生态环境,你会怎样处理这些废水呢?
应在排放前用碱性物质(例如熟石灰)进行中和处理。
你能写出化学方程式吗?
Ca(OH)2+H2SO4 = CaSO4 + 2H2O
用CaO来中和污水行不行?
CaO + H2O =Ca(OH)2
三、合作探究,质疑解难
3. 用于医药
⑴ 中和胃酸过多
用含有氢氧化铝的胃药中和胃酸中过多的盐酸。
化学方程式:
Al(OH)3 + 3HCl=AlCl3 + 3H2O
⑵ 中和蚁酸
思考:可不可以用NaOH来中和胃酸、蚁酸?为什么?
蚊虫能分泌出蚁酸,人被一些蚊虫叮咬后可在叮咬处涂一些含有碱性物质的溶液,如稀氨水、肥皂液等,可减轻痛痒。
答:不可以。因为NaOH的碱性太强,具有强的腐蚀性。
三、合作探究,质疑解难
4.调配食物:
添加食醋(CH3COOH)
食用松花蛋时加入食醋可以将其中的碱性物质中和,从而消除其涩味,使松花蛋变得可口。
三、合作探究,质疑解难
1.中和反应:酸与碱作用生成盐和水的反应。
实质: H+ + OH- = H2O
2.盐:由金属离子(或氨根离子)和酸根离子构成的化合物。
3.中和反应在日常生活和工农业生产中有广泛的应用:
改良酸性土壤;处理酸性废水;
用于医药:治疗胃酸过多;处理蚊虫叮咬。
四、展示归纳,点拨提升
五、目标检测,检查效果升
01
练习一
1. 下列物质属于盐的是( )
A. CuO B. Ba(OH)2 C. FeSO4 D. HCl
2. 下列反应属于中和反应的是( )
A. Zn+2HCl == ZnCl2+2H2↑
B. Cu(OH)2+H2SO4 == CuSO4+2H2O
C. CuSO4+Fe == FeSO4+Cu
D. CO2+Ca(OH)2 == CaCO3↓+H2O
C
B
01
练习二
五、目标检测,检查效果升
01
练习三
3. 下列化学反应属于中和反应的是( )
A. 盐酸与氧化镁
B. 硫酸与锌
C. 氢氧化钠与二氧化碳
D. 氢氧化钡与稀硫酸
D
五、目标检测,检查效果升
01
练习四
4. 下列实际应用中,利用了中和反应的是( )
①用稀硫酸除铁锈②用熟石灰改良酸性土壤③用碳酸氢钠治疗胃酸过多④用氢氧化钠溶液洗去石油产品中的残余硫酸⑤用稀氨水涂抹在蚊子叮咬处(分泌出蚁酸)止痒
A. ②④⑤ B. ②③⑤ C. ①②④ D. ②③④⑤
A
五、目标检测,检查效果升
01
练习五
5. 根据图10-2-2回答下列问题:
(1)在烧杯中加入5 mL的氢氧化钠溶液,滴入几滴酚酞溶液,此时溶液呈________色。
(2)加入稀盐酸至过量能观察到的现象是__________________,写出该反应的化学方程式:____________________________。
红
溶液由红色变为无色
NaOH+HCl == H2O+NaCl
五、目标检测,检查效果升
01
练习五
(3)反应中,数目减少的离子是___________(填离子符号)。
(4)验证反应后溶液中稀盐酸有剩余,下列操作可行的是________(多选)。
A. 取样,加入CuO粉末
B. 取样,滴加Fe铁粉
C. 取样,加入CaCO3粉末
H+、OH-
ABC
同课章节目录
