化学人教版(2019)必修第一册第四章第三节 化学键(共58张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册第四章第三节 化学键(共58张ppt) |
|
|
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-11 00:00:00 | ||
图片预览





文档简介
(共58张PPT)
第四章第三节
化学键
118种元素、不少于1000种原子、8000多万种物质
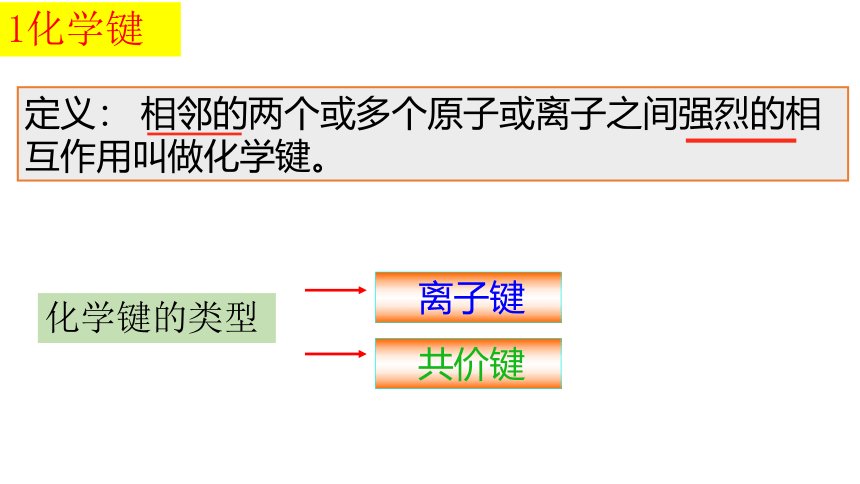
定义: 相邻的两个或多个原子或离子之间强烈的相互作用叫做化学键。
离子键
共价键
1化学键
化学键的类型
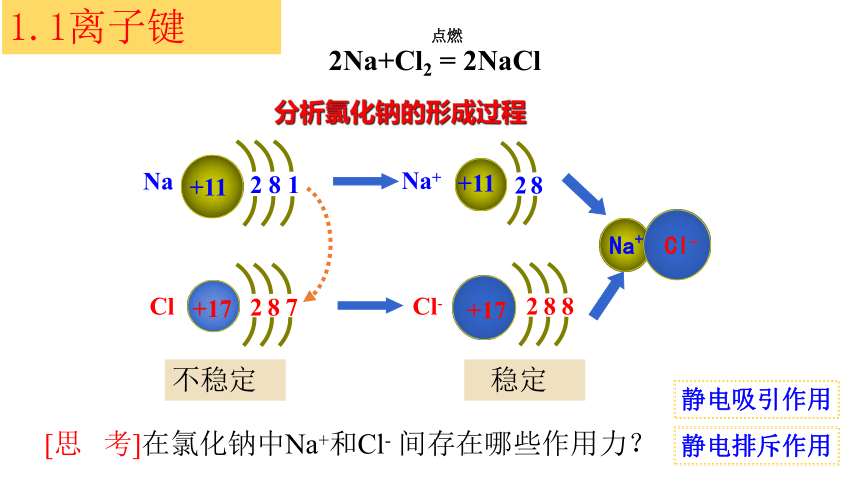
2Na+Cl2 = 2NaCl
点燃
分析氯化钠的形成过程
Cl
+17
8
7
2
Na+
Cl-
+11
8
2
Na+
+17
8
8
2
Cl-
Na
+11
8
1
2
[思 考]在氯化钠中Na+和Cl- 间存在哪些作用力?
1.1离子键
不稳定
稳定
静电吸引作用
静电排斥作用
定义:
把带相反电荷的离子之间的相互作用称为离子键。
1.1离子键
成键粒子:
阴离子、阳离子
成键的性质:
静电作用(吸引和排斥)
成键的原因:
电子的得失、静电平衡、体系总能量降低
存在物质:
离子化合物
1.2离子化合物
定义:由离子键构成的化合物
分类:
(1)二元素化合物:
活泼的金属元素(ⅠA、ⅡA)和活泼的非金属元素(ⅥA、ⅦA)之间形成的化合物。除 AlCl3
(2)多元素化合物:
①强碱:NaOH、KOH
②含氧酸盐:Na2SO4、KNO3
③氨盐:NH4Cl、NH4NO3
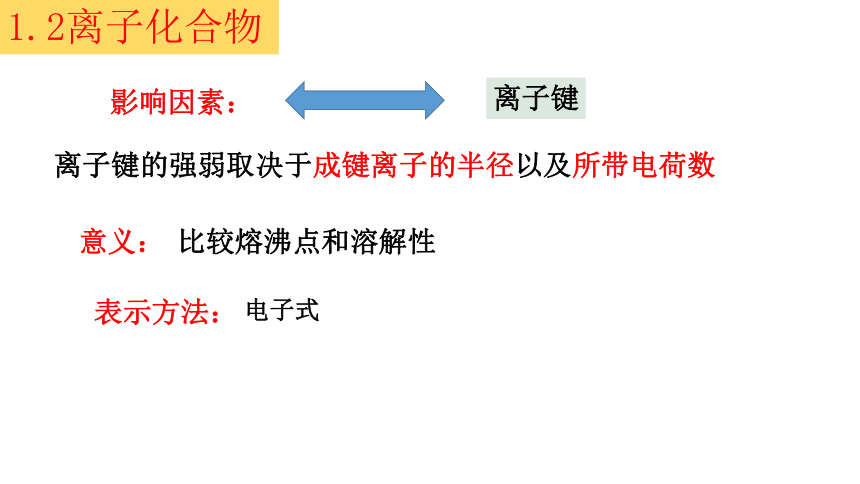
离子键的强弱取决于成键离子的半径以及所带电荷数
影响因素:
离子键
意义:
比较熔沸点和溶解性
表示方法:
1.2离子化合物
电子式
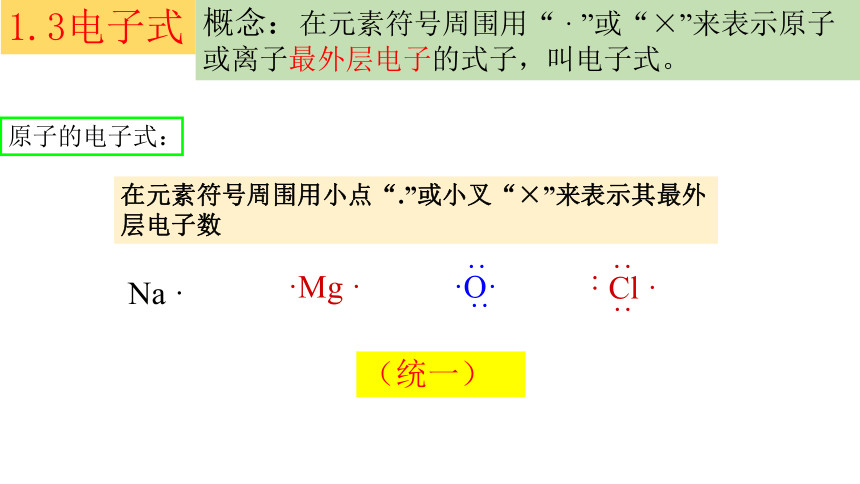
概念:在元素符号周围用“ · ”或“×”来表示原子或离子最外层电子的式子,叫电子式。
Na ·
·Mg ·
·O·
··
··
Cl ·
··
··
··
原子的电子式:
1.3电子式
在元素符号周围用小点“.”或小叉“×”来表示其最外层电子数
(统一)
Cl
O
2-
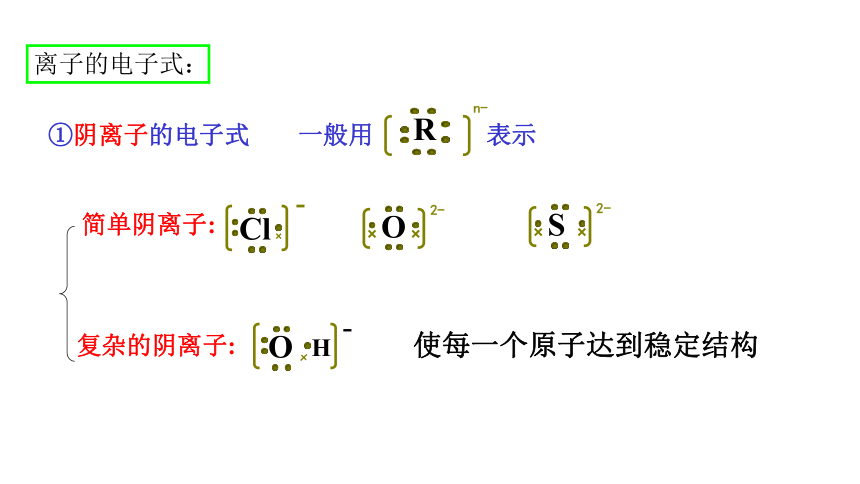
①阴离子的电子式
简单阴离子:
复杂的阴离子:
O
H
-
一般用 表示
R
n-
使每一个原子达到稳定结构
S
2-
离子的电子式:
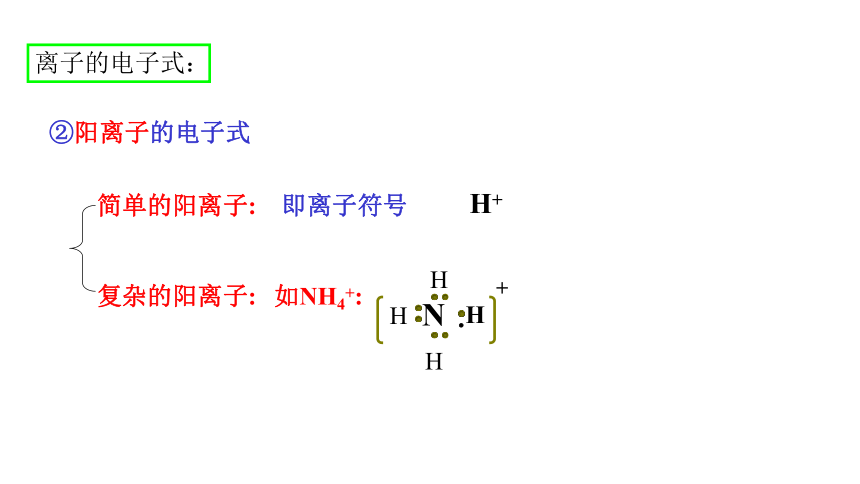
②阳离子的电子式
简单的阳离子:
复杂的阳离子:
即离子符号
如NH4+:
N
H
+
H
H
H
.
H+
离子的电子式:
【练习】写出下列微粒的电子式:
硫原子,溴原子, 硫离子, 溴离子、铝离子
·S·
··
··
Br ·
··
··
··
[ S ]2-
··
··
:
:
[ Br ]-
··
··
:
:
由阳离子的电子式和阴离子的电子式组合而成.
注意:相同的离子不能合并写(每个离子都要单独写),一般对称排列. 如:
离子化合物的电子式:
AB型
A2B型
AB2型
练习:写出MgO、K2S、CaF2、NH4Cl的电子式
Mg
2
Br
Br
Br
Mg
Br
S
2-
K
K
S
K
K
例:
左侧写原子的电子式,右侧写离子化合物的电子式,中间用 连接.
注意:用弧形箭头表示电子转移的方向.
用电子式表示离子化合物的形成过程
练习:用电子式表示离子化合物的形成过程
1、Na2O 2、 CaCl2
Na + O + Na
‥
‥
Na
∶O∶
‥
‥
[ ]
+
2-
Na
+
Cl + Ca + Cl
‥
‥
∶
∶
∶
∶
∶
‥
‥
‥
‥
∶
‥
‥
Cl Ca Cl
[ ]
[ ]
-
-
2+
1、下列说法正确的是( )
A、离子键就是阴阳离子间的静电引力
B、所有金属元素与所有非金属间都能形成离子键
C、钠原子与氯原子结合成氯化钠后体系很稳定
D、在离子化合物氯化钙中,两个氯原子间也存在离子键
C
2、下列各数值表示有关元素的原子序数,能以离子键相互结合成稳定化合物的是( )
A、10和19
B、6和16
C、11和17
D、14和8
C
Ne是惰性气体,不能与钾元素形成稳定的化合物
碳与硫以共价键形成共价化合物
钠与氯以离子键形成离子化合物
硅与氧以共价键形成共价化合物
×
×
×
√
3、下列用电子式表示化合物的形成过程正确的是( )
K
O
K
O
]
[
K
2
K
A、
[
]
Ba
[
]
Cl
[
]
Cl
2
Ba
Cl
Cl
B、
]
Mg
F
F
Mg
F
2
[
2
C、
Cl
]
[
H
Cl
H
D、
A
Ba
[
]
Cl
[
]
Cl
2
]
Mg
F
2
[
]
F
[
Cl
H
×
×
×
√
电子式
离子键
1. 离子键的概念及其成键粒子、成键本质
2. 离子键可由原子得失电子后形成,也可由离子直接形成
3. 由离子键形成离子化合物
电子式
离子键
(1)原子的电子式在元素符号四个方向逐一放置最外层电子
(2)简单离子的电子式(简单阳离子及简单阴离子和离子化合物)
(3)用电子式表示由原子形成离子化合物的过程
··
· Cl
··
:
H ·
+
→
Cl
··
··
H
··
··
共用电子对
在HCl分子的形成过程中,没有发生电子的得失,而是通过共用电子对双方达到稳定结构
1.4共价键
原子之间通过共用电子对所形成的强烈相互作用,叫共价键
1、共价键定义
成键微粒
成键本质
原 子
共用电子对
2、共价键的成键特点
成键条件
一般由非金属元素形成
1.4共价键
3、用电子式表示原子形成共价键
HCl
H2O
H2
NH3
CO2
H ·
· H
+
→
H H
··
··
· Cl
··
:
H ·
+
→
··
··
Cl
H
··
··
··
· O ·
··
H ·
+
· H
+
··
→
O
··
H
H
:
:
··
··
+
· O ·
··
+
:
C
:
· O ·
··
→
C
:
:
O
··
··
O
··
··
:
:
3H ·
+
:
· N
·
·
→
··
N
H
:
:
··
H
H
1.4共价键
(2)四种常见的共价化合物
①非金属氢化物:如NH3、H2S、H2O等。
②非金属氧化物:如CO、CO2、SO2等。
③酸:如H2SO4、HNO3等。
④大多数有机化合物:如CH4、CH3CH2OH等。
1.4共价键
4、共价键的存在
(1) 多原子非金属单质
如:Cl2、 O3、 P4
(1)电子式
①每个原子一般达到相对稳定结构
②不加中括号[ ],不标正负电荷数
③原子周围共用电子对数=8-原子最外层电子数
5、分子的电子式和结构式
(2)结构式
分别用“-、═、≡”表示一对、二对和三对共用电子对
H-O-H
H-H
H-Cl
O =C =O
1.4共价键
氯气
写出下列物质的电子式和结构式
溴化氢
过氧化氢
甲烷
氮气
Cl Cl
:
:
:
:
:
:
:
…
N N
··
…
··
Cl-Cl
H-Br
N≡N
H-C -H
H
H
-
-
H-O-O-H
﹕
H Br
﹕
﹕
﹕
H
H C H
H
﹕
﹕
﹕
﹕
﹕
﹕
H O O H
﹕
﹕
﹕
﹕
﹕
5、分子的电子式和结构式
1.4共价键
6、共价键的分类
非极性键:共用电子对不发生偏移
电子对不偏移
极性键:共用电子对偏向某一方
电子对偏向Cl
Cl
··
··
H
··
··
H H
··
成键元素相同
成键元素不同
1.4共价键
指出下列物质中的共价键类型
O2
CH4
CO2
H2O2
Na2O2
NaOH
6、共价键的分类
非极性键
极性键
极性键
(H-O-O-H)
极性键
非极性键
非极性键
极性键
1.4共价键
⑴化学键
7、化学键
⑵化学键的分类
离子键
共价键
非极性键
极性键
使离子或原子相结合的强烈相互作用
⑶化学反应的实质
点燃
Cl2+2H2 == 2HCl
先破坏非极性键
后形成极性键
AgNO3 NaCl = AgCl ↓ + NaNO3
先破坏离子键
后形成离子键
化学键先破后立的过程
1.4共价键
化学键
共价键
(1)共价键的定义及其成键微粒和成键本质
(2)共价键的成键条件及共价键的存在
(3)共价键的存在及分类
(4)分子的电子式和结构式
化学键
共价键
化学键的分类(离子键和共价键)
化学反应的实质(旧键的断裂和新键的形成)
离子化合物与共价化合物的比较
【点拨提升】
离子化合物 共价化合物
概念 由离子键构成的化合物 以共用电子对形成的化合物
构成粒子 阴、阳离子 原子
粒子间 的作用 离子键 共价键
实例 强碱、大多数盐、活泼金属的氧化物 酸、非金属的氢化物、非金属的氧化物
归纳总结
判断离子化合物、共价化合物的方法
(1)根据化合元素的性质判断
离子化合物:活泼的金属元素跟活泼的非金属元素化合时形成的化合物
共价化合物:不同种非金属元素形成的化合物
常见的活泼金属元素是元素周期表中第ⅠA族的金属元素和第ⅡA族中除铍以外的金属元素;常见的活泼非金属元素是元素周期表中第ⅦA族元素,还有氮、氧、硫等元素。如NaCl、CaO、K2S、Mg3N2等都是典型的离子化合物。
(2)根据组成化合物的粒子类型判断
化合物中,由阴、阳离子组成的是离子化合物,其他的是共价化合物。
(3)根据化合物的基本类型判断
离子化合物:活泼金属氧化物、活泼金属氢化物、金属过氧化物、强碱和大多数盐(除AlCl3、BeCl2、Pb(CH3COO)2)
共价化合物:非金属氢化物、非金属氧化物、含氧酸、大多数有机物
概念辨析
(1)共价键与离子键的成键微粒是一样的( )
(2)金属元素与非金属元素只能形成离子键( )
(3)非金属元素只能形成共价键( )
(4)共价化合物H2O2只含共价键,离子化合物Na2O2只含离子键( )
(5)H2O2中既有极性键,又含有非极性键( )
×
×
×
×
√
1.(2019·哈尔滨高一期中)下列说法中正确的是
A.HCl中存在离子键,属于离子化合物
B.由非金属元素组成的化合物一定是共价化合物
C.熔融状态下能导电的化合物一定是离子化合物
D.阴、阳离子间通过静电引力而形成的化学键叫做离子键
解析 HCl分子中只存在共价键,属于共价化合物,A错误;
由非金属元素组成的化合物中可能含有离子键,如铵盐,B错误;
在熔融状态下共价键不能被破坏,离子键可以被破坏,所以熔融状态下能导电的化合物一定是离子化合物,C正确;
阴、阳离子通过静电作用而形成的化学键称为离子键,静电作用包含静电引力和电子之间、原子核之间的斥力,D错误。
√
2.对于HCl、H2SO4、NaOH、NaCl、NH4Cl、Ne、N2、金刚石,回答下列问题:
(1)不存在化学键的_________________________。
(2)属于共价化合物的_______________________。
(3)属于离子化合物的______________________。
(4)既含离子键,又含共价键的_______________。
答案 (1)Ne (2)HCl、H2SO4 (3)NaOH、NaCl、NH4Cl 4)NaOH、NH4Cl
(1)“三个一定”
①离子化合物中一定含离子键。
②含离子键的一定是离子化合物。
③共价化合物中一定不含离子键。
(2)“三个可能”
①离子化合物中可能含有共价键,如NaOH。
②金属与非金属形成的化合物可能是共价化合物,如AlCl3。
③完全由非金属形成的化合物可能是离子化合物,如NH4Cl。
【点拨提升】
化学键和化合物关系的“三个一定”和“三个可能”
通过化学键判断离子化合物和共价化合物
1、画出下列物质的电子式,后用线标出化学键种类
A、HCl
B、N2
C、NaCl
D、NaOH
E、Na2O2
F、NH4Cl
H Cl
N N
Na Cl
+
[ ]
-
Na O H
[ ]
+
—
Na O O Na
[ ]
2-
+
+
N
H
H
H
H
Cl
[ ]
-
[ ]
+
极性共价键
非极性共价键
离子键
习题巩固
2、判断以下说法的正误
A、离子化合物一定含离子键,共价化合物一定含共价键。
B、含离子键的化合物一定为离子化合物。
C、金属元素与非金属元素之间一定形成离子键。
D、由非金属元素组成的化合物一定不含离子键。
E、有离子就一定可以形成离子键。
×
×
×
√
√
习题巩固
3、下列说法正确的是( )
A、含有金属元素的化合物一定是离子化合物
B、第ⅠA族和第ⅦA族原子化合时,一定生成离子键
C、由非金属元素形成的化合物一定不是离子化合物
D、活泼金属与非金属化合时,能形成离子键
D
如:AlCl3
如:HCl
如:NH4Cl
√
×
×
×
习题巩固
4、下列说法正确的是( )
A.离子键就是使阴、阳离子结合成化合物的静电引力
B.所有金属与所有非金属原子之间都能形成离子键
C.在化合物CaCl2中,两个氯离子之间也存在离子键
D.钠原子与氯原子结合成氯化钠后体系能量降低
D
√
×
×
×
静电引力和静电斥力
AlCl3为共价化合物
习题巩固
我们学了原子间通过强烈的相互作用(共用电子对)形成了共价键,从而形成了分子。那么,分子之间是否也有相互作用呢
(1)存在:分子间
1、概念:分子间存在的将分子聚集在一起的作用力称为分子间作用力,又称为范德华力。
(2)大小:比化学键弱得多。
2、意义:影响物质的熔沸点和溶解性等物理性质
1.5 分子间作用力
规律:一般来说,组成相似的分子,相对分子质量越大,分子间作用力越大,熔沸点越高。
如:沸点:O2>N2>H2 HI>HBr>HCl
物质 F2 Cl2 Br2 I2
相对分子量 38 71 160 254
熔点(℃) -219.6 -101 -7.2 113.5
沸点(℃) -188.1 -34.6 58.78 184.4
熔沸点变化趋势
熔沸点逐渐升高
H2O
H2S
H2Se
H2Te
HF
HCl
HBr
HI
NH3
PH3
AsH3
SbH3
CH4
SiH4
GeH4
SnH4
一些氢化物的沸点
为什么HF、H2O和NH3的沸点会反常呢?
在H2O分子中,由于O原子吸引电子的能力很强,H—O键的极性很强,共用电子对强烈地偏向O原子,亦即H原子的电子云被O原子吸引,使H原子几乎成为“裸露”的质子。这个半径很小、带部分正电荷的H核,就能与另一个H2O分子中带部分负电荷的O原子的孤电子对接近并产生相互作用。这种静电相互作用就是氢键。
水分子间形成的氢键
定义:由于氢原子的存在而使分子间产生的一种比分子间作用力稍强的相互作用——氢键。
(1)氢键不属于化学键,比化学键弱得多,比分子间作用力稍强,也属于分子间作用力的范畴,
(2)形成条件:氢原子与得电子能力很强、原子半径很小的原子形成的分子之间。如HF、H2O、NH3等分子间易形成氢键。
1.6 氢键
1.6 氢键
(3)表示方法:一般表示为X—H···Y,其中H···Y的结合力就是氢键。
①对熔点和沸点的影响
分子间形成氢键会导致物质的熔沸点升高
分子内形成氢键则会导致物质的熔沸点降低
②对溶解度的影响
溶质分子与溶剂分子之间形成氢键使溶解度增大。
氢键对物质性质的影响
化学键、氢键和范德华力的比较
化学键 氢 键 范德华力
概 念
范 围
强度比较
性质影响
物质分子间存在的微弱相互作用
分子间
比化学键弱得多
随范德华力的增大,物质的熔沸点升高、溶解度增大
比化学键弱得多,比范德华力稍强
分子中含有与H原子相结合的原子半径小、电负性大、有孤对电子的F、O、N
分子间(内)电负性较大的成键原子通过H原子而形成的静电作用
分子间氢键使物质熔沸点升高硬度增大、水中溶解度增大
分子内氢键使物质熔沸点降低、硬度减小
影响物质的化学性质和物理性质
相邻的原子或离子之间的强烈的相互作用。
原子或离子
很强烈,克服它需要较高的能量
如化学反应:H2+Cl2=====2HCl。实质:旧键断裂:H—H―→H+H(吸收能量)Cl—Cl―→Cl+Cl(吸收能量)新键的形成:H+Cl―→H—Cl(放出能量)
【点拨提升】
1.化学反应的本质一个化学反应过程,本质上就是旧化学键的断裂和新化学键的形成过程。
点燃
(1)化学反应过程中,反应物中的化学键被破坏。(2)离子化合物的溶解或熔化过程。离子化合物―――→电离―――→阴、阳离子
溶解或熔化
离子键被破坏
2.化学键的破坏
①溶解过程:能与水反应的共价化合物如SO2、CO2共价键被破坏属于共价化合物的电解质如H2SO4、HCl共价键断裂生成阴、阳离子部分非电解质如蔗糖、酒精共价键不被破坏
(3)共价化合物的溶解或熔化过程。
②熔化:
①由分子构成的固体单质,如I2的升华、P4的熔化只破坏分子间作用力,而不破坏化学键。②由原子构成的单质,如金刚石、晶体硅,熔化时破坏共价键。③对于某些活泼的非金属单质,溶于水后,能与水反应,其分子内共价键被破坏,如Cl2、F2等。
(4)单质的熔化或溶解过程。
【典题例证】
在下列变化①I2升华,②烧碱熔化,③NaCl溶于水,④HCl溶于水,⑤O2溶于水,⑥氯化铵受热分解,未发生化学键破坏的是________;仅发生离子键破坏的是________;仅发生共价键破坏的是________;既发生离子键破坏,又发生共价键破坏的是________。
①⑤
②③
④
⑥
【学以致用】 在下列变化过程中,属于“破坏极性键和非极性键→形成极性键和非极性键”过程的是( )A.冰→水→水蒸气→H2和O2B.2Na+Cl2===2NaClC.2H2+O2=====2H2OD.2H2O2=====2H2O+O2↑
点燃
MnO2
D
第四章第三节
化学键
118种元素、不少于1000种原子、8000多万种物质
定义: 相邻的两个或多个原子或离子之间强烈的相互作用叫做化学键。
离子键
共价键
1化学键
化学键的类型
2Na+Cl2 = 2NaCl
点燃
分析氯化钠的形成过程
Cl
+17
8
7
2
Na+
Cl-
+11
8
2
Na+
+17
8
8
2
Cl-
Na
+11
8
1
2
[思 考]在氯化钠中Na+和Cl- 间存在哪些作用力?
1.1离子键
不稳定
稳定
静电吸引作用
静电排斥作用
定义:
把带相反电荷的离子之间的相互作用称为离子键。
1.1离子键
成键粒子:
阴离子、阳离子
成键的性质:
静电作用(吸引和排斥)
成键的原因:
电子的得失、静电平衡、体系总能量降低
存在物质:
离子化合物
1.2离子化合物
定义:由离子键构成的化合物
分类:
(1)二元素化合物:
活泼的金属元素(ⅠA、ⅡA)和活泼的非金属元素(ⅥA、ⅦA)之间形成的化合物。除 AlCl3
(2)多元素化合物:
①强碱:NaOH、KOH
②含氧酸盐:Na2SO4、KNO3
③氨盐:NH4Cl、NH4NO3
离子键的强弱取决于成键离子的半径以及所带电荷数
影响因素:
离子键
意义:
比较熔沸点和溶解性
表示方法:
1.2离子化合物
电子式
概念:在元素符号周围用“ · ”或“×”来表示原子或离子最外层电子的式子,叫电子式。
Na ·
·Mg ·
·O·
··
··
Cl ·
··
··
··
原子的电子式:
1.3电子式
在元素符号周围用小点“.”或小叉“×”来表示其最外层电子数
(统一)
Cl
O
2-
①阴离子的电子式
简单阴离子:
复杂的阴离子:
O
H
-
一般用 表示
R
n-
使每一个原子达到稳定结构
S
2-
离子的电子式:
②阳离子的电子式
简单的阳离子:
复杂的阳离子:
即离子符号
如NH4+:
N
H
+
H
H
H
.
H+
离子的电子式:
【练习】写出下列微粒的电子式:
硫原子,溴原子, 硫离子, 溴离子、铝离子
·S·
··
··
Br ·
··
··
··
[ S ]2-
··
··
:
:
[ Br ]-
··
··
:
:
由阳离子的电子式和阴离子的电子式组合而成.
注意:相同的离子不能合并写(每个离子都要单独写),一般对称排列. 如:
离子化合物的电子式:
AB型
A2B型
AB2型
练习:写出MgO、K2S、CaF2、NH4Cl的电子式
Mg
2
Br
Br
Br
Mg
Br
S
2-
K
K
S
K
K
例:
左侧写原子的电子式,右侧写离子化合物的电子式,中间用 连接.
注意:用弧形箭头表示电子转移的方向.
用电子式表示离子化合物的形成过程
练习:用电子式表示离子化合物的形成过程
1、Na2O 2、 CaCl2
Na + O + Na
‥
‥
Na
∶O∶
‥
‥
[ ]
+
2-
Na
+
Cl + Ca + Cl
‥
‥
∶
∶
∶
∶
∶
‥
‥
‥
‥
∶
‥
‥
Cl Ca Cl
[ ]
[ ]
-
-
2+
1、下列说法正确的是( )
A、离子键就是阴阳离子间的静电引力
B、所有金属元素与所有非金属间都能形成离子键
C、钠原子与氯原子结合成氯化钠后体系很稳定
D、在离子化合物氯化钙中,两个氯原子间也存在离子键
C
2、下列各数值表示有关元素的原子序数,能以离子键相互结合成稳定化合物的是( )
A、10和19
B、6和16
C、11和17
D、14和8
C
Ne是惰性气体,不能与钾元素形成稳定的化合物
碳与硫以共价键形成共价化合物
钠与氯以离子键形成离子化合物
硅与氧以共价键形成共价化合物
×
×
×
√
3、下列用电子式表示化合物的形成过程正确的是( )
K
O
K
O
]
[
K
2
K
A、
[
]
Ba
[
]
Cl
[
]
Cl
2
Ba
Cl
Cl
B、
]
Mg
F
F
Mg
F
2
[
2
C、
Cl
]
[
H
Cl
H
D、
A
Ba
[
]
Cl
[
]
Cl
2
]
Mg
F
2
[
]
F
[
Cl
H
×
×
×
√
电子式
离子键
1. 离子键的概念及其成键粒子、成键本质
2. 离子键可由原子得失电子后形成,也可由离子直接形成
3. 由离子键形成离子化合物
电子式
离子键
(1)原子的电子式在元素符号四个方向逐一放置最外层电子
(2)简单离子的电子式(简单阳离子及简单阴离子和离子化合物)
(3)用电子式表示由原子形成离子化合物的过程
··
· Cl
··
:
H ·
+
→
Cl
··
··
H
··
··
共用电子对
在HCl分子的形成过程中,没有发生电子的得失,而是通过共用电子对双方达到稳定结构
1.4共价键
原子之间通过共用电子对所形成的强烈相互作用,叫共价键
1、共价键定义
成键微粒
成键本质
原 子
共用电子对
2、共价键的成键特点
成键条件
一般由非金属元素形成
1.4共价键
3、用电子式表示原子形成共价键
HCl
H2O
H2
NH3
CO2
H ·
· H
+
→
H H
··
··
· Cl
··
:
H ·
+
→
··
··
Cl
H
··
··
··
· O ·
··
H ·
+
· H
+
··
→
O
··
H
H
:
:
··
··
+
· O ·
··
+
:
C
:
· O ·
··
→
C
:
:
O
··
··
O
··
··
:
:
3H ·
+
:
· N
·
·
→
··
N
H
:
:
··
H
H
1.4共价键
(2)四种常见的共价化合物
①非金属氢化物:如NH3、H2S、H2O等。
②非金属氧化物:如CO、CO2、SO2等。
③酸:如H2SO4、HNO3等。
④大多数有机化合物:如CH4、CH3CH2OH等。
1.4共价键
4、共价键的存在
(1) 多原子非金属单质
如:Cl2、 O3、 P4
(1)电子式
①每个原子一般达到相对稳定结构
②不加中括号[ ],不标正负电荷数
③原子周围共用电子对数=8-原子最外层电子数
5、分子的电子式和结构式
(2)结构式
分别用“-、═、≡”表示一对、二对和三对共用电子对
H-O-H
H-H
H-Cl
O =C =O
1.4共价键
氯气
写出下列物质的电子式和结构式
溴化氢
过氧化氢
甲烷
氮气
Cl Cl
:
:
:
:
:
:
:
…
N N
··
…
··
Cl-Cl
H-Br
N≡N
H-C -H
H
H
-
-
H-O-O-H
﹕
H Br
﹕
﹕
﹕
H
H C H
H
﹕
﹕
﹕
﹕
﹕
﹕
H O O H
﹕
﹕
﹕
﹕
﹕
5、分子的电子式和结构式
1.4共价键
6、共价键的分类
非极性键:共用电子对不发生偏移
电子对不偏移
极性键:共用电子对偏向某一方
电子对偏向Cl
Cl
··
··
H
··
··
H H
··
成键元素相同
成键元素不同
1.4共价键
指出下列物质中的共价键类型
O2
CH4
CO2
H2O2
Na2O2
NaOH
6、共价键的分类
非极性键
极性键
极性键
(H-O-O-H)
极性键
非极性键
非极性键
极性键
1.4共价键
⑴化学键
7、化学键
⑵化学键的分类
离子键
共价键
非极性键
极性键
使离子或原子相结合的强烈相互作用
⑶化学反应的实质
点燃
Cl2+2H2 == 2HCl
先破坏非极性键
后形成极性键
AgNO3 NaCl = AgCl ↓ + NaNO3
先破坏离子键
后形成离子键
化学键先破后立的过程
1.4共价键
化学键
共价键
(1)共价键的定义及其成键微粒和成键本质
(2)共价键的成键条件及共价键的存在
(3)共价键的存在及分类
(4)分子的电子式和结构式
化学键
共价键
化学键的分类(离子键和共价键)
化学反应的实质(旧键的断裂和新键的形成)
离子化合物与共价化合物的比较
【点拨提升】
离子化合物 共价化合物
概念 由离子键构成的化合物 以共用电子对形成的化合物
构成粒子 阴、阳离子 原子
粒子间 的作用 离子键 共价键
实例 强碱、大多数盐、活泼金属的氧化物 酸、非金属的氢化物、非金属的氧化物
归纳总结
判断离子化合物、共价化合物的方法
(1)根据化合元素的性质判断
离子化合物:活泼的金属元素跟活泼的非金属元素化合时形成的化合物
共价化合物:不同种非金属元素形成的化合物
常见的活泼金属元素是元素周期表中第ⅠA族的金属元素和第ⅡA族中除铍以外的金属元素;常见的活泼非金属元素是元素周期表中第ⅦA族元素,还有氮、氧、硫等元素。如NaCl、CaO、K2S、Mg3N2等都是典型的离子化合物。
(2)根据组成化合物的粒子类型判断
化合物中,由阴、阳离子组成的是离子化合物,其他的是共价化合物。
(3)根据化合物的基本类型判断
离子化合物:活泼金属氧化物、活泼金属氢化物、金属过氧化物、强碱和大多数盐(除AlCl3、BeCl2、Pb(CH3COO)2)
共价化合物:非金属氢化物、非金属氧化物、含氧酸、大多数有机物
概念辨析
(1)共价键与离子键的成键微粒是一样的( )
(2)金属元素与非金属元素只能形成离子键( )
(3)非金属元素只能形成共价键( )
(4)共价化合物H2O2只含共价键,离子化合物Na2O2只含离子键( )
(5)H2O2中既有极性键,又含有非极性键( )
×
×
×
×
√
1.(2019·哈尔滨高一期中)下列说法中正确的是
A.HCl中存在离子键,属于离子化合物
B.由非金属元素组成的化合物一定是共价化合物
C.熔融状态下能导电的化合物一定是离子化合物
D.阴、阳离子间通过静电引力而形成的化学键叫做离子键
解析 HCl分子中只存在共价键,属于共价化合物,A错误;
由非金属元素组成的化合物中可能含有离子键,如铵盐,B错误;
在熔融状态下共价键不能被破坏,离子键可以被破坏,所以熔融状态下能导电的化合物一定是离子化合物,C正确;
阴、阳离子通过静电作用而形成的化学键称为离子键,静电作用包含静电引力和电子之间、原子核之间的斥力,D错误。
√
2.对于HCl、H2SO4、NaOH、NaCl、NH4Cl、Ne、N2、金刚石,回答下列问题:
(1)不存在化学键的_________________________。
(2)属于共价化合物的_______________________。
(3)属于离子化合物的______________________。
(4)既含离子键,又含共价键的_______________。
答案 (1)Ne (2)HCl、H2SO4 (3)NaOH、NaCl、NH4Cl 4)NaOH、NH4Cl
(1)“三个一定”
①离子化合物中一定含离子键。
②含离子键的一定是离子化合物。
③共价化合物中一定不含离子键。
(2)“三个可能”
①离子化合物中可能含有共价键,如NaOH。
②金属与非金属形成的化合物可能是共价化合物,如AlCl3。
③完全由非金属形成的化合物可能是离子化合物,如NH4Cl。
【点拨提升】
化学键和化合物关系的“三个一定”和“三个可能”
通过化学键判断离子化合物和共价化合物
1、画出下列物质的电子式,后用线标出化学键种类
A、HCl
B、N2
C、NaCl
D、NaOH
E、Na2O2
F、NH4Cl
H Cl
N N
Na Cl
+
[ ]
-
Na O H
[ ]
+
—
Na O O Na
[ ]
2-
+
+
N
H
H
H
H
Cl
[ ]
-
[ ]
+
极性共价键
非极性共价键
离子键
习题巩固
2、判断以下说法的正误
A、离子化合物一定含离子键,共价化合物一定含共价键。
B、含离子键的化合物一定为离子化合物。
C、金属元素与非金属元素之间一定形成离子键。
D、由非金属元素组成的化合物一定不含离子键。
E、有离子就一定可以形成离子键。
×
×
×
√
√
习题巩固
3、下列说法正确的是( )
A、含有金属元素的化合物一定是离子化合物
B、第ⅠA族和第ⅦA族原子化合时,一定生成离子键
C、由非金属元素形成的化合物一定不是离子化合物
D、活泼金属与非金属化合时,能形成离子键
D
如:AlCl3
如:HCl
如:NH4Cl
√
×
×
×
习题巩固
4、下列说法正确的是( )
A.离子键就是使阴、阳离子结合成化合物的静电引力
B.所有金属与所有非金属原子之间都能形成离子键
C.在化合物CaCl2中,两个氯离子之间也存在离子键
D.钠原子与氯原子结合成氯化钠后体系能量降低
D
√
×
×
×
静电引力和静电斥力
AlCl3为共价化合物
习题巩固
我们学了原子间通过强烈的相互作用(共用电子对)形成了共价键,从而形成了分子。那么,分子之间是否也有相互作用呢
(1)存在:分子间
1、概念:分子间存在的将分子聚集在一起的作用力称为分子间作用力,又称为范德华力。
(2)大小:比化学键弱得多。
2、意义:影响物质的熔沸点和溶解性等物理性质
1.5 分子间作用力
规律:一般来说,组成相似的分子,相对分子质量越大,分子间作用力越大,熔沸点越高。
如:沸点:O2>N2>H2 HI>HBr>HCl
物质 F2 Cl2 Br2 I2
相对分子量 38 71 160 254
熔点(℃) -219.6 -101 -7.2 113.5
沸点(℃) -188.1 -34.6 58.78 184.4
熔沸点变化趋势
熔沸点逐渐升高
H2O
H2S
H2Se
H2Te
HF
HCl
HBr
HI
NH3
PH3
AsH3
SbH3
CH4
SiH4
GeH4
SnH4
一些氢化物的沸点
为什么HF、H2O和NH3的沸点会反常呢?
在H2O分子中,由于O原子吸引电子的能力很强,H—O键的极性很强,共用电子对强烈地偏向O原子,亦即H原子的电子云被O原子吸引,使H原子几乎成为“裸露”的质子。这个半径很小、带部分正电荷的H核,就能与另一个H2O分子中带部分负电荷的O原子的孤电子对接近并产生相互作用。这种静电相互作用就是氢键。
水分子间形成的氢键
定义:由于氢原子的存在而使分子间产生的一种比分子间作用力稍强的相互作用——氢键。
(1)氢键不属于化学键,比化学键弱得多,比分子间作用力稍强,也属于分子间作用力的范畴,
(2)形成条件:氢原子与得电子能力很强、原子半径很小的原子形成的分子之间。如HF、H2O、NH3等分子间易形成氢键。
1.6 氢键
1.6 氢键
(3)表示方法:一般表示为X—H···Y,其中H···Y的结合力就是氢键。
①对熔点和沸点的影响
分子间形成氢键会导致物质的熔沸点升高
分子内形成氢键则会导致物质的熔沸点降低
②对溶解度的影响
溶质分子与溶剂分子之间形成氢键使溶解度增大。
氢键对物质性质的影响
化学键、氢键和范德华力的比较
化学键 氢 键 范德华力
概 念
范 围
强度比较
性质影响
物质分子间存在的微弱相互作用
分子间
比化学键弱得多
随范德华力的增大,物质的熔沸点升高、溶解度增大
比化学键弱得多,比范德华力稍强
分子中含有与H原子相结合的原子半径小、电负性大、有孤对电子的F、O、N
分子间(内)电负性较大的成键原子通过H原子而形成的静电作用
分子间氢键使物质熔沸点升高硬度增大、水中溶解度增大
分子内氢键使物质熔沸点降低、硬度减小
影响物质的化学性质和物理性质
相邻的原子或离子之间的强烈的相互作用。
原子或离子
很强烈,克服它需要较高的能量
如化学反应:H2+Cl2=====2HCl。实质:旧键断裂:H—H―→H+H(吸收能量)Cl—Cl―→Cl+Cl(吸收能量)新键的形成:H+Cl―→H—Cl(放出能量)
【点拨提升】
1.化学反应的本质一个化学反应过程,本质上就是旧化学键的断裂和新化学键的形成过程。
点燃
(1)化学反应过程中,反应物中的化学键被破坏。(2)离子化合物的溶解或熔化过程。离子化合物―――→电离―――→阴、阳离子
溶解或熔化
离子键被破坏
2.化学键的破坏
①溶解过程:能与水反应的共价化合物如SO2、CO2共价键被破坏属于共价化合物的电解质如H2SO4、HCl共价键断裂生成阴、阳离子部分非电解质如蔗糖、酒精共价键不被破坏
(3)共价化合物的溶解或熔化过程。
②熔化:
①由分子构成的固体单质,如I2的升华、P4的熔化只破坏分子间作用力,而不破坏化学键。②由原子构成的单质,如金刚石、晶体硅,熔化时破坏共价键。③对于某些活泼的非金属单质,溶于水后,能与水反应,其分子内共价键被破坏,如Cl2、F2等。
(4)单质的熔化或溶解过程。
【典题例证】
在下列变化①I2升华,②烧碱熔化,③NaCl溶于水,④HCl溶于水,⑤O2溶于水,⑥氯化铵受热分解,未发生化学键破坏的是________;仅发生离子键破坏的是________;仅发生共价键破坏的是________;既发生离子键破坏,又发生共价键破坏的是________。
①⑤
②③
④
⑥
【学以致用】 在下列变化过程中,属于“破坏极性键和非极性键→形成极性键和非极性键”过程的是( )A.冰→水→水蒸气→H2和O2B.2Na+Cl2===2NaClC.2H2+O2=====2H2OD.2H2O2=====2H2O+O2↑
点燃
MnO2
D
