甘肃省古浪三中2023年春学期高二年级开校考试化学试卷(含答案)
文档属性
| 名称 | 甘肃省古浪三中2023年春学期高二年级开校考试化学试卷(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 373.4KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-09 15:53:07 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
2023年春学期高二年级开校考试试卷
化 学
(满分 100 分,考试时间60分钟)
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息
2.请将答案正确填写在答题卡上
第I卷(选择题)
一、单选题(每小题4分,总60分)
1.下列图示的能量转变中主要转化为化学能的是( )
A.光合作用 B.核电站
C.发射导弹 D.水果电池
2.下列反应属于吸热反应的是( )
A.锌粒与稀硫酸的反应 B.NaOH与稀硫酸的反应
C.酒精在空气中燃烧的反应 D.Ba(OH)2 8H2O晶体与NH4Cl晶体的反应
3.下列关于燃料充分燃烧的说法中,不正确的是( )
A.热能要充分利用 B.固体燃料要粉碎
C.空气的量越多越好 D.液体燃料喷成雾状
4.下列说法正确的是( )
A.反应2Mg(s)+CO2(g)=C(s)+2MgO(s)能自发进行,则该反应的ΔH<0
B.ΔH<0、ΔS<0的反应在高温条件下能自发进行
C.反应MgCO3(s)=MgO(s)+CO2(g)的ΔS<0
D.同一物质的固、液、气三种状态的熵值相同
5.下列不属于自发进行的变化是( )
A.红墨水加到清水使整杯水变红 B.冰在室温下融化成水
C.电解饱和食盐水 D.铁器在潮湿的空气中生锈
6.对已达平衡的下列反应:3A(g)+B(g) 2C(g)+2D(g),若增大压强,则所产生的影响正确的是( )
A.正反应速率增大,逆反应速率减小,平衡向正反应方向移动
B.正、逆反应速率都增大,平衡不发生移动
C.正反应速率减小,逆反应速率增大,平衡向逆反应方向移动
D.正、逆反应速率都增大,平衡向正反应方向移动
7.在2A+B=3C+4D反应中,表示该反应速率最快的是( )
A.v(A)=0.5mol·L-1·s-1 B.v(B)=0.3mol·L-1·s-1
C.v(C)=0.8mol·L-1·s-1 D.v(D)=1mol·L-1·s-1
8.当Mg(OH)2固体在水中溶解达到平衡时:Mg(OH)2 (s) Mg2++2OH- ,为使Mg(OH)2固体的量减少,可加入的物质是( )
A.MgSO4 B.NaOH C.HCl D.NaCl
9.常温下,在0.01mol/L氨水中,水的离子积是( )
A. B. C. D.
10.水溶液呈碱性的是( )
A.CH3COONa B.NaHSO4 C.NaCl D.NaNO3
11.有一支25.00 mL酸式滴定管,其中盛有溶液,液面恰好在5.00mL 刻度处,把滴定管的溶液全部排出,则排出的溶液的体积是( )
A.小于20.00 mL B.大于20.00 mL
C.20.00 mL D.25.00 mL
12.X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X和Y组成原电池时,Y为电池的负极。X、Y、Z三种金属的活动性顺序为( )
A.X>Y>Z B.X>Z>Y C.Y>X>Z D.Y>Z>X
13.下列说法中正确的是( )
A.时Kw为,pH=6的纯水呈酸性
B.常温下将1mL1×10-6mol/L的稀盐酸稀释至1000mL,所得溶液的pH为9
C.常温下当水电离的c(H+)为1×10-13mol/L时,此溶液的pH可能为1或13
D.常温下将pH=2的盐酸与醋酸各分别稀释至100mL,所得醋酸溶液的pH更大
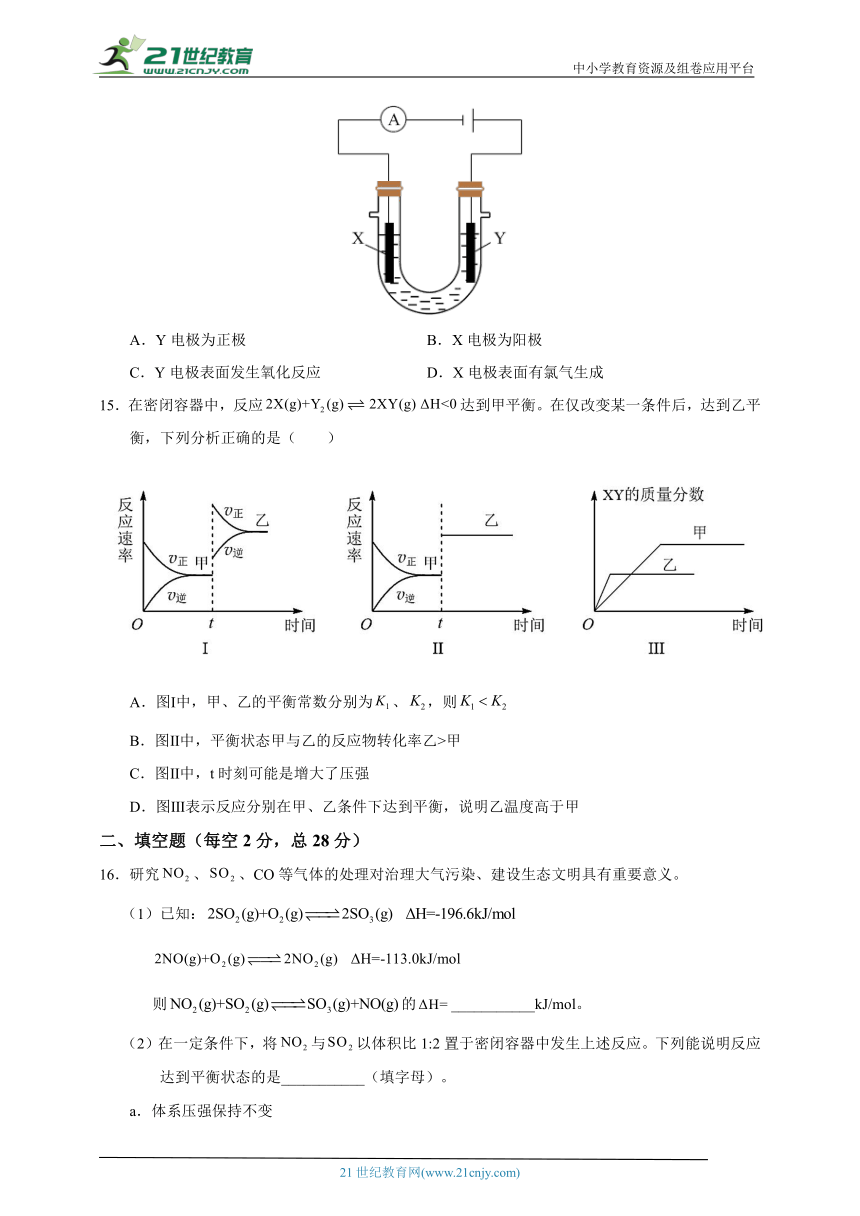
14.用如图所示装置电解氯化钠溶液(X、Y是碳棒)。下列判断正确的是( )
A.Y电极为正极 B.X电极为阳极
C.Y电极表面发生氧化反应 D.X电极表面有氯气生成
15.在密闭容器中,反应达到甲平衡。在仅改变某一条件后,达到乙平衡,下列分析正确的是( )
A.图Ⅰ中,甲、乙的平衡常数分别为、,则
B.图Ⅱ中,平衡状态甲与乙的反应物转化率乙>甲
C.图Ⅱ中,t时刻可能是增大了压强
D.图Ⅲ表示反应分别在甲、乙条件下达到平衡,说明乙温度高于甲
二、填空题(每空2分,总28分)
16.研究、、CO等气体的处理对治理大气污染、建设生态文明具有重要意义。
(1)已知:
则的___________kJ/mol。
(2)在一定条件下,将与以体积比1:2置于密闭容器中发生上述反应。下列能说明反应达到平衡状态的是___________(填字母)。
a.体系压强保持不变
b.混合气体的颜色保持不变
c.和NO的体积比保持不变
d.每生成1mol的同时消耗1mol
17.如图表示800℃时A、B、C三种气体物质的浓度随时间变化的情况,t是到达平衡状态的时间。试回答:
(1)该反应的反应物是_______。
(2)该反应的化学反应方程式为_______。
(3)若达到平衡状态的时间是2min,A物质的平均反应速率为_______。
18.常温下,有四种溶液:
①0.1 mol·L-1 CH3COOH溶液 ②0.1 mol·L-1 CH3COONa溶液 ③0.1 mol·L-1 NaHSO3溶液④0.1 mol·L-1 NaHCO3溶液
(1)溶液①的pH____(填“>”“<”或“=”)7。
(2)溶液②呈______(填“酸”“碱”或“中”)性。其原因是_____________(用离子方程式说明)。
(3)下列有关①和②两种溶液的说法正确的是_______(填字母)。
a.两种溶液中c(CH3COO-) 都等于0.1 mol·L-1
b.两种溶液中c(CH3COO-) 都小于0.1 mol·L-1
c.CH3COOH溶液中c(CH3COO-) 小于CH3COONa溶液中c(CH3COO-)
19.原电池原理的发现和各种电池装置的发明,改变了人们的生活方式。
(1)将锌片放入盛有稀硫酸的烧杯中,反应的离子方程式为___________。
(2)将锌片、铜片按照如图所示装置连接,锌片是______________(填“正极”或“负极”),锌片上发生反应的电极反应式为______________;能证明化学能转化为电能的实验现象是:电流表指针偏转,铜片______________。
(3)下列反应通过原电池装置,可实现化学能直接转化为电能的是___________(填序号)。
①CH4 + 2O2 CO2 + 2H2O ②Fe + Cu2+=Cu + Fe2+③ CaO + H2O =Ca(OH)2
三、实验题(每空2分,总12分)
20.某学生用已知物质的量浓度的标难溶液来测定未知物质的量浓度的盐酸时,选择酚酞作指示剂。请回答下列问题:
(1)配制标准溶液。配制所需的玻璃仪器有:烧杯、量筒,玻璃棒、_________、_______。
(2)若滴定开始和结束时,碱式滴定管中的液面如图所示,所用NaOH标准溶液的体积为________。
(3)滴定过程中边滴加边摇动锥形瓶,直到加入半滴溶液后,___________,表明已经到达滴定终点。
(4)某学生根据3次实验分别记录有关数据如表所示:
滴定次数 待测盐酸的体积 标准溶液体积
滴定前的刻度/mL 滴定后的刻度
第一次 25.00 0.00 26.11
第二次 25.00 1.56 30.30
第三次 25.00 0.22 26.31
依据表中数据计算该盐酸的物质的量浓度为___________。
(5)在上述实验中,下列操作会造成测定结果偏低的有___________(填字母)。
a.滴定结束后盛装标准液的滴定管有气泡
b.锥形瓶水洗后末干燥
c.碱式滴定管水洗后末用标准溶液润洗
d.滴定终点时俯视读数
参考答案
一、单选题(每小题4分,总60分)
1.A 2.D 3.C 4.A 5.C 6.B 7.B 8.C
9.A 10.A 11.B 12.C 13.C 14.C 15.D
二、填空题(每空2分,总28分)
16.(4分)
(1)-41.8
(2)b
17.(6分)
(1)A
(2)3A(g)B(g)+3C(g)
(3)0.6mol/(L·min)
18.(8分) < 碱 CH3COO-+H2OCH3COOH+OH- bc
19.(10分) Zn +2H+=Zn2+ + H2↑ 负极 Zn–2e-=Zn2+ 有气泡产生 ① ②
三、实验题(每空2分,总12分)
20.(1) 容量瓶 胶头滴管
(2)26.10
(3)溶液由无色变为浅红色且半分钟内不褪色
(4)0.1044
(5)ad
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
2023年春学期高二年级开校考试试卷
化 学
(满分 100 分,考试时间60分钟)
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息
2.请将答案正确填写在答题卡上
第I卷(选择题)
一、单选题(每小题4分,总60分)
1.下列图示的能量转变中主要转化为化学能的是( )
A.光合作用 B.核电站
C.发射导弹 D.水果电池
2.下列反应属于吸热反应的是( )
A.锌粒与稀硫酸的反应 B.NaOH与稀硫酸的反应
C.酒精在空气中燃烧的反应 D.Ba(OH)2 8H2O晶体与NH4Cl晶体的反应
3.下列关于燃料充分燃烧的说法中,不正确的是( )
A.热能要充分利用 B.固体燃料要粉碎
C.空气的量越多越好 D.液体燃料喷成雾状
4.下列说法正确的是( )
A.反应2Mg(s)+CO2(g)=C(s)+2MgO(s)能自发进行,则该反应的ΔH<0
B.ΔH<0、ΔS<0的反应在高温条件下能自发进行
C.反应MgCO3(s)=MgO(s)+CO2(g)的ΔS<0
D.同一物质的固、液、气三种状态的熵值相同
5.下列不属于自发进行的变化是( )
A.红墨水加到清水使整杯水变红 B.冰在室温下融化成水
C.电解饱和食盐水 D.铁器在潮湿的空气中生锈
6.对已达平衡的下列反应:3A(g)+B(g) 2C(g)+2D(g),若增大压强,则所产生的影响正确的是( )
A.正反应速率增大,逆反应速率减小,平衡向正反应方向移动
B.正、逆反应速率都增大,平衡不发生移动
C.正反应速率减小,逆反应速率增大,平衡向逆反应方向移动
D.正、逆反应速率都增大,平衡向正反应方向移动
7.在2A+B=3C+4D反应中,表示该反应速率最快的是( )
A.v(A)=0.5mol·L-1·s-1 B.v(B)=0.3mol·L-1·s-1
C.v(C)=0.8mol·L-1·s-1 D.v(D)=1mol·L-1·s-1
8.当Mg(OH)2固体在水中溶解达到平衡时:Mg(OH)2 (s) Mg2++2OH- ,为使Mg(OH)2固体的量减少,可加入的物质是( )
A.MgSO4 B.NaOH C.HCl D.NaCl
9.常温下,在0.01mol/L氨水中,水的离子积是( )
A. B. C. D.
10.水溶液呈碱性的是( )
A.CH3COONa B.NaHSO4 C.NaCl D.NaNO3
11.有一支25.00 mL酸式滴定管,其中盛有溶液,液面恰好在5.00mL 刻度处,把滴定管的溶液全部排出,则排出的溶液的体积是( )
A.小于20.00 mL B.大于20.00 mL
C.20.00 mL D.25.00 mL
12.X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X和Y组成原电池时,Y为电池的负极。X、Y、Z三种金属的活动性顺序为( )
A.X>Y>Z B.X>Z>Y C.Y>X>Z D.Y>Z>X
13.下列说法中正确的是( )
A.时Kw为,pH=6的纯水呈酸性
B.常温下将1mL1×10-6mol/L的稀盐酸稀释至1000mL,所得溶液的pH为9
C.常温下当水电离的c(H+)为1×10-13mol/L时,此溶液的pH可能为1或13
D.常温下将pH=2的盐酸与醋酸各分别稀释至100mL,所得醋酸溶液的pH更大
14.用如图所示装置电解氯化钠溶液(X、Y是碳棒)。下列判断正确的是( )
A.Y电极为正极 B.X电极为阳极
C.Y电极表面发生氧化反应 D.X电极表面有氯气生成
15.在密闭容器中,反应达到甲平衡。在仅改变某一条件后,达到乙平衡,下列分析正确的是( )
A.图Ⅰ中,甲、乙的平衡常数分别为、,则
B.图Ⅱ中,平衡状态甲与乙的反应物转化率乙>甲
C.图Ⅱ中,t时刻可能是增大了压强
D.图Ⅲ表示反应分别在甲、乙条件下达到平衡,说明乙温度高于甲
二、填空题(每空2分,总28分)
16.研究、、CO等气体的处理对治理大气污染、建设生态文明具有重要意义。
(1)已知:
则的___________kJ/mol。
(2)在一定条件下,将与以体积比1:2置于密闭容器中发生上述反应。下列能说明反应达到平衡状态的是___________(填字母)。
a.体系压强保持不变
b.混合气体的颜色保持不变
c.和NO的体积比保持不变
d.每生成1mol的同时消耗1mol
17.如图表示800℃时A、B、C三种气体物质的浓度随时间变化的情况,t是到达平衡状态的时间。试回答:
(1)该反应的反应物是_______。
(2)该反应的化学反应方程式为_______。
(3)若达到平衡状态的时间是2min,A物质的平均反应速率为_______。
18.常温下,有四种溶液:
①0.1 mol·L-1 CH3COOH溶液 ②0.1 mol·L-1 CH3COONa溶液 ③0.1 mol·L-1 NaHSO3溶液④0.1 mol·L-1 NaHCO3溶液
(1)溶液①的pH____(填“>”“<”或“=”)7。
(2)溶液②呈______(填“酸”“碱”或“中”)性。其原因是_____________(用离子方程式说明)。
(3)下列有关①和②两种溶液的说法正确的是_______(填字母)。
a.两种溶液中c(CH3COO-) 都等于0.1 mol·L-1
b.两种溶液中c(CH3COO-) 都小于0.1 mol·L-1
c.CH3COOH溶液中c(CH3COO-) 小于CH3COONa溶液中c(CH3COO-)
19.原电池原理的发现和各种电池装置的发明,改变了人们的生活方式。
(1)将锌片放入盛有稀硫酸的烧杯中,反应的离子方程式为___________。
(2)将锌片、铜片按照如图所示装置连接,锌片是______________(填“正极”或“负极”),锌片上发生反应的电极反应式为______________;能证明化学能转化为电能的实验现象是:电流表指针偏转,铜片______________。
(3)下列反应通过原电池装置,可实现化学能直接转化为电能的是___________(填序号)。
①CH4 + 2O2 CO2 + 2H2O ②Fe + Cu2+=Cu + Fe2+③ CaO + H2O =Ca(OH)2
三、实验题(每空2分,总12分)
20.某学生用已知物质的量浓度的标难溶液来测定未知物质的量浓度的盐酸时,选择酚酞作指示剂。请回答下列问题:
(1)配制标准溶液。配制所需的玻璃仪器有:烧杯、量筒,玻璃棒、_________、_______。
(2)若滴定开始和结束时,碱式滴定管中的液面如图所示,所用NaOH标准溶液的体积为________。
(3)滴定过程中边滴加边摇动锥形瓶,直到加入半滴溶液后,___________,表明已经到达滴定终点。
(4)某学生根据3次实验分别记录有关数据如表所示:
滴定次数 待测盐酸的体积 标准溶液体积
滴定前的刻度/mL 滴定后的刻度
第一次 25.00 0.00 26.11
第二次 25.00 1.56 30.30
第三次 25.00 0.22 26.31
依据表中数据计算该盐酸的物质的量浓度为___________。
(5)在上述实验中,下列操作会造成测定结果偏低的有___________(填字母)。
a.滴定结束后盛装标准液的滴定管有气泡
b.锥形瓶水洗后末干燥
c.碱式滴定管水洗后末用标准溶液润洗
d.滴定终点时俯视读数
参考答案
一、单选题(每小题4分,总60分)
1.A 2.D 3.C 4.A 5.C 6.B 7.B 8.C
9.A 10.A 11.B 12.C 13.C 14.C 15.D
二、填空题(每空2分,总28分)
16.(4分)
(1)-41.8
(2)b
17.(6分)
(1)A
(2)3A(g)B(g)+3C(g)
(3)0.6mol/(L·min)
18.(8分) < 碱 CH3COO-+H2OCH3COOH+OH- bc
19.(10分) Zn +2H+=Zn2+ + H2↑ 负极 Zn–2e-=Zn2+ 有气泡产生 ① ②
三、实验题(每空2分,总12分)
20.(1) 容量瓶 胶头滴管
(2)26.10
(3)溶液由无色变为浅红色且半分钟内不褪色
(4)0.1044
(5)ad
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
同课章节目录
