7.3 乙醇与乙酸 第2课时 课件(22张ppt) 2022-2023学年高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 7.3 乙醇与乙酸 第2课时 课件(22张ppt) 2022-2023学年高一下学期化学人教版(2019)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 63.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-10 11:04:59 | ||
图片预览






文档简介
第七章 有机化合物
第三节 乙醇与乙酸
第二部分 乙酸
1.乙酸(醋酸)的物理性质
活动:阅读教材P79,结合生活经验,说说乙酸的物理性质
{5940675A-B579-460E-94D1-54222C63F5DA}颜色
状态
气味
溶解度
挥发性
?
?
?
?
?
无色
液体
刺激性气味
易溶于水
易挥发
冰醋酸固体
我们用冰醋酸表示纯净的醋酸
2.乙酸的分子结构
活动:根据乙酸的球棍模型和比例模型,写出分子式、结构式、结构简式(拍照提交)
{5940675A-B579-460E-94D1-54222C63F5DA}分子式
结构式
结构简式
C2H4O2
CH3COOH
-COOH
官能团:羧基
羧基的结构与醛基、羟基都不相同,因此具有特殊性质
问题:分析下列表格,说说影响熔沸点的因素有哪些
{5940675A-B579-460E-94D1-54222C63F5DA}物质
分子量
沸点/℃
乙醇
46
78.5
丙烷
44
-42.1
乙酸
60
118
正丁烷
58
-0.5
水
18
100
甲烷
16
-164
影响熔沸点的因素有范德华力和氢键
分子量越大,范德华力越大,熔沸点越高
羧基能形成氢键,使熔沸点升高
3.乙酸的酸性
活动:在以前的学习中,我们知道乙酸是弱酸,写出乙酸的电离方程式,写出醋酸除水垢的化学方程式、写出乙酸和碳酸氢钠反应的离子方程式
乙酸的电离方程式: 。
醋酸除水垢的化学方程式: 。
乙酸和碳酸氢钠反应的离子方程式: 。
判断:乙酸的酸性比碳酸强
CH3COOH CH3COO—+H+
2CH3COOH +CaCO3=(CH3COO)2Ca+H2O+CO2↑
CH3COOH +HCO3—=CH3COO—+H2O+CO2↑
√
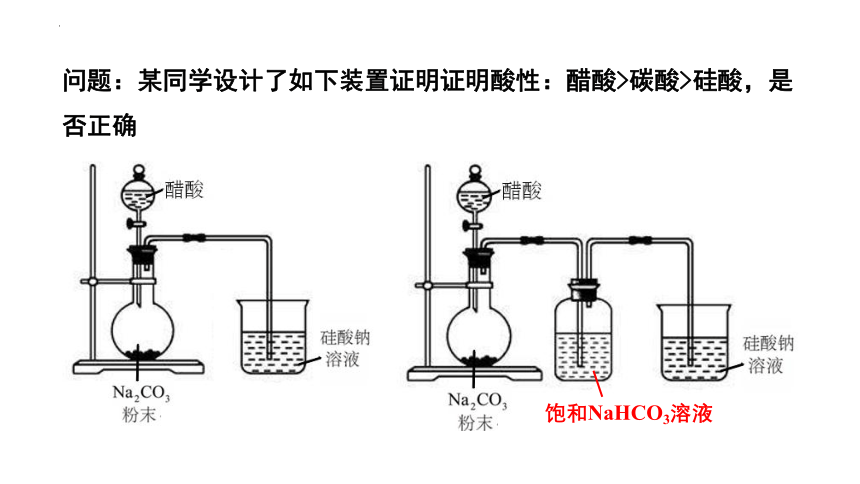
问题:某同学设计了如下装置证明证明酸性:醋酸>碳酸>硅酸,是否正确
饱和NaHCO3溶液
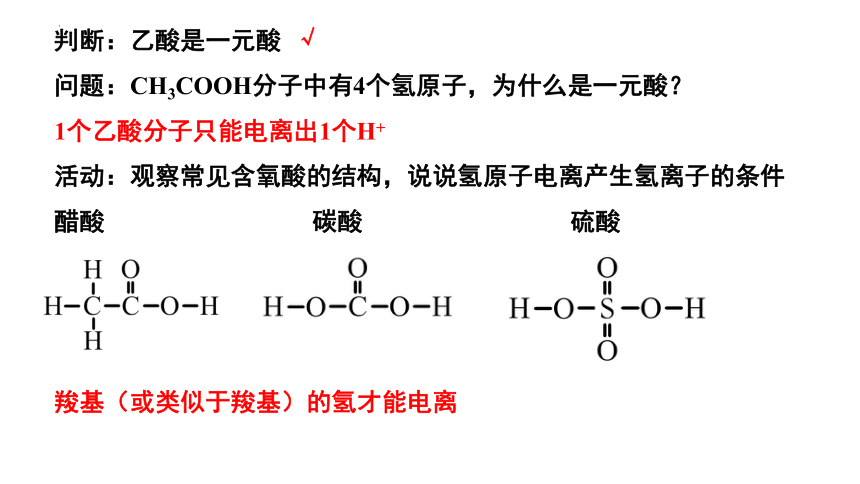
判断:乙酸是一元酸
问题:CH3COOH分子中有4个氢原子,为什么是一元酸?
1个乙酸分子只能电离出1个H+
活动:观察常见含氧酸的结构,说说氢原子电离产生氢离子的条件
醋酸 碳酸 硫酸
羧基(或类似于羧基)的氢才能电离
√
磷酸 亚磷酸 次磷酸
三元酸 二元酸 一元酸
元酸
1mol该分子能与 mol Na反应
1mol该分子能与 mol NaHCO3反应
一
2
1
4.酯化反应
活动:观看实验视频,说说哪些现象说明有新物质生成
活动2:观察反应方程式,在纸上画出酯化反应过程中化学键的变化?
CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O
浓硫酸
△
乙酸乙酯
思考:反应类型是什么?
取代反应
or
or
问题:如何证明酸脱羟基醇脱氢
CH3CO18OH+CH3CH2OH CH3COOCH2CH3+H2O
浓硫酸
△
18
同位素标记法
CH3COOCH2CH3
酯基
-COO-
羧基
-COOH
C
C
C
C
或H
C
或H
实验中有如下细节,请思考:
(1)碎瓷片的作用?
(2)乙醇为什么要过量(乙醇比乙酸用的多)?
乙醇更易挥发,加入过量乙醇可以提高乙酸的转化率
(3)浓硫酸的作用?
(4)导管为什么不伸入液面下方?
(5)饱和碳酸钠的作用
①吸收乙醇(溶液中的水溶解乙醇);②除去乙酸(碳酸钠和乙酸反应)
③降低乙酸乙酯的溶解度(高二讲解原理)
防暴沸
防倒吸
催化剂、吸水剂
(6)如何将乙酸乙酯和饱和碳酸钠分离
分液
分液漏斗
注意:视频中的溶液不是乙酸乙酯和饱和碳酸钠
练习:写出以下几种物质酯化反应的方程式
COOH
COOH
+ 2CH3CH2OH
浓硫酸
△
COOCH2CH3
COOCH2CH3
+2H2O
CH3COOH + CH3CHCH2CH2OH
CH3
浓硫酸
△
CH3COOCH2CH2CHCH3+H2O
CH3
5.酯的水解
若不用浓硫酸(改用稀硫酸),则反应更倾向于生成乙酸和乙醇,在这样的反应中乙酸乙酯与水的作用发生分解,称为水解反应
CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O 酯化反应
浓硫酸
△
CH3COOCH2CH3+H2O CH3COOH+CH3CH2OH 水解反应
稀硫酸
△
CH3COOCH2CH3+NaOH CH3COONa+CH3CH2OH
水解反应(碱性水解,不可逆)
△
练习:写出以下两个酯酸性水解的方程式
CH3CH2CO18OCH2CH3
+H2O CH3CH2COOH + CH3CH218OH
稀硫酸
△
C17H35COOCH2
C17H35COOCH
C17H35COOCH2
+3H2O 3C17H35COOH +
CH2OH
CHOH
CH2OH
稀硫酸
△
水解是酯基的独特性质,因此酯基也是一种官能团
P81,官能团决定物质类别
注意:
①苯环不是官能团
②含有碳卤键的是卤代烃
第三节 乙醇与乙酸
第二部分 乙酸
1.乙酸(醋酸)的物理性质
活动:阅读教材P79,结合生活经验,说说乙酸的物理性质
{5940675A-B579-460E-94D1-54222C63F5DA}颜色
状态
气味
溶解度
挥发性
?
?
?
?
?
无色
液体
刺激性气味
易溶于水
易挥发
冰醋酸固体
我们用冰醋酸表示纯净的醋酸
2.乙酸的分子结构
活动:根据乙酸的球棍模型和比例模型,写出分子式、结构式、结构简式(拍照提交)
{5940675A-B579-460E-94D1-54222C63F5DA}分子式
结构式
结构简式
C2H4O2
CH3COOH
-COOH
官能团:羧基
羧基的结构与醛基、羟基都不相同,因此具有特殊性质
问题:分析下列表格,说说影响熔沸点的因素有哪些
{5940675A-B579-460E-94D1-54222C63F5DA}物质
分子量
沸点/℃
乙醇
46
78.5
丙烷
44
-42.1
乙酸
60
118
正丁烷
58
-0.5
水
18
100
甲烷
16
-164
影响熔沸点的因素有范德华力和氢键
分子量越大,范德华力越大,熔沸点越高
羧基能形成氢键,使熔沸点升高
3.乙酸的酸性
活动:在以前的学习中,我们知道乙酸是弱酸,写出乙酸的电离方程式,写出醋酸除水垢的化学方程式、写出乙酸和碳酸氢钠反应的离子方程式
乙酸的电离方程式: 。
醋酸除水垢的化学方程式: 。
乙酸和碳酸氢钠反应的离子方程式: 。
判断:乙酸的酸性比碳酸强
CH3COOH CH3COO—+H+
2CH3COOH +CaCO3=(CH3COO)2Ca+H2O+CO2↑
CH3COOH +HCO3—=CH3COO—+H2O+CO2↑
√
问题:某同学设计了如下装置证明证明酸性:醋酸>碳酸>硅酸,是否正确
饱和NaHCO3溶液
判断:乙酸是一元酸
问题:CH3COOH分子中有4个氢原子,为什么是一元酸?
1个乙酸分子只能电离出1个H+
活动:观察常见含氧酸的结构,说说氢原子电离产生氢离子的条件
醋酸 碳酸 硫酸
羧基(或类似于羧基)的氢才能电离
√
磷酸 亚磷酸 次磷酸
三元酸 二元酸 一元酸
元酸
1mol该分子能与 mol Na反应
1mol该分子能与 mol NaHCO3反应
一
2
1
4.酯化反应
活动:观看实验视频,说说哪些现象说明有新物质生成
活动2:观察反应方程式,在纸上画出酯化反应过程中化学键的变化?
CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O
浓硫酸
△
乙酸乙酯
思考:反应类型是什么?
取代反应
or
or
问题:如何证明酸脱羟基醇脱氢
CH3CO18OH+CH3CH2OH CH3COOCH2CH3+H2O
浓硫酸
△
18
同位素标记法
CH3COOCH2CH3
酯基
-COO-
羧基
-COOH
C
C
C
C
或H
C
或H
实验中有如下细节,请思考:
(1)碎瓷片的作用?
(2)乙醇为什么要过量(乙醇比乙酸用的多)?
乙醇更易挥发,加入过量乙醇可以提高乙酸的转化率
(3)浓硫酸的作用?
(4)导管为什么不伸入液面下方?
(5)饱和碳酸钠的作用
①吸收乙醇(溶液中的水溶解乙醇);②除去乙酸(碳酸钠和乙酸反应)
③降低乙酸乙酯的溶解度(高二讲解原理)
防暴沸
防倒吸
催化剂、吸水剂
(6)如何将乙酸乙酯和饱和碳酸钠分离
分液
分液漏斗
注意:视频中的溶液不是乙酸乙酯和饱和碳酸钠
练习:写出以下几种物质酯化反应的方程式
COOH
COOH
+ 2CH3CH2OH
浓硫酸
△
COOCH2CH3
COOCH2CH3
+2H2O
CH3COOH + CH3CHCH2CH2OH
CH3
浓硫酸
△
CH3COOCH2CH2CHCH3+H2O
CH3
5.酯的水解
若不用浓硫酸(改用稀硫酸),则反应更倾向于生成乙酸和乙醇,在这样的反应中乙酸乙酯与水的作用发生分解,称为水解反应
CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O 酯化反应
浓硫酸
△
CH3COOCH2CH3+H2O CH3COOH+CH3CH2OH 水解反应
稀硫酸
△
CH3COOCH2CH3+NaOH CH3COONa+CH3CH2OH
水解反应(碱性水解,不可逆)
△
练习:写出以下两个酯酸性水解的方程式
CH3CH2CO18OCH2CH3
+H2O CH3CH2COOH + CH3CH218OH
稀硫酸
△
C17H35COOCH2
C17H35COOCH
C17H35COOCH2
+3H2O 3C17H35COOH +
CH2OH
CHOH
CH2OH
稀硫酸
△
水解是酯基的独特性质,因此酯基也是一种官能团
P81,官能团决定物质类别
注意:
①苯环不是官能团
②含有碳卤键的是卤代烃
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
