1.2.2 原子结构与元素周期表(第2课时) 课件(41张ppt) 2022-2023学年高二化学鲁科版(2019)选择性必修2
文档属性
| 名称 | 1.2.2 原子结构与元素周期表(第2课时) 课件(41张ppt) 2022-2023学年高二化学鲁科版(2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-10 09:01:25 | ||
图片预览









文档简介
(共41张PPT)
第二节 原子结构与元素周期表
鲁科版高中化学选择性必修2
第2课时
核外电子排布与元素周期表
第1章 原子结构与元素性质
复习:基态原子的核外电子排布三大原则
1、能量最低原则:
核外电子的排布要使整个原子的能量最低,以形成稳定结构。
2、泡利不相容原理:
一个原子轨道中最多只能容纳两个电子,并且这两个电子的自旋方向必须相反。
3、洪特规则:
对于基态原子,电子在能量相同的轨道上排布时,应尽可能的分占不同的轨道并且自旋方向相同。
4、洪特规则的特例:
对于能量相同的轨道,当电子排布处于全满(s2、p6、d10、f14)、半满(s1、p3、d5、f7)、全空(s0、p0、d0、f0)时比较稳定,整个体系的能量最低。
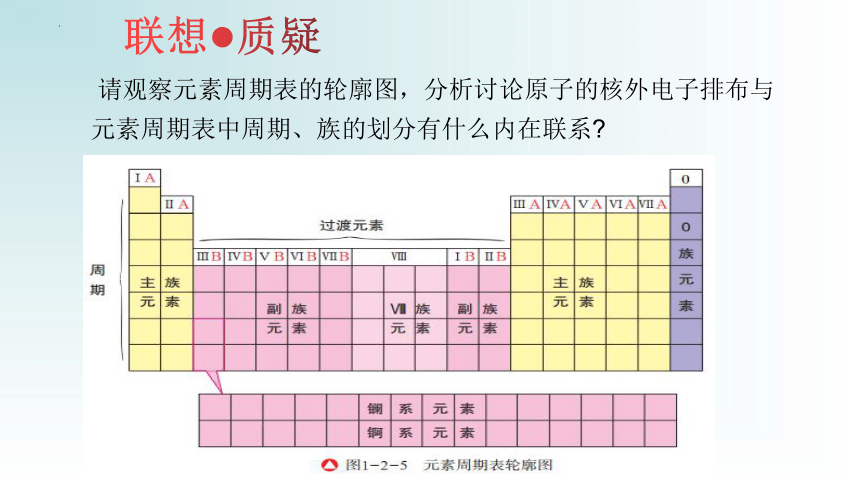
请观察元素周期表的轮廓图,分析讨论原子的核外电子排布与元素周期表中周期、族的划分有什么内在联系
联想 质疑
复习回顾
1 元素周期表有几个周期?每个周期里面又包含有多少种元素?
2 元素周期表里有多少个纵列?有几个族?
元素周期表
主族(A)(1、2、13、14、15、16、17列)
副族(B)(3、4、5、6、7、11、12列)
第Ⅷ族(8、9、10列)
零族(18列稀有气体元素)
长周期(4、5、6、7行)(元素有18、18、32、32种)
短周期(1、2、3行)(元素有2、8、8种)
周期
族
七横十八纵,横行叫周期。共有七周期,三四分长短;纵行叫做族共有十六族(七主七副一八一零),八族最特殊三行为一族。
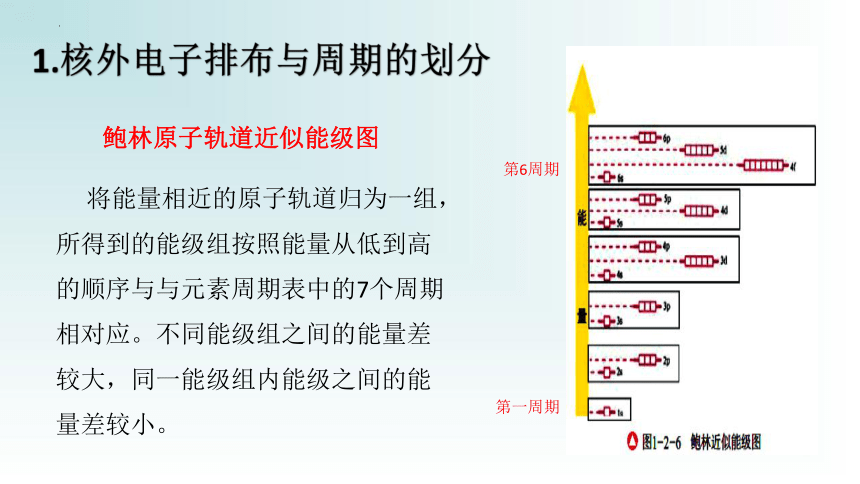
1.核外电子排布与周期的划分
将能量相近的原子轨道归为一组,所得到的能级组按照能量从低到高的顺序与与元素周期表中的7个周期相对应。不同能级组之间的能量差较大,同一能级组内能级之间的能量差较小。
鲍林原子轨道近似能级图
第一周期
第6周期
请根据1~36号元素原子的电子排布,参照鲍林近似能级图,尝试分析原子中电子排布与元素周期表中周期划分的内在联系。
交流研讨
周期序数 对应能级 原子轨道数 最多容纳电子数 价电子排布式 元素种数
ⅠA族 0族 1
2
3
4
5
6
7
周期序数 对应能级 原子轨道数 最多容纳电子数 价电子排布式 元素种数
ⅠA族 0族 1 1s 1 2 1s1 1s2 2
2 2s2p 4 8 2s1 2s22p6 8
3 3s3p 4 8 3s1 3s23p6 8
4 4s3d4p 9 18 4s1 4s24p6 18
5 5s4d5p 9 18 5s1 5s25p6 18
6 6s4f5d6p 16 32 6s1 6s26p6 32
7 7s5f6d7p 16 32 7s1 7s27p6 32
总结:
(1)周期序数=电子层数。(2)本周期包含的元素种数=对应能级组所含原子轨道数的2倍=对应能级组最多容纳的电子数。
迁移应用
某元素M2+的3d轨道上有5个电子,则(1)M原子的核外电子排布式为_____________________________________________。
(2)M元素在元素周期表中的位置为第__________周期。
1s22s22p63s23p63d54s2
4
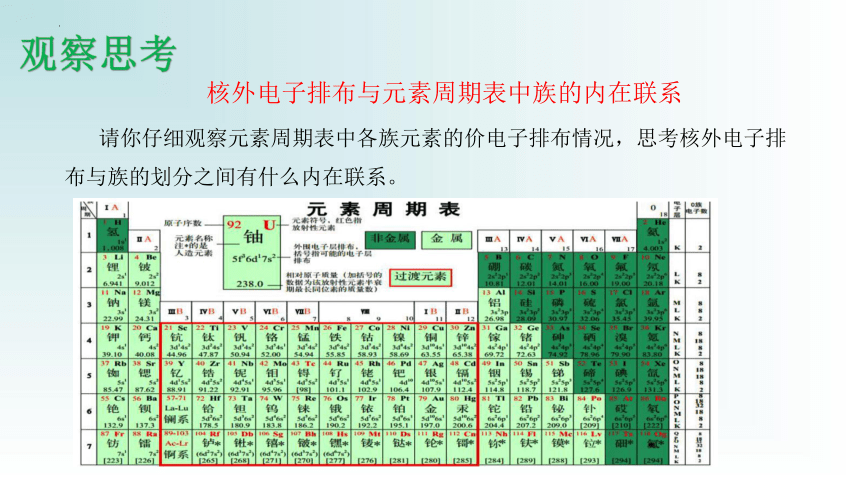
观察思考
请你仔细观察元素周期表中各族元素的价电子排布情况,思考核外电子排布与族的划分之间有什么内在联系。
核外电子排布与元素周期表中族的内在联系
交流研讨
(1)主族元素原子的价电子排布与过渡元素原子的价电子排布有什么区别
(2)同一主族元素原子的价电子排布有什么特点,主族序数与什么有关
(3)同一族过渡元素原子的价电子排布有什么特点,其族序数与什么有关
注意:He 1s2
2.核外电子排布与族的划分
(1)族的划分与核外电子排布的关系
族的划分与原子的价电子数目和价电子排布密切相关。
(2)各族核外电子排布的特点
主族元素
过渡元素
稀有气体元素:
价电子排布:
主族序数=
价电子排布:
族序数
价电子排布为ns2np6
ns1~2或ns2np1~5
价电子数
(n-1)d1~10ns1~2
ⅢB~ⅦB族:族序数=
ⅠB族和ⅡB族:族序数=
价电子数
ns电子数
1)外围电子结构一般相同
2)元素所在族的判断:
①主族元素:主族序数=外围电子数=最外层电子数
②副族元素:以外围(n-1)d+ns的电子总数判断
A、电子总数为3~7,ⅢB~ⅦB
B、电子总数为8~10,Ⅷ
C、电子总数为11~12,ⅠB和ⅡB
二、核外电子排布与族的划分
规律:由元素的价电子结构判断
4、(n-1)d10nsX n 周期 XB 族
1、nsX n 周期 XA 族
2、ns2npX n 周期 (2+X)A 族
3、(n-1)dXnsY
X+Y≤7时: n 周期(X+Y)B 族
X+Y>7时: n 周期 VIII族
练习:写出下列价电子结构所对应的周期表的位置
A. 4s24p5 B. 3d54s1
C. 4d105s2 D. 5s1
E. 3d74s2 F. 6s26p6
G. 1s2
第 周期 族
(3)元素周期表的分区
分区 价电子排布 元素分布 元素分类
s区 ns1~2 ⅠA、ⅡA族、He
p区 ns2np1~6 ⅢA族~ⅦA族、0族(He除外)
d区 (n-1)d1~9ns1~2(Pd除外) ⅢB族~ⅦB族、Ⅷ族
ds区 (n-1)d10ns1~2 ⅠB族、ⅡB族
f区 (n-2)f0~14(n-1)d0~2ns2 镧系、锕系
各区元素的原子最外层电子排布特点
归纳总结
活泼金属
大多为非金属
过渡元素
过渡元素
过渡元素
拓展视野
核外电子排布与元素周期表的分区
书本p17-18
(4)元素化合价
①除Ⅷ族、ⅠB族的某些元素和0族元素外,元素的最高化合价等于它所在族的序数,如Sc、Ti、V、 Cr、Mn的最高化合价分别为+3、+4、+5、+6、+7。②一般来说,非金属元素的最高正化合价和它的最低负化合价的绝对值之和等于8(F无正价)。
③稀有气体元素的化合价在通常情况下为0。
④过渡元素的价电子较多且所在轨道的能量相差不大,因此过渡元素具有多种价态,如锰元素的化合价为+2~+7。
元素的化合价与原子的核外电子排布尤其是价电子排布有着密切的关系。
迁移应用
(1)砷原子的最外层电子排布式是4s24p3,在元素周期表中,砷元素位于第________周期________族;最高价氧化物的化学式为______________,砷酸钠的化学式是________________。
(2)已知下列元素在周期表中的位置,写出它们的价电子排布式和元素符号:
①第4周期ⅣB族______________;
②第5周期ⅦA族______________。
4
ⅤA
As2O5
Na3AsO4
3d24s2、Ti
5s25p5、I
1.每一周期都是从活泼金属开始以惰性气体结束吗?
2.最外层电子排布式为ns2的基态原子对应元素一定位于ⅡA族吗?
3.元素周期表中周期与族的划分与原子结构的哪部分有关?
思考交流
不是。第1周期是从H开始的,它是非金属元素。
不一定,比如He(1s2),或者是副族或Ⅷ族的某些过渡元素。
周期的划分与电子层数有关。
族的划分与价电子数或最外层上的电子数有关。
2、已知某元素在周期表中位于第五周期、ⅥA族位置上。试写出该元素基态原子的价电子排布式、电子排布式并分析该元素在哪区?
由于是ⅥA族, 4d必是全充满的,所以价电子排布为5s25p4
电子排布式[Kr]4d105s25p4
课堂练习
属P区
1、指出下列元素的名称和原子序数,写出电子排布式
(1)原子中4p轨道半充满的元素;
、 、
(2)原子中3d轨道半充满的元素(有几个写几个);
、 、
、 、 ;
2、 (1)2p上有2个未成对电子的元素名称 。
(2)满足nsnnp2n 的元素的元素符号 。
(3) 3d轨道有四个未成对电子的价电子排布式 。
(4)35号元素有 个单电子,有个 电子层,
有个 原子轨道,价电子排布为 。
巩固提升:
铬
24
锰
25
碳和氧
O
3d64s2
1
4
18
4s24p5
1s22s2p63s23p63d54s2
1s22s2p63s23p63d54s1
砷
33
1s22s2p63s23p63d104s24p3
1)除第一周期外, 各周期均以填充 s 轨道的元素开始, 并以填充满p 轨道的元素告终.(第一周期除外)
1s1 1s2
2s1 2s22p6
3s1 3s23p6
4s1 4s24p6
5s1 5s25p6
6s1 6s26p6
外围电子数有1 8个
最后1个电子填充在ns轨道上,价电子的构型是ns1或ns2,位于周期表的左侧,包括ⅠA和ⅡA族,它们都是活泼金属,容易失去电子形成+1 或+2价离子。
s区元素
s区和p区的共同特点是:最后1个电子都排布在最外层,最外层电子的总数等于该元素的族序数。s区和p区就是按族划分的周期表中的主族、0族。
最后1个电子填充在np轨道上,价层电子构型是ns2np1~6,位于周期表右侧,包括ⅢA~ⅦA族元素。大部分为非金属。0族稀有气体也属于p区。
p区元素
它们的价层电子构型是(n-1)d1~9ns1~2 ,最后1个电子基本都是填充在倒数第二层
(n-1)d轨道上的元素,位于长周期的中部。这些元素都是金属,常有可变化合价,称为过渡元素。它包括ⅢB~Ⅷ族元素。
d区元素
价层电子构型是(n-1)d10ns1~2,即次外层d轨道是充满的,最外层轨道上有1~2个电子。它们既不同于s区,也不同于d区,故称为ds区,它包括ⅠB和ⅡB族,处于周期表d区和p区之间。它们都是金属,也属过渡元素。
ds区元素
最后1个电子填充在f轨道上,价电子构型是:(n-2)f 0~14ns2,或(n – 2)f 0~14
(n-1)d 0~2ns2,它包括镧系和锕系元素(各有14种元素)。
f区元素
包括元素 价电子排布 元素分类
s区
p区
d区
ds区
f区
ⅠA、ⅡA族
ⅢA~零族
ⅢB~Ⅷ族
ⅠB、ⅡB族
镧系和锕系
ns1、ns2
ns2np1~6
(n-1)d1~9ns2
(n-1)d10ns1~2
(n-2)f0~14ns2
各区元素特点:
活泼金属
大多为非金属
过渡元素
过渡元素
小结
过渡元素
1、已知某元素的原子序数为25,
试写出该元素原子的电子排布式,并指出该元素在周期表中所属周期、族和区。
课堂练习
2、已知某元素在周期表中位于第五周期、ⅥA族位置上。试写出该元素基态原子的价电子排布式、电子排布式并分析该元素在哪区?
由于是ⅥA族, 4d必是全充满的,所以价电子排布为5s25p4,
电子排布式[Kr]4d105s25p4
课堂练习
属P区
1.已知一元素的价层电子结构为3d54s2,试确定其在周期表中的位置。
第四周期,ⅦB族。
2.试确定32号元素在周期表中的位置。
第四周期,ⅣA族
3.判断处于第三周期,ⅣA族元素的价层
电子结构、原子序数。
[Ne]3s23p2,第14号元素
练习:
元素周期律
——元素周期律是指元素性质随核电荷数递增发生周期性的递变
主族 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
原子核外价电子排布
最高正价
最低负价
化合价变化 金属性和非金属性变化 原子半径变化规律 ns2
ns1
ns2np1
ns2np2
ns2np3
ns2np4
ns2np5
+1
+2
+3
+4
+5
+6
+7
-4
-3
-2
-1
最高正价:+1→+7;最低负价:-4→-1
金属性减弱,非金属性增强
同周期从左到右半径逐渐减小
(1)同一周期元素结构和性质具有一定的递变性;从左到右原子半径逐渐 ,失电子能力逐渐 ,得电子能力逐渐 ,元素的金属性逐渐 ,非金属性逐渐 ,对应氢化物的稳定性逐渐 ;最高价氧化物对应的水化物的酸性逐渐 ;碱性逐渐 ;
(2)同一主族元素结构和性质具有一定的相似性和递变性;同一主族,从上到下:原子半径逐渐 ,失电子能力逐渐 ,得电子能力逐渐 ,金属性逐渐 ,非金属性逐渐 ;对应氢化物的稳定性逐渐 ;最高价氧化物对应的水化物的酸性逐渐 ;碱性逐渐 ;
原子结构和性质周期性变化
复习回忆
减小
减弱
增强
减弱
减弱
增强
增强
增强
增大
增强
增强
增强
减弱
减弱
减弱
减弱
知识复习:
请同学们回忆一下:我们学过的元素重要性质有哪些?它们各有怎样的递变规律?
1.失电子能力:
同一周期从左到右失电子能力逐渐减弱;
同一主族从上到下失电子能力逐渐增强。
2.得电子能力:
同一周期从左到右得电子能力逐渐增强;
同一主族从上到下得电子能力逐渐减弱。
3.价电子数:
同周期:从1变到7,同主族:相同
4.原子半径:
同一周期从左到右原子半径逐渐减小;
同一主族从上到下原子半径逐渐增大。
1、指出下列元素的名称和原子序数,写出电子排布式
(1)原子中4p轨道半充满的元素;
、 、
(2)原子中3d轨道半充满的元素(有几个写几个);
、 、
、 、 ;
2、 (1)2p上有2个未成对电子的元素名称 。
(2)满足nsnnp2n 的元素的元素符号 。
(3) 3d轨道有四个未成对电子的价电子排布式 。
(4)35号元素有 个单电子,有个 电子层,
有个 原子轨道,价电子排布为 。
复习提问:
铬
24
锰
25
碳和氧
O
3d64s2
1
4
18
4s24p5
1s22s2p63s23p63d54s2
1s22s2p63s23p63d54s1
砷
33
1s22s2p63s23p63d104s24p3
[例题]某元素原子共有3个价电子,其中一个价电子的四个量子数为n=3, l=2, m=2, ms=+1/2。
试回答:
(1)写出该元素原子核外电子排布式。
(2)指出该元素的原子序数,在周期表中所处的
分区、周期数和族序数,是金属还是非金属以及
最高正化合价。
答案: 核外电子排布式为1s22s22p63s23p63d14s2
原子序数为21, 处于周期表中的d区第4周期 ⅢB族,
是金属元素,最高正价为+3.
某元素4p能级上有3个电子,该元素位于第 周期, 族,第 列其M层上有 电子,4p轨道上有 个单电子,电子排布式为 ,简化为: 。
某原子的4p能级中有2个单电子,其第四电子层中的电子数可能为 A. 3 B. 5 C. 6 D. 4
强化训练
C D
四
ⅤA
15
18
3
1s22s22p63s23p63d104s24p3
[Ar]3d104s24p3
1
2
下列微粒半径大小比较正确的是A.Na+B.S2->Cl->Na+>Al3+
C.NaD.CsB
作业:A、B、C、D是短周期元素,A元素的最高价氧
化物的水化物与它的气态氢化物反应得到离子化合
物,1mol该化合物含有42mol电子,B原子的最外层
电子排布式为nsnnp2n。C、D两原子的最外层电子
数分别是内层电子数的一半。C元素是植物生长的营
养元素之一。试写出:
(1)A、B元素形成的酸酐的化学式 。
(2)D元素的单质与水反应的化学方程式 。组卷网
(3)A、C元素气态氢化物的稳定性大小: < (用分子式表示。)
(4)A、B、C、D四种元素中电负性最大的是
(用元素符号表示,下同),第一电离能最小的是 。
展示电子排布的周期表
第二节 原子结构与元素周期表
鲁科版高中化学选择性必修2
第2课时
核外电子排布与元素周期表
第1章 原子结构与元素性质
复习:基态原子的核外电子排布三大原则
1、能量最低原则:
核外电子的排布要使整个原子的能量最低,以形成稳定结构。
2、泡利不相容原理:
一个原子轨道中最多只能容纳两个电子,并且这两个电子的自旋方向必须相反。
3、洪特规则:
对于基态原子,电子在能量相同的轨道上排布时,应尽可能的分占不同的轨道并且自旋方向相同。
4、洪特规则的特例:
对于能量相同的轨道,当电子排布处于全满(s2、p6、d10、f14)、半满(s1、p3、d5、f7)、全空(s0、p0、d0、f0)时比较稳定,整个体系的能量最低。
请观察元素周期表的轮廓图,分析讨论原子的核外电子排布与元素周期表中周期、族的划分有什么内在联系
联想 质疑
复习回顾
1 元素周期表有几个周期?每个周期里面又包含有多少种元素?
2 元素周期表里有多少个纵列?有几个族?
元素周期表
主族(A)(1、2、13、14、15、16、17列)
副族(B)(3、4、5、6、7、11、12列)
第Ⅷ族(8、9、10列)
零族(18列稀有气体元素)
长周期(4、5、6、7行)(元素有18、18、32、32种)
短周期(1、2、3行)(元素有2、8、8种)
周期
族
七横十八纵,横行叫周期。共有七周期,三四分长短;纵行叫做族共有十六族(七主七副一八一零),八族最特殊三行为一族。
1.核外电子排布与周期的划分
将能量相近的原子轨道归为一组,所得到的能级组按照能量从低到高的顺序与与元素周期表中的7个周期相对应。不同能级组之间的能量差较大,同一能级组内能级之间的能量差较小。
鲍林原子轨道近似能级图
第一周期
第6周期
请根据1~36号元素原子的电子排布,参照鲍林近似能级图,尝试分析原子中电子排布与元素周期表中周期划分的内在联系。
交流研讨
周期序数 对应能级 原子轨道数 最多容纳电子数 价电子排布式 元素种数
ⅠA族 0族 1
2
3
4
5
6
7
周期序数 对应能级 原子轨道数 最多容纳电子数 价电子排布式 元素种数
ⅠA族 0族 1 1s 1 2 1s1 1s2 2
2 2s2p 4 8 2s1 2s22p6 8
3 3s3p 4 8 3s1 3s23p6 8
4 4s3d4p 9 18 4s1 4s24p6 18
5 5s4d5p 9 18 5s1 5s25p6 18
6 6s4f5d6p 16 32 6s1 6s26p6 32
7 7s5f6d7p 16 32 7s1 7s27p6 32
总结:
(1)周期序数=电子层数。(2)本周期包含的元素种数=对应能级组所含原子轨道数的2倍=对应能级组最多容纳的电子数。
迁移应用
某元素M2+的3d轨道上有5个电子,则(1)M原子的核外电子排布式为_____________________________________________。
(2)M元素在元素周期表中的位置为第__________周期。
1s22s22p63s23p63d54s2
4
观察思考
请你仔细观察元素周期表中各族元素的价电子排布情况,思考核外电子排布与族的划分之间有什么内在联系。
核外电子排布与元素周期表中族的内在联系
交流研讨
(1)主族元素原子的价电子排布与过渡元素原子的价电子排布有什么区别
(2)同一主族元素原子的价电子排布有什么特点,主族序数与什么有关
(3)同一族过渡元素原子的价电子排布有什么特点,其族序数与什么有关
注意:He 1s2
2.核外电子排布与族的划分
(1)族的划分与核外电子排布的关系
族的划分与原子的价电子数目和价电子排布密切相关。
(2)各族核外电子排布的特点
主族元素
过渡元素
稀有气体元素:
价电子排布:
主族序数=
价电子排布:
族序数
价电子排布为ns2np6
ns1~2或ns2np1~5
价电子数
(n-1)d1~10ns1~2
ⅢB~ⅦB族:族序数=
ⅠB族和ⅡB族:族序数=
价电子数
ns电子数
1)外围电子结构一般相同
2)元素所在族的判断:
①主族元素:主族序数=外围电子数=最外层电子数
②副族元素:以外围(n-1)d+ns的电子总数判断
A、电子总数为3~7,ⅢB~ⅦB
B、电子总数为8~10,Ⅷ
C、电子总数为11~12,ⅠB和ⅡB
二、核外电子排布与族的划分
规律:由元素的价电子结构判断
4、(n-1)d10nsX n 周期 XB 族
1、nsX n 周期 XA 族
2、ns2npX n 周期 (2+X)A 族
3、(n-1)dXnsY
X+Y≤7时: n 周期(X+Y)B 族
X+Y>7时: n 周期 VIII族
练习:写出下列价电子结构所对应的周期表的位置
A. 4s24p5 B. 3d54s1
C. 4d105s2 D. 5s1
E. 3d74s2 F. 6s26p6
G. 1s2
第 周期 族
(3)元素周期表的分区
分区 价电子排布 元素分布 元素分类
s区 ns1~2 ⅠA、ⅡA族、He
p区 ns2np1~6 ⅢA族~ⅦA族、0族(He除外)
d区 (n-1)d1~9ns1~2(Pd除外) ⅢB族~ⅦB族、Ⅷ族
ds区 (n-1)d10ns1~2 ⅠB族、ⅡB族
f区 (n-2)f0~14(n-1)d0~2ns2 镧系、锕系
各区元素的原子最外层电子排布特点
归纳总结
活泼金属
大多为非金属
过渡元素
过渡元素
过渡元素
拓展视野
核外电子排布与元素周期表的分区
书本p17-18
(4)元素化合价
①除Ⅷ族、ⅠB族的某些元素和0族元素外,元素的最高化合价等于它所在族的序数,如Sc、Ti、V、 Cr、Mn的最高化合价分别为+3、+4、+5、+6、+7。②一般来说,非金属元素的最高正化合价和它的最低负化合价的绝对值之和等于8(F无正价)。
③稀有气体元素的化合价在通常情况下为0。
④过渡元素的价电子较多且所在轨道的能量相差不大,因此过渡元素具有多种价态,如锰元素的化合价为+2~+7。
元素的化合价与原子的核外电子排布尤其是价电子排布有着密切的关系。
迁移应用
(1)砷原子的最外层电子排布式是4s24p3,在元素周期表中,砷元素位于第________周期________族;最高价氧化物的化学式为______________,砷酸钠的化学式是________________。
(2)已知下列元素在周期表中的位置,写出它们的价电子排布式和元素符号:
①第4周期ⅣB族______________;
②第5周期ⅦA族______________。
4
ⅤA
As2O5
Na3AsO4
3d24s2、Ti
5s25p5、I
1.每一周期都是从活泼金属开始以惰性气体结束吗?
2.最外层电子排布式为ns2的基态原子对应元素一定位于ⅡA族吗?
3.元素周期表中周期与族的划分与原子结构的哪部分有关?
思考交流
不是。第1周期是从H开始的,它是非金属元素。
不一定,比如He(1s2),或者是副族或Ⅷ族的某些过渡元素。
周期的划分与电子层数有关。
族的划分与价电子数或最外层上的电子数有关。
2、已知某元素在周期表中位于第五周期、ⅥA族位置上。试写出该元素基态原子的价电子排布式、电子排布式并分析该元素在哪区?
由于是ⅥA族, 4d必是全充满的,所以价电子排布为5s25p4
电子排布式[Kr]4d105s25p4
课堂练习
属P区
1、指出下列元素的名称和原子序数,写出电子排布式
(1)原子中4p轨道半充满的元素;
、 、
(2)原子中3d轨道半充满的元素(有几个写几个);
、 、
、 、 ;
2、 (1)2p上有2个未成对电子的元素名称 。
(2)满足nsnnp2n 的元素的元素符号 。
(3) 3d轨道有四个未成对电子的价电子排布式 。
(4)35号元素有 个单电子,有个 电子层,
有个 原子轨道,价电子排布为 。
巩固提升:
铬
24
锰
25
碳和氧
O
3d64s2
1
4
18
4s24p5
1s22s2p63s23p63d54s2
1s22s2p63s23p63d54s1
砷
33
1s22s2p63s23p63d104s24p3
1)除第一周期外, 各周期均以填充 s 轨道的元素开始, 并以填充满p 轨道的元素告终.(第一周期除外)
1s1 1s2
2s1 2s22p6
3s1 3s23p6
4s1 4s24p6
5s1 5s25p6
6s1 6s26p6
外围电子数有1 8个
最后1个电子填充在ns轨道上,价电子的构型是ns1或ns2,位于周期表的左侧,包括ⅠA和ⅡA族,它们都是活泼金属,容易失去电子形成+1 或+2价离子。
s区元素
s区和p区的共同特点是:最后1个电子都排布在最外层,最外层电子的总数等于该元素的族序数。s区和p区就是按族划分的周期表中的主族、0族。
最后1个电子填充在np轨道上,价层电子构型是ns2np1~6,位于周期表右侧,包括ⅢA~ⅦA族元素。大部分为非金属。0族稀有气体也属于p区。
p区元素
它们的价层电子构型是(n-1)d1~9ns1~2 ,最后1个电子基本都是填充在倒数第二层
(n-1)d轨道上的元素,位于长周期的中部。这些元素都是金属,常有可变化合价,称为过渡元素。它包括ⅢB~Ⅷ族元素。
d区元素
价层电子构型是(n-1)d10ns1~2,即次外层d轨道是充满的,最外层轨道上有1~2个电子。它们既不同于s区,也不同于d区,故称为ds区,它包括ⅠB和ⅡB族,处于周期表d区和p区之间。它们都是金属,也属过渡元素。
ds区元素
最后1个电子填充在f轨道上,价电子构型是:(n-2)f 0~14ns2,或(n – 2)f 0~14
(n-1)d 0~2ns2,它包括镧系和锕系元素(各有14种元素)。
f区元素
包括元素 价电子排布 元素分类
s区
p区
d区
ds区
f区
ⅠA、ⅡA族
ⅢA~零族
ⅢB~Ⅷ族
ⅠB、ⅡB族
镧系和锕系
ns1、ns2
ns2np1~6
(n-1)d1~9ns2
(n-1)d10ns1~2
(n-2)f0~14ns2
各区元素特点:
活泼金属
大多为非金属
过渡元素
过渡元素
小结
过渡元素
1、已知某元素的原子序数为25,
试写出该元素原子的电子排布式,并指出该元素在周期表中所属周期、族和区。
课堂练习
2、已知某元素在周期表中位于第五周期、ⅥA族位置上。试写出该元素基态原子的价电子排布式、电子排布式并分析该元素在哪区?
由于是ⅥA族, 4d必是全充满的,所以价电子排布为5s25p4,
电子排布式[Kr]4d105s25p4
课堂练习
属P区
1.已知一元素的价层电子结构为3d54s2,试确定其在周期表中的位置。
第四周期,ⅦB族。
2.试确定32号元素在周期表中的位置。
第四周期,ⅣA族
3.判断处于第三周期,ⅣA族元素的价层
电子结构、原子序数。
[Ne]3s23p2,第14号元素
练习:
元素周期律
——元素周期律是指元素性质随核电荷数递增发生周期性的递变
主族 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
原子核外价电子排布
最高正价
最低负价
化合价变化 金属性和非金属性变化 原子半径变化规律 ns2
ns1
ns2np1
ns2np2
ns2np3
ns2np4
ns2np5
+1
+2
+3
+4
+5
+6
+7
-4
-3
-2
-1
最高正价:+1→+7;最低负价:-4→-1
金属性减弱,非金属性增强
同周期从左到右半径逐渐减小
(1)同一周期元素结构和性质具有一定的递变性;从左到右原子半径逐渐 ,失电子能力逐渐 ,得电子能力逐渐 ,元素的金属性逐渐 ,非金属性逐渐 ,对应氢化物的稳定性逐渐 ;最高价氧化物对应的水化物的酸性逐渐 ;碱性逐渐 ;
(2)同一主族元素结构和性质具有一定的相似性和递变性;同一主族,从上到下:原子半径逐渐 ,失电子能力逐渐 ,得电子能力逐渐 ,金属性逐渐 ,非金属性逐渐 ;对应氢化物的稳定性逐渐 ;最高价氧化物对应的水化物的酸性逐渐 ;碱性逐渐 ;
原子结构和性质周期性变化
复习回忆
减小
减弱
增强
减弱
减弱
增强
增强
增强
增大
增强
增强
增强
减弱
减弱
减弱
减弱
知识复习:
请同学们回忆一下:我们学过的元素重要性质有哪些?它们各有怎样的递变规律?
1.失电子能力:
同一周期从左到右失电子能力逐渐减弱;
同一主族从上到下失电子能力逐渐增强。
2.得电子能力:
同一周期从左到右得电子能力逐渐增强;
同一主族从上到下得电子能力逐渐减弱。
3.价电子数:
同周期:从1变到7,同主族:相同
4.原子半径:
同一周期从左到右原子半径逐渐减小;
同一主族从上到下原子半径逐渐增大。
1、指出下列元素的名称和原子序数,写出电子排布式
(1)原子中4p轨道半充满的元素;
、 、
(2)原子中3d轨道半充满的元素(有几个写几个);
、 、
、 、 ;
2、 (1)2p上有2个未成对电子的元素名称 。
(2)满足nsnnp2n 的元素的元素符号 。
(3) 3d轨道有四个未成对电子的价电子排布式 。
(4)35号元素有 个单电子,有个 电子层,
有个 原子轨道,价电子排布为 。
复习提问:
铬
24
锰
25
碳和氧
O
3d64s2
1
4
18
4s24p5
1s22s2p63s23p63d54s2
1s22s2p63s23p63d54s1
砷
33
1s22s2p63s23p63d104s24p3
[例题]某元素原子共有3个价电子,其中一个价电子的四个量子数为n=3, l=2, m=2, ms=+1/2。
试回答:
(1)写出该元素原子核外电子排布式。
(2)指出该元素的原子序数,在周期表中所处的
分区、周期数和族序数,是金属还是非金属以及
最高正化合价。
答案: 核外电子排布式为1s22s22p63s23p63d14s2
原子序数为21, 处于周期表中的d区第4周期 ⅢB族,
是金属元素,最高正价为+3.
某元素4p能级上有3个电子,该元素位于第 周期, 族,第 列其M层上有 电子,4p轨道上有 个单电子,电子排布式为 ,简化为: 。
某原子的4p能级中有2个单电子,其第四电子层中的电子数可能为 A. 3 B. 5 C. 6 D. 4
强化训练
C D
四
ⅤA
15
18
3
1s22s22p63s23p63d104s24p3
[Ar]3d104s24p3
1
2
下列微粒半径大小比较正确的是A.Na+
C.Na
作业:A、B、C、D是短周期元素,A元素的最高价氧
化物的水化物与它的气态氢化物反应得到离子化合
物,1mol该化合物含有42mol电子,B原子的最外层
电子排布式为nsnnp2n。C、D两原子的最外层电子
数分别是内层电子数的一半。C元素是植物生长的营
养元素之一。试写出:
(1)A、B元素形成的酸酐的化学式 。
(2)D元素的单质与水反应的化学方程式 。组卷网
(3)A、C元素气态氢化物的稳定性大小: < (用分子式表示。)
(4)A、B、C、D四种元素中电负性最大的是
(用元素符号表示,下同),第一电离能最小的是 。
展示电子排布的周期表
