5.1 硫及其化合物 第1课时 二氧化硫的性质探究 课件(22张ppt) 2022-2023学年高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 5.1 硫及其化合物 第1课时 二氧化硫的性质探究 课件(22张ppt) 2022-2023学年高一下学期化学人教版(2019)必修第二册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-10 00:00:00 | ||
图片预览




文档简介
(共22张PPT)
二氧化硫的性质探究
物理性质
颜色 状态 气味 毒性 密度
溶解性
无色气态
刺激性
有毒
比空气大
易溶于水
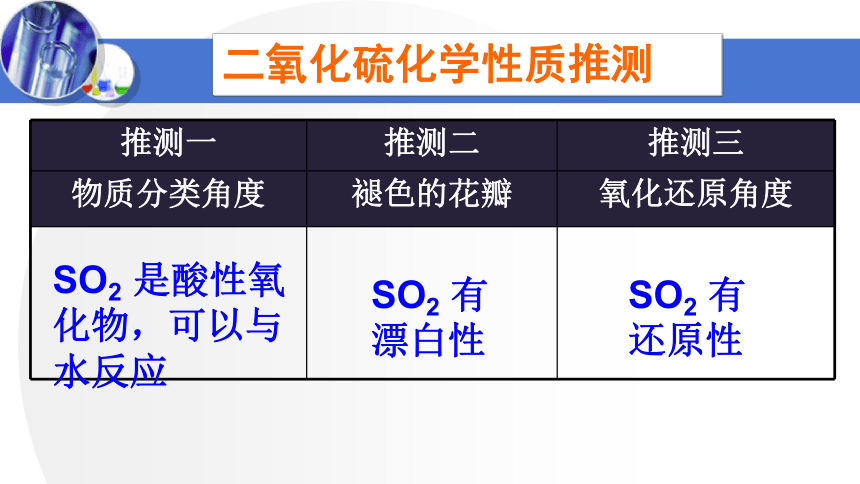
二氧化硫化学性质推测
推测一 推测二 推测三
物质分类角度 褪色的花瓣 氧化还原角度
SO2 是酸性氧化物,可以与水反应
SO2 有漂白性
SO2 有还原性
1.根据提供的实验用品,在学案上设计
实验方案;
2. 各小组汇报实验方案,讨论优化方案;
3. 实施优化后的实验方案;
4. 各小组展示实验现象和结论 。
小组实验探究活动阶段
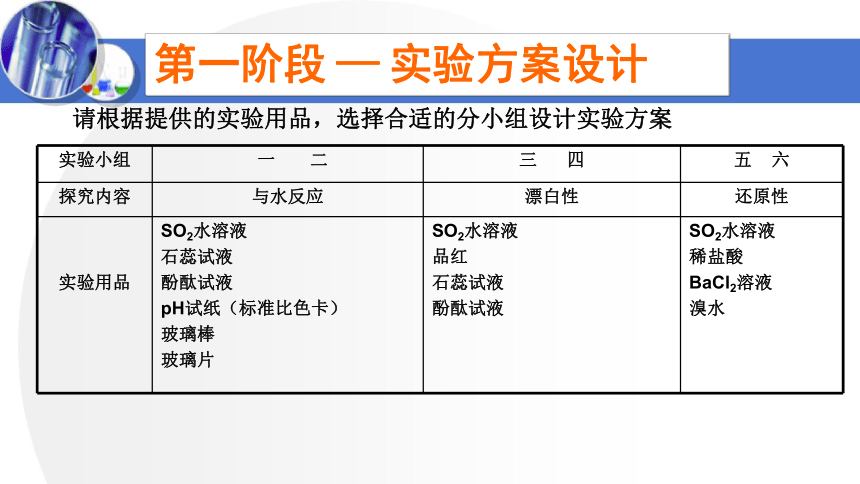
请根据提供的实验用品,选择合适的分小组设计实验方案
实验小组 一 二 三 四 五 六
探究内容 与水反应 漂白性 还原性
实验用品 SO2水溶液 石蕊试液 酚酞试液 pH试纸(标准比色卡) 玻璃棒 玻璃片 SO2水溶液 品红 石蕊试液 酚酞试液 SO2水溶液
稀盐酸
BaCl2溶液
溴水
第一阶段 — 实验方案设计
实验操作 预期现象 实验结论
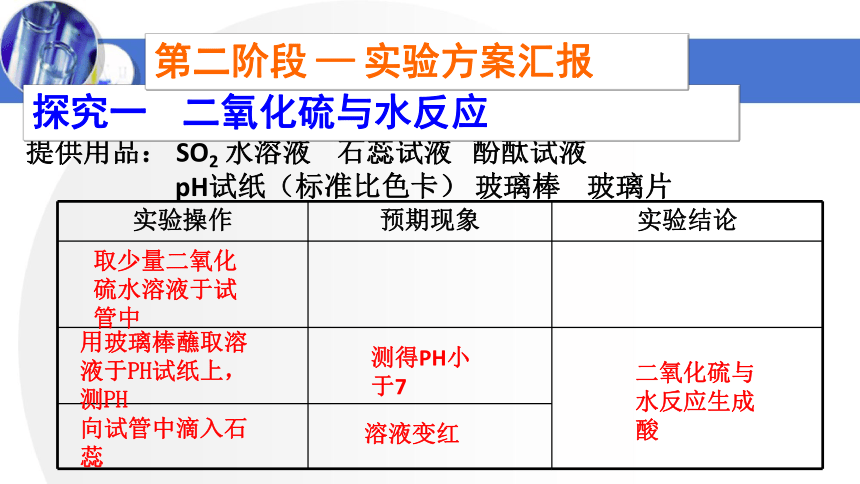
提供用品: SO2 水溶液 石蕊试液 酚酞试液
pH试纸(标准比色卡) 玻璃棒 玻璃片
探究一 二氧化硫与水反应
取少量二氧化硫水溶液于试管中
用玻璃棒蘸取溶液于PH试纸上,测PH
向试管中滴入石蕊
测得PH小于7
二氧化硫与水反应生成酸
溶液变红
第二阶段 — 实验方案汇报
实验操作 预期现象 实验结论
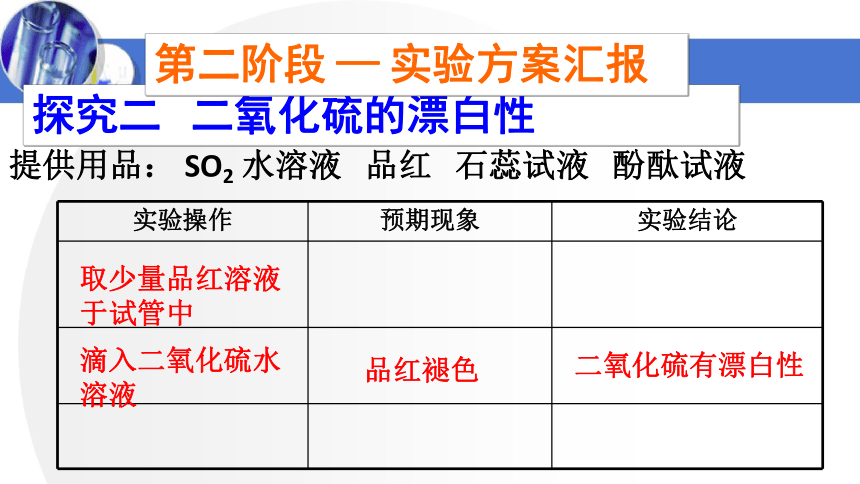
提供用品: SO2 水溶液 品红 石蕊试液 酚酞试液
探究二 二氧化硫的漂白性
取少量品红溶液于试管中
滴入二氧化硫水溶液
品红褪色
二氧化硫有漂白性
第二阶段 — 实验方案汇报
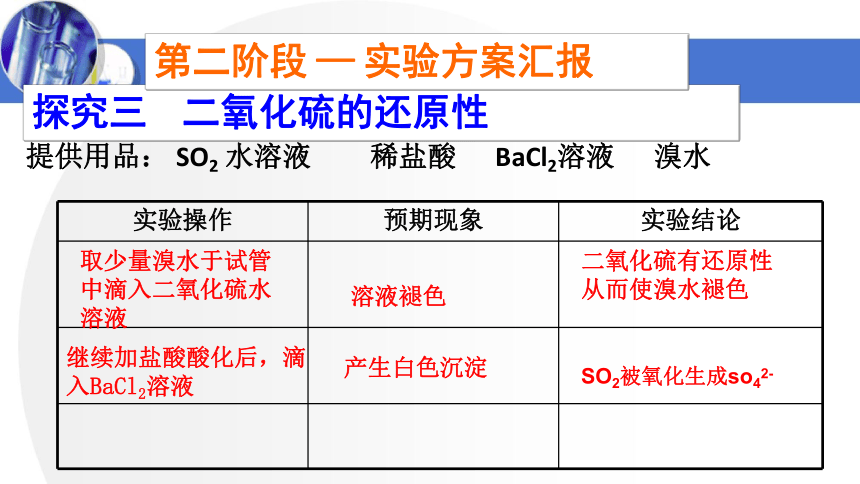
实验操作 预期现象 实验结论
提供用品: SO2 水溶液 稀盐酸 BaCl2溶液 溴水
探究三 二氧化硫的还原性
取少量溴水于试管中滴入二氧化硫水溶液
继续加盐酸酸化后,滴入BaCl2溶液
溶液褪色
产生白色沉淀
二氧化硫有还原性从而使溴水褪色
SO2被氧化生成so42-
第二阶段 — 实验方案汇报
第三阶段 —实施实验方案
温馨提示:1.SO2有毒,注意环保
2.分工合作
3.规范操作
实验操作 预期现象 实验结论
提供用品: SO2 水溶液 石蕊试液 酚酞试液
pH试纸(标准比色卡) 玻璃棒 玻璃片
探究一 二氧化硫与水反应
取少量二氧化硫水溶液于试管中
用玻璃棒蘸取溶液于PH试纸水,测PH
向试管中滴入石蕊
测得PH小于7
二氧化硫与水反应生成酸
溶液变红
第四阶段 —汇报实验现象及结论
可逆反应:在同一条件下既能向正反应方向进
行,又能向逆反应方向进行的反应。
(可逆符号)
SO2 + H2O H2SO3(亚硫酸)
SO2与水的反应
H2 燃烧生成水与水通电生成H2和O2,是可逆反应吗?
反应条件不同,不是可逆反应。
酸性氧化物的通性
1.与水反应
SO2 + H2O H2SO3
2.与碱反应
3.与碱性氧化物反应
SO2+2NaOH = Na2SO3+H2O
SO2 + Ca(OH)2 = CaSO3↓ + H2O
SO2+Na2O = Na2SO3
SO2 +CaO = CaSO3
实验操作 预期现象 实验结论
提供用品: SO2 水溶液 品红 石蕊试液 酚酞试液
探究二 二氧化硫的漂白性
取少量品红溶液于试管中
滴入二氧化硫水溶液
品红褪色
二氧化硫有漂白性
第四阶段 —汇报实验现象及结论
物质 HClO SO2
原理 将有色物质氧化
实质 氧化还原反应
效果
范围
漂白性比较
与有色物质结合生成不稳定的无色物质
非氧化还原反应
永久性
暂时性
可漂白大多数有机色素,能使紫色石蕊试液褪色
可漂白某些有机色素,不能使石蕊试液褪色
SO2漂白性应用
SO2漂白性应用
毒土豆
毒竹笋
毒坚果
毒卤蛋
毒香菇
毒豆芽
食品安全问题
实验操作 预期现象 实验结论
提供用品: SO2 水溶液 稀盐酸 BaCl2溶液 溴水
探究三 二氧化硫的还原性
取少量溴水于试管中滴入二氧化硫水溶液
继续加盐酸酸化后,滴入BaCl2溶液
溶液褪色
产生白色沉淀
二氧化硫有还原性从而使溴水褪色
SO2被氧化生成so42-
第四阶段 —汇报实验现象及结论
二氧化硫的还原性
1.书写二氧化硫通入溴水的化学方程式
2. 书写二氧化硫被O2氧化的化学方程式
催化剂
2SO2+O2
2SO3
△
SO3 + H2O = H2SO4
SO2 + Br2 + 2H2O = 2HBr + H2SO4
+4
+6
0
-1
思考:还有哪些物质能氧化二氧化硫?
氯水,高锰酸钾溶液,氧气等氧化剂
SO2的作用
1. 工业制硫酸
2. 漂白
3.消毒,杀菌
一、物理性质
二氧化硫知识小结
二、化学性质
1. 酸性氧化物的通性
SO2 + H2O H2SO3
SO2+2NaOH = Na2SO3+H2O
SO2+Na2O = Na2SO3
2.漂白性
3.还原性SO2 + Br2 + 2H2O = 2HBr + H2SO4
催化剂
2SO2+O2
2SO3
△
三、作用
1、列举可以用来鉴别SO2和CO2的化学方法。
2、湿润的氯气和二氧化硫皆可做漂白剂,若用两者 (1:1) 一起漂白一种物质时,漂白效果会( )
A. 增强 B. 不变 C. 减弱 D. 难确定
C
品红溶液
氯水 溴水 高锰酸钾溶液等氧化剂
知识应用
SO2 + Cl2 + 2H2O = 2HCl + H2SO4
二氧化硫的性质探究
物理性质
颜色 状态 气味 毒性 密度
溶解性
无色气态
刺激性
有毒
比空气大
易溶于水
二氧化硫化学性质推测
推测一 推测二 推测三
物质分类角度 褪色的花瓣 氧化还原角度
SO2 是酸性氧化物,可以与水反应
SO2 有漂白性
SO2 有还原性
1.根据提供的实验用品,在学案上设计
实验方案;
2. 各小组汇报实验方案,讨论优化方案;
3. 实施优化后的实验方案;
4. 各小组展示实验现象和结论 。
小组实验探究活动阶段
请根据提供的实验用品,选择合适的分小组设计实验方案
实验小组 一 二 三 四 五 六
探究内容 与水反应 漂白性 还原性
实验用品 SO2水溶液 石蕊试液 酚酞试液 pH试纸(标准比色卡) 玻璃棒 玻璃片 SO2水溶液 品红 石蕊试液 酚酞试液 SO2水溶液
稀盐酸
BaCl2溶液
溴水
第一阶段 — 实验方案设计
实验操作 预期现象 实验结论
提供用品: SO2 水溶液 石蕊试液 酚酞试液
pH试纸(标准比色卡) 玻璃棒 玻璃片
探究一 二氧化硫与水反应
取少量二氧化硫水溶液于试管中
用玻璃棒蘸取溶液于PH试纸上,测PH
向试管中滴入石蕊
测得PH小于7
二氧化硫与水反应生成酸
溶液变红
第二阶段 — 实验方案汇报
实验操作 预期现象 实验结论
提供用品: SO2 水溶液 品红 石蕊试液 酚酞试液
探究二 二氧化硫的漂白性
取少量品红溶液于试管中
滴入二氧化硫水溶液
品红褪色
二氧化硫有漂白性
第二阶段 — 实验方案汇报
实验操作 预期现象 实验结论
提供用品: SO2 水溶液 稀盐酸 BaCl2溶液 溴水
探究三 二氧化硫的还原性
取少量溴水于试管中滴入二氧化硫水溶液
继续加盐酸酸化后,滴入BaCl2溶液
溶液褪色
产生白色沉淀
二氧化硫有还原性从而使溴水褪色
SO2被氧化生成so42-
第二阶段 — 实验方案汇报
第三阶段 —实施实验方案
温馨提示:1.SO2有毒,注意环保
2.分工合作
3.规范操作
实验操作 预期现象 实验结论
提供用品: SO2 水溶液 石蕊试液 酚酞试液
pH试纸(标准比色卡) 玻璃棒 玻璃片
探究一 二氧化硫与水反应
取少量二氧化硫水溶液于试管中
用玻璃棒蘸取溶液于PH试纸水,测PH
向试管中滴入石蕊
测得PH小于7
二氧化硫与水反应生成酸
溶液变红
第四阶段 —汇报实验现象及结论
可逆反应:在同一条件下既能向正反应方向进
行,又能向逆反应方向进行的反应。
(可逆符号)
SO2 + H2O H2SO3(亚硫酸)
SO2与水的反应
H2 燃烧生成水与水通电生成H2和O2,是可逆反应吗?
反应条件不同,不是可逆反应。
酸性氧化物的通性
1.与水反应
SO2 + H2O H2SO3
2.与碱反应
3.与碱性氧化物反应
SO2+2NaOH = Na2SO3+H2O
SO2 + Ca(OH)2 = CaSO3↓ + H2O
SO2+Na2O = Na2SO3
SO2 +CaO = CaSO3
实验操作 预期现象 实验结论
提供用品: SO2 水溶液 品红 石蕊试液 酚酞试液
探究二 二氧化硫的漂白性
取少量品红溶液于试管中
滴入二氧化硫水溶液
品红褪色
二氧化硫有漂白性
第四阶段 —汇报实验现象及结论
物质 HClO SO2
原理 将有色物质氧化
实质 氧化还原反应
效果
范围
漂白性比较
与有色物质结合生成不稳定的无色物质
非氧化还原反应
永久性
暂时性
可漂白大多数有机色素,能使紫色石蕊试液褪色
可漂白某些有机色素,不能使石蕊试液褪色
SO2漂白性应用
SO2漂白性应用
毒土豆
毒竹笋
毒坚果
毒卤蛋
毒香菇
毒豆芽
食品安全问题
实验操作 预期现象 实验结论
提供用品: SO2 水溶液 稀盐酸 BaCl2溶液 溴水
探究三 二氧化硫的还原性
取少量溴水于试管中滴入二氧化硫水溶液
继续加盐酸酸化后,滴入BaCl2溶液
溶液褪色
产生白色沉淀
二氧化硫有还原性从而使溴水褪色
SO2被氧化生成so42-
第四阶段 —汇报实验现象及结论
二氧化硫的还原性
1.书写二氧化硫通入溴水的化学方程式
2. 书写二氧化硫被O2氧化的化学方程式
催化剂
2SO2+O2
2SO3
△
SO3 + H2O = H2SO4
SO2 + Br2 + 2H2O = 2HBr + H2SO4
+4
+6
0
-1
思考:还有哪些物质能氧化二氧化硫?
氯水,高锰酸钾溶液,氧气等氧化剂
SO2的作用
1. 工业制硫酸
2. 漂白
3.消毒,杀菌
一、物理性质
二氧化硫知识小结
二、化学性质
1. 酸性氧化物的通性
SO2 + H2O H2SO3
SO2+2NaOH = Na2SO3+H2O
SO2+Na2O = Na2SO3
2.漂白性
3.还原性SO2 + Br2 + 2H2O = 2HBr + H2SO4
催化剂
2SO2+O2
2SO3
△
三、作用
1、列举可以用来鉴别SO2和CO2的化学方法。
2、湿润的氯气和二氧化硫皆可做漂白剂,若用两者 (1:1) 一起漂白一种物质时,漂白效果会( )
A. 增强 B. 不变 C. 减弱 D. 难确定
C
品红溶液
氯水 溴水 高锰酸钾溶液等氧化剂
知识应用
SO2 + Cl2 + 2H2O = 2HCl + H2SO4
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
