5.1 硫及其化合物 第1课时 二氧化硫——酸雨的形成 课件(16张ppt) 2022-2023学年高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 5.1 硫及其化合物 第1课时 二氧化硫——酸雨的形成 课件(16张ppt) 2022-2023学年高一下学期化学人教版(2019)必修第二册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-10 09:06:16 | ||
图片预览



文档简介
(共16张PPT)
二氧化硫
——酸雨的形成
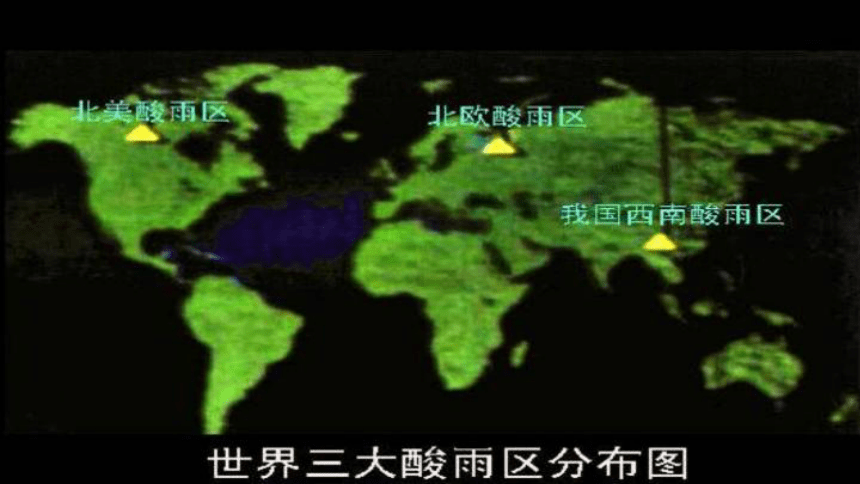
酸雨(acid rain):pH<5.6的降水
【资料】二氧化碳饱和溶液的 pH=5.6
【探究一】酸雨的形成——
SO2水溶性及其水溶液酸碱性
迅速变瘪
易溶于水
变红
实验操作 实验现象 实验结论
1 输液袋__________ SO2 _________
2 溶液___________ SO2溶液________
呈酸性
注意: 以铁架台为中心3人为一组
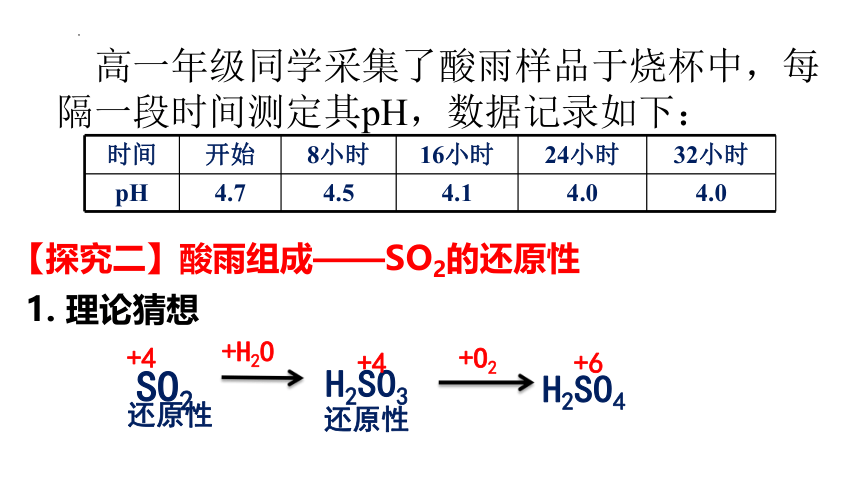
时间 开始 8小时 16小时 24小时 32小时
pH 4.7 4.5 4.1 4.0 4.0
高一年级同学采集了酸雨样品于烧杯中,每隔一段时间测定其pH,数据记录如下:
【探究二】酸雨组成——SO2的还原性
SO2
还原性
H2SO3
+O2
H2SO4
+H2O
+4
+4
+6
1. 理论猜想
还原性
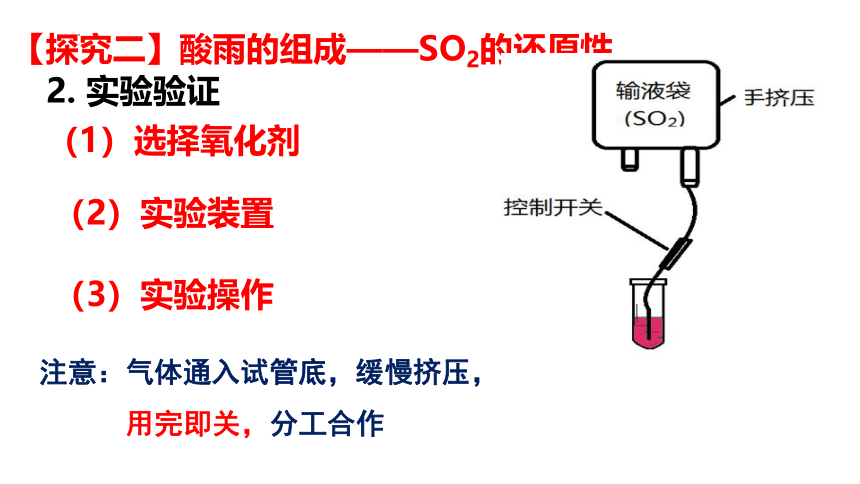
(1)选择氧化剂
(2)实验装置
【探究二】酸雨的组成——SO2的还原性
(3)实验操作
注意:气体通入试管底,缓慢挤压,
用完即关,分工合作
2. 实验验证
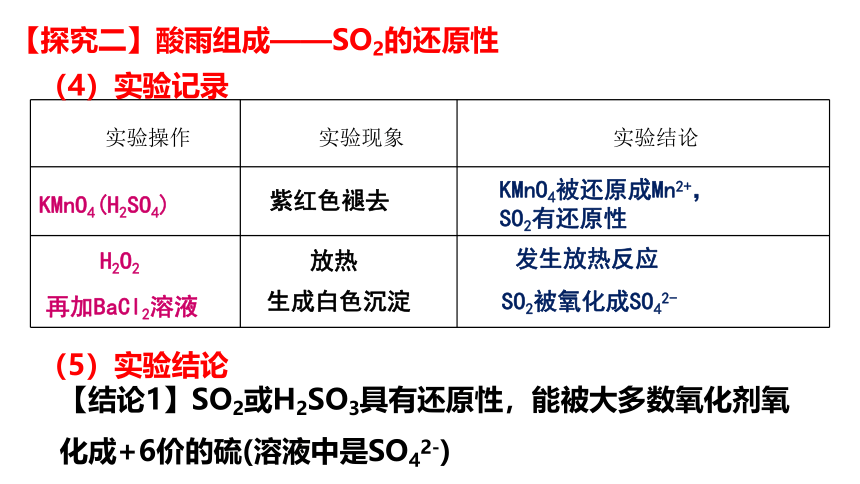
紫红色褪去
KMnO4被还原成Mn2+,
SO2有还原性
放热
实验操作 实验现象 实验结论
KMnO4(H2SO4)
H2O2
再加BaCl2溶液
生成白色沉淀
发生放热反应
SO2被氧化成SO42-
【结论1】SO2或H2SO3具有还原性,能被大多数氧化剂氧化成+6价的硫(溶液中是SO42-)
【探究二】酸雨组成——SO2的还原性
(4)实验记录
(5)实验结论
SO2
催化剂
H2SO4
+O2
SO3
+H2O
工业生产硫酸的步骤
【结论2】酸雨的形成途径
SO2
H2SO3
+O2
H2SO4
+H2O
【结论3】SO2导致的酸雨被称为
硫酸型酸雨
【探究二】酸雨的组成——SO2的还原性
(5)实验结论
加热
2SO2+O2 2SO3
催化剂
1.侵蚀建筑和和金属结构
酸雨的危害
2.损害生物和自然生态系统
【探究三】酸雨的危害——
SO2水溶液使红色树叶的红色消失的原因
1. 理论猜想
漂白性
2. 实验验证
【资料】漂白性:将有机色素变成无色物质的性质
品红:一种有机红色色素(染料)
(2)现象:
品红溶液由红色变为无色
(3)结论:
SO2具有漂白性
(1)实验操作:向SO2溶液中滴加品红溶液
【类比】
H2O(加酚酞)
先变红,再褪色
Na2O2
SO2(水溶液)
变红,不褪色
石蕊试液
(4)问题: SO2的漂白性原理?
【资料查阅并整理】
+有机色素
SO2
无色物质
加热
【实验验证】加热溶液,溶液变红,用红花检验生成的SO2 红花被漂白
SO2特点:不稳定(可逆)、选择性
(4)问题:SO2的漂白性原理?
利用SO2的漂白性
SO2作防腐剂
S+O2==SO2
点燃
酸雨的防治
1.减少化石燃料的使用
减少SO2的生成,先处理再排放
2、利用化学技术,找到更多的清洁能源
3、使用固硫技术和脱硫技术(钙积固硫)
CaO+SO2 =CaSO3 2CaSO3+O2=2CaSO4
4、收集成为工业硫酸的原料(变废为宝)
二氧化硫
——酸雨的形成
酸雨(acid rain):pH<5.6的降水
【资料】二氧化碳饱和溶液的 pH=5.6
【探究一】酸雨的形成——
SO2水溶性及其水溶液酸碱性
迅速变瘪
易溶于水
变红
实验操作 实验现象 实验结论
1 输液袋__________ SO2 _________
2 溶液___________ SO2溶液________
呈酸性
注意: 以铁架台为中心3人为一组
时间 开始 8小时 16小时 24小时 32小时
pH 4.7 4.5 4.1 4.0 4.0
高一年级同学采集了酸雨样品于烧杯中,每隔一段时间测定其pH,数据记录如下:
【探究二】酸雨组成——SO2的还原性
SO2
还原性
H2SO3
+O2
H2SO4
+H2O
+4
+4
+6
1. 理论猜想
还原性
(1)选择氧化剂
(2)实验装置
【探究二】酸雨的组成——SO2的还原性
(3)实验操作
注意:气体通入试管底,缓慢挤压,
用完即关,分工合作
2. 实验验证
紫红色褪去
KMnO4被还原成Mn2+,
SO2有还原性
放热
实验操作 实验现象 实验结论
KMnO4(H2SO4)
H2O2
再加BaCl2溶液
生成白色沉淀
发生放热反应
SO2被氧化成SO42-
【结论1】SO2或H2SO3具有还原性,能被大多数氧化剂氧化成+6价的硫(溶液中是SO42-)
【探究二】酸雨组成——SO2的还原性
(4)实验记录
(5)实验结论
SO2
催化剂
H2SO4
+O2
SO3
+H2O
工业生产硫酸的步骤
【结论2】酸雨的形成途径
SO2
H2SO3
+O2
H2SO4
+H2O
【结论3】SO2导致的酸雨被称为
硫酸型酸雨
【探究二】酸雨的组成——SO2的还原性
(5)实验结论
加热
2SO2+O2 2SO3
催化剂
1.侵蚀建筑和和金属结构
酸雨的危害
2.损害生物和自然生态系统
【探究三】酸雨的危害——
SO2水溶液使红色树叶的红色消失的原因
1. 理论猜想
漂白性
2. 实验验证
【资料】漂白性:将有机色素变成无色物质的性质
品红:一种有机红色色素(染料)
(2)现象:
品红溶液由红色变为无色
(3)结论:
SO2具有漂白性
(1)实验操作:向SO2溶液中滴加品红溶液
【类比】
H2O(加酚酞)
先变红,再褪色
Na2O2
SO2(水溶液)
变红,不褪色
石蕊试液
(4)问题: SO2的漂白性原理?
【资料查阅并整理】
+有机色素
SO2
无色物质
加热
【实验验证】加热溶液,溶液变红,用红花检验生成的SO2 红花被漂白
SO2特点:不稳定(可逆)、选择性
(4)问题:SO2的漂白性原理?
利用SO2的漂白性
SO2作防腐剂
S+O2==SO2
点燃
酸雨的防治
1.减少化石燃料的使用
减少SO2的生成,先处理再排放
2、利用化学技术,找到更多的清洁能源
3、使用固硫技术和脱硫技术(钙积固硫)
CaO+SO2 =CaSO3 2CaSO3+O2=2CaSO4
4、收集成为工业硫酸的原料(变废为宝)
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
