6.1 化学反应与能量变化 第2课时 课件(28张ppt) 2022-2023学年高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 6.1 化学反应与能量变化 第2课时 课件(28张ppt) 2022-2023学年高一下学期化学人教版(2019)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 794.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-10 09:07:30 | ||
图片预览





文档简介
(共28张PPT)
第六章 化学反应与能量
第一节 化学反应与能量变化
第二部分 化学反应与电能
一、原电池的能量转化
阅读P36第一、二段,了解化学电池的能量转化形式。
化学电池:将氧化还原反应释放的能量直接转化为电能。
这种将化学能转化为内容的装置称为原电池(P37)。
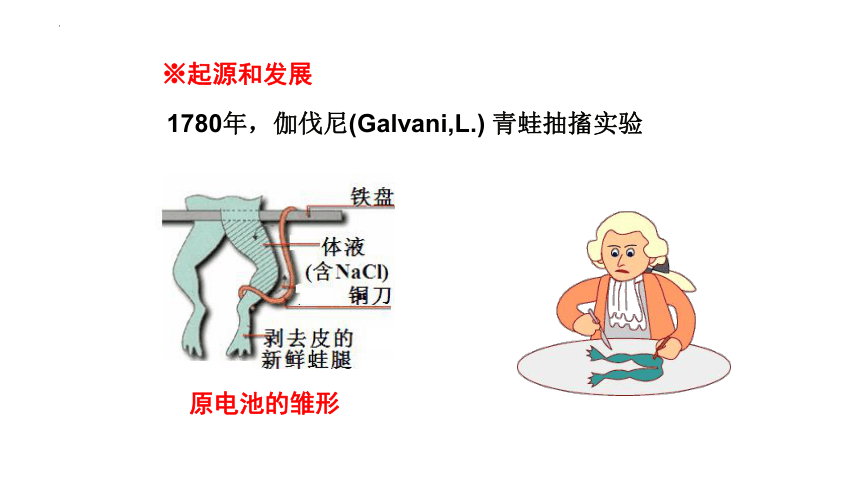
※起源和发展
1780年,伽伐尼(Galvani,L.) 青蛙抽搐实验
原电池的雏形
伏打对生物电观点的质疑
(Volta,A.1745-1827)
1800年建立伏打电堆模型。
伏打电池是
实用电池的开端。
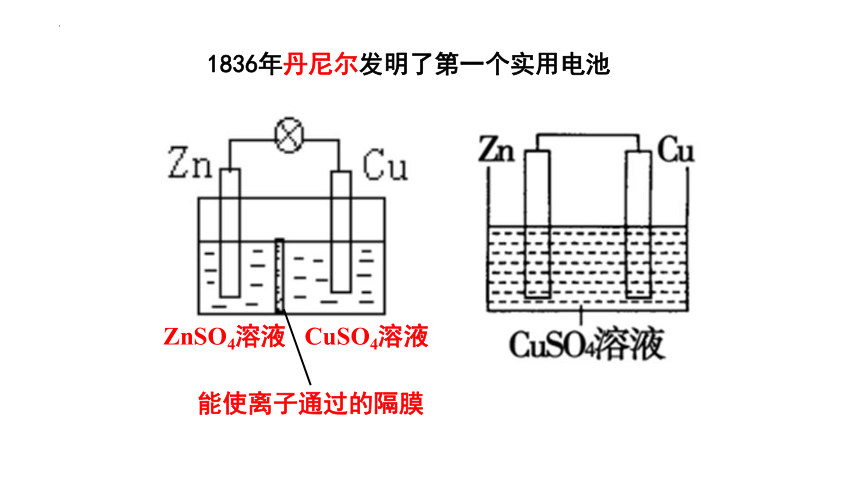
ZnSO4溶液 CuSO4溶液
1836年丹尼尔发明了第一个实用电池
能使离子通过的隔膜
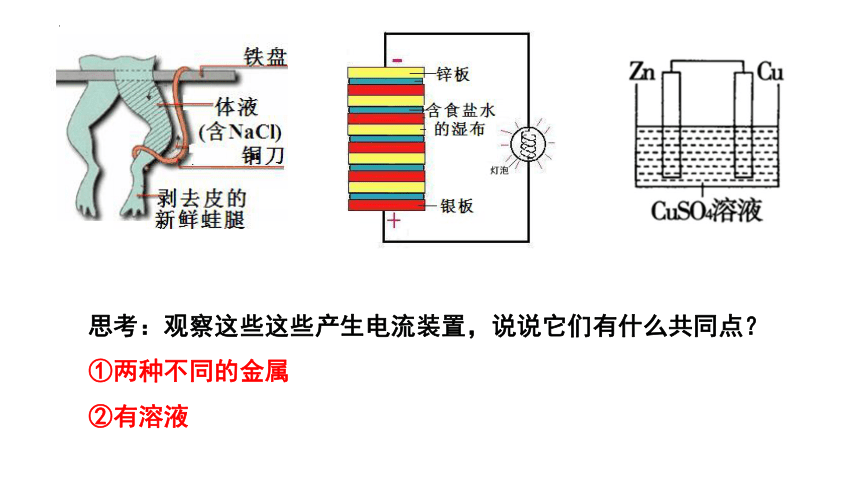
思考:观察这些这些产生电流装置,说说它们有什么共同点?
①两种不同的金属
②有溶液
产生电流装置——原电池,有以下特点
①两种不同的金属
②有溶液
观察实验6-3,完成以下任务
①进一步补充原电池产生电流的条件
②从控制变量的角度出发提出补充实验,对上述条件进行验证
或金属与非金属(石墨)
能导电
③形成闭合回路
④有氧化还原反应
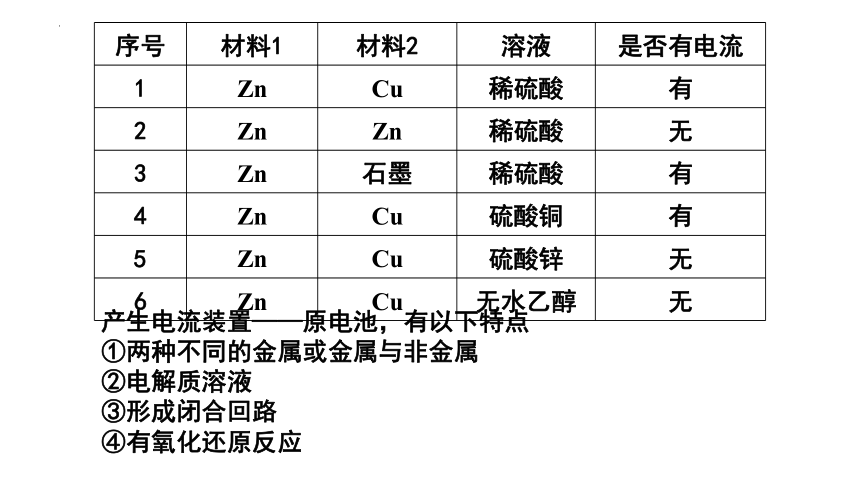
序号 材料1 材料2 溶液 是否有电流
1 Zn Cu 稀硫酸 有
2 Zn Zn 稀硫酸 无
3 Zn 石墨 稀硫酸 有
4 Zn Cu 硫酸铜 有
5 Zn Cu 硫酸锌 无
6 Zn Cu 无水乙醇 无
产生电流装置——原电池,有以下特点
①两种不同的金属或金属与非金属
②电解质溶液
③形成闭合回路
④有氧化还原反应
下列能形成原电池的是
①②③
下列能产生电流的是
都可以
下列能形成原电池的是
AD
三、原电池的工作原理
电流方向
外电路(导线)
内电路(电解液)
-
+
电子方向
正电荷方向→
←负电荷方向
失电子(氧化反应)
电流方向
得电子(还原反应)
-
+
电子方向
电流方向
-
+
电子方向
正电荷方向→
←负电荷方向
正极聚集了电子,吸引正电荷
负极失去了电子,正电性增强,吸引负电荷
外电路:
①电子从负极流向正极
②电流从正极流向负极
内电路:
①正电荷向正极移动,负电荷向负极移动
(正极聚集正电荷,负极聚集负电荷)
②内电路不传递电子,电子只在金属导体中移动
③电流从负极流向正极
小结1:移动方向
电极 Zn电极 Cu电极
得失电子 ____电子 ____电子
电子流向
电极名称
反应类型
电极反应式
总反应式 推测现象
负极
正极
失
得
流出
流入
氧化反应
还原反应
锌片溶解
产生气泡
Zn-2e-=Zn2+
2H++2e-=H2↑
Zn+2H+=Zn2++H2↑
负极:
负极材料失电子
正极:
正极附近的离子得电子
小结2:电极反应
小结3:负极判断
①活泼的金属是负极
②……
练习:判断正极和负极
I→
e-→
Cl-→
-
+
-
+
-
+
电流流入端是负极
电子流出端是负极
阴离子向负极移动
铁片溶解
-
+
Fe2+→Fe3+
-
+
练习:判断正极和负极
溶解的是负极
发生氧化反应是负极
小结3:负极判断
①活泼金属是负极
②电子流出的方向是负极
③阴离子移动的方向是负极
④失电子,发生氧化反应的是负极
⑤溶解的是负极
关于右图装置的叙述,正确的是( )
A.铜是负极,铜片上有气泡产生
B.铜片质量逐渐减少
C.电流从锌片经导线流向铜片
D.氢离子在铜片表面被还原后生成H2
E .正极附近的SO42 -离子浓度逐渐增大
D
将Al片和Cu片用导线连接,一组插入浓硝酸中,一组插入稀氢氧化钠溶液中,分别形成原电池。在这两个原电池中,负极分别为( )
A.Al片、Cu片 B.Cu片、Al片
C.Al片、Al片 D.Cu片、Cu片
B
总反应为:Zn+MnO2+2H2O=Zn(OH)2+Mn(OH)2
总反应为:Zn+MnO2+4NH4Cl=ZnCl2+MnCl2+4NH3+2H2O
VO2+/VO2+
V3+/V2+
e-
质子交换膜(只允许氢离子通过)
一种以稀硫酸为电解质溶液的钒电池,两个电极为惰性电极(不参加反应)。该电池放电时
A.电能转化为化学能
B.a为电池正极
C.H+由a极向b极移动
D.b的电极反应为:V3++e-=V2+
a
b
B
三、化学电源
1.一次电池
2.二次电池(充电电池)
3.燃料电池
原电池原理的应用
(1)判断金属活泼性
(2)加快反应速率
(3)保护金属
Zn
Fe
电解质溶液
Zn活泼,作负极,发生氧化反应,正极金属Fe不反应,受到保护,不会腐蚀
第六章 化学反应与能量
第一节 化学反应与能量变化
第二部分 化学反应与电能
一、原电池的能量转化
阅读P36第一、二段,了解化学电池的能量转化形式。
化学电池:将氧化还原反应释放的能量直接转化为电能。
这种将化学能转化为内容的装置称为原电池(P37)。
※起源和发展
1780年,伽伐尼(Galvani,L.) 青蛙抽搐实验
原电池的雏形
伏打对生物电观点的质疑
(Volta,A.1745-1827)
1800年建立伏打电堆模型。
伏打电池是
实用电池的开端。
ZnSO4溶液 CuSO4溶液
1836年丹尼尔发明了第一个实用电池
能使离子通过的隔膜
思考:观察这些这些产生电流装置,说说它们有什么共同点?
①两种不同的金属
②有溶液
产生电流装置——原电池,有以下特点
①两种不同的金属
②有溶液
观察实验6-3,完成以下任务
①进一步补充原电池产生电流的条件
②从控制变量的角度出发提出补充实验,对上述条件进行验证
或金属与非金属(石墨)
能导电
③形成闭合回路
④有氧化还原反应
序号 材料1 材料2 溶液 是否有电流
1 Zn Cu 稀硫酸 有
2 Zn Zn 稀硫酸 无
3 Zn 石墨 稀硫酸 有
4 Zn Cu 硫酸铜 有
5 Zn Cu 硫酸锌 无
6 Zn Cu 无水乙醇 无
产生电流装置——原电池,有以下特点
①两种不同的金属或金属与非金属
②电解质溶液
③形成闭合回路
④有氧化还原反应
下列能形成原电池的是
①②③
下列能产生电流的是
都可以
下列能形成原电池的是
AD
三、原电池的工作原理
电流方向
外电路(导线)
内电路(电解液)
-
+
电子方向
正电荷方向→
←负电荷方向
失电子(氧化反应)
电流方向
得电子(还原反应)
-
+
电子方向
电流方向
-
+
电子方向
正电荷方向→
←负电荷方向
正极聚集了电子,吸引正电荷
负极失去了电子,正电性增强,吸引负电荷
外电路:
①电子从负极流向正极
②电流从正极流向负极
内电路:
①正电荷向正极移动,负电荷向负极移动
(正极聚集正电荷,负极聚集负电荷)
②内电路不传递电子,电子只在金属导体中移动
③电流从负极流向正极
小结1:移动方向
电极 Zn电极 Cu电极
得失电子 ____电子 ____电子
电子流向
电极名称
反应类型
电极反应式
总反应式 推测现象
负极
正极
失
得
流出
流入
氧化反应
还原反应
锌片溶解
产生气泡
Zn-2e-=Zn2+
2H++2e-=H2↑
Zn+2H+=Zn2++H2↑
负极:
负极材料失电子
正极:
正极附近的离子得电子
小结2:电极反应
小结3:负极判断
①活泼的金属是负极
②……
练习:判断正极和负极
I→
e-→
Cl-→
-
+
-
+
-
+
电流流入端是负极
电子流出端是负极
阴离子向负极移动
铁片溶解
-
+
Fe2+→Fe3+
-
+
练习:判断正极和负极
溶解的是负极
发生氧化反应是负极
小结3:负极判断
①活泼金属是负极
②电子流出的方向是负极
③阴离子移动的方向是负极
④失电子,发生氧化反应的是负极
⑤溶解的是负极
关于右图装置的叙述,正确的是( )
A.铜是负极,铜片上有气泡产生
B.铜片质量逐渐减少
C.电流从锌片经导线流向铜片
D.氢离子在铜片表面被还原后生成H2
E .正极附近的SO42 -离子浓度逐渐增大
D
将Al片和Cu片用导线连接,一组插入浓硝酸中,一组插入稀氢氧化钠溶液中,分别形成原电池。在这两个原电池中,负极分别为( )
A.Al片、Cu片 B.Cu片、Al片
C.Al片、Al片 D.Cu片、Cu片
B
总反应为:Zn+MnO2+2H2O=Zn(OH)2+Mn(OH)2
总反应为:Zn+MnO2+4NH4Cl=ZnCl2+MnCl2+4NH3+2H2O
VO2+/VO2+
V3+/V2+
e-
质子交换膜(只允许氢离子通过)
一种以稀硫酸为电解质溶液的钒电池,两个电极为惰性电极(不参加反应)。该电池放电时
A.电能转化为化学能
B.a为电池正极
C.H+由a极向b极移动
D.b的电极反应为:V3++e-=V2+
a
b
B
三、化学电源
1.一次电池
2.二次电池(充电电池)
3.燃料电池
原电池原理的应用
(1)判断金属活泼性
(2)加快反应速率
(3)保护金属
Zn
Fe
电解质溶液
Zn活泼,作负极,发生氧化反应,正极金属Fe不反应,受到保护,不会腐蚀
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
