2022—2023学年人教九年级下册第8单元 金属和金属材料 同步训练题(含答案)
文档属性
| 名称 | 2022—2023学年人教九年级下册第8单元 金属和金属材料 同步训练题(含答案) |
|
|
| 格式 | zip | ||
| 文件大小 | 368.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-10 00:00:00 | ||
图片预览




文档简介
2022—2023学年人教九年级下册第8单元 金属和金属材料 同步训练题含答案
人教第8单元 金属和金属材料
一、选择题。
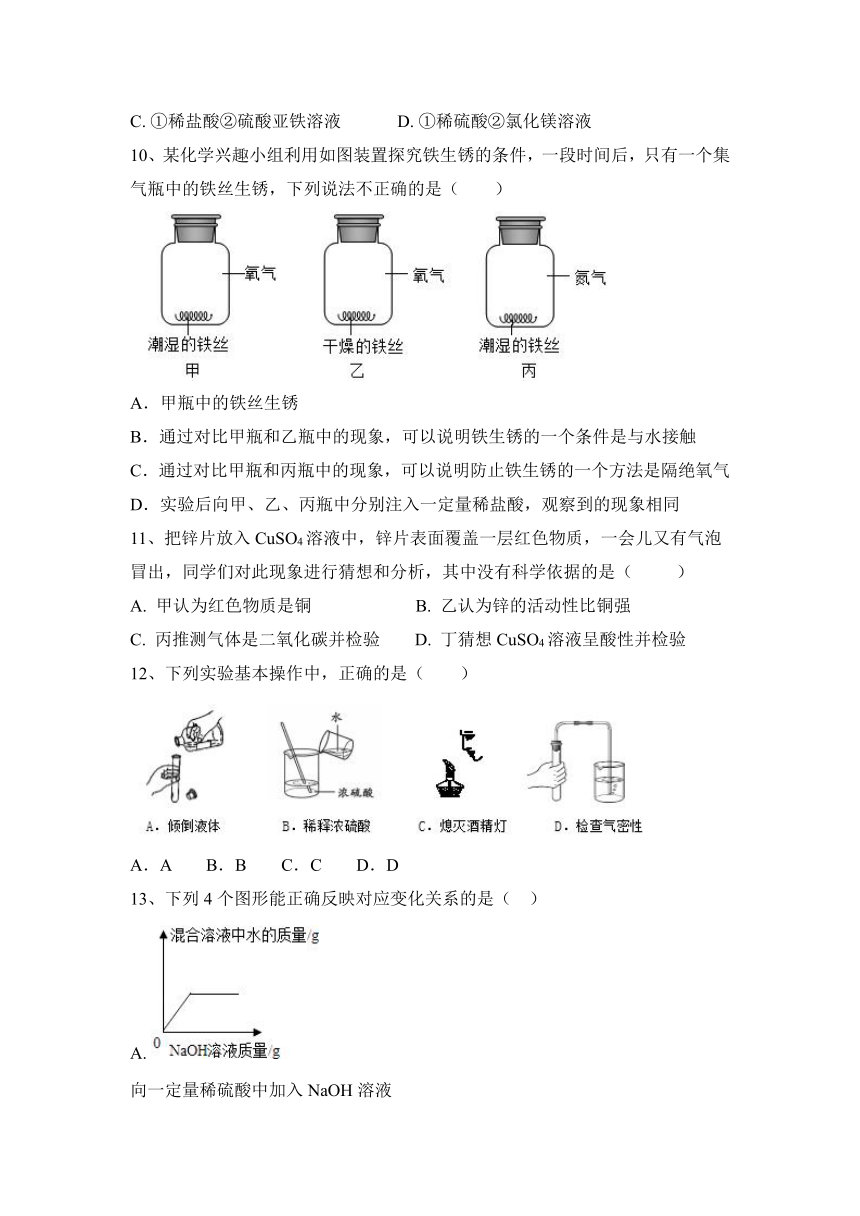
1、下列实验操作或设计正确的是( )
A.量取液体 B.蒸发溶剂
C.证明质量守恒定律 D.稀释浓硫酸
2、下列反应属于置换反应的是( )
A.甲烷燃烧:CH4+2O2CO2+2H2O
B.一氧化碳还原氧化铜:CO+CuOCu+CO2
C.木炭还原氧化铜:C+2CuO2Cu+CO2↑
D.CO2的检验:Ca( OH )2+CO2CaCO3↓+H2O
3、某兴趣小组进行实验探究,向盛有硝酸亚铁和硝酸银混合液的烧杯中加入一定量的锌粉,反应停止后过滤,向滤渣中加入稀盐酸,有气泡产生下列说法正确的是( )
A. 滤液中一定含有Zn2+和Fe2+,一定没有Ag+
B. 滤液中一定含有Zn2+,一定没有Fe2+和Ag+
C. 滤渣中一定含有银,可能含有锌和铁
D. 滤渣中一定含有银和铁,可能含有锌
4、下列四种矿石中主要成分属于单质的是( )
A.铝土矿 B.金矿 C.白钨矿 D.辉铜矿
5、如图是某化学兴趣小组设计的观察铁制品锈蚀的实验装置。下列相关叙述中正确的是( )
①一段时间后,铁丝会由下向上出现锈蚀现象
②一段时间后,水面处铁丝锈蚀严重
③一段时间后,塑料瓶会膨胀,因为铁生锈放热
④一段时间后,塑料瓶会变瘪,因为铁生锈与空气有关
A.①② B.②④ C.②③ D.③④
6、下列关于金属的说法正确的是( )
A.铜质插头利用了铜的导电性
B.硬铝的硬度比铝小
C.在金属表面喷涂油漆是防止其锈蚀的唯一方法
D.Ag能将硝酸铜溶液中的铜置换出来
7、现有X、Y、Z三种金属,已知:①X+YCl2===XCl2+Y,②把Y、Z两种金属分别放入稀硫酸中,只有 Y 和稀硫酸反应。这三种金属的活动性由强到弱的顺序是( )
A. X>Z>Y B. Z>Y>X C. Y>Z>X D. X>Y>Z
8、下列物质的用途和性质对应错误的是( )
A.氧气可用于炼钢:氧气具有可燃性
B.浓硫酸做干燥剂:浓硫酸具有吸水性
C.二氧化碳可用于灭火:二氧化碳不支持燃烧
D.氢氧化铝可用于治疗胃酸过多症:氢氧化铝可与胃酸发生中和反应
9、某同学为探究镁、锌、铜、银的活动性顺序,设计如图实验流程,依据流程设计,下面对物质①、②的选择合理的是( )
A. ①稀硫酸②硫酸铜溶液 B. ①稀盐酸②硫酸锌溶液
C. ①稀盐酸②硫酸亚铁溶液 D. ①稀硫酸②氯化镁溶液
10、某化学兴趣小组利用如图装置探究铁生锈的条件,一段时间后,只有一个集气瓶中的铁丝生锈,下列说法不正确的是( )
A.甲瓶中的铁丝生锈
B.通过对比甲瓶和乙瓶中的现象,可以说明铁生锈的一个条件是与水接触
C.通过对比甲瓶和丙瓶中的现象,可以说明防止铁生锈的一个方法是隔绝氧气
D.实验后向甲、乙、丙瓶中分别注入一定量稀盐酸,观察到的现象相同
11、把锌片放入CuSO4溶液中,锌片表面覆盖一层红色物质,一会儿又有气泡冒出,同学们对此现象进行猜想和分析,其中没有科学依据的是( )
A. 甲认为红色物质是铜 B. 乙认为锌的活动性比铜强
C. 丙推测气体是二氧化碳并检验 D. 丁猜想CuSO4溶液呈酸性并检验
12、下列实验基本操作中,正确的是( )
A.A B.B C.C D.D
13、下列4个图形能正确反映对应变化关系的是( )
A.
向一定量稀硫酸中加入NaOH溶液
B.
向一定量CuSO4溶液中加入Zn粉
C.
加热KClO3与MnO2固体混合物
D.
向一定量NaOH和Ca(OH)2的混合溶液中加入Na2CO3溶液
14、下列有关金属材料的说法错误的是( )
A.在潮湿的空气中铁易生锈
B.金属的回收利用是保护金属资源的有效途径之一
C.铝和金都有很好的抗腐蚀性,是因为二者的化学性质都很稳定
D.高炉炼铁的原理是在高温条件下,用一氧化碳把铁从铁矿石里还原出来
15、为了验证铁、铜两种金属的活动性差异,如图所示取两支试管分别进行有关实验,若要观察到现象的显著差异,所用液体合理的是( )
A. 蒸馏水 B. 稀盐酸 C. 酒精水溶液 D. 硫酸钠溶液
二、填空题。
16、铝土矿的主要成分是氧化铝(Al2O3),在氧化铝中铝元素与氧元素的质量之比是 ,170t含氧化铝80%的铝土矿,理论上可炼出金属铝 吨。
17、用铝丝、洁净的铜丝、稀盐酸、AgNO3溶液,验证Al、Cu Ag的活动性顺序。
(1)把打磨过的铝丝和洁净的铜丝分别浸入稀盐酸中,观察到铝丝表面有气泡产生,铜丝表面无明显现象,由此判断出Al和Cu的活动性强弱顺序为________>(H)>________;发生反应的基本反应类型是________ ;铝丝使用前需用砂纸打磨的原因是________ ;
(2)为了达到实验目的,除(1)中实验外,还需要进行的实验是:
________ 。
18、化学电池在通信、交通和日常生活中有着广泛的应用,但是,废弃电池所带来的环境污染问题也日益突出.已知镍镉(Ni﹣Cd)电池中发生的化学反应为:
Cd+2NiO(OH)+2H2O2Ni(OH)2+Cd(OH)2
其中Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸.请回答:
(1)镍镉电池充电时,其能量的转化是由 能转化为 能;
(2)一节废镍镉电池会使1m2的耕地失去使用价值,要酸性土壤中,这种污染尤为严重.这是因为 。
(3)废弃的镍镉电池所产生的Cd2+污染,可导致人体患骨痛病及肝、肾、肺的病变,其中,Cd2+进入人体的途径如下图所示:
A、B、C代表Cd2+污染传递的载体,如果A代表土壤;则B代表 ;C代表 .
(4)你认为减少甚至消除废弃电池污染,应采取的措施是: 。
19、镁条与稀硫酸反应,产生大量 ,反应的化学方程式为 。
20、“轻轨电车”(如图)是近年来新兴的城市高架交通工具,具有污染小的优点.当轻轨电车开动时,轻轨电车上裸露的“电刷”沿架空电线滑动.电刷材料中含有石墨.选择石墨作电刷材料是因为其具有下列性质:
① ;
② .
21、向一定量的硝酸银和硝酸铜的混合溶液中加入锌粉,所得溶液的质量与加入锌粉质量关系如图,请回答下列问题。
(1)a点时溶液中有哪些溶质?________ 。
(2)b~d段发生反应的化学方程式。_______ _ 。
(3)充分反应后发现得到固体质量增加的原因是什么
________ 。
22、为充分利用资源,全国各地都在试行垃圾分类回收,有以下生活垃圾:
①纸盒;②铝质易拉罐;③雪碧塑料饮料瓶;④铜导线;⑤镀锌自来水管
可以作为同一类回收的是 (填编号),它们属于 (填“金属”、“非金属”)
23、铁片与稀硫酸反应,产生少量 ,溶液由无色变成 色,反应的化学方程式为 。
三、实验题。
24、某课外学习小组的同学为进一步探究活泼金属与酸反应的情况,做了以下两组对比实验(如图所示)。请根据实验Ⅰ、Ⅱ回答下列问题。
(1)实验Ⅰ反映了 的剧烈程度不同;实验Ⅱ则表明了不同种金属与同种酸反应的剧烈程度不同,原因是 ;写出实验Ⅱ中锌片与稀盐酸反应的化学方程式: 。
(2)按照实验Ⅰ和Ⅱ的设计思路,请你再设计一组对比实验,简述实验方案:
。
四、计算题。
25、欲测定Cu﹣Zn合金及Cu﹣Ag合金中铜的质量分数,实验室只提供一瓶未标明质量分数的稀硫酸和必要的仪器。
(1)你认为用以上药品和仪器能测出铜的质量分数的是________ 合金。
(2)取该合金的粉末32.5g与足量该硫酸充分反应,经测定产生了0.4g气体。请你计算该合金中铜的质量分数。
2022—2023学年人教九年级下册第8单元 金属和金属材料 同步训练题含答案
人教第8单元 金属和金属材料
一、选择题。
1、下列实验操作或设计正确的是( )
A.量取液体 B.蒸发溶剂
C.证明质量守恒定律 D.稀释浓硫酸
【答案】B
2、下列反应属于置换反应的是( )
A.甲烷燃烧:CH4+2O2CO2+2H2O
B.一氧化碳还原氧化铜:CO+CuOCu+CO2
C.木炭还原氧化铜:C+2CuO2Cu+CO2↑
D.CO2的检验:Ca( OH )2+CO2CaCO3↓+H2O
【答案】C
3、某兴趣小组进行实验探究,向盛有硝酸亚铁和硝酸银混合液的烧杯中加入一定量的锌粉,反应停止后过滤,向滤渣中加入稀盐酸,有气泡产生下列说法正确的是( )
A. 滤液中一定含有Zn2+和Fe2+,一定没有Ag+
B. 滤液中一定含有Zn2+,一定没有Fe2+和Ag+
C. 滤渣中一定含有银,可能含有锌和铁
D. 滤渣中一定含有银和铁,可能含有锌
【答案】D
4、下列四种矿石中主要成分属于单质的是( )
A.铝土矿 B.金矿 C.白钨矿 D.辉铜矿
【答案】B
5、如图是某化学兴趣小组设计的观察铁制品锈蚀的实验装置。下列相关叙述中正确的是( )
①一段时间后,铁丝会由下向上出现锈蚀现象
②一段时间后,水面处铁丝锈蚀严重
③一段时间后,塑料瓶会膨胀,因为铁生锈放热
④一段时间后,塑料瓶会变瘪,因为铁生锈与空气有关
A.①② B.②④ C.②③ D.③④
【答案】B
6、下列关于金属的说法正确的是( )
A.铜质插头利用了铜的导电性
B.硬铝的硬度比铝小
C.在金属表面喷涂油漆是防止其锈蚀的唯一方法
D.Ag能将硝酸铜溶液中的铜置换出来
【答案】A
7、现有X、Y、Z三种金属,已知:①X+YCl2===XCl2+Y,②把Y、Z两种金属分别放入稀硫酸中,只有 Y 和稀硫酸反应。这三种金属的活动性由强到弱的顺序是( )
A. X>Z>Y B. Z>Y>X C. Y>Z>X D. X>Y>Z
【答案】D
8、下列物质的用途和性质对应错误的是( )
A.氧气可用于炼钢:氧气具有可燃性
B.浓硫酸做干燥剂:浓硫酸具有吸水性
C.二氧化碳可用于灭火:二氧化碳不支持燃烧
D.氢氧化铝可用于治疗胃酸过多症:氢氧化铝可与胃酸发生中和反应
【答案】A
9、某同学为探究镁、锌、铜、银的活动性顺序,设计如图实验流程,依据流程设计,下面对物质①、②的选择合理的是( )
A. ①稀硫酸②硫酸铜溶液 B. ①稀盐酸②硫酸锌溶液
C. ①稀盐酸②硫酸亚铁溶液 D. ①稀硫酸②氯化镁溶液
【答案】A
10、某化学兴趣小组利用如图装置探究铁生锈的条件,一段时间后,只有一个集气瓶中的铁丝生锈,下列说法不正确的是( )
A.甲瓶中的铁丝生锈
B.通过对比甲瓶和乙瓶中的现象,可以说明铁生锈的一个条件是与水接触
C.通过对比甲瓶和丙瓶中的现象,可以说明防止铁生锈的一个方法是隔绝氧气
D.实验后向甲、乙、丙瓶中分别注入一定量稀盐酸,观察到的现象相同
【答案】D
11、把锌片放入CuSO4溶液中,锌片表面覆盖一层红色物质,一会儿又有气泡冒出,同学们对此现象进行猜想和分析,其中没有科学依据的是( )
A. 甲认为红色物质是铜 B. 乙认为锌的活动性比铜强
C. 丙推测气体是二氧化碳并检验 D. 丁猜想CuSO4溶液呈酸性并检验
【答案】C
12、下列实验基本操作中,正确的是( )
A.A B.B C.C D.D
【答案】D
13、下列4个图形能正确反映对应变化关系的是( )
A.
向一定量稀硫酸中加入NaOH溶液
B.
向一定量CuSO4溶液中加入Zn粉
C.
加热KClO3与MnO2固体混合物
D.
向一定量NaOH和Ca(OH)2的混合溶液中加入Na2CO3溶液
【答案】C
14、下列有关金属材料的说法错误的是( )
A.在潮湿的空气中铁易生锈
B.金属的回收利用是保护金属资源的有效途径之一
C.铝和金都有很好的抗腐蚀性,是因为二者的化学性质都很稳定
D.高炉炼铁的原理是在高温条件下,用一氧化碳把铁从铁矿石里还原出来
【答案】C
15、为了验证铁、铜两种金属的活动性差异,如图所示取两支试管分别进行有关实验,若要观察到现象的显著差异,所用液体合理的是( )
A. 蒸馏水 B. 稀盐酸 C. 酒精水溶液 D. 硫酸钠溶液
【答案】B
二、填空题。
16、铝土矿的主要成分是氧化铝(Al2O3),在氧化铝中铝元素与氧元素的质量之比是 ,170t含氧化铝80%的铝土矿,理论上可炼出金属铝 吨。
【答案】9:8; 72
17、用铝丝、洁净的铜丝、稀盐酸、AgNO3溶液,验证Al、Cu Ag的活动性顺序。
(1)把打磨过的铝丝和洁净的铜丝分别浸入稀盐酸中,观察到铝丝表面有气泡产生,铜丝表面无明显现象,由此判断出Al和Cu的活动性强弱顺序为________>(H)>________;发生反应的基本反应类型是________ ;铝丝使用前需用砂纸打磨的原因是________ ;
(2)为了达到实验目的,除(1)中实验外,还需要进行的实验是:
________ 。
【答案】(1)Al;Cu(或铝 铜);置换反应;除去铝表面致密的氧化铝薄膜,防止其影响反应(或除去铝表面的氧化膜或除去铝表面的氧化物等,合理均可)
(2)将铜丝浸入硝酸银溶液中(只要用不超出所给四种试剂,就能得出符合题意结论的即可给分)
18、化学电池在通信、交通和日常生活中有着广泛的应用,但是,废弃电池所带来的环境污染问题也日益突出.已知镍镉(Ni﹣Cd)电池中发生的化学反应为:
Cd+2NiO(OH)+2H2O2Ni(OH)2+Cd(OH)2
其中Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸.请回答:
(1)镍镉电池充电时,其能量的转化是由 能转化为 能;
(2)一节废镍镉电池会使1m2的耕地失去使用价值,要酸性土壤中,这种污染尤为严重.这是因为 。
(3)废弃的镍镉电池所产生的Cd2+污染,可导致人体患骨痛病及肝、肾、肺的病变,其中,Cd2+进入人体的途径如下图所示:
A、B、C代表Cd2+污染传递的载体,如果A代表土壤;则B代表 ;C代表 .
(4)你认为减少甚至消除废弃电池污染,应采取的措施是: 。
【答案】(1)电能;化学;
(2)Ni(OH)2和Cd(OH)2能溶于酸溶液,导致这些重金属离子污染的扩散;
(3)水体;生物体(或食物);
(4)集中回收,处理废旧电池;研制高效无污染的电池。
19、镁条与稀硫酸反应,产生大量 ,反应的化学方程式为 。
【答案】气泡 Mg+H2SO4===MgSO4+H2↑
20、“轻轨电车”(如图)是近年来新兴的城市高架交通工具,具有污染小的优点.当轻轨电车开动时,轻轨电车上裸露的“电刷”沿架空电线滑动.电刷材料中含有石墨.选择石墨作电刷材料是因为其具有下列性质:
① ;
② .
【答案】①导电 性; ②润滑性.
21、向一定量的硝酸银和硝酸铜的混合溶液中加入锌粉,所得溶液的质量与加入锌粉质量关系如图,请回答下列问题。
(1)a点时溶液中有哪些溶质?________ 。
(2)b~d段发生反应的化学方程式。_______ _ 。
(3)充分反应后发现得到固体质量增加的原因是什么
________ 。
【答案】(1)硝酸银,硝酸铜和硝酸锌(填化学式亦可)
(2)Zn+Cu(NO3)2=Zn(NO3)2+Cu
(3)锌与硝酸银反应使固体质量增加,与硝酸铜反应时使固体质量减少,所以固体质量可能增加(合理即可)。
22、为充分利用资源,全国各地都在试行垃圾分类回收,有以下生活垃圾:
①纸盒;②铝质易拉罐;③雪碧塑料饮料瓶;④铜导线;⑤镀锌自来水管
可以作为同一类回收的是 (填编号),它们属于 (填“金属”、“非金属”)
【答案】②④⑤;金属。
23、铁片与稀硫酸反应,产生少量 ,溶液由无色变成 色,反应的化学方程式为 。
【答案】气泡 浅绿 Fe+H2SO4===FeSO4+H2↑
三、实验题。
24、某课外学习小组的同学为进一步探究活泼金属与酸反应的情况,做了以下两组对比实验(如图所示)。请根据实验Ⅰ、Ⅱ回答下列问题。
(1)实验Ⅰ反映了 的剧烈程度不同;实验Ⅱ则表明了不同种金属与同种酸反应的剧烈程度不同,原因是 ;写出实验Ⅱ中锌片与稀盐酸反应的化学方程式: 。
(2)按照实验Ⅰ和Ⅱ的设计思路,请你再设计一组对比实验,简述实验方案:
。
【答案】(1)同种金属与不同种酸反应
锌比铁活泼 Zn+2HClZnCl2+H2↑
(2)取相同表面积的铝片加入不同浓度的同种酸中
四、计算题。
25、欲测定Cu﹣Zn合金及Cu﹣Ag合金中铜的质量分数,实验室只提供一瓶未标明质量分数的稀硫酸和必要的仪器。
(1)你认为用以上药品和仪器能测出铜的质量分数的是________ 合金。
(2)取该合金的粉末32.5g与足量该硫酸充分反应,经测定产生了0.4g气体。请你计算该合金中铜的质量分数。
【答案】(1)Cu﹣Zn
(2)解:设合金中Zn的质量为x。
Zn+H2SO4= ZnSO4+ H2↑
65 2
x 0.4g
列比例式得:65:X=2:0.4克 解得X= 13 g
合金中铜的质量= 32.5g – 13g = 19.5g
合金中铜的质量分数为:19.5克/32.5克×100%=60%
答:该合金中铜的质量分数是60%.
人教第8单元 金属和金属材料
一、选择题。
1、下列实验操作或设计正确的是( )
A.量取液体 B.蒸发溶剂
C.证明质量守恒定律 D.稀释浓硫酸
2、下列反应属于置换反应的是( )
A.甲烷燃烧:CH4+2O2CO2+2H2O
B.一氧化碳还原氧化铜:CO+CuOCu+CO2
C.木炭还原氧化铜:C+2CuO2Cu+CO2↑
D.CO2的检验:Ca( OH )2+CO2CaCO3↓+H2O
3、某兴趣小组进行实验探究,向盛有硝酸亚铁和硝酸银混合液的烧杯中加入一定量的锌粉,反应停止后过滤,向滤渣中加入稀盐酸,有气泡产生下列说法正确的是( )
A. 滤液中一定含有Zn2+和Fe2+,一定没有Ag+
B. 滤液中一定含有Zn2+,一定没有Fe2+和Ag+
C. 滤渣中一定含有银,可能含有锌和铁
D. 滤渣中一定含有银和铁,可能含有锌
4、下列四种矿石中主要成分属于单质的是( )
A.铝土矿 B.金矿 C.白钨矿 D.辉铜矿
5、如图是某化学兴趣小组设计的观察铁制品锈蚀的实验装置。下列相关叙述中正确的是( )
①一段时间后,铁丝会由下向上出现锈蚀现象
②一段时间后,水面处铁丝锈蚀严重
③一段时间后,塑料瓶会膨胀,因为铁生锈放热
④一段时间后,塑料瓶会变瘪,因为铁生锈与空气有关
A.①② B.②④ C.②③ D.③④
6、下列关于金属的说法正确的是( )
A.铜质插头利用了铜的导电性
B.硬铝的硬度比铝小
C.在金属表面喷涂油漆是防止其锈蚀的唯一方法
D.Ag能将硝酸铜溶液中的铜置换出来
7、现有X、Y、Z三种金属,已知:①X+YCl2===XCl2+Y,②把Y、Z两种金属分别放入稀硫酸中,只有 Y 和稀硫酸反应。这三种金属的活动性由强到弱的顺序是( )
A. X>Z>Y B. Z>Y>X C. Y>Z>X D. X>Y>Z
8、下列物质的用途和性质对应错误的是( )
A.氧气可用于炼钢:氧气具有可燃性
B.浓硫酸做干燥剂:浓硫酸具有吸水性
C.二氧化碳可用于灭火:二氧化碳不支持燃烧
D.氢氧化铝可用于治疗胃酸过多症:氢氧化铝可与胃酸发生中和反应
9、某同学为探究镁、锌、铜、银的活动性顺序,设计如图实验流程,依据流程设计,下面对物质①、②的选择合理的是( )
A. ①稀硫酸②硫酸铜溶液 B. ①稀盐酸②硫酸锌溶液
C. ①稀盐酸②硫酸亚铁溶液 D. ①稀硫酸②氯化镁溶液
10、某化学兴趣小组利用如图装置探究铁生锈的条件,一段时间后,只有一个集气瓶中的铁丝生锈,下列说法不正确的是( )
A.甲瓶中的铁丝生锈
B.通过对比甲瓶和乙瓶中的现象,可以说明铁生锈的一个条件是与水接触
C.通过对比甲瓶和丙瓶中的现象,可以说明防止铁生锈的一个方法是隔绝氧气
D.实验后向甲、乙、丙瓶中分别注入一定量稀盐酸,观察到的现象相同
11、把锌片放入CuSO4溶液中,锌片表面覆盖一层红色物质,一会儿又有气泡冒出,同学们对此现象进行猜想和分析,其中没有科学依据的是( )
A. 甲认为红色物质是铜 B. 乙认为锌的活动性比铜强
C. 丙推测气体是二氧化碳并检验 D. 丁猜想CuSO4溶液呈酸性并检验
12、下列实验基本操作中,正确的是( )
A.A B.B C.C D.D
13、下列4个图形能正确反映对应变化关系的是( )
A.
向一定量稀硫酸中加入NaOH溶液
B.
向一定量CuSO4溶液中加入Zn粉
C.
加热KClO3与MnO2固体混合物
D.
向一定量NaOH和Ca(OH)2的混合溶液中加入Na2CO3溶液
14、下列有关金属材料的说法错误的是( )
A.在潮湿的空气中铁易生锈
B.金属的回收利用是保护金属资源的有效途径之一
C.铝和金都有很好的抗腐蚀性,是因为二者的化学性质都很稳定
D.高炉炼铁的原理是在高温条件下,用一氧化碳把铁从铁矿石里还原出来
15、为了验证铁、铜两种金属的活动性差异,如图所示取两支试管分别进行有关实验,若要观察到现象的显著差异,所用液体合理的是( )
A. 蒸馏水 B. 稀盐酸 C. 酒精水溶液 D. 硫酸钠溶液
二、填空题。
16、铝土矿的主要成分是氧化铝(Al2O3),在氧化铝中铝元素与氧元素的质量之比是 ,170t含氧化铝80%的铝土矿,理论上可炼出金属铝 吨。
17、用铝丝、洁净的铜丝、稀盐酸、AgNO3溶液,验证Al、Cu Ag的活动性顺序。
(1)把打磨过的铝丝和洁净的铜丝分别浸入稀盐酸中,观察到铝丝表面有气泡产生,铜丝表面无明显现象,由此判断出Al和Cu的活动性强弱顺序为________>(H)>________;发生反应的基本反应类型是________ ;铝丝使用前需用砂纸打磨的原因是________ ;
(2)为了达到实验目的,除(1)中实验外,还需要进行的实验是:
________ 。
18、化学电池在通信、交通和日常生活中有着广泛的应用,但是,废弃电池所带来的环境污染问题也日益突出.已知镍镉(Ni﹣Cd)电池中发生的化学反应为:
Cd+2NiO(OH)+2H2O2Ni(OH)2+Cd(OH)2
其中Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸.请回答:
(1)镍镉电池充电时,其能量的转化是由 能转化为 能;
(2)一节废镍镉电池会使1m2的耕地失去使用价值,要酸性土壤中,这种污染尤为严重.这是因为 。
(3)废弃的镍镉电池所产生的Cd2+污染,可导致人体患骨痛病及肝、肾、肺的病变,其中,Cd2+进入人体的途径如下图所示:
A、B、C代表Cd2+污染传递的载体,如果A代表土壤;则B代表 ;C代表 .
(4)你认为减少甚至消除废弃电池污染,应采取的措施是: 。
19、镁条与稀硫酸反应,产生大量 ,反应的化学方程式为 。
20、“轻轨电车”(如图)是近年来新兴的城市高架交通工具,具有污染小的优点.当轻轨电车开动时,轻轨电车上裸露的“电刷”沿架空电线滑动.电刷材料中含有石墨.选择石墨作电刷材料是因为其具有下列性质:
① ;
② .
21、向一定量的硝酸银和硝酸铜的混合溶液中加入锌粉,所得溶液的质量与加入锌粉质量关系如图,请回答下列问题。
(1)a点时溶液中有哪些溶质?________ 。
(2)b~d段发生反应的化学方程式。_______ _ 。
(3)充分反应后发现得到固体质量增加的原因是什么
________ 。
22、为充分利用资源,全国各地都在试行垃圾分类回收,有以下生活垃圾:
①纸盒;②铝质易拉罐;③雪碧塑料饮料瓶;④铜导线;⑤镀锌自来水管
可以作为同一类回收的是 (填编号),它们属于 (填“金属”、“非金属”)
23、铁片与稀硫酸反应,产生少量 ,溶液由无色变成 色,反应的化学方程式为 。
三、实验题。
24、某课外学习小组的同学为进一步探究活泼金属与酸反应的情况,做了以下两组对比实验(如图所示)。请根据实验Ⅰ、Ⅱ回答下列问题。
(1)实验Ⅰ反映了 的剧烈程度不同;实验Ⅱ则表明了不同种金属与同种酸反应的剧烈程度不同,原因是 ;写出实验Ⅱ中锌片与稀盐酸反应的化学方程式: 。
(2)按照实验Ⅰ和Ⅱ的设计思路,请你再设计一组对比实验,简述实验方案:
。
四、计算题。
25、欲测定Cu﹣Zn合金及Cu﹣Ag合金中铜的质量分数,实验室只提供一瓶未标明质量分数的稀硫酸和必要的仪器。
(1)你认为用以上药品和仪器能测出铜的质量分数的是________ 合金。
(2)取该合金的粉末32.5g与足量该硫酸充分反应,经测定产生了0.4g气体。请你计算该合金中铜的质量分数。
2022—2023学年人教九年级下册第8单元 金属和金属材料 同步训练题含答案
人教第8单元 金属和金属材料
一、选择题。
1、下列实验操作或设计正确的是( )
A.量取液体 B.蒸发溶剂
C.证明质量守恒定律 D.稀释浓硫酸
【答案】B
2、下列反应属于置换反应的是( )
A.甲烷燃烧:CH4+2O2CO2+2H2O
B.一氧化碳还原氧化铜:CO+CuOCu+CO2
C.木炭还原氧化铜:C+2CuO2Cu+CO2↑
D.CO2的检验:Ca( OH )2+CO2CaCO3↓+H2O
【答案】C
3、某兴趣小组进行实验探究,向盛有硝酸亚铁和硝酸银混合液的烧杯中加入一定量的锌粉,反应停止后过滤,向滤渣中加入稀盐酸,有气泡产生下列说法正确的是( )
A. 滤液中一定含有Zn2+和Fe2+,一定没有Ag+
B. 滤液中一定含有Zn2+,一定没有Fe2+和Ag+
C. 滤渣中一定含有银,可能含有锌和铁
D. 滤渣中一定含有银和铁,可能含有锌
【答案】D
4、下列四种矿石中主要成分属于单质的是( )
A.铝土矿 B.金矿 C.白钨矿 D.辉铜矿
【答案】B
5、如图是某化学兴趣小组设计的观察铁制品锈蚀的实验装置。下列相关叙述中正确的是( )
①一段时间后,铁丝会由下向上出现锈蚀现象
②一段时间后,水面处铁丝锈蚀严重
③一段时间后,塑料瓶会膨胀,因为铁生锈放热
④一段时间后,塑料瓶会变瘪,因为铁生锈与空气有关
A.①② B.②④ C.②③ D.③④
【答案】B
6、下列关于金属的说法正确的是( )
A.铜质插头利用了铜的导电性
B.硬铝的硬度比铝小
C.在金属表面喷涂油漆是防止其锈蚀的唯一方法
D.Ag能将硝酸铜溶液中的铜置换出来
【答案】A
7、现有X、Y、Z三种金属,已知:①X+YCl2===XCl2+Y,②把Y、Z两种金属分别放入稀硫酸中,只有 Y 和稀硫酸反应。这三种金属的活动性由强到弱的顺序是( )
A. X>Z>Y B. Z>Y>X C. Y>Z>X D. X>Y>Z
【答案】D
8、下列物质的用途和性质对应错误的是( )
A.氧气可用于炼钢:氧气具有可燃性
B.浓硫酸做干燥剂:浓硫酸具有吸水性
C.二氧化碳可用于灭火:二氧化碳不支持燃烧
D.氢氧化铝可用于治疗胃酸过多症:氢氧化铝可与胃酸发生中和反应
【答案】A
9、某同学为探究镁、锌、铜、银的活动性顺序,设计如图实验流程,依据流程设计,下面对物质①、②的选择合理的是( )
A. ①稀硫酸②硫酸铜溶液 B. ①稀盐酸②硫酸锌溶液
C. ①稀盐酸②硫酸亚铁溶液 D. ①稀硫酸②氯化镁溶液
【答案】A
10、某化学兴趣小组利用如图装置探究铁生锈的条件,一段时间后,只有一个集气瓶中的铁丝生锈,下列说法不正确的是( )
A.甲瓶中的铁丝生锈
B.通过对比甲瓶和乙瓶中的现象,可以说明铁生锈的一个条件是与水接触
C.通过对比甲瓶和丙瓶中的现象,可以说明防止铁生锈的一个方法是隔绝氧气
D.实验后向甲、乙、丙瓶中分别注入一定量稀盐酸,观察到的现象相同
【答案】D
11、把锌片放入CuSO4溶液中,锌片表面覆盖一层红色物质,一会儿又有气泡冒出,同学们对此现象进行猜想和分析,其中没有科学依据的是( )
A. 甲认为红色物质是铜 B. 乙认为锌的活动性比铜强
C. 丙推测气体是二氧化碳并检验 D. 丁猜想CuSO4溶液呈酸性并检验
【答案】C
12、下列实验基本操作中,正确的是( )
A.A B.B C.C D.D
【答案】D
13、下列4个图形能正确反映对应变化关系的是( )
A.
向一定量稀硫酸中加入NaOH溶液
B.
向一定量CuSO4溶液中加入Zn粉
C.
加热KClO3与MnO2固体混合物
D.
向一定量NaOH和Ca(OH)2的混合溶液中加入Na2CO3溶液
【答案】C
14、下列有关金属材料的说法错误的是( )
A.在潮湿的空气中铁易生锈
B.金属的回收利用是保护金属资源的有效途径之一
C.铝和金都有很好的抗腐蚀性,是因为二者的化学性质都很稳定
D.高炉炼铁的原理是在高温条件下,用一氧化碳把铁从铁矿石里还原出来
【答案】C
15、为了验证铁、铜两种金属的活动性差异,如图所示取两支试管分别进行有关实验,若要观察到现象的显著差异,所用液体合理的是( )
A. 蒸馏水 B. 稀盐酸 C. 酒精水溶液 D. 硫酸钠溶液
【答案】B
二、填空题。
16、铝土矿的主要成分是氧化铝(Al2O3),在氧化铝中铝元素与氧元素的质量之比是 ,170t含氧化铝80%的铝土矿,理论上可炼出金属铝 吨。
【答案】9:8; 72
17、用铝丝、洁净的铜丝、稀盐酸、AgNO3溶液,验证Al、Cu Ag的活动性顺序。
(1)把打磨过的铝丝和洁净的铜丝分别浸入稀盐酸中,观察到铝丝表面有气泡产生,铜丝表面无明显现象,由此判断出Al和Cu的活动性强弱顺序为________>(H)>________;发生反应的基本反应类型是________ ;铝丝使用前需用砂纸打磨的原因是________ ;
(2)为了达到实验目的,除(1)中实验外,还需要进行的实验是:
________ 。
【答案】(1)Al;Cu(或铝 铜);置换反应;除去铝表面致密的氧化铝薄膜,防止其影响反应(或除去铝表面的氧化膜或除去铝表面的氧化物等,合理均可)
(2)将铜丝浸入硝酸银溶液中(只要用不超出所给四种试剂,就能得出符合题意结论的即可给分)
18、化学电池在通信、交通和日常生活中有着广泛的应用,但是,废弃电池所带来的环境污染问题也日益突出.已知镍镉(Ni﹣Cd)电池中发生的化学反应为:
Cd+2NiO(OH)+2H2O2Ni(OH)2+Cd(OH)2
其中Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸.请回答:
(1)镍镉电池充电时,其能量的转化是由 能转化为 能;
(2)一节废镍镉电池会使1m2的耕地失去使用价值,要酸性土壤中,这种污染尤为严重.这是因为 。
(3)废弃的镍镉电池所产生的Cd2+污染,可导致人体患骨痛病及肝、肾、肺的病变,其中,Cd2+进入人体的途径如下图所示:
A、B、C代表Cd2+污染传递的载体,如果A代表土壤;则B代表 ;C代表 .
(4)你认为减少甚至消除废弃电池污染,应采取的措施是: 。
【答案】(1)电能;化学;
(2)Ni(OH)2和Cd(OH)2能溶于酸溶液,导致这些重金属离子污染的扩散;
(3)水体;生物体(或食物);
(4)集中回收,处理废旧电池;研制高效无污染的电池。
19、镁条与稀硫酸反应,产生大量 ,反应的化学方程式为 。
【答案】气泡 Mg+H2SO4===MgSO4+H2↑
20、“轻轨电车”(如图)是近年来新兴的城市高架交通工具,具有污染小的优点.当轻轨电车开动时,轻轨电车上裸露的“电刷”沿架空电线滑动.电刷材料中含有石墨.选择石墨作电刷材料是因为其具有下列性质:
① ;
② .
【答案】①导电 性; ②润滑性.
21、向一定量的硝酸银和硝酸铜的混合溶液中加入锌粉,所得溶液的质量与加入锌粉质量关系如图,请回答下列问题。
(1)a点时溶液中有哪些溶质?________ 。
(2)b~d段发生反应的化学方程式。_______ _ 。
(3)充分反应后发现得到固体质量增加的原因是什么
________ 。
【答案】(1)硝酸银,硝酸铜和硝酸锌(填化学式亦可)
(2)Zn+Cu(NO3)2=Zn(NO3)2+Cu
(3)锌与硝酸银反应使固体质量增加,与硝酸铜反应时使固体质量减少,所以固体质量可能增加(合理即可)。
22、为充分利用资源,全国各地都在试行垃圾分类回收,有以下生活垃圾:
①纸盒;②铝质易拉罐;③雪碧塑料饮料瓶;④铜导线;⑤镀锌自来水管
可以作为同一类回收的是 (填编号),它们属于 (填“金属”、“非金属”)
【答案】②④⑤;金属。
23、铁片与稀硫酸反应,产生少量 ,溶液由无色变成 色,反应的化学方程式为 。
【答案】气泡 浅绿 Fe+H2SO4===FeSO4+H2↑
三、实验题。
24、某课外学习小组的同学为进一步探究活泼金属与酸反应的情况,做了以下两组对比实验(如图所示)。请根据实验Ⅰ、Ⅱ回答下列问题。
(1)实验Ⅰ反映了 的剧烈程度不同;实验Ⅱ则表明了不同种金属与同种酸反应的剧烈程度不同,原因是 ;写出实验Ⅱ中锌片与稀盐酸反应的化学方程式: 。
(2)按照实验Ⅰ和Ⅱ的设计思路,请你再设计一组对比实验,简述实验方案:
。
【答案】(1)同种金属与不同种酸反应
锌比铁活泼 Zn+2HClZnCl2+H2↑
(2)取相同表面积的铝片加入不同浓度的同种酸中
四、计算题。
25、欲测定Cu﹣Zn合金及Cu﹣Ag合金中铜的质量分数,实验室只提供一瓶未标明质量分数的稀硫酸和必要的仪器。
(1)你认为用以上药品和仪器能测出铜的质量分数的是________ 合金。
(2)取该合金的粉末32.5g与足量该硫酸充分反应,经测定产生了0.4g气体。请你计算该合金中铜的质量分数。
【答案】(1)Cu﹣Zn
(2)解:设合金中Zn的质量为x。
Zn+H2SO4= ZnSO4+ H2↑
65 2
x 0.4g
列比例式得:65:X=2:0.4克 解得X= 13 g
合金中铜的质量= 32.5g – 13g = 19.5g
合金中铜的质量分数为:19.5克/32.5克×100%=60%
答:该合金中铜的质量分数是60%.
同课章节目录
