2022—2023学年人教九年级下册第9单元 溶液 同步训练题(含答案)
文档属性
| 名称 | 2022—2023学年人教九年级下册第9单元 溶液 同步训练题(含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-10 21:33:42 | ||
图片预览




文档简介
2022—2023学年人教九年级下册第9单元 溶液 同步训练题附答案
人教第9单元 溶液
一、选择题。
1、下列对溶液中溶质和溶剂的判断正确的是( )
选项 溶液 溶质 溶剂
A 硫酸铜溶液 铜 硫酸
B 碳酸钠溶液 碳酸钠 水
C 生理盐水 氯化氢 水
D 医用酒精 水 酒精
A.A B.B C.C D.D
2、下列溶液中,溶剂不是水的是 ( )
A.蔗糖溶液 B.生理盐水 C.碘的酒精溶液 D.稀盐酸
3、小明在玻璃片上滴几滴水,往右图所示的烧杯中加入一种物质,轻轻搅拌后,烧杯和玻璃片粘在一起。加入的物质可能是( )
A.食盐 B.硝酸铵 C.氢氧化钠 D.硝酸钾
4、溶液、悬浊液、乳浊液都是( )
A.均一、稳定的 B.久置不分层
C.无色、透明的 D.混合物
5、将热的硝酸钾不饱和溶液降温至如图所示的状态。对该过程的描述错误的是 ( )
A.降温过程中硝酸钾溶液逐渐达到饱和状态
B.饱和的硝酸钾溶液继续降温,会析出硝酸钾晶体
C.硝酸钾以晶体的形式析出的过程叫作结晶
D.析出晶体后的硝酸钾溶液是不饱和溶液
6、下表列出了KNO3和NaCl在不同温度时的溶解度。下列说法不正确的是 ( )
温度/℃ 0 10 20 30 40 50 60
溶解度/g NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3
KNO3 13.3 20.9 31.6 45.8 63.9 85.5 110
A.20 ℃时,NaCl的溶解度是36.0 g
B.KNO3的溶解度大于NaCl的溶解度
C.KNO3和NaCl的溶解度都随温度的升高而增大
D.60 ℃时,110 g KNO3溶解在100 g水中,恰好形成饱和溶液
7、如图所示,试管中盛有某种液体,将气球中的某种固体小心的倒入试管中,能观察到气球先变大后复原的一组物质是( )
A.氯化钠和水 B.铁粉和稀硫酸
C.氢氧化钠和水 D.二氧化锰和过氧化氢溶液
8、要使20 g 20%的食盐水的质量分数变为原来的一半,可采取的方法是( )
A.加入20 g 水 B.加入10 g 水
C.加入10 g 食盐 D.蒸发掉10 g 水
9、下列图像变化与对应的实验操作一致的是( )
A. 将足量的氯化钠饱和溶液恒温蒸发少量水
B. 等质量的铁片和镁条分别与足量的稀盐酸反应
C. 向装有稀硫酸的小烧杯中,逐滴滴加氢氧化钡溶液至过量
D. 向氢氧化钠与硝酸钡的混合溶液中,逐滴滴加稀硫酸至过量
10、已知硫酸的浓度越大,密度越大,现将等体积质量分数为90%和10%的硫酸溶液混合,所得溶液的溶质质量分数为( )
A.>50% B.=50% C.<50% D.不能确定
11、锌与足量的盐酸反应后的液体和少量二氧化碳通入澄清石灰水后的液体分别是( )
A.乳浊液、溶液 B.溶液、乳浊液
C.悬浊液、乳浊液 D.溶液、悬浊液
12、下列有关溶液的说法正确的是( )
A.溶液都是无色透明液体
B.饱和溶液就是不能继续溶解溶质的溶液
C.同一溶质的饱和溶液一定比不饱和溶液浓
D.汗水浸湿的衣服晾干后出现白色斑迹,是因为水分蒸发后盐分结晶析出
*13、室温下,将盛有接近饱和的硝酸钾溶液的小烧杯放在盛水的大烧杯中,如图所示,欲使硝酸钾溶液变为饱和溶液,可向大烧杯中加入的固体物质是( )
A.氧化钙 B.氯化钠 C.硝酸铵 D.氢氧化钠
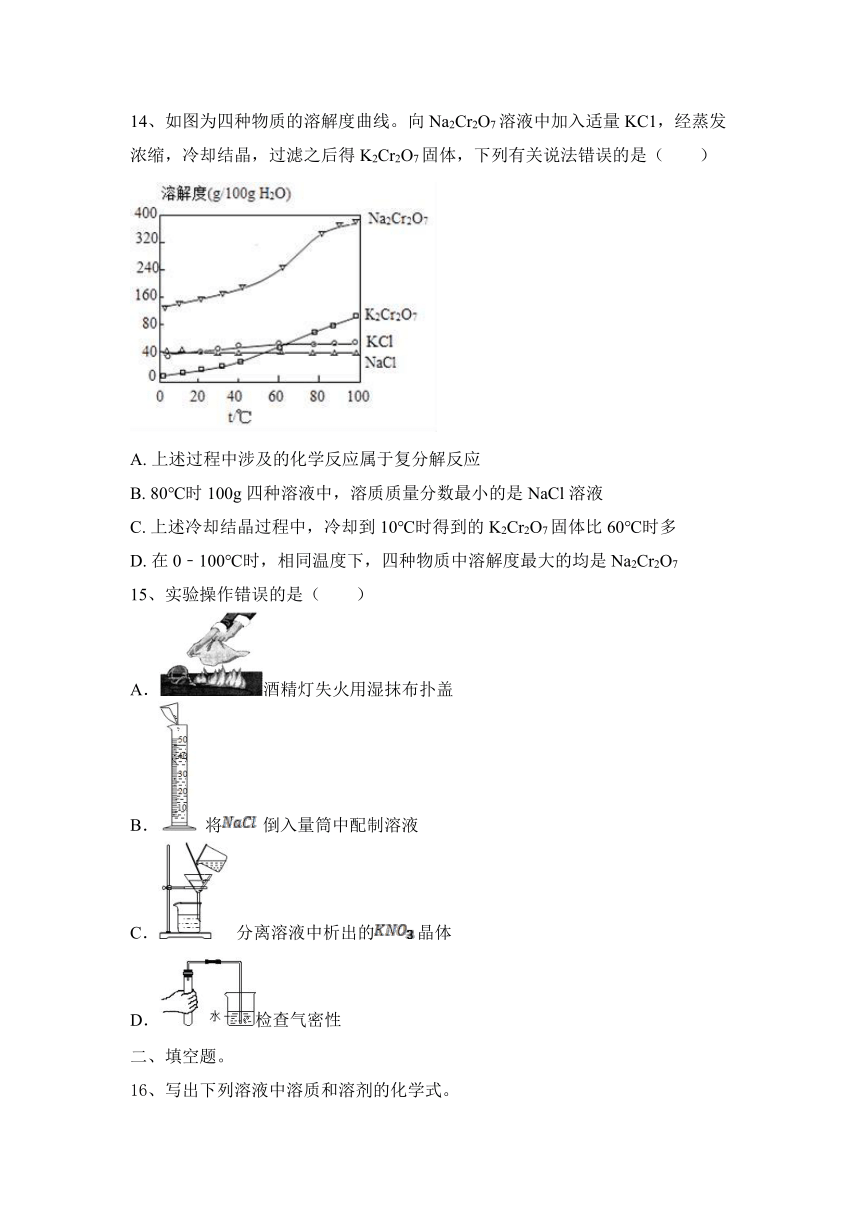
14、如图为四种物质的溶解度曲线。向Na2Cr2O7溶液中加入适量KC1,经蒸发浓缩,冷却结晶,过滤之后得K2Cr2O7固体,下列有关说法错误的是( )
A. 上述过程中涉及的化学反应属于复分解反应
B. 80℃时100g四种溶液中,溶质质量分数最小的是NaCl溶液
C. 上述冷却结晶过程中,冷却到10℃时得到的K2Cr2O7固体比60℃时多
D. 在0﹣100℃时,相同温度下,四种物质中溶解度最大的均是Na2Cr2O7
15、实验操作错误的是( )
A.酒精灯失火用湿抹布扑盖
B. 将倒入量筒中配制溶液
C. 分离溶液中析出的晶体
D.检查气密性
二、填空题。
16、写出下列溶液中溶质和溶剂的化学式。
医用酒精 高锰酸钾溶液 浓盐酸 铁和硫酸恰好完全反应后的溶液
溶质 ____ ______ ____ ________________
溶剂 ____ ______ ____ ________________
17、20 ℃时,氯化钠的溶解度为36.0 g,对这句话的理解错误的是 (填序号)。
①100 g水中最多能溶解氯化钠固体36.0 g
②20 ℃时,36.0 g氯化钠固体全部溶解至少需要100 g水
③20 ℃时,100 g氯化钠饱和溶液中含有氯化钠36.0 g
④20 ℃时,从足量的氯化钠饱和溶液中蒸发100 g水,能析出36.0 g氯化钠晶体
⑤20 ℃时,氯化钠的饱和溶液中水与氯化钠的质量比为100∶36
⑥20 ℃时,将氯化钠与水以36∶100的质量比混合,可得该温度下氯化钠的饱和溶液
18、甲和乙两种固体物质的溶解度曲线如图所示,回答下列问题:
(1)在________℃时,甲和乙两种物质的溶解度相等。
(2)将t1℃时等质量的甲和乙两种物质的饱和溶液分别降温到0℃,析出固体质量较少的是________(填“甲”或“乙”)。
(3)t2℃时,将甲、乙两物质各60g分别放入100g水中,充分搅拌,所得溶液的溶质质量分数w(甲)________(填字母)w(乙)(填“>“、“<“或“=“)。
19、探究学习小组在制作“叶脉书签”时,需要将树叶放在质量分数为10%的氢氧化钠溶液中煮沸。如图所示为该小组配制10%氢氧化钠溶液的操作过程:
(1)图中仪器a的名称是____,写出该仪器的另一种用途_
(2)操作B中,必须将氢氧化钠固体放在__ _里,并置于托盘天平__ __(填“左”或“右”)盘进行称量;
(3)操作D中,用量筒量取所需体积的蒸馏水时还用到__ __(填写仪器名称)。某同学在读取量筒读数时的视线如图2所示,若其他操作正确,则会造成所配制氢氧化钠溶液的质量分数__ __(填“偏大”“偏小”或“无影响”);
(4)如果不慎将氢氧化钠溶液沾到皮肤上,要先用大量水冲洗,再涂上__ ;
(5)制作“叶脉书签”结束后,刘强同学想继续测定废液的酸碱度,下列用品不需要的是__ __(填写字母标号)。
a.玻璃棒 b.pH试纸 c.酚酞试液 d.白瓷板(或玻璃片)
20、用如图所示装置探究物质溶解时的吸热或放热现象。请回答下列问题。
(1)溶解过程中溶液温度无明显变化的物质是_________,溶液温度升高的物质是_________,溶液温度降低的物质是_________。
(2)该实验说明物质溶解时会伴随着________的变化,有些物质在溶解时会________热量,有些物质在溶解时会________热量。
21、已知硝酸钾的溶解度随着温度的升高而增大,有下列方法:
A.升高温度 B.降低温度 C.加水 D.加硝酸钾
(1)能使接近饱和的硝酸钾溶液变成饱和溶液的方法是 (填字母,下同)。
(2)能使饱和的硝酸钾溶液变成不饱和溶液的方法是 。
(3)能增大硝酸钾溶解度的方法是 。
(4)能减小硝酸钾溶解度的方法是 。
22、电动车一般使用铅酸蓄电池.某铅酸蓄电池使用的酸溶液是质量分数为20%的稀硫酸.若用50g质量分数为98%的浓硫酸配制该稀硫酸时,需要加水________ mL(水的密度为1g/mL)。
23、以下是实验室配制一定溶质质量分数的氯化钠溶液的流程示意图。
请根据示意图回答:
(1)托盘天平左盘中固体氯化钠的质量为_______g,量筒中水的体积为________mL。
(2)玻璃棒的作用是______________ 。
(3)若量取水时仰视读数(其他操作均正确),则所配氯化钠溶液的溶质质量分数_____15%(填“大于”、“等于”或“小于”)。
三、实验题。
24、为了探究影响物质溶解性的因素,某同学设计并进行了如下实验。
实验
现象 固体溶解,形成紫色溶液 固体几乎不溶解 固体溶解,形成棕色溶液
(1)对比实验①②的现象,可得出的结论是:______________________________。
(2)设计实验②③的目的是:___________________________________。
(3)通过以上实验,归纳影响物质溶解性的因素有:______________________。
25、水是一种重要的自然资源,是生活、生产必不可少的物质.请回答下列问题:
(1)水是一种良好的溶剂,下列物质在水中能配成溶液的是 (填字母).
A.氢氧化镁 B.氯化镁 C.植物油 D.金属镁
(2)水能与多种物质发生化学反应,试举一例,写出化学方程式:
。
(3)如图所示,实验I是制备蒸馏水的装置,实验Ⅱ是电解水的装置。
①实验I中水从A经B转移到C的过程中,水分子的组成没有发生变化,发生变化的是水分子的 。
②实验II中反应的化学方程式为 。
B试管中产生的气体可以使带火星的木条复燃,当B中气体的分子数目为n时,A中气体分子数为 。
(4)“节约用水,从我做起.”请你任举一例生活中节约用水的措施: 。
四、计算题。
26、铝合金的生产与销售是潍坊市一条重要的产业链,为测定某种铝铜合金中铝的质量分数,探究小组进行了如下实验:
实验编号 铝铜合金的质量(g) 加入稀硫酸的质量(g) 生成H2的质量(g)
实验1 30 392 2
实验2 30 588 3
实验3 30 600 3
(1)所用稀硫酸溶质的质量分数是多少?
(2)该铝铜合金中铝的质量分数是多少?
2022—2023学年人教九年级下册第9单元 溶液 同步训练题附答案
人教第9单元 溶液
一、选择题。
1、下列对溶液中溶质和溶剂的判断正确的是( )
选项 溶液 溶质 溶剂
A 硫酸铜溶液 铜 硫酸
B 碳酸钠溶液 碳酸钠 水
C 生理盐水 氯化氢 水
D 医用酒精 水 酒精
A.A B.B C.C D.D
【答案】B
2、下列溶液中,溶剂不是水的是 ( )
A.蔗糖溶液 B.生理盐水 C.碘的酒精溶液 D.稀盐酸
【答案】C
3、小明在玻璃片上滴几滴水,往右图所示的烧杯中加入一种物质,轻轻搅拌后,烧杯和玻璃片粘在一起。加入的物质可能是( )
A.食盐 B.硝酸铵 C.氢氧化钠 D.硝酸钾
【答案】B
4、溶液、悬浊液、乳浊液都是( )
A.均一、稳定的 B.久置不分层
C.无色、透明的 D.混合物
【答案】D。
5、将热的硝酸钾不饱和溶液降温至如图所示的状态。对该过程的描述错误的是 ( )
A.降温过程中硝酸钾溶液逐渐达到饱和状态
B.饱和的硝酸钾溶液继续降温,会析出硝酸钾晶体
C.硝酸钾以晶体的形式析出的过程叫作结晶
D.析出晶体后的硝酸钾溶液是不饱和溶液
【答案】D
6、下表列出了KNO3和NaCl在不同温度时的溶解度。下列说法不正确的是 ( )
温度/℃ 0 10 20 30 40 50 60
溶解度/g NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3
KNO3 13.3 20.9 31.6 45.8 63.9 85.5 110
A.20 ℃时,NaCl的溶解度是36.0 g
B.KNO3的溶解度大于NaCl的溶解度
C.KNO3和NaCl的溶解度都随温度的升高而增大
D.60 ℃时,110 g KNO3溶解在100 g水中,恰好形成饱和溶液
【答案】B
7、如图所示,试管中盛有某种液体,将气球中的某种固体小心的倒入试管中,能观察到气球先变大后复原的一组物质是( )
A.氯化钠和水 B.铁粉和稀硫酸
C.氢氧化钠和水 D.二氧化锰和过氧化氢溶液
【答案】C
8、要使20 g 20%的食盐水的质量分数变为原来的一半,可采取的方法是( )
A.加入20 g 水 B.加入10 g 水
C.加入10 g 食盐 D.蒸发掉10 g 水
【答案】A
9、下列图像变化与对应的实验操作一致的是( )
A. 将足量的氯化钠饱和溶液恒温蒸发少量水
B. 等质量的铁片和镁条分别与足量的稀盐酸反应
C. 向装有稀硫酸的小烧杯中,逐滴滴加氢氧化钡溶液至过量
D. 向氢氧化钠与硝酸钡的混合溶液中,逐滴滴加稀硫酸至过量
【答案】D
10、已知硫酸的浓度越大,密度越大,现将等体积质量分数为90%和10%的硫酸溶液混合,所得溶液的溶质质量分数为( )
A.>50% B.=50% C.<50% D.不能确定
【答案】A
11、锌与足量的盐酸反应后的液体和少量二氧化碳通入澄清石灰水后的液体分别是( )
A.乳浊液、溶液 B.溶液、乳浊液
C.悬浊液、乳浊液 D.溶液、悬浊液
【答案】D。
12、下列有关溶液的说法正确的是( )
A.溶液都是无色透明液体
B.饱和溶液就是不能继续溶解溶质的溶液
C.同一溶质的饱和溶液一定比不饱和溶液浓
D.汗水浸湿的衣服晾干后出现白色斑迹,是因为水分蒸发后盐分结晶析出
【答案】D
*13、室温下,将盛有接近饱和的硝酸钾溶液的小烧杯放在盛水的大烧杯中,如图所示,欲使硝酸钾溶液变为饱和溶液,可向大烧杯中加入的固体物质是( )
A.氧化钙 B.氯化钠 C.硝酸铵 D.氢氧化钠
【答案】C
14、如图为四种物质的溶解度曲线。向Na2Cr2O7溶液中加入适量KC1,经蒸发浓缩,冷却结晶,过滤之后得K2Cr2O7固体,下列有关说法错误的是( )
A. 上述过程中涉及的化学反应属于复分解反应
B. 80℃时100g四种溶液中,溶质质量分数最小的是NaCl溶液
C. 上述冷却结晶过程中,冷却到10℃时得到的K2Cr2O7固体比60℃时多
D. 在0﹣100℃时,相同温度下,四种物质中溶解度最大的均是Na2Cr2O7
【答案】B
15、实验操作错误的是( )
A.酒精灯失火用湿抹布扑盖
B. 将倒入量筒中配制溶液
C. 分离溶液中析出的晶体
D.检查气密性
【答案】B
二、填空题。
16、写出下列溶液中溶质和溶剂的化学式。
医用酒精 高锰酸钾溶液 浓盐酸 铁和硫酸恰好完全反应后的溶液
溶质 ____ ______ ____ ________________
溶剂 ____ ______ ____ ________________
【答案】
溶质 C2H5OH KMnO4 HCl FeSO4
溶剂 H2O H2O H2O H2O
17、20 ℃时,氯化钠的溶解度为36.0 g,对这句话的理解错误的是 (填序号)。
①100 g水中最多能溶解氯化钠固体36.0 g
②20 ℃时,36.0 g氯化钠固体全部溶解至少需要100 g水
③20 ℃时,100 g氯化钠饱和溶液中含有氯化钠36.0 g
④20 ℃时,从足量的氯化钠饱和溶液中蒸发100 g水,能析出36.0 g氯化钠晶体
⑤20 ℃时,氯化钠的饱和溶液中水与氯化钠的质量比为100∶36
⑥20 ℃时,将氯化钠与水以36∶100的质量比混合,可得该温度下氯化钠的饱和溶液
【答案】①③
18、甲和乙两种固体物质的溶解度曲线如图所示,回答下列问题:
(1)在________℃时,甲和乙两种物质的溶解度相等。
(2)将t1℃时等质量的甲和乙两种物质的饱和溶液分别降温到0℃,析出固体质量较少的是________(填“甲”或“乙”)。
(3)t2℃时,将甲、乙两物质各60g分别放入100g水中,充分搅拌,所得溶液的溶质质量分数w(甲)________(填字母)w(乙)(填“>“、“<“或“=“)。
【答案】 (1)20 (2)乙 (3)>
19、探究学习小组在制作“叶脉书签”时,需要将树叶放在质量分数为10%的氢氧化钠溶液中煮沸。如图所示为该小组配制10%氢氧化钠溶液的操作过程:
(1)图中仪器a的名称是____,写出该仪器的另一种用途_
(2)操作B中,必须将氢氧化钠固体放在__ _里,并置于托盘天平__ __(填“左”或“右”)盘进行称量;
(3)操作D中,用量筒量取所需体积的蒸馏水时还用到__ __(填写仪器名称)。某同学在读取量筒读数时的视线如图2所示,若其他操作正确,则会造成所配制氢氧化钠溶液的质量分数__ __(填“偏大”“偏小”或“无影响”);
(4)如果不慎将氢氧化钠溶液沾到皮肤上,要先用大量水冲洗,再涂上__ ;
(5)制作“叶脉书签”结束后,刘强同学想继续测定废液的酸碱度,下列用品不需要的是__ __(填写字母标号)。
a.玻璃棒 b.pH试纸 c.酚酞试液 d.白瓷板(或玻璃片)
【答案】 (1) 烧杯 用作反应容器
(2) 玻璃器皿(或小烧杯、表面皿) 左
(3) 胶头滴管 偏小 (4) 硼酸溶液 (5) C
20、用如图所示装置探究物质溶解时的吸热或放热现象。请回答下列问题。
(1)溶解过程中溶液温度无明显变化的物质是_________,溶液温度升高的物质是_________,溶液温度降低的物质是_________。
(2)该实验说明物质溶解时会伴随着________的变化,有些物质在溶解时会________热量,有些物质在溶解时会________热量。
【答案】(1)NaCl NaOH NH4NO3 (2)热量 吸收 放出
21、已知硝酸钾的溶解度随着温度的升高而增大,有下列方法:
A.升高温度 B.降低温度 C.加水 D.加硝酸钾
(1)能使接近饱和的硝酸钾溶液变成饱和溶液的方法是 (填字母,下同)。
(2)能使饱和的硝酸钾溶液变成不饱和溶液的方法是 。
(3)能增大硝酸钾溶解度的方法是 。
(4)能减小硝酸钾溶解度的方法是 。
【答案】(1)BD (2)AC (3)A (4)B
22、电动车一般使用铅酸蓄电池.某铅酸蓄电池使用的酸溶液是质量分数为20%的稀硫酸.若用50g质量分数为98%的浓硫酸配制该稀硫酸时,需要加水________ mL(水的密度为1g/mL)。
【答案】195
23、以下是实验室配制一定溶质质量分数的氯化钠溶液的流程示意图。
请根据示意图回答:
(1)托盘天平左盘中固体氯化钠的质量为_______g,量筒中水的体积为________mL。
(2)玻璃棒的作用是______________ 。
(3)若量取水时仰视读数(其他操作均正确),则所配氯化钠溶液的溶质质量分数_____15%(填“大于”、“等于”或“小于”)。
【答案】(1)6 34 (2)加速氯化钠的溶解 (3)小于
三、实验题。
24、为了探究影响物质溶解性的因素,某同学设计并进行了如下实验。
实验
现象 固体溶解,形成紫色溶液 固体几乎不溶解 固体溶解,形成棕色溶液
(1)对比实验①②的现象,可得出的结论是:______________________________。
(2)设计实验②③的目的是:___________________________________。
(3)通过以上实验,归纳影响物质溶解性的因素有:______________________。
【答案】(1)同种溶质在不同溶剂中的溶解性不同
(2)探究不同溶质在同一种溶剂中的溶解性
(3)溶质种类(或性质)和溶剂种类(或性质)
25、水是一种重要的自然资源,是生活、生产必不可少的物质.请回答下列问题:
(1)水是一种良好的溶剂,下列物质在水中能配成溶液的是 (填字母).
A.氢氧化镁 B.氯化镁 C.植物油 D.金属镁
(2)水能与多种物质发生化学反应,试举一例,写出化学方程式:
。
(3)如图所示,实验I是制备蒸馏水的装置,实验Ⅱ是电解水的装置。
①实验I中水从A经B转移到C的过程中,水分子的组成没有发生变化,发生变化的是水分子的 。
②实验II中反应的化学方程式为 。
B试管中产生的气体可以使带火星的木条复燃,当B中气体的分子数目为n时,A中气体分子数为 。
(4)“节约用水,从我做起.”请你任举一例生活中节约用水的措施: 。
【答案】(1)B;
(2)CaO+H2O=Ca(OH)2或CO2+H2O=H2CO3(合理得分)
(3)①分子间间隔;②2H2O2H2↑+O2↑;2n;
(4)用淘米水浇花;用洗衣服的水冲厕所;及时关闭水龙头等。
四、计算题。
26、铝合金的生产与销售是潍坊市一条重要的产业链,为测定某种铝铜合金中铝的质量分数,探究小组进行了如下实验:
实验编号 铝铜合金的质量(g) 加入稀硫酸的质量(g) 生成H2的质量(g)
实验1 30 392 2
实验2 30 588 3
实验3 30 600 3
(1)所用稀硫酸溶质的质量分数是多少?
(2)该铝铜合金中铝的质量分数是多少?
【答案及解析】(1)设铝的质量为x,588g稀硫酸中硫酸的质量为y。
2Al+3H2SO4=Al2(SO4)3+3H2↑
54 294 6
x y 3g
54:x=294:y=6:3g
解得x=27g,y=147g
所用稀硫酸溶质的质量分数为:147g/588g×100%=25%
(2)该铝铜合金中铝的质量分数为:27g/30g×100%=90%
人教第9单元 溶液
一、选择题。
1、下列对溶液中溶质和溶剂的判断正确的是( )
选项 溶液 溶质 溶剂
A 硫酸铜溶液 铜 硫酸
B 碳酸钠溶液 碳酸钠 水
C 生理盐水 氯化氢 水
D 医用酒精 水 酒精
A.A B.B C.C D.D
2、下列溶液中,溶剂不是水的是 ( )
A.蔗糖溶液 B.生理盐水 C.碘的酒精溶液 D.稀盐酸
3、小明在玻璃片上滴几滴水,往右图所示的烧杯中加入一种物质,轻轻搅拌后,烧杯和玻璃片粘在一起。加入的物质可能是( )
A.食盐 B.硝酸铵 C.氢氧化钠 D.硝酸钾
4、溶液、悬浊液、乳浊液都是( )
A.均一、稳定的 B.久置不分层
C.无色、透明的 D.混合物
5、将热的硝酸钾不饱和溶液降温至如图所示的状态。对该过程的描述错误的是 ( )
A.降温过程中硝酸钾溶液逐渐达到饱和状态
B.饱和的硝酸钾溶液继续降温,会析出硝酸钾晶体
C.硝酸钾以晶体的形式析出的过程叫作结晶
D.析出晶体后的硝酸钾溶液是不饱和溶液
6、下表列出了KNO3和NaCl在不同温度时的溶解度。下列说法不正确的是 ( )
温度/℃ 0 10 20 30 40 50 60
溶解度/g NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3
KNO3 13.3 20.9 31.6 45.8 63.9 85.5 110
A.20 ℃时,NaCl的溶解度是36.0 g
B.KNO3的溶解度大于NaCl的溶解度
C.KNO3和NaCl的溶解度都随温度的升高而增大
D.60 ℃时,110 g KNO3溶解在100 g水中,恰好形成饱和溶液
7、如图所示,试管中盛有某种液体,将气球中的某种固体小心的倒入试管中,能观察到气球先变大后复原的一组物质是( )
A.氯化钠和水 B.铁粉和稀硫酸
C.氢氧化钠和水 D.二氧化锰和过氧化氢溶液
8、要使20 g 20%的食盐水的质量分数变为原来的一半,可采取的方法是( )
A.加入20 g 水 B.加入10 g 水
C.加入10 g 食盐 D.蒸发掉10 g 水
9、下列图像变化与对应的实验操作一致的是( )
A. 将足量的氯化钠饱和溶液恒温蒸发少量水
B. 等质量的铁片和镁条分别与足量的稀盐酸反应
C. 向装有稀硫酸的小烧杯中,逐滴滴加氢氧化钡溶液至过量
D. 向氢氧化钠与硝酸钡的混合溶液中,逐滴滴加稀硫酸至过量
10、已知硫酸的浓度越大,密度越大,现将等体积质量分数为90%和10%的硫酸溶液混合,所得溶液的溶质质量分数为( )
A.>50% B.=50% C.<50% D.不能确定
11、锌与足量的盐酸反应后的液体和少量二氧化碳通入澄清石灰水后的液体分别是( )
A.乳浊液、溶液 B.溶液、乳浊液
C.悬浊液、乳浊液 D.溶液、悬浊液
12、下列有关溶液的说法正确的是( )
A.溶液都是无色透明液体
B.饱和溶液就是不能继续溶解溶质的溶液
C.同一溶质的饱和溶液一定比不饱和溶液浓
D.汗水浸湿的衣服晾干后出现白色斑迹,是因为水分蒸发后盐分结晶析出
*13、室温下,将盛有接近饱和的硝酸钾溶液的小烧杯放在盛水的大烧杯中,如图所示,欲使硝酸钾溶液变为饱和溶液,可向大烧杯中加入的固体物质是( )
A.氧化钙 B.氯化钠 C.硝酸铵 D.氢氧化钠
14、如图为四种物质的溶解度曲线。向Na2Cr2O7溶液中加入适量KC1,经蒸发浓缩,冷却结晶,过滤之后得K2Cr2O7固体,下列有关说法错误的是( )
A. 上述过程中涉及的化学反应属于复分解反应
B. 80℃时100g四种溶液中,溶质质量分数最小的是NaCl溶液
C. 上述冷却结晶过程中,冷却到10℃时得到的K2Cr2O7固体比60℃时多
D. 在0﹣100℃时,相同温度下,四种物质中溶解度最大的均是Na2Cr2O7
15、实验操作错误的是( )
A.酒精灯失火用湿抹布扑盖
B. 将倒入量筒中配制溶液
C. 分离溶液中析出的晶体
D.检查气密性
二、填空题。
16、写出下列溶液中溶质和溶剂的化学式。
医用酒精 高锰酸钾溶液 浓盐酸 铁和硫酸恰好完全反应后的溶液
溶质 ____ ______ ____ ________________
溶剂 ____ ______ ____ ________________
17、20 ℃时,氯化钠的溶解度为36.0 g,对这句话的理解错误的是 (填序号)。
①100 g水中最多能溶解氯化钠固体36.0 g
②20 ℃时,36.0 g氯化钠固体全部溶解至少需要100 g水
③20 ℃时,100 g氯化钠饱和溶液中含有氯化钠36.0 g
④20 ℃时,从足量的氯化钠饱和溶液中蒸发100 g水,能析出36.0 g氯化钠晶体
⑤20 ℃时,氯化钠的饱和溶液中水与氯化钠的质量比为100∶36
⑥20 ℃时,将氯化钠与水以36∶100的质量比混合,可得该温度下氯化钠的饱和溶液
18、甲和乙两种固体物质的溶解度曲线如图所示,回答下列问题:
(1)在________℃时,甲和乙两种物质的溶解度相等。
(2)将t1℃时等质量的甲和乙两种物质的饱和溶液分别降温到0℃,析出固体质量较少的是________(填“甲”或“乙”)。
(3)t2℃时,将甲、乙两物质各60g分别放入100g水中,充分搅拌,所得溶液的溶质质量分数w(甲)________(填字母)w(乙)(填“>“、“<“或“=“)。
19、探究学习小组在制作“叶脉书签”时,需要将树叶放在质量分数为10%的氢氧化钠溶液中煮沸。如图所示为该小组配制10%氢氧化钠溶液的操作过程:
(1)图中仪器a的名称是____,写出该仪器的另一种用途_
(2)操作B中,必须将氢氧化钠固体放在__ _里,并置于托盘天平__ __(填“左”或“右”)盘进行称量;
(3)操作D中,用量筒量取所需体积的蒸馏水时还用到__ __(填写仪器名称)。某同学在读取量筒读数时的视线如图2所示,若其他操作正确,则会造成所配制氢氧化钠溶液的质量分数__ __(填“偏大”“偏小”或“无影响”);
(4)如果不慎将氢氧化钠溶液沾到皮肤上,要先用大量水冲洗,再涂上__ ;
(5)制作“叶脉书签”结束后,刘强同学想继续测定废液的酸碱度,下列用品不需要的是__ __(填写字母标号)。
a.玻璃棒 b.pH试纸 c.酚酞试液 d.白瓷板(或玻璃片)
20、用如图所示装置探究物质溶解时的吸热或放热现象。请回答下列问题。
(1)溶解过程中溶液温度无明显变化的物质是_________,溶液温度升高的物质是_________,溶液温度降低的物质是_________。
(2)该实验说明物质溶解时会伴随着________的变化,有些物质在溶解时会________热量,有些物质在溶解时会________热量。
21、已知硝酸钾的溶解度随着温度的升高而增大,有下列方法:
A.升高温度 B.降低温度 C.加水 D.加硝酸钾
(1)能使接近饱和的硝酸钾溶液变成饱和溶液的方法是 (填字母,下同)。
(2)能使饱和的硝酸钾溶液变成不饱和溶液的方法是 。
(3)能增大硝酸钾溶解度的方法是 。
(4)能减小硝酸钾溶解度的方法是 。
22、电动车一般使用铅酸蓄电池.某铅酸蓄电池使用的酸溶液是质量分数为20%的稀硫酸.若用50g质量分数为98%的浓硫酸配制该稀硫酸时,需要加水________ mL(水的密度为1g/mL)。
23、以下是实验室配制一定溶质质量分数的氯化钠溶液的流程示意图。
请根据示意图回答:
(1)托盘天平左盘中固体氯化钠的质量为_______g,量筒中水的体积为________mL。
(2)玻璃棒的作用是______________ 。
(3)若量取水时仰视读数(其他操作均正确),则所配氯化钠溶液的溶质质量分数_____15%(填“大于”、“等于”或“小于”)。
三、实验题。
24、为了探究影响物质溶解性的因素,某同学设计并进行了如下实验。
实验
现象 固体溶解,形成紫色溶液 固体几乎不溶解 固体溶解,形成棕色溶液
(1)对比实验①②的现象,可得出的结论是:______________________________。
(2)设计实验②③的目的是:___________________________________。
(3)通过以上实验,归纳影响物质溶解性的因素有:______________________。
25、水是一种重要的自然资源,是生活、生产必不可少的物质.请回答下列问题:
(1)水是一种良好的溶剂,下列物质在水中能配成溶液的是 (填字母).
A.氢氧化镁 B.氯化镁 C.植物油 D.金属镁
(2)水能与多种物质发生化学反应,试举一例,写出化学方程式:
。
(3)如图所示,实验I是制备蒸馏水的装置,实验Ⅱ是电解水的装置。
①实验I中水从A经B转移到C的过程中,水分子的组成没有发生变化,发生变化的是水分子的 。
②实验II中反应的化学方程式为 。
B试管中产生的气体可以使带火星的木条复燃,当B中气体的分子数目为n时,A中气体分子数为 。
(4)“节约用水,从我做起.”请你任举一例生活中节约用水的措施: 。
四、计算题。
26、铝合金的生产与销售是潍坊市一条重要的产业链,为测定某种铝铜合金中铝的质量分数,探究小组进行了如下实验:
实验编号 铝铜合金的质量(g) 加入稀硫酸的质量(g) 生成H2的质量(g)
实验1 30 392 2
实验2 30 588 3
实验3 30 600 3
(1)所用稀硫酸溶质的质量分数是多少?
(2)该铝铜合金中铝的质量分数是多少?
2022—2023学年人教九年级下册第9单元 溶液 同步训练题附答案
人教第9单元 溶液
一、选择题。
1、下列对溶液中溶质和溶剂的判断正确的是( )
选项 溶液 溶质 溶剂
A 硫酸铜溶液 铜 硫酸
B 碳酸钠溶液 碳酸钠 水
C 生理盐水 氯化氢 水
D 医用酒精 水 酒精
A.A B.B C.C D.D
【答案】B
2、下列溶液中,溶剂不是水的是 ( )
A.蔗糖溶液 B.生理盐水 C.碘的酒精溶液 D.稀盐酸
【答案】C
3、小明在玻璃片上滴几滴水,往右图所示的烧杯中加入一种物质,轻轻搅拌后,烧杯和玻璃片粘在一起。加入的物质可能是( )
A.食盐 B.硝酸铵 C.氢氧化钠 D.硝酸钾
【答案】B
4、溶液、悬浊液、乳浊液都是( )
A.均一、稳定的 B.久置不分层
C.无色、透明的 D.混合物
【答案】D。
5、将热的硝酸钾不饱和溶液降温至如图所示的状态。对该过程的描述错误的是 ( )
A.降温过程中硝酸钾溶液逐渐达到饱和状态
B.饱和的硝酸钾溶液继续降温,会析出硝酸钾晶体
C.硝酸钾以晶体的形式析出的过程叫作结晶
D.析出晶体后的硝酸钾溶液是不饱和溶液
【答案】D
6、下表列出了KNO3和NaCl在不同温度时的溶解度。下列说法不正确的是 ( )
温度/℃ 0 10 20 30 40 50 60
溶解度/g NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3
KNO3 13.3 20.9 31.6 45.8 63.9 85.5 110
A.20 ℃时,NaCl的溶解度是36.0 g
B.KNO3的溶解度大于NaCl的溶解度
C.KNO3和NaCl的溶解度都随温度的升高而增大
D.60 ℃时,110 g KNO3溶解在100 g水中,恰好形成饱和溶液
【答案】B
7、如图所示,试管中盛有某种液体,将气球中的某种固体小心的倒入试管中,能观察到气球先变大后复原的一组物质是( )
A.氯化钠和水 B.铁粉和稀硫酸
C.氢氧化钠和水 D.二氧化锰和过氧化氢溶液
【答案】C
8、要使20 g 20%的食盐水的质量分数变为原来的一半,可采取的方法是( )
A.加入20 g 水 B.加入10 g 水
C.加入10 g 食盐 D.蒸发掉10 g 水
【答案】A
9、下列图像变化与对应的实验操作一致的是( )
A. 将足量的氯化钠饱和溶液恒温蒸发少量水
B. 等质量的铁片和镁条分别与足量的稀盐酸反应
C. 向装有稀硫酸的小烧杯中,逐滴滴加氢氧化钡溶液至过量
D. 向氢氧化钠与硝酸钡的混合溶液中,逐滴滴加稀硫酸至过量
【答案】D
10、已知硫酸的浓度越大,密度越大,现将等体积质量分数为90%和10%的硫酸溶液混合,所得溶液的溶质质量分数为( )
A.>50% B.=50% C.<50% D.不能确定
【答案】A
11、锌与足量的盐酸反应后的液体和少量二氧化碳通入澄清石灰水后的液体分别是( )
A.乳浊液、溶液 B.溶液、乳浊液
C.悬浊液、乳浊液 D.溶液、悬浊液
【答案】D。
12、下列有关溶液的说法正确的是( )
A.溶液都是无色透明液体
B.饱和溶液就是不能继续溶解溶质的溶液
C.同一溶质的饱和溶液一定比不饱和溶液浓
D.汗水浸湿的衣服晾干后出现白色斑迹,是因为水分蒸发后盐分结晶析出
【答案】D
*13、室温下,将盛有接近饱和的硝酸钾溶液的小烧杯放在盛水的大烧杯中,如图所示,欲使硝酸钾溶液变为饱和溶液,可向大烧杯中加入的固体物质是( )
A.氧化钙 B.氯化钠 C.硝酸铵 D.氢氧化钠
【答案】C
14、如图为四种物质的溶解度曲线。向Na2Cr2O7溶液中加入适量KC1,经蒸发浓缩,冷却结晶,过滤之后得K2Cr2O7固体,下列有关说法错误的是( )
A. 上述过程中涉及的化学反应属于复分解反应
B. 80℃时100g四种溶液中,溶质质量分数最小的是NaCl溶液
C. 上述冷却结晶过程中,冷却到10℃时得到的K2Cr2O7固体比60℃时多
D. 在0﹣100℃时,相同温度下,四种物质中溶解度最大的均是Na2Cr2O7
【答案】B
15、实验操作错误的是( )
A.酒精灯失火用湿抹布扑盖
B. 将倒入量筒中配制溶液
C. 分离溶液中析出的晶体
D.检查气密性
【答案】B
二、填空题。
16、写出下列溶液中溶质和溶剂的化学式。
医用酒精 高锰酸钾溶液 浓盐酸 铁和硫酸恰好完全反应后的溶液
溶质 ____ ______ ____ ________________
溶剂 ____ ______ ____ ________________
【答案】
溶质 C2H5OH KMnO4 HCl FeSO4
溶剂 H2O H2O H2O H2O
17、20 ℃时,氯化钠的溶解度为36.0 g,对这句话的理解错误的是 (填序号)。
①100 g水中最多能溶解氯化钠固体36.0 g
②20 ℃时,36.0 g氯化钠固体全部溶解至少需要100 g水
③20 ℃时,100 g氯化钠饱和溶液中含有氯化钠36.0 g
④20 ℃时,从足量的氯化钠饱和溶液中蒸发100 g水,能析出36.0 g氯化钠晶体
⑤20 ℃时,氯化钠的饱和溶液中水与氯化钠的质量比为100∶36
⑥20 ℃时,将氯化钠与水以36∶100的质量比混合,可得该温度下氯化钠的饱和溶液
【答案】①③
18、甲和乙两种固体物质的溶解度曲线如图所示,回答下列问题:
(1)在________℃时,甲和乙两种物质的溶解度相等。
(2)将t1℃时等质量的甲和乙两种物质的饱和溶液分别降温到0℃,析出固体质量较少的是________(填“甲”或“乙”)。
(3)t2℃时,将甲、乙两物质各60g分别放入100g水中,充分搅拌,所得溶液的溶质质量分数w(甲)________(填字母)w(乙)(填“>“、“<“或“=“)。
【答案】 (1)20 (2)乙 (3)>
19、探究学习小组在制作“叶脉书签”时,需要将树叶放在质量分数为10%的氢氧化钠溶液中煮沸。如图所示为该小组配制10%氢氧化钠溶液的操作过程:
(1)图中仪器a的名称是____,写出该仪器的另一种用途_
(2)操作B中,必须将氢氧化钠固体放在__ _里,并置于托盘天平__ __(填“左”或“右”)盘进行称量;
(3)操作D中,用量筒量取所需体积的蒸馏水时还用到__ __(填写仪器名称)。某同学在读取量筒读数时的视线如图2所示,若其他操作正确,则会造成所配制氢氧化钠溶液的质量分数__ __(填“偏大”“偏小”或“无影响”);
(4)如果不慎将氢氧化钠溶液沾到皮肤上,要先用大量水冲洗,再涂上__ ;
(5)制作“叶脉书签”结束后,刘强同学想继续测定废液的酸碱度,下列用品不需要的是__ __(填写字母标号)。
a.玻璃棒 b.pH试纸 c.酚酞试液 d.白瓷板(或玻璃片)
【答案】 (1) 烧杯 用作反应容器
(2) 玻璃器皿(或小烧杯、表面皿) 左
(3) 胶头滴管 偏小 (4) 硼酸溶液 (5) C
20、用如图所示装置探究物质溶解时的吸热或放热现象。请回答下列问题。
(1)溶解过程中溶液温度无明显变化的物质是_________,溶液温度升高的物质是_________,溶液温度降低的物质是_________。
(2)该实验说明物质溶解时会伴随着________的变化,有些物质在溶解时会________热量,有些物质在溶解时会________热量。
【答案】(1)NaCl NaOH NH4NO3 (2)热量 吸收 放出
21、已知硝酸钾的溶解度随着温度的升高而增大,有下列方法:
A.升高温度 B.降低温度 C.加水 D.加硝酸钾
(1)能使接近饱和的硝酸钾溶液变成饱和溶液的方法是 (填字母,下同)。
(2)能使饱和的硝酸钾溶液变成不饱和溶液的方法是 。
(3)能增大硝酸钾溶解度的方法是 。
(4)能减小硝酸钾溶解度的方法是 。
【答案】(1)BD (2)AC (3)A (4)B
22、电动车一般使用铅酸蓄电池.某铅酸蓄电池使用的酸溶液是质量分数为20%的稀硫酸.若用50g质量分数为98%的浓硫酸配制该稀硫酸时,需要加水________ mL(水的密度为1g/mL)。
【答案】195
23、以下是实验室配制一定溶质质量分数的氯化钠溶液的流程示意图。
请根据示意图回答:
(1)托盘天平左盘中固体氯化钠的质量为_______g,量筒中水的体积为________mL。
(2)玻璃棒的作用是______________ 。
(3)若量取水时仰视读数(其他操作均正确),则所配氯化钠溶液的溶质质量分数_____15%(填“大于”、“等于”或“小于”)。
【答案】(1)6 34 (2)加速氯化钠的溶解 (3)小于
三、实验题。
24、为了探究影响物质溶解性的因素,某同学设计并进行了如下实验。
实验
现象 固体溶解,形成紫色溶液 固体几乎不溶解 固体溶解,形成棕色溶液
(1)对比实验①②的现象,可得出的结论是:______________________________。
(2)设计实验②③的目的是:___________________________________。
(3)通过以上实验,归纳影响物质溶解性的因素有:______________________。
【答案】(1)同种溶质在不同溶剂中的溶解性不同
(2)探究不同溶质在同一种溶剂中的溶解性
(3)溶质种类(或性质)和溶剂种类(或性质)
25、水是一种重要的自然资源,是生活、生产必不可少的物质.请回答下列问题:
(1)水是一种良好的溶剂,下列物质在水中能配成溶液的是 (填字母).
A.氢氧化镁 B.氯化镁 C.植物油 D.金属镁
(2)水能与多种物质发生化学反应,试举一例,写出化学方程式:
。
(3)如图所示,实验I是制备蒸馏水的装置,实验Ⅱ是电解水的装置。
①实验I中水从A经B转移到C的过程中,水分子的组成没有发生变化,发生变化的是水分子的 。
②实验II中反应的化学方程式为 。
B试管中产生的气体可以使带火星的木条复燃,当B中气体的分子数目为n时,A中气体分子数为 。
(4)“节约用水,从我做起.”请你任举一例生活中节约用水的措施: 。
【答案】(1)B;
(2)CaO+H2O=Ca(OH)2或CO2+H2O=H2CO3(合理得分)
(3)①分子间间隔;②2H2O2H2↑+O2↑;2n;
(4)用淘米水浇花;用洗衣服的水冲厕所;及时关闭水龙头等。
四、计算题。
26、铝合金的生产与销售是潍坊市一条重要的产业链,为测定某种铝铜合金中铝的质量分数,探究小组进行了如下实验:
实验编号 铝铜合金的质量(g) 加入稀硫酸的质量(g) 生成H2的质量(g)
实验1 30 392 2
实验2 30 588 3
实验3 30 600 3
(1)所用稀硫酸溶质的质量分数是多少?
(2)该铝铜合金中铝的质量分数是多少?
【答案及解析】(1)设铝的质量为x,588g稀硫酸中硫酸的质量为y。
2Al+3H2SO4=Al2(SO4)3+3H2↑
54 294 6
x y 3g
54:x=294:y=6:3g
解得x=27g,y=147g
所用稀硫酸溶质的质量分数为:147g/588g×100%=25%
(2)该铝铜合金中铝的质量分数为:27g/30g×100%=90%
同课章节目录
