化学人教版(2019)选择性必修1 3.1 电离平衡 (共27张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 3.1 电离平衡 (共27张ppt) |
|
|
| 格式 | zip | ||
| 文件大小 | 152.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-11 13:44:57 | ||
图片预览






文档简介
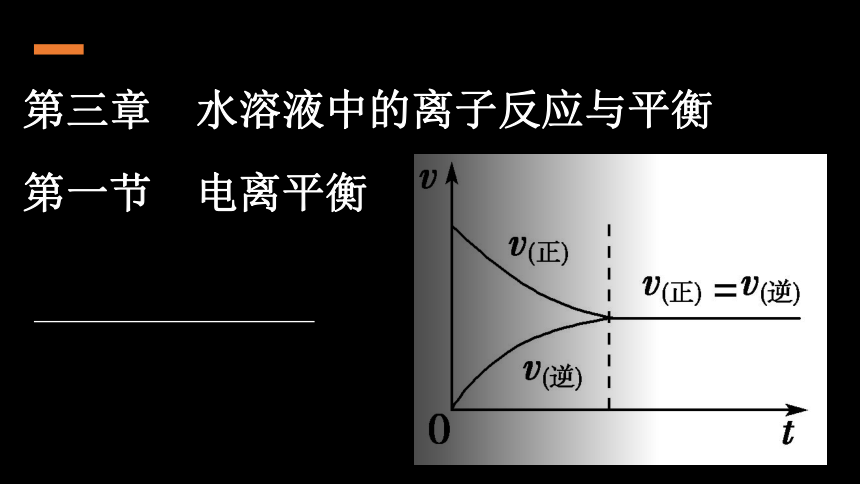
(共27张PPT)
第三章 水溶液中的离子反应与平衡
第一节 电离平衡
一、回顾化合物分类、溶液导电能力
1.电解质
下列哪个是电解质的概念
A.在水溶液或熔融状态下能导电的物质
B.在水溶液和熔融状态下能导电的物质
C.在水溶液或熔融状态下能导电的化合物
D.在水溶液和熔融状态下能导电的化合物
C
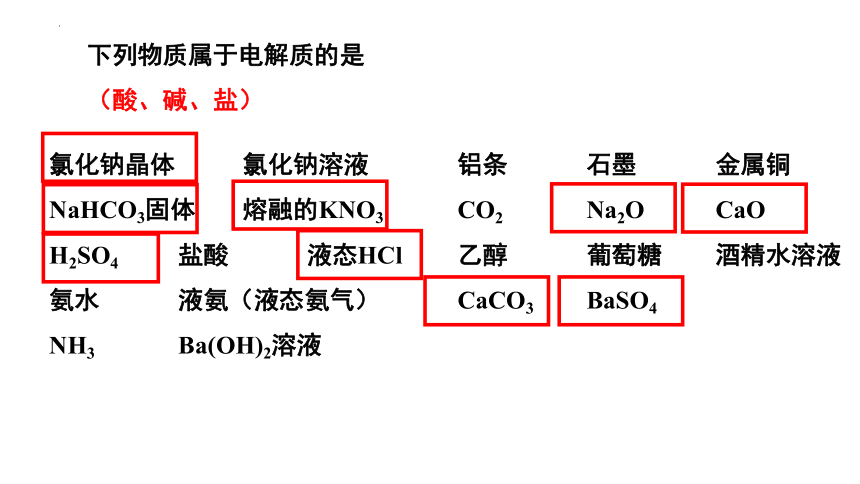
下列物质属于电解质的是
(酸、碱、盐)
氯化钠晶体 氯化钠溶液
NaHCO3固体 熔融的KNO3
H2SO4 盐酸 液态HCl
氨水 液氨(液态氨气)
NH3 Ba(OH)2溶液
铝条 石墨 金属铜
CO2 Na2O CaO
乙醇 葡萄糖 酒精水溶液
CaCO3 BaSO4
2.溶液导电能力
实验序号 温度 电解质溶液 电导率/
μS/cm
1 25 0.1 mol/L NaCl溶液 9500
2 25 0.2 mol/L NaCl溶液 14000
从表格数据可得出什么结论?
二、弱电解质
试剂 浓度/mol·L-1 pH 电导率
盐酸 0.1 1 22000
醋酸 0.1 2.7 501
由上表可知,同浓度的盐酸和醋酸,离子浓度:盐酸 醋酸(填“<”“>”“=”)。
能够全部电离的电解质——强电解质
部分电离的电解质——弱电解质
>
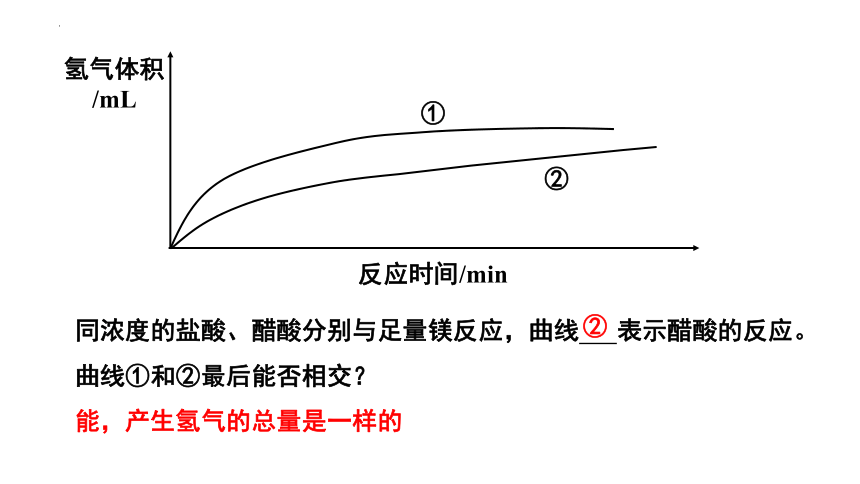
反应时间/min
氢气体积
/mL
同浓度的盐酸、醋酸分别与足量镁反应,曲线 表示醋酸的反应。
曲线①和②最后能否相交?
能,产生氢气的总量是一样的
①
②
②
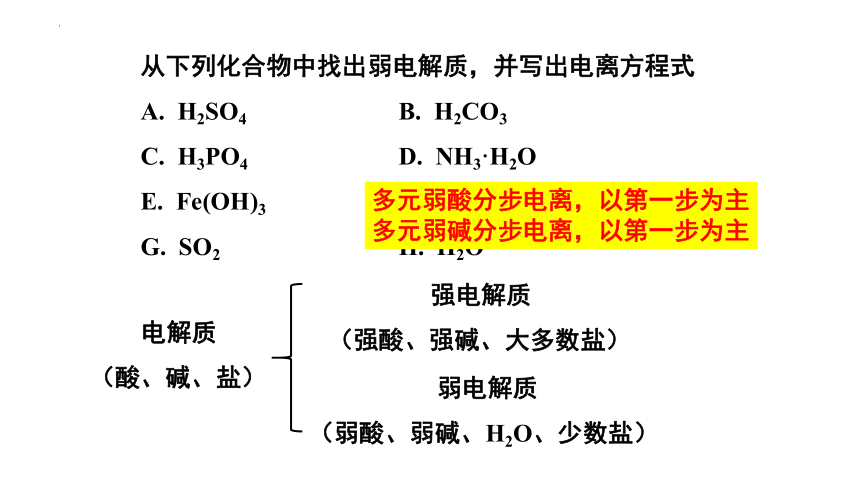
从下列化合物中找出弱电解质,并写出电离方程式
A. H2SO4 B. H2CO3
C. H3PO4 D. NH3·H2O
E. Fe(OH)3 F. BaSO4
G. SO2 H. H2O
电解质
(酸、碱、盐)
强电解质
(强酸、强碱、大多数盐)
弱电解质
(弱酸、弱碱、H2O、少数盐)
多元弱酸分步电离,以第一步为主
多元弱碱分步电离,以第一步为主
甲、乙两图中,能表示弱酸HA在水溶液中粒子状况的 。
甲
乙
乙
下列关于强弱电解质的叙述错误的是( )
A.强电解质在溶液中完全电离
B.在溶液中,导电能力强的电解质是强电解质,导电能力弱的是弱电解质
C.同一弱电解质的溶液,当温度、浓度不同时,其导电能力也不一定相同
D.纯净的强电解质在液态时,有的导电,有的不导电
B
(双选题)把0.05 mol NaOH固体分别加入到下列100 mL溶液中,溶液的导电能力变化不大的是( )
A.自来水
B.0.5 mol/L盐酸
C.0.5 mol/L醋酸
D.0.5 mol/L氯化铵
BD
变大
不变
变大
变大,但基本不变
三、电离平衡
上图表示pH相同的盐酸①、醋酸②分别与足量镁反应
(1)溶液中H+浓度:盐酸 醋酸(填“<”“>”“=”)
(2)溶液浓度:盐酸 醋酸(填“<”“>”“=”)
(3)曲线②pH变化慢,原因是?
=
<
pH
反应时间/min
①
②
反应时间/min
氢气体积
/mL
③
④
上图表示pH相同的盐酸、醋酸分别与足量镁反应
(1)曲线 表示盐酸。
(2)最终产生氢气的体积:盐酸 醋酸(填“<”“>”“=”)
④
<
CH3COOH CH3COO-+H+ △H 0
只改变下列一个条件,分析物理量变化
条件 平衡移动 c(CH3COOH) c(CH3COO-) c(H+) 电离程度
升高温度
正向
>
↓
↑
↑
↑
CH3COOH CH3COO-+H+
只改变下列一个条件,分析物理量变化
条件 平衡移动 n(HA) c(HA) n(A-) c(A-) n(H+) c(H+) 电离程度
加水 稀释
加入 冰醋酸
正向
↓
↓
↓
↑
正向
↑
↑
↑
↓
↓
↑
↑
↑
↑
↑
CH3COOH CH3COO-+H+ △H 0
只改变下列一个条件,分析物理量变化
条件 平衡移动 c(HA) c(A-) c(H+) 电离程度
加NaOH固体(忽略温度变化)
加入 醋酸钠固体
正向
>
↓
↑
↓
↑
逆向
↑
↑
↓
↓
请分析向NaHCO3溶液中滴加少量盐酸和氢氧化钠
条件 电离平衡移动 HCO3- CO32- c(H+) 电离程度
加少量盐酸
加少量NaOH
逆向
↑
↓
↑
↓
正向
↓
↑
↓
↑
血液中含有NaHCO3,能够维持pH稳定,具有缓冲作用
下列关于盐酸与醋酸两种稀溶液的说法正确的是( )
A.相同浓度的两溶液中c(H+)相同
B.100 mL 0.1 mol/L的两溶液能中和等物质的量的氢氧化钠
C.c(H+)=10-3 mol/L的两溶液稀释100倍,c(H+)都为10-5 mol/L
D.两溶液中分别加入少量对应的钠盐,c(H+)均明显减小
B
pH
水的体积
左图
①
②
水的体积
右图
pH
③
④
(1)相同浓度的盐酸和醋酸加水稀释,pH变化如 图,曲线 表示盐酸,稀释相同倍数 溶液的pH变化快, 溶液的pH始终较小。
右
④
盐酸
盐酸
(2)相同pH的盐酸和醋酸加水稀释,pH变化如 图,曲线 表示盐酸,稀释相同倍数 溶液的pH变化快, 溶液的pH始终较小。
左
①
盐酸
醋酸
四、电离平衡常数
写出下列弱电解质的电离平衡常数
CH3COOH、H2CO3
NH3·H2O、N2H4(二元弱碱)
Ka1、Ka2表示弱酸第一步、第二步电离
Kb1、Kb2表示弱碱第一步、第二步电离
阅读P125,观察Ka1、Ka2有什么共同特征,分析原因
练习1:已知0.1mol/L的醋酸pH=3,求电离常数
练习2:已知甲酸的电离平衡常数为,求0.1mol/L甲酸的pH
练习3:请推测甲酸和乙酸的酸性强弱,并提出验证方案
试剂 浓度/mol·L-1 pH 电导率
醋酸 0.1 2.7 501
甲酸 0.1 2.2 1825
电离常数越大(多元看第一步),酸性越强
练习4:已知平衡常数P125,比较酸性强弱
(双选题)已知0.1 mol/L的醋酸溶液中存在电离平衡:
CH3COOH CH3COO-+H+。要使溶液中c(H+)/ c(CH3COOH)值增大,可以采取的措施是( )
A.加少量醋酸钠溶液 B.升高温度
C.加少量冰醋酸 D.加水
课后题第3题
BD
下列事实中一定不能证明CH3COOH是弱电解质的是( )
②用CH3COOH溶液做导电实验,灯泡很暗
③等pH、等体积的盐酸、CH3COOH溶液和足量锌反应,CH3COOH放出的氢气较多
④0.1 mol·L-1 CH3COOH溶液的pH=2.1
⑤CH3COONa和H3PO4反应,生成CH3COOH
⑥0.1 mol·L-1的CH3COOH溶液稀释100倍,pH<3
A.② B.②⑤
C.③⑤ D.③④⑤⑥
A
第三章 水溶液中的离子反应与平衡
第一节 电离平衡
一、回顾化合物分类、溶液导电能力
1.电解质
下列哪个是电解质的概念
A.在水溶液或熔融状态下能导电的物质
B.在水溶液和熔融状态下能导电的物质
C.在水溶液或熔融状态下能导电的化合物
D.在水溶液和熔融状态下能导电的化合物
C
下列物质属于电解质的是
(酸、碱、盐)
氯化钠晶体 氯化钠溶液
NaHCO3固体 熔融的KNO3
H2SO4 盐酸 液态HCl
氨水 液氨(液态氨气)
NH3 Ba(OH)2溶液
铝条 石墨 金属铜
CO2 Na2O CaO
乙醇 葡萄糖 酒精水溶液
CaCO3 BaSO4
2.溶液导电能力
实验序号 温度 电解质溶液 电导率/
μS/cm
1 25 0.1 mol/L NaCl溶液 9500
2 25 0.2 mol/L NaCl溶液 14000
从表格数据可得出什么结论?
二、弱电解质
试剂 浓度/mol·L-1 pH 电导率
盐酸 0.1 1 22000
醋酸 0.1 2.7 501
由上表可知,同浓度的盐酸和醋酸,离子浓度:盐酸 醋酸(填“<”“>”“=”)。
能够全部电离的电解质——强电解质
部分电离的电解质——弱电解质
>
反应时间/min
氢气体积
/mL
同浓度的盐酸、醋酸分别与足量镁反应,曲线 表示醋酸的反应。
曲线①和②最后能否相交?
能,产生氢气的总量是一样的
①
②
②
从下列化合物中找出弱电解质,并写出电离方程式
A. H2SO4 B. H2CO3
C. H3PO4 D. NH3·H2O
E. Fe(OH)3 F. BaSO4
G. SO2 H. H2O
电解质
(酸、碱、盐)
强电解质
(强酸、强碱、大多数盐)
弱电解质
(弱酸、弱碱、H2O、少数盐)
多元弱酸分步电离,以第一步为主
多元弱碱分步电离,以第一步为主
甲、乙两图中,能表示弱酸HA在水溶液中粒子状况的 。
甲
乙
乙
下列关于强弱电解质的叙述错误的是( )
A.强电解质在溶液中完全电离
B.在溶液中,导电能力强的电解质是强电解质,导电能力弱的是弱电解质
C.同一弱电解质的溶液,当温度、浓度不同时,其导电能力也不一定相同
D.纯净的强电解质在液态时,有的导电,有的不导电
B
(双选题)把0.05 mol NaOH固体分别加入到下列100 mL溶液中,溶液的导电能力变化不大的是( )
A.自来水
B.0.5 mol/L盐酸
C.0.5 mol/L醋酸
D.0.5 mol/L氯化铵
BD
变大
不变
变大
变大,但基本不变
三、电离平衡
上图表示pH相同的盐酸①、醋酸②分别与足量镁反应
(1)溶液中H+浓度:盐酸 醋酸(填“<”“>”“=”)
(2)溶液浓度:盐酸 醋酸(填“<”“>”“=”)
(3)曲线②pH变化慢,原因是?
=
<
pH
反应时间/min
①
②
反应时间/min
氢气体积
/mL
③
④
上图表示pH相同的盐酸、醋酸分别与足量镁反应
(1)曲线 表示盐酸。
(2)最终产生氢气的体积:盐酸 醋酸(填“<”“>”“=”)
④
<
CH3COOH CH3COO-+H+ △H 0
只改变下列一个条件,分析物理量变化
条件 平衡移动 c(CH3COOH) c(CH3COO-) c(H+) 电离程度
升高温度
正向
>
↓
↑
↑
↑
CH3COOH CH3COO-+H+
只改变下列一个条件,分析物理量变化
条件 平衡移动 n(HA) c(HA) n(A-) c(A-) n(H+) c(H+) 电离程度
加水 稀释
加入 冰醋酸
正向
↓
↓
↓
↑
正向
↑
↑
↑
↓
↓
↑
↑
↑
↑
↑
CH3COOH CH3COO-+H+ △H 0
只改变下列一个条件,分析物理量变化
条件 平衡移动 c(HA) c(A-) c(H+) 电离程度
加NaOH固体(忽略温度变化)
加入 醋酸钠固体
正向
>
↓
↑
↓
↑
逆向
↑
↑
↓
↓
请分析向NaHCO3溶液中滴加少量盐酸和氢氧化钠
条件 电离平衡移动 HCO3- CO32- c(H+) 电离程度
加少量盐酸
加少量NaOH
逆向
↑
↓
↑
↓
正向
↓
↑
↓
↑
血液中含有NaHCO3,能够维持pH稳定,具有缓冲作用
下列关于盐酸与醋酸两种稀溶液的说法正确的是( )
A.相同浓度的两溶液中c(H+)相同
B.100 mL 0.1 mol/L的两溶液能中和等物质的量的氢氧化钠
C.c(H+)=10-3 mol/L的两溶液稀释100倍,c(H+)都为10-5 mol/L
D.两溶液中分别加入少量对应的钠盐,c(H+)均明显减小
B
pH
水的体积
左图
①
②
水的体积
右图
pH
③
④
(1)相同浓度的盐酸和醋酸加水稀释,pH变化如 图,曲线 表示盐酸,稀释相同倍数 溶液的pH变化快, 溶液的pH始终较小。
右
④
盐酸
盐酸
(2)相同pH的盐酸和醋酸加水稀释,pH变化如 图,曲线 表示盐酸,稀释相同倍数 溶液的pH变化快, 溶液的pH始终较小。
左
①
盐酸
醋酸
四、电离平衡常数
写出下列弱电解质的电离平衡常数
CH3COOH、H2CO3
NH3·H2O、N2H4(二元弱碱)
Ka1、Ka2表示弱酸第一步、第二步电离
Kb1、Kb2表示弱碱第一步、第二步电离
阅读P125,观察Ka1、Ka2有什么共同特征,分析原因
练习1:已知0.1mol/L的醋酸pH=3,求电离常数
练习2:已知甲酸的电离平衡常数为,求0.1mol/L甲酸的pH
练习3:请推测甲酸和乙酸的酸性强弱,并提出验证方案
试剂 浓度/mol·L-1 pH 电导率
醋酸 0.1 2.7 501
甲酸 0.1 2.2 1825
电离常数越大(多元看第一步),酸性越强
练习4:已知平衡常数P125,比较酸性强弱
(双选题)已知0.1 mol/L的醋酸溶液中存在电离平衡:
CH3COOH CH3COO-+H+。要使溶液中c(H+)/ c(CH3COOH)值增大,可以采取的措施是( )
A.加少量醋酸钠溶液 B.升高温度
C.加少量冰醋酸 D.加水
课后题第3题
BD
下列事实中一定不能证明CH3COOH是弱电解质的是( )
②用CH3COOH溶液做导电实验,灯泡很暗
③等pH、等体积的盐酸、CH3COOH溶液和足量锌反应,CH3COOH放出的氢气较多
④0.1 mol·L-1 CH3COOH溶液的pH=2.1
⑤CH3COONa和H3PO4反应,生成CH3COOH
⑥0.1 mol·L-1的CH3COOH溶液稀释100倍,pH<3
A.② B.②⑤
C.③⑤ D.③④⑤⑥
A
