专题7 第三单元 含氮化合物的合理使用 课件(共83张PPT)
文档属性
| 名称 | 专题7 第三单元 含氮化合物的合理使用 课件(共83张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-10 00:00:00 | ||
图片预览










文档简介
(共83张PPT)
第三单元
DISANDANYUAN
铵盐的性质 / 常见氮肥及其使用 氮氧化物的无害化处理 / 随堂演练 知识落实 / 课时对点练
含氮化合物的合理使用
专题7
核心素养
发展目标
1.能从物质的类别、氮元素价态的角度,预测铵盐的性质与转化,掌握铵盐的物理性质和化学性质,提高宏观辨识与模型认知能力。
2.能够根据铵盐的性质提出探究问题,并会设计实验探究氨气的制法、铵根离子的检验等,培养科学探究与创新意识。
3.理解氮氧化物(NO、NO2)的来源和性质,认识氮氧化物对人体健康、社会可持续发展可能带来的双重影响。
内容索引
一、铵盐的性质
二、常见氮肥及其使用 氮氧化物的无害化处理
随堂演练 知识落实
课时对点练
铵盐的性质
一
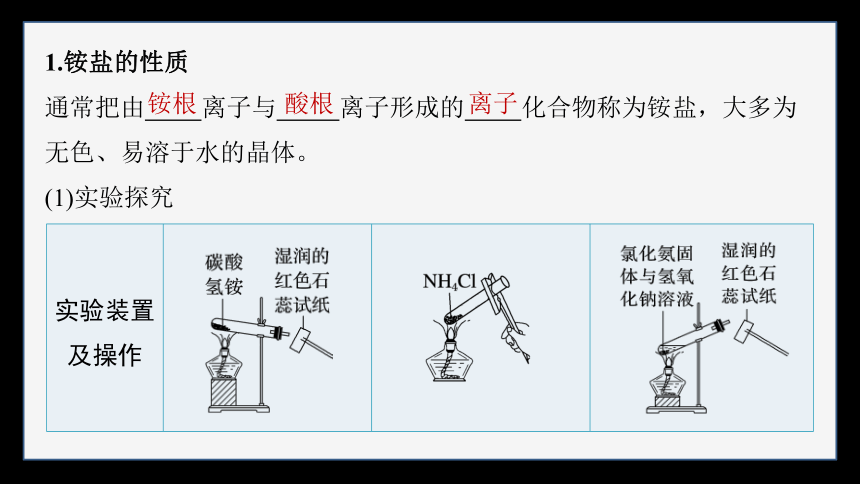
1.铵盐的性质
通常把由 离子与 离子形成的 化合物称为铵盐,大多为无色、易溶于水的晶体。
(1)实验探究
铵根
酸根
离子
实验装置及操作
现象 试管中固体_____ ,试纸变蓝 固体 ,产生 气体,试管口有 生成 试管中_________
,试纸变蓝
结论 NH4HCO3分解 产生_____ NH4Cl分解产生_____ NH4Cl和NaOH
反应生成_____
逐渐
减少
逐渐减少
有刺激性气味
白色固体
有刺激性
气味气体产生
NH3
NH3
NH3
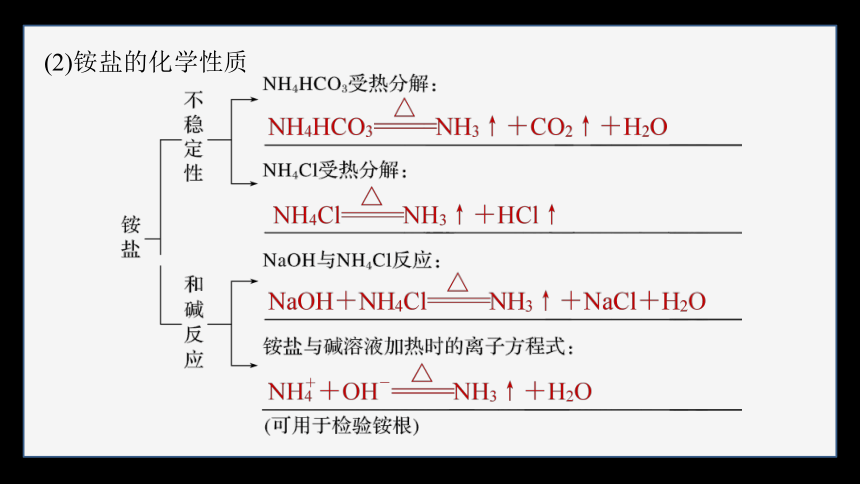
(2)铵盐的化学性质
①原理
变蓝
白烟
②操作方法
取少量固体样品(或溶液)于试管中,加入 溶液,加热,用
靠近试管口(或将蘸有 的玻璃棒靠近试管口),试纸 (或产生白烟),则证明固体样品(或溶液中)含有 。
浓氢氧化钠
湿润的红色石蕊试纸
浓盐酸
变蓝
2.氨气的实验室制法
(1)氨气的实验室制法
①制备原理
铵盐(NH4Cl)与强碱[Ca(OH)2]反应生成NH3,其化学方程式_________
。
2NH4Cl+
②实验装置
固体+固体→气体
或
③收集和验满
收集:NH3极易溶于水,密度比空气小,可以用 收集。
验满:利用NH3的性质检验是否收集满。
把湿润的红色石蕊试纸置于试管口,试纸变 ;或将蘸有浓盐酸的玻璃棒置于试管口,有 产生。
向下排空气法
蓝色
白烟
特别提醒 ①因为NH3为碱性气体,且能与CaCl2反应生成CaCl2·8NH3,所以不能用浓硫酸、无水氯化钙、P2O5等代替碱石灰干燥NH3。②收集NH3时,试管口处的棉花可减缓NH3与空气的对流。
(2)氨气的简易制法
方法及装置 原理及化学方程式
氨水具有 和 ,受热易分解。
化学方程式为__________________________
不稳定性
挥发性
NaOH固体具有吸水性,溶于水放出大量的热,促使氨水分解。
CaO与水反应,使溶剂(水)减少;反应放热,促使氨水分解。化学方程式为_________________________
_________
NH3·H2O+CaO===NH3↑+
Ca(OH)2
正误判断
(1)加热盛有NH4Cl的试管,试管底部固体消失,试管口有晶体凝结,说明NH4Cl固体可以升华( )
(2)NH4Cl受热分解,所以可用加热的方法分离NH4Cl和NaCl( )
(3)某同学根据铵盐受热分解的性质,认为可以采用加热NH4Cl的方法来制取氨( )
(4)由于氨极易溶于水,所以多余的氨可以用导管直接插入水中进行吸收
( )
(5)氨可以用浓硫酸来进行干燥( )
×
√
×
×
×
深度思考
1.铵盐受热分解都能放出氨气,对吗?
提示 不对。有的铵盐受热分解不能放出氨气,如一定条件下NH4NO3受热分解成HNO3、N2和水。
深度思考
2.试设计一个简单的实验,证明某白色固体是铵盐。
提示 取少量白色固体放在研钵中,再加入氢氧化钙固体,用研杵混合研磨,慢慢可以闻到刺激性气味,证明该固体为铵盐。
应用体验
1.下列关于铵盐的叙述正确的是________(填序号)。
①所有铵盐中,氮元素化合价都是-3;②绝大多数铵盐都易溶于水;③铵态氮肥不宜与碱性肥料混合施用;④铵盐都是由离子构成的化合物;⑤铵盐都能与碱反应,不能与酸反应;⑥铵盐受热分解一定都会产生氨气
②③④
①硝酸铵中氮元素既有-3价又有+5价,错误;
②绝大多数铵盐都易溶于水,正确;
③铵态氮肥中含有 ,能与OH-结合形成NH3·H2O,NH3·H2O受热分解产生氨并逸出,使铵态氮肥的肥效降低,因此不宜与碱性肥料混合施用,正确;
④铵盐都是由铵根离子与酸根离子构成的,属于离子化合物,正确;
⑤弱酸的铵盐(如碳酸铵等)能与酸反应,错误;
⑥铵盐受热分解不一定生成氨气,如硝酸铵等,错误。
2.氨是化学实验室常需制取的气体。实验室也可以用下列两种方法快速制备NH3:
方法一:加热浓氨水。
方法二:将浓氨水滴入生石灰(或碱石灰)固体中。
(1)请写出上述两方法中发生反应的化学方程式(原理)。
方法二:NH3·H2O+CaO===NH3↑+Ca(OH)2。
(2)根据上述原理,该小组欲用下列装置制取氨,方法一应选择____(填字母,下同),方法二应选择_____。
D
C
(3)下图是该小组设计收集氨气的几种装置,其中可行的是___(填字母),集气的原理是_________________________________________________
_______________。
d
利用NH3的密度小于空气,采用短管进氨气,长管出
空气的方法收集
返回
常见氮肥及其使用 氮氧化物的无害化处理
二
1.常见氮肥及其使用
(1)常见氮肥
氮肥 主要成分 注意事项
铵态 氮肥 含 、NH4HCO3、(NH4)2SO4 保存、深施盖土;不可以跟 物质(如草木灰)混合
硝态 氮肥 NaNO3、Ca(NO3)2等 不易被以带 为主的土壤胶粒所吸附,在潮湿的土壤中 ,容易被植物吸收。但土壤湿度大时,易被微生物还原为气体逸出,发生 导致硝态氮肥流失
低温
碱性
负电荷
流动性大
反硝化作用
尿素 CO(NH2)2白色晶体 有机氮肥,被微生物水解成__________
或 ,缓慢释放 被吸收利用,在农作物需肥期前4~8天施用。由于尿素肥效高、易保存、使用方便、长期使用对土壤的破坏作用小,是目前使用量最大的一种氮肥
中性
(NH4)2CO3
NH4HCO3
NH3
(2)合理使用氮肥
①长期使用化肥的土壤容易 、 。
②部分肥料随着雨水流入河流和湖泊,水中的肥料会使细菌、藻类迅速生长,并消耗水中的氧气,严重时导致水中含氧量减少,许多水生生物随之死亡、腐烂,水质下降。
酸化
板结
2.氮氧化物的无害化处理
(1)氮氧化物的来源
氮氧化物(NOx)是大气污染物,主要包括: 、_________
。 的燃烧、 生产等工业废气,机动车的尾气等都产生大量的氮氧化物产生大气污染。
一氧化氮(NO)
二氧化氮
(NO2)
化石燃料
硝酸
(2)氮氧化物的危害
①酸雨:NO2 HNO3,随雨水降落的硝酸会危害动植物和建筑物等。
②光化学烟雾:臭氧与氮氧化物和一些 在紫外线照射下发生反应形成光化学烟雾。具有特殊气味,刺激眼睛,对人体健康和植物生长有很大危害。
碳氢化合物
(3)预防和控制氮氧化物的污染
①减少化石燃料使用并进行脱硝处理,积极寻找替代能源。
②合理处理工业废气,减少有害气体排放。
③汽车尾气:以甲醇、液化气代替汽油,安装汽车尾气净化装置。如:
2NO+2CO N2+CO2,使用液化天然气或高效燃料电池等方法,减少汽车尾气的排放。
(1)草木灰含钾元素和铵态氮肥混用效果更好( )
(2)目前广泛使用的肥料有尿素、复合化肥( )
(3)尿素是目前固态氮肥中含氮量最高的一种化肥( )
(4)汽车尾气中的氮氧化物和碳氢化合物是造成光化学烟雾的元凶( )
(5)“温室效应”加剧所带来的环境问题是形成光化学烟雾( )
(6)严格控制汽车尾气的排放,可有效减少氮氧化物对大气的污染( )
正误判断
×
√
√
√
×
√
深度思考
请根据氮肥的特性回答下列问题:
(1)为什么硝态氮肥不宜在高温天气、多雨的水田区施用,而多用于冷凉的旱地?
提示 硝态氮肥的特点:①易溶于水,②不易被土壤吸附,③湿度大的情况下易进行反硝化而损失,④受热易分解。
深度思考
(2)为什么适应在pH较高的石灰性土壤中生长的植物优先使用硝态氮肥,而适应在酸性土壤中生长的植物优先使用铵态氮肥?
提示 硝态氮肥易溶于水,对作物吸收钙、镁、钾等养分无抑制作用,长期使用可有效改良碱性土壤。铵态氮肥在碱性环境中氨易挥发损失,作物吸收过量铵态氮对钙、钾的吸收有一定的抑制作用。
应用体验
1.施用氮肥能促进作物生长,并能提高作物中蛋白质的含量。下列关于氮肥的说法错误的是
A.尿素[CO(NH2)2]是一种氮肥
B.储存碳酸氢铵时,应密封并置于阴凉通风处
C.铵态氮肥不能与碱性物质如草木灰等混合使用
D.氮肥溶于水,其中的氮元素均以铵根离子形式存在
√
尿素[CO(NH2)2]是一种常用的高效的氮肥,A正确;
由于碳酸氢铵在温度较高时易分解,则储存碳酸氢铵时,应密封并置于阴凉通风处,B正确;
铵态氮肥水解呈酸性,碳酸钾水解呈碱性,二者混合可相互促进水解生成氨气而降低肥效,C正确;
氮元素在尿素中以分子形式存在,不是铵根离子,硝态氮肥中氮元素以 形式存在,D错误。
2.(1)在一定条件下氨气亦可用来将氮氧化物转化为无污染的物质。写出氨气和二氧化氮在一定条件下反应的化学方程式:________________
_____________________。
(2)若某工厂排出废气中NO2的含量为0.5%(体积分数),则处理1.0×103 m3
(标准状况)这种废气,需要______ kg氨气(计算结果保留2位小数)。
8NH3+6NO2
5.06
尾气中二氧化氮含量为1.0×106 L×0.5%=0.5×104 L,设需要氨气x mol,
6NO2 + 8NH3 7N2+ 12H2O
6×22.4 L 8 mol
0.5×104 L x mol
解得x≈297.62,则氨气的质量为297.62×17×10-3 kg≈5.06 kg。
返回
随堂演练 知识落实
1.中办、国办在第二轮中央生态环保督察启动之际印发了《中央生态环境保护督察工作规定》。可见国家对环境保护的重视程度。
1
2
3
4
5
下列环境问题与产生的主要原因不相符的是
①“光化学烟雾”主要是由汽车排放的
氮氧化物所引起的
②“酸雨”主要是由空气中CO2的浓度
增大引起的
③“温室效应”主要是由空气中CO2的浓度增大引起的
④“赤潮”主要是由于水体中N、P等元素含量过高而引起的
A.只有①② B.只有②③ C.全部 D.只有②
1
2
3
4
5
√
1
2
3
4
5
“酸雨”主要是由空气中SO2或NOx的浓度增大引起的。
2.下列关于铵盐的叙述中不正确的是
A.常温下,大多都是易溶于水的晶体
B.可用作氮肥
C.热稳定性差,加热分解时一定产生NH3和酸
D.跟强碱共热时,有氨气放出
√
1
2
3
4
5
铵盐的共性:大多都易溶于水;与强碱加热反应生成氨气;受热易分解,但分解不一定都产生氨气;含有氮元素,可做氮肥;分析可知C不正确。
3.(2022·山东郓城县第一中学月考)下列氮肥属于复合肥料的是
A.CO(NH2)2 B.(NH4)2SO4
C.NH3·H2O D.KNO3
√
1
2
3
4
5
复合肥料是指同时含有两种或两种以上营养元素的肥料,KNO3含有钾元素和氮元素,属于复合肥料。
4.在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示。下列说法错误的是
A.NO2是该过程的中间产物
B.汽车尾气的主要污染成分包括CO和NO
C.NO和O2必须在催化剂表面才能反应
D.催化转化总反应式为2NO+O2+4CO 4CO2+N2
1
2
3
4
5
√
1
2
3
4
5
由题图可知:2NO+O2===2NO2,2NO2+4CO 4CO2+N2,NO2是该过程的中间产物,A项正确;
汽车尾气的主要污染成分为有毒的CO和NO,B项正确;
NO和O2在常温下就能反应生成NO2,C项错误;
1
2
3
4
5
5.氨气是化学实验室常需制取的气体。实验室制取氨气通常有两种方法:①用固体氢氧化钙与氯化铵共热;②在常温下用固体氢氧化钠与浓氨水反应。
(1)右面的制取装置图中,方法①应选用
装置____(填“A”或“B”,下同),方法
②应选用装置____。
(2)在制取后,如果要干燥氨气,应选用的
干燥剂是____(填字母)。
A.浓硫酸 B.固体氢氧化钠 C.五氧化二磷
A
B
B
1
2
3
4
5
(3)检验集气瓶中是否收集满氨气的方法是__________________________________
_____________________________。
将湿润的红色石蕊试纸放在集气瓶口,如试纸变蓝,说明气体已收集满
A装置适用于固体与固体加热制气体,B装置适用于液体与固体(或液体)不加热制气体。NH3为碱性气体,只能用碱性干燥剂。检验NH3一般用湿润的红色石蕊试纸。
返回
课时对点练
题组一 铵盐的性质
1.给装有下列少量固体物质的试管加热,试管底部的物质不可能完全消失的是
A.碳酸氢铵 B.碳酸氢钠
C.氯化铵 D.碳酸铵
1
2
3
4
5
6
7
8
9
10
11
12
13
14
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
碳酸氢铵受热分解生成氨气、二氧化碳和水,氯化铵受热分解生成氨气和氯化氢,碳酸铵受热分解生成氨气、二氧化碳和水,即铵盐受热分解无固体残留物。碳酸氢钠受热分解生成二氧化碳、水和固体碳酸钠,试管底部的物质不可能完全消失。
2.下列关于铵盐的说法正确的是
A.将NH4Cl固体加热,NH4Cl发生了升华
B.铵盐的溶液能使石蕊试液变蓝色
C.铵盐大多都易溶于水
D.要密封保存铵盐,防止氨气泄漏
1
2
3
4
5
6
7
8
9
10
11
12
13
14
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
氯化铵受热分解生成氨气和氯化氢,A错误;
氯化铵是强酸弱碱盐,使紫色石蕊试液变红,B错误;
铵盐大多都易溶于水,C正确;
要密封保存铵盐,防止分解,D错误。
3.检验铵盐的一般方法是将待测物取少许置于试管中,然后
A.加水溶解后,再滴入酚酞溶液
B.加强碱溶液加热后,用湿润的红色石蕊试纸在试管口检验
C.加入强酸溶液加热后,再滴入酚酞溶液
D.加入强碱溶液加热后,再滴入酚酞溶液
1
2
3
4
5
6
7
8
9
10
11
12
13
14
√
将固体放入试管中,加强碱溶液加热后,把湿润的红色石蕊试纸放在试管口,湿润的红色石蕊试纸会变蓝色,证明产生的气体是氨,则该盐中含有铵根离子,B正确。
4.(2022·安徽定远中学高一月考)能把Na2SO4溶液、NH4NO3溶液、KCl溶液、(NH4)2SO4溶液这四种无色溶液区分开的一种试剂是(必要时可加热)
A.Ba(OH)2溶液 B.NaOH溶液
C.NaCl溶液 D.Ba(NO3)2溶液
1
2
3
4
5
6
7
8
9
10
11
12
13
14
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
Na2SO4溶液与Ba(OH)2溶液反应有白色沉淀产生,NH4NO3溶液、(NH4)2SO4溶液分别与Ba(OH)2溶液混合加热,前者有氨气放出,后者既有氨气放出,又产生白色沉淀,由此可鉴别出Na2SO4溶液、NH4NO3溶液和(NH4)2SO4溶液,则剩余的一种为KCl溶液,A项正确。
题组二 氨的实验室制法
5.在实验室里,某学习小组设计了下列制取纯净干燥氨的方案,简易、可行的方案是
A.加热氯化铵固体,再通过碱石灰
B.在氮气和氢气的混合气体中加入铁触媒,并加热至500 ℃,再通过
碱石灰
C.加热浓氨水,再通过浓硫酸
D.在生石灰中加入浓氨水,再通过碱石灰
1
2
3
4
5
6
7
8
9
10
11
12
13
14
√
6.下列装置能达到实验目的的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A.用装置甲制备氨 B.用装置乙除去氨中少量水
C.用装置丙收集氨 D.用装置丁吸收多余的氨
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
用装置甲制备氨时试管口应该略向下倾斜,A错误;
氨能被浓硫酸吸收,不能用装置乙除去氨中少量水,B错误;
氨密度小于空气,用向下排空气法收集,但集气装置不能密闭,故不能用装置丙收集氨,C错误;
氨极易溶于水,用装置丁吸收多余的氨可以防止倒吸,D正确。
7.已知氨极易溶于水,难溶于有机溶剂CCl4。下列不适合做氨的尾气吸收装置的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
NH3极易溶于水,若用C项中的装置做NH3的尾气处理装置,则容易发生倒吸;
NH3难溶于CCl4,故A装置可防倒吸;
B和D项装置原理相似都可以防倒吸。
题组三 氮氧化物的无害化处理
8.化学与环境密切相关,下列有关说法正确的是
A.CO2和NO2都会导致酸雨的形成
B.大气中的PM2.5会导致雾霾的形成
C.NO2和SO2都会导致光化学烟雾的形成
D.大气中SO2含量的增加会导致温室效应加剧
1
2
3
4
5
6
7
8
9
10
11
12
13
14
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
CO2不会导致酸雨的形成,会导致温室效应,A错误;
大气中的PM2.5会导致雾霾形成,B正确;
SO2不能导致光化学烟雾,C错误;
SO2会导致酸雨,不会导致温室效应,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
9.诺贝尔化学奖曾授予德国化学家Gerhard Ertl,以表彰他对固体表面化学研究过程中的重大发现。使CO、NOx等在铂表面发生化学反应转变成无毒气体,以减少汽车尾气中有毒气体的排放,正是此项研究的重要应用之一。下列有关说法不正确的是
A.CO在铂表面被氧化生成CO2,铂起催化作用
B.汽车尾气中的NOx在铂表面发生反应的产物是N2
C.CO在铂表面可能和O2、NOx反应
D.NOx、CO、CO2均能与人体中的血红蛋白结合
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
CO、NOx在铂表面发生的反应为CO+NOx――→CO2+N2(未配平),也可能是CO与O2反应,此过程中铂作催化剂;CO2不能与人体中的血红蛋白结合。
10.实验室制取少量干燥的氨气涉及右列装置,其中正确的是
A.①是氨气发生装置
B.②是氨气吸收装置
C.③是氨气发生装置
D.④是氨气收集、检验装置
1
2
3
4
5
6
7
8
9
10
11
12
13
14
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
①中氯化铵固体受热分解生成氨气和氯化氢,而在试管口温度降低,氨气和氯化氢又重新化合成固体氯化铵,无法得到氨气;
②中漏斗没入水下起不到防倒吸的作用,应使倒置漏斗的上边缘刚好没入水中;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
③氧化钙能与浓氨水中的水反应生成氢氧化钙,同时放出大量热,使浓氨水分解放出氨气;
④中的收集装置应在试管口塞一团棉花,防止因空气对流,而使氨气逸出。
11.尿素是人工合成的有机物,其结构简式为 ,下列关于尿素的叙述不正确的是
A.尿素是一种氮肥
B.尿素是人体新陈代谢的一种产物
C.尿素在水中可以电离出
D.尿素的分子式为CH4N2O,是一种有机氮肥
1
2
3
4
5
6
7
8
9
10
11
12
13
14
√
12.(2022·河北泊头市第一中学高一测试)如图所示,在一个密闭的玻璃管两端各放一团棉花,再用注射器同时在两端注入适量的浓氨水和浓盐酸,下列说法不正确的是
A.玻璃管中发生的反应可表示为NH3+HCl===NH4Cl
B.实验时会在玻璃管中看到白雾
C.用手触摸玻璃管外壁,会感觉到有热量放出
D.将浓盐酸换成浓硝酸也会有相似现象
1
2
3
4
5
6
7
8
9
10
11
12
13
14
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
浓氨水和浓盐酸都有挥发性,两者挥发在玻璃管中发生的反应可表示为NH3+HCl===NH4Cl,故A正确;
实验时会在玻璃管中看到白烟,故B错误;
氨气和氯化氢是化合反应,是放热反应,用手触摸玻璃管外壁,会感觉到有热量放出,故C正确;
浓硝酸也有挥发性,因此将浓盐酸换成浓硝酸也会有相似现象,故D正确。
13.常见的化肥有氨水、NH4Cl、NH4HCO3、(NH4)2SO4、K2CO3、尿素[CO(NH2)2]等。为确定某种化肥的组成,进行下列实验:
(1)取少量化肥与烧碱共热,放出可使湿润的红色石蕊试纸变蓝的气体。此气体为 ,证明化肥中含 (填离子符号,下同)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
NH3
取少量化肥与烧碱共热,放出可使湿润的红色石蕊试纸变蓝的气体,该气体为氨气,证明化肥中含有 ;
(2)向上述反应后的溶液中注入过量盐酸,生成的无色无味气体可使澄清石灰水变浑浊。此气体为 ,证明化肥中含有 或 。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
CO2
将上述反应后的溶液中加入盐酸,生成无色无味气体,将所得气体通入澄清石灰水后出现浑浊现象,可以推知生成的无色无味的气体为二氧化碳,证明化肥中含有
1
2
3
4
5
6
7
8
9
10
11
12
13
14
(3)另取少量化肥溶于水,加入CaCl2溶液无明显反应现象。由上可知该化肥的化学式为 。
NH4HCO3
1
2
3
4
5
6
7
8
9
10
11
12
13
14
14.农业生产离不开氮肥,几乎所有的氮肥都以氨为原料,某化学兴趣小组利用图1装置制备氨并探究相关性质。
(1)装置A中,盛有浓氨水的仪器名称为_____
_____,烧瓶内药品可选用________________。装置B的作用是_______。
分液
漏斗
碱石灰(或生石灰)
干燥氨
1
2
3
4
5
6
7
8
9
10
11
12
13
14
根据仪器装置图可知,盛有浓氨水的仪器名称为分液漏斗;浓氨水在碱石灰或生石灰的作用下生成氨,其中含有水分,若直接通入C中,会导致C中试管破裂,因此选用碱石灰进行干燥。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
(2)连接好装置并检验装置的气密性后,装入药品,然后应先 (填字母)。
a.打开旋塞逐滴向圆底烧瓶中加入浓氨水
b.加热装置C
a
1
2
3
4
5
6
7
8
9
10
11
12
13
14
整个装置中含有空气,连接好装置并检验装置的气密性后,装入药品,打开旋塞逐滴向圆底烧瓶中加入氨水发生反应生成氨,通过氧化铜的颜色变化分析氨的性质。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
(3)实验中观察到C中CuO粉末变红,D中无水硫酸铜变蓝,并收集到一种单质气体,则该反应证明氨具有_____性;氨跟氧气的反应也体现了这
一性质,反应的化学方程式为____________________________。
还原
1
2
3
4
5
6
7
8
9
10
11
12
13
14
实验中观察到C中CuO粉末变红证明生成铜,D中无水硫酸铜变蓝证明生成水,并收集到一种单质气体,依据氧化还原反应分析,氧化铜把氨氧化为氮气,氧化铜被还原为铜,
氮元素化合价升高为0价,作还原剂具有还原性;氨与氧气反应生成NO、
H2O,其反应的化学方程式为4NH3+5O2 4NO+6H2O。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
(4)该实验缺少尾气吸收装置,图2中能用来吸收尾气的装置是_______
(填装置序号)。
Ⅱ、Ⅲ
氨极易溶于水,尾气吸收需要防止倒吸,图2中能用来吸收尾气的装置是Ⅱ、Ⅲ,装置Ⅰ易发生倒吸。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
(5)实验室还可用图3所示装置制备氨,反应的化学方程式为_________________
___________________________;用圆底烧瓶收集干燥的氨,用图4装置进行喷泉
2NH4Cl+Ca(OH)2
实验,挤压胶头滴管时,可以得到红色喷泉,原因是(用化学方程式表示)
__________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
NH4Cl与Ca(OH)2在加热条件下反应生成氯化钙、氨和水,其反应的化学方程式为2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+
2H2O;氨为碱性气体,其溶于水生成一水
合氨,一水合氨发生电离使溶液呈碱性,使含有酚酞的溶液呈红色,故总的反应式为
(6)尿素CO(NH2)2是一种常用化肥,与水发生缓慢的非氧化还原反应释放出氨,则尿素中C的化合价为 。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
+4价
其反应为非氧化还原反应,说明N元素化合价为-3,H元素化合价为+1,O元素化合价为-2,根据化合物中化合价代数和为0可知C元素化合价为+4。
返回
本课结束
专题7
第三单元
DISANDANYUAN
铵盐的性质 / 常见氮肥及其使用 氮氧化物的无害化处理 / 随堂演练 知识落实 / 课时对点练
含氮化合物的合理使用
专题7
核心素养
发展目标
1.能从物质的类别、氮元素价态的角度,预测铵盐的性质与转化,掌握铵盐的物理性质和化学性质,提高宏观辨识与模型认知能力。
2.能够根据铵盐的性质提出探究问题,并会设计实验探究氨气的制法、铵根离子的检验等,培养科学探究与创新意识。
3.理解氮氧化物(NO、NO2)的来源和性质,认识氮氧化物对人体健康、社会可持续发展可能带来的双重影响。
内容索引
一、铵盐的性质
二、常见氮肥及其使用 氮氧化物的无害化处理
随堂演练 知识落实
课时对点练
铵盐的性质
一
1.铵盐的性质
通常把由 离子与 离子形成的 化合物称为铵盐,大多为无色、易溶于水的晶体。
(1)实验探究
铵根
酸根
离子
实验装置及操作
现象 试管中固体_____ ,试纸变蓝 固体 ,产生 气体,试管口有 生成 试管中_________
,试纸变蓝
结论 NH4HCO3分解 产生_____ NH4Cl分解产生_____ NH4Cl和NaOH
反应生成_____
逐渐
减少
逐渐减少
有刺激性气味
白色固体
有刺激性
气味气体产生
NH3
NH3
NH3
(2)铵盐的化学性质
①原理
变蓝
白烟
②操作方法
取少量固体样品(或溶液)于试管中,加入 溶液,加热,用
靠近试管口(或将蘸有 的玻璃棒靠近试管口),试纸 (或产生白烟),则证明固体样品(或溶液中)含有 。
浓氢氧化钠
湿润的红色石蕊试纸
浓盐酸
变蓝
2.氨气的实验室制法
(1)氨气的实验室制法
①制备原理
铵盐(NH4Cl)与强碱[Ca(OH)2]反应生成NH3,其化学方程式_________
。
2NH4Cl+
②实验装置
固体+固体→气体
或
③收集和验满
收集:NH3极易溶于水,密度比空气小,可以用 收集。
验满:利用NH3的性质检验是否收集满。
把湿润的红色石蕊试纸置于试管口,试纸变 ;或将蘸有浓盐酸的玻璃棒置于试管口,有 产生。
向下排空气法
蓝色
白烟
特别提醒 ①因为NH3为碱性气体,且能与CaCl2反应生成CaCl2·8NH3,所以不能用浓硫酸、无水氯化钙、P2O5等代替碱石灰干燥NH3。②收集NH3时,试管口处的棉花可减缓NH3与空气的对流。
(2)氨气的简易制法
方法及装置 原理及化学方程式
氨水具有 和 ,受热易分解。
化学方程式为__________________________
不稳定性
挥发性
NaOH固体具有吸水性,溶于水放出大量的热,促使氨水分解。
CaO与水反应,使溶剂(水)减少;反应放热,促使氨水分解。化学方程式为_________________________
_________
NH3·H2O+CaO===NH3↑+
Ca(OH)2
正误判断
(1)加热盛有NH4Cl的试管,试管底部固体消失,试管口有晶体凝结,说明NH4Cl固体可以升华( )
(2)NH4Cl受热分解,所以可用加热的方法分离NH4Cl和NaCl( )
(3)某同学根据铵盐受热分解的性质,认为可以采用加热NH4Cl的方法来制取氨( )
(4)由于氨极易溶于水,所以多余的氨可以用导管直接插入水中进行吸收
( )
(5)氨可以用浓硫酸来进行干燥( )
×
√
×
×
×
深度思考
1.铵盐受热分解都能放出氨气,对吗?
提示 不对。有的铵盐受热分解不能放出氨气,如一定条件下NH4NO3受热分解成HNO3、N2和水。
深度思考
2.试设计一个简单的实验,证明某白色固体是铵盐。
提示 取少量白色固体放在研钵中,再加入氢氧化钙固体,用研杵混合研磨,慢慢可以闻到刺激性气味,证明该固体为铵盐。
应用体验
1.下列关于铵盐的叙述正确的是________(填序号)。
①所有铵盐中,氮元素化合价都是-3;②绝大多数铵盐都易溶于水;③铵态氮肥不宜与碱性肥料混合施用;④铵盐都是由离子构成的化合物;⑤铵盐都能与碱反应,不能与酸反应;⑥铵盐受热分解一定都会产生氨气
②③④
①硝酸铵中氮元素既有-3价又有+5价,错误;
②绝大多数铵盐都易溶于水,正确;
③铵态氮肥中含有 ,能与OH-结合形成NH3·H2O,NH3·H2O受热分解产生氨并逸出,使铵态氮肥的肥效降低,因此不宜与碱性肥料混合施用,正确;
④铵盐都是由铵根离子与酸根离子构成的,属于离子化合物,正确;
⑤弱酸的铵盐(如碳酸铵等)能与酸反应,错误;
⑥铵盐受热分解不一定生成氨气,如硝酸铵等,错误。
2.氨是化学实验室常需制取的气体。实验室也可以用下列两种方法快速制备NH3:
方法一:加热浓氨水。
方法二:将浓氨水滴入生石灰(或碱石灰)固体中。
(1)请写出上述两方法中发生反应的化学方程式(原理)。
方法二:NH3·H2O+CaO===NH3↑+Ca(OH)2。
(2)根据上述原理,该小组欲用下列装置制取氨,方法一应选择____(填字母,下同),方法二应选择_____。
D
C
(3)下图是该小组设计收集氨气的几种装置,其中可行的是___(填字母),集气的原理是_________________________________________________
_______________。
d
利用NH3的密度小于空气,采用短管进氨气,长管出
空气的方法收集
返回
常见氮肥及其使用 氮氧化物的无害化处理
二
1.常见氮肥及其使用
(1)常见氮肥
氮肥 主要成分 注意事项
铵态 氮肥 含 、NH4HCO3、(NH4)2SO4 保存、深施盖土;不可以跟 物质(如草木灰)混合
硝态 氮肥 NaNO3、Ca(NO3)2等 不易被以带 为主的土壤胶粒所吸附,在潮湿的土壤中 ,容易被植物吸收。但土壤湿度大时,易被微生物还原为气体逸出,发生 导致硝态氮肥流失
低温
碱性
负电荷
流动性大
反硝化作用
尿素 CO(NH2)2白色晶体 有机氮肥,被微生物水解成__________
或 ,缓慢释放 被吸收利用,在农作物需肥期前4~8天施用。由于尿素肥效高、易保存、使用方便、长期使用对土壤的破坏作用小,是目前使用量最大的一种氮肥
中性
(NH4)2CO3
NH4HCO3
NH3
(2)合理使用氮肥
①长期使用化肥的土壤容易 、 。
②部分肥料随着雨水流入河流和湖泊,水中的肥料会使细菌、藻类迅速生长,并消耗水中的氧气,严重时导致水中含氧量减少,许多水生生物随之死亡、腐烂,水质下降。
酸化
板结
2.氮氧化物的无害化处理
(1)氮氧化物的来源
氮氧化物(NOx)是大气污染物,主要包括: 、_________
。 的燃烧、 生产等工业废气,机动车的尾气等都产生大量的氮氧化物产生大气污染。
一氧化氮(NO)
二氧化氮
(NO2)
化石燃料
硝酸
(2)氮氧化物的危害
①酸雨:NO2 HNO3,随雨水降落的硝酸会危害动植物和建筑物等。
②光化学烟雾:臭氧与氮氧化物和一些 在紫外线照射下发生反应形成光化学烟雾。具有特殊气味,刺激眼睛,对人体健康和植物生长有很大危害。
碳氢化合物
(3)预防和控制氮氧化物的污染
①减少化石燃料使用并进行脱硝处理,积极寻找替代能源。
②合理处理工业废气,减少有害气体排放。
③汽车尾气:以甲醇、液化气代替汽油,安装汽车尾气净化装置。如:
2NO+2CO N2+CO2,使用液化天然气或高效燃料电池等方法,减少汽车尾气的排放。
(1)草木灰含钾元素和铵态氮肥混用效果更好( )
(2)目前广泛使用的肥料有尿素、复合化肥( )
(3)尿素是目前固态氮肥中含氮量最高的一种化肥( )
(4)汽车尾气中的氮氧化物和碳氢化合物是造成光化学烟雾的元凶( )
(5)“温室效应”加剧所带来的环境问题是形成光化学烟雾( )
(6)严格控制汽车尾气的排放,可有效减少氮氧化物对大气的污染( )
正误判断
×
√
√
√
×
√
深度思考
请根据氮肥的特性回答下列问题:
(1)为什么硝态氮肥不宜在高温天气、多雨的水田区施用,而多用于冷凉的旱地?
提示 硝态氮肥的特点:①易溶于水,②不易被土壤吸附,③湿度大的情况下易进行反硝化而损失,④受热易分解。
深度思考
(2)为什么适应在pH较高的石灰性土壤中生长的植物优先使用硝态氮肥,而适应在酸性土壤中生长的植物优先使用铵态氮肥?
提示 硝态氮肥易溶于水,对作物吸收钙、镁、钾等养分无抑制作用,长期使用可有效改良碱性土壤。铵态氮肥在碱性环境中氨易挥发损失,作物吸收过量铵态氮对钙、钾的吸收有一定的抑制作用。
应用体验
1.施用氮肥能促进作物生长,并能提高作物中蛋白质的含量。下列关于氮肥的说法错误的是
A.尿素[CO(NH2)2]是一种氮肥
B.储存碳酸氢铵时,应密封并置于阴凉通风处
C.铵态氮肥不能与碱性物质如草木灰等混合使用
D.氮肥溶于水,其中的氮元素均以铵根离子形式存在
√
尿素[CO(NH2)2]是一种常用的高效的氮肥,A正确;
由于碳酸氢铵在温度较高时易分解,则储存碳酸氢铵时,应密封并置于阴凉通风处,B正确;
铵态氮肥水解呈酸性,碳酸钾水解呈碱性,二者混合可相互促进水解生成氨气而降低肥效,C正确;
氮元素在尿素中以分子形式存在,不是铵根离子,硝态氮肥中氮元素以 形式存在,D错误。
2.(1)在一定条件下氨气亦可用来将氮氧化物转化为无污染的物质。写出氨气和二氧化氮在一定条件下反应的化学方程式:________________
_____________________。
(2)若某工厂排出废气中NO2的含量为0.5%(体积分数),则处理1.0×103 m3
(标准状况)这种废气,需要______ kg氨气(计算结果保留2位小数)。
8NH3+6NO2
5.06
尾气中二氧化氮含量为1.0×106 L×0.5%=0.5×104 L,设需要氨气x mol,
6NO2 + 8NH3 7N2+ 12H2O
6×22.4 L 8 mol
0.5×104 L x mol
解得x≈297.62,则氨气的质量为297.62×17×10-3 kg≈5.06 kg。
返回
随堂演练 知识落实
1.中办、国办在第二轮中央生态环保督察启动之际印发了《中央生态环境保护督察工作规定》。可见国家对环境保护的重视程度。
1
2
3
4
5
下列环境问题与产生的主要原因不相符的是
①“光化学烟雾”主要是由汽车排放的
氮氧化物所引起的
②“酸雨”主要是由空气中CO2的浓度
增大引起的
③“温室效应”主要是由空气中CO2的浓度增大引起的
④“赤潮”主要是由于水体中N、P等元素含量过高而引起的
A.只有①② B.只有②③ C.全部 D.只有②
1
2
3
4
5
√
1
2
3
4
5
“酸雨”主要是由空气中SO2或NOx的浓度增大引起的。
2.下列关于铵盐的叙述中不正确的是
A.常温下,大多都是易溶于水的晶体
B.可用作氮肥
C.热稳定性差,加热分解时一定产生NH3和酸
D.跟强碱共热时,有氨气放出
√
1
2
3
4
5
铵盐的共性:大多都易溶于水;与强碱加热反应生成氨气;受热易分解,但分解不一定都产生氨气;含有氮元素,可做氮肥;分析可知C不正确。
3.(2022·山东郓城县第一中学月考)下列氮肥属于复合肥料的是
A.CO(NH2)2 B.(NH4)2SO4
C.NH3·H2O D.KNO3
√
1
2
3
4
5
复合肥料是指同时含有两种或两种以上营养元素的肥料,KNO3含有钾元素和氮元素,属于复合肥料。
4.在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示。下列说法错误的是
A.NO2是该过程的中间产物
B.汽车尾气的主要污染成分包括CO和NO
C.NO和O2必须在催化剂表面才能反应
D.催化转化总反应式为2NO+O2+4CO 4CO2+N2
1
2
3
4
5
√
1
2
3
4
5
由题图可知:2NO+O2===2NO2,2NO2+4CO 4CO2+N2,NO2是该过程的中间产物,A项正确;
汽车尾气的主要污染成分为有毒的CO和NO,B项正确;
NO和O2在常温下就能反应生成NO2,C项错误;
1
2
3
4
5
5.氨气是化学实验室常需制取的气体。实验室制取氨气通常有两种方法:①用固体氢氧化钙与氯化铵共热;②在常温下用固体氢氧化钠与浓氨水反应。
(1)右面的制取装置图中,方法①应选用
装置____(填“A”或“B”,下同),方法
②应选用装置____。
(2)在制取后,如果要干燥氨气,应选用的
干燥剂是____(填字母)。
A.浓硫酸 B.固体氢氧化钠 C.五氧化二磷
A
B
B
1
2
3
4
5
(3)检验集气瓶中是否收集满氨气的方法是__________________________________
_____________________________。
将湿润的红色石蕊试纸放在集气瓶口,如试纸变蓝,说明气体已收集满
A装置适用于固体与固体加热制气体,B装置适用于液体与固体(或液体)不加热制气体。NH3为碱性气体,只能用碱性干燥剂。检验NH3一般用湿润的红色石蕊试纸。
返回
课时对点练
题组一 铵盐的性质
1.给装有下列少量固体物质的试管加热,试管底部的物质不可能完全消失的是
A.碳酸氢铵 B.碳酸氢钠
C.氯化铵 D.碳酸铵
1
2
3
4
5
6
7
8
9
10
11
12
13
14
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
碳酸氢铵受热分解生成氨气、二氧化碳和水,氯化铵受热分解生成氨气和氯化氢,碳酸铵受热分解生成氨气、二氧化碳和水,即铵盐受热分解无固体残留物。碳酸氢钠受热分解生成二氧化碳、水和固体碳酸钠,试管底部的物质不可能完全消失。
2.下列关于铵盐的说法正确的是
A.将NH4Cl固体加热,NH4Cl发生了升华
B.铵盐的溶液能使石蕊试液变蓝色
C.铵盐大多都易溶于水
D.要密封保存铵盐,防止氨气泄漏
1
2
3
4
5
6
7
8
9
10
11
12
13
14
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
氯化铵受热分解生成氨气和氯化氢,A错误;
氯化铵是强酸弱碱盐,使紫色石蕊试液变红,B错误;
铵盐大多都易溶于水,C正确;
要密封保存铵盐,防止分解,D错误。
3.检验铵盐的一般方法是将待测物取少许置于试管中,然后
A.加水溶解后,再滴入酚酞溶液
B.加强碱溶液加热后,用湿润的红色石蕊试纸在试管口检验
C.加入强酸溶液加热后,再滴入酚酞溶液
D.加入强碱溶液加热后,再滴入酚酞溶液
1
2
3
4
5
6
7
8
9
10
11
12
13
14
√
将固体放入试管中,加强碱溶液加热后,把湿润的红色石蕊试纸放在试管口,湿润的红色石蕊试纸会变蓝色,证明产生的气体是氨,则该盐中含有铵根离子,B正确。
4.(2022·安徽定远中学高一月考)能把Na2SO4溶液、NH4NO3溶液、KCl溶液、(NH4)2SO4溶液这四种无色溶液区分开的一种试剂是(必要时可加热)
A.Ba(OH)2溶液 B.NaOH溶液
C.NaCl溶液 D.Ba(NO3)2溶液
1
2
3
4
5
6
7
8
9
10
11
12
13
14
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
Na2SO4溶液与Ba(OH)2溶液反应有白色沉淀产生,NH4NO3溶液、(NH4)2SO4溶液分别与Ba(OH)2溶液混合加热,前者有氨气放出,后者既有氨气放出,又产生白色沉淀,由此可鉴别出Na2SO4溶液、NH4NO3溶液和(NH4)2SO4溶液,则剩余的一种为KCl溶液,A项正确。
题组二 氨的实验室制法
5.在实验室里,某学习小组设计了下列制取纯净干燥氨的方案,简易、可行的方案是
A.加热氯化铵固体,再通过碱石灰
B.在氮气和氢气的混合气体中加入铁触媒,并加热至500 ℃,再通过
碱石灰
C.加热浓氨水,再通过浓硫酸
D.在生石灰中加入浓氨水,再通过碱石灰
1
2
3
4
5
6
7
8
9
10
11
12
13
14
√
6.下列装置能达到实验目的的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A.用装置甲制备氨 B.用装置乙除去氨中少量水
C.用装置丙收集氨 D.用装置丁吸收多余的氨
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
用装置甲制备氨时试管口应该略向下倾斜,A错误;
氨能被浓硫酸吸收,不能用装置乙除去氨中少量水,B错误;
氨密度小于空气,用向下排空气法收集,但集气装置不能密闭,故不能用装置丙收集氨,C错误;
氨极易溶于水,用装置丁吸收多余的氨可以防止倒吸,D正确。
7.已知氨极易溶于水,难溶于有机溶剂CCl4。下列不适合做氨的尾气吸收装置的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
NH3极易溶于水,若用C项中的装置做NH3的尾气处理装置,则容易发生倒吸;
NH3难溶于CCl4,故A装置可防倒吸;
B和D项装置原理相似都可以防倒吸。
题组三 氮氧化物的无害化处理
8.化学与环境密切相关,下列有关说法正确的是
A.CO2和NO2都会导致酸雨的形成
B.大气中的PM2.5会导致雾霾的形成
C.NO2和SO2都会导致光化学烟雾的形成
D.大气中SO2含量的增加会导致温室效应加剧
1
2
3
4
5
6
7
8
9
10
11
12
13
14
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
CO2不会导致酸雨的形成,会导致温室效应,A错误;
大气中的PM2.5会导致雾霾形成,B正确;
SO2不能导致光化学烟雾,C错误;
SO2会导致酸雨,不会导致温室效应,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
9.诺贝尔化学奖曾授予德国化学家Gerhard Ertl,以表彰他对固体表面化学研究过程中的重大发现。使CO、NOx等在铂表面发生化学反应转变成无毒气体,以减少汽车尾气中有毒气体的排放,正是此项研究的重要应用之一。下列有关说法不正确的是
A.CO在铂表面被氧化生成CO2,铂起催化作用
B.汽车尾气中的NOx在铂表面发生反应的产物是N2
C.CO在铂表面可能和O2、NOx反应
D.NOx、CO、CO2均能与人体中的血红蛋白结合
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
CO、NOx在铂表面发生的反应为CO+NOx――→CO2+N2(未配平),也可能是CO与O2反应,此过程中铂作催化剂;CO2不能与人体中的血红蛋白结合。
10.实验室制取少量干燥的氨气涉及右列装置,其中正确的是
A.①是氨气发生装置
B.②是氨气吸收装置
C.③是氨气发生装置
D.④是氨气收集、检验装置
1
2
3
4
5
6
7
8
9
10
11
12
13
14
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
①中氯化铵固体受热分解生成氨气和氯化氢,而在试管口温度降低,氨气和氯化氢又重新化合成固体氯化铵,无法得到氨气;
②中漏斗没入水下起不到防倒吸的作用,应使倒置漏斗的上边缘刚好没入水中;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
③氧化钙能与浓氨水中的水反应生成氢氧化钙,同时放出大量热,使浓氨水分解放出氨气;
④中的收集装置应在试管口塞一团棉花,防止因空气对流,而使氨气逸出。
11.尿素是人工合成的有机物,其结构简式为 ,下列关于尿素的叙述不正确的是
A.尿素是一种氮肥
B.尿素是人体新陈代谢的一种产物
C.尿素在水中可以电离出
D.尿素的分子式为CH4N2O,是一种有机氮肥
1
2
3
4
5
6
7
8
9
10
11
12
13
14
√
12.(2022·河北泊头市第一中学高一测试)如图所示,在一个密闭的玻璃管两端各放一团棉花,再用注射器同时在两端注入适量的浓氨水和浓盐酸,下列说法不正确的是
A.玻璃管中发生的反应可表示为NH3+HCl===NH4Cl
B.实验时会在玻璃管中看到白雾
C.用手触摸玻璃管外壁,会感觉到有热量放出
D.将浓盐酸换成浓硝酸也会有相似现象
1
2
3
4
5
6
7
8
9
10
11
12
13
14
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
浓氨水和浓盐酸都有挥发性,两者挥发在玻璃管中发生的反应可表示为NH3+HCl===NH4Cl,故A正确;
实验时会在玻璃管中看到白烟,故B错误;
氨气和氯化氢是化合反应,是放热反应,用手触摸玻璃管外壁,会感觉到有热量放出,故C正确;
浓硝酸也有挥发性,因此将浓盐酸换成浓硝酸也会有相似现象,故D正确。
13.常见的化肥有氨水、NH4Cl、NH4HCO3、(NH4)2SO4、K2CO3、尿素[CO(NH2)2]等。为确定某种化肥的组成,进行下列实验:
(1)取少量化肥与烧碱共热,放出可使湿润的红色石蕊试纸变蓝的气体。此气体为 ,证明化肥中含 (填离子符号,下同)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
NH3
取少量化肥与烧碱共热,放出可使湿润的红色石蕊试纸变蓝的气体,该气体为氨气,证明化肥中含有 ;
(2)向上述反应后的溶液中注入过量盐酸,生成的无色无味气体可使澄清石灰水变浑浊。此气体为 ,证明化肥中含有 或 。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
CO2
将上述反应后的溶液中加入盐酸,生成无色无味气体,将所得气体通入澄清石灰水后出现浑浊现象,可以推知生成的无色无味的气体为二氧化碳,证明化肥中含有
1
2
3
4
5
6
7
8
9
10
11
12
13
14
(3)另取少量化肥溶于水,加入CaCl2溶液无明显反应现象。由上可知该化肥的化学式为 。
NH4HCO3
1
2
3
4
5
6
7
8
9
10
11
12
13
14
14.农业生产离不开氮肥,几乎所有的氮肥都以氨为原料,某化学兴趣小组利用图1装置制备氨并探究相关性质。
(1)装置A中,盛有浓氨水的仪器名称为_____
_____,烧瓶内药品可选用________________。装置B的作用是_______。
分液
漏斗
碱石灰(或生石灰)
干燥氨
1
2
3
4
5
6
7
8
9
10
11
12
13
14
根据仪器装置图可知,盛有浓氨水的仪器名称为分液漏斗;浓氨水在碱石灰或生石灰的作用下生成氨,其中含有水分,若直接通入C中,会导致C中试管破裂,因此选用碱石灰进行干燥。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
(2)连接好装置并检验装置的气密性后,装入药品,然后应先 (填字母)。
a.打开旋塞逐滴向圆底烧瓶中加入浓氨水
b.加热装置C
a
1
2
3
4
5
6
7
8
9
10
11
12
13
14
整个装置中含有空气,连接好装置并检验装置的气密性后,装入药品,打开旋塞逐滴向圆底烧瓶中加入氨水发生反应生成氨,通过氧化铜的颜色变化分析氨的性质。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
(3)实验中观察到C中CuO粉末变红,D中无水硫酸铜变蓝,并收集到一种单质气体,则该反应证明氨具有_____性;氨跟氧气的反应也体现了这
一性质,反应的化学方程式为____________________________。
还原
1
2
3
4
5
6
7
8
9
10
11
12
13
14
实验中观察到C中CuO粉末变红证明生成铜,D中无水硫酸铜变蓝证明生成水,并收集到一种单质气体,依据氧化还原反应分析,氧化铜把氨氧化为氮气,氧化铜被还原为铜,
氮元素化合价升高为0价,作还原剂具有还原性;氨与氧气反应生成NO、
H2O,其反应的化学方程式为4NH3+5O2 4NO+6H2O。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
(4)该实验缺少尾气吸收装置,图2中能用来吸收尾气的装置是_______
(填装置序号)。
Ⅱ、Ⅲ
氨极易溶于水,尾气吸收需要防止倒吸,图2中能用来吸收尾气的装置是Ⅱ、Ⅲ,装置Ⅰ易发生倒吸。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
(5)实验室还可用图3所示装置制备氨,反应的化学方程式为_________________
___________________________;用圆底烧瓶收集干燥的氨,用图4装置进行喷泉
2NH4Cl+Ca(OH)2
实验,挤压胶头滴管时,可以得到红色喷泉,原因是(用化学方程式表示)
__________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
NH4Cl与Ca(OH)2在加热条件下反应生成氯化钙、氨和水,其反应的化学方程式为2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+
2H2O;氨为碱性气体,其溶于水生成一水
合氨,一水合氨发生电离使溶液呈碱性,使含有酚酞的溶液呈红色,故总的反应式为
(6)尿素CO(NH2)2是一种常用化肥,与水发生缓慢的非氧化还原反应释放出氨,则尿素中C的化合价为 。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
+4价
其反应为非氧化还原反应,说明N元素化合价为-3,H元素化合价为+1,O元素化合价为-2,根据化合物中化合价代数和为0可知C元素化合价为+4。
返回
本课结束
专题7
