5.1.2 硫酸及硫酸的性质课件(27张ppt)2022-2023学年高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 5.1.2 硫酸及硫酸的性质课件(27张ppt)2022-2023学年高一下学期化学人教版(2019)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 32.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-12 14:52:54 | ||
图片预览






文档简介
(共27张PPT)
第1节 硫及其化合物
第2课时 硫 酸
课程学习目标
认识硫酸在相关反应中体现的性质
3
掌握浓硫酸的吸水性、脱水性、强氧化性
2
了解硫酸的生产原理
1
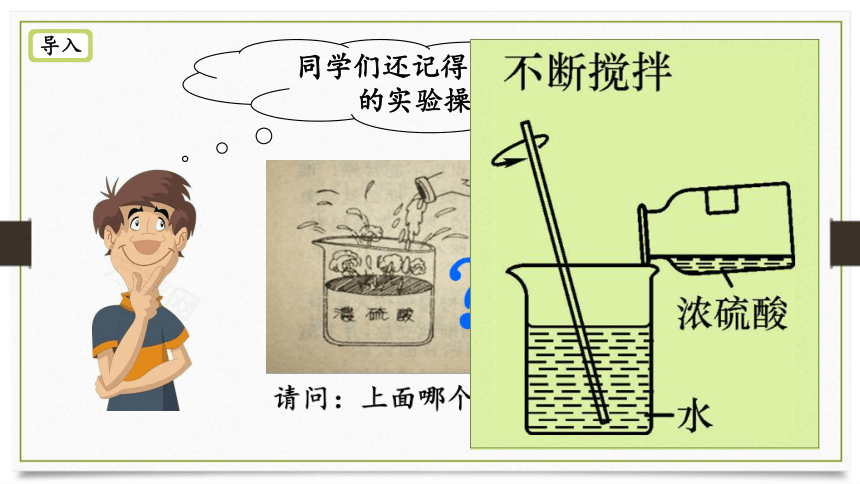
导入
同学们还记得浓硫酸稀释的实验操作吗
1.高沸点——制取挥发性酸
2.吸水性——做干燥剂
3.脱水性——做催化剂
4.酸性——去金属表面的氧化物、制取硫酸盐、制造化肥
5.强氧化性——制炸药
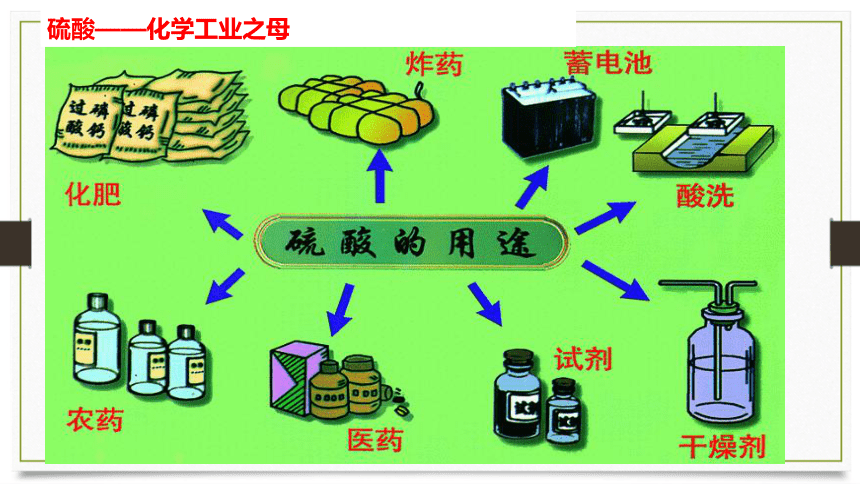
硫酸——化学工业之母
新课展示
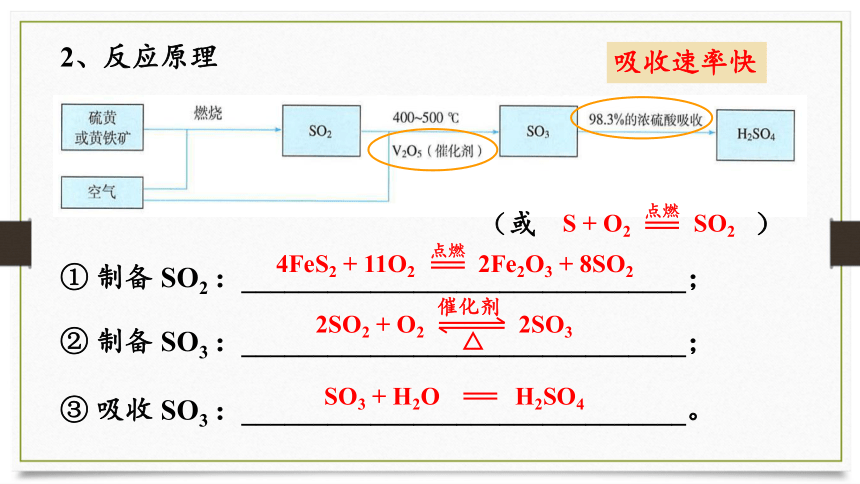
硫酸的工业制备
1、原料:硫黄或硫矿物(黄铁矿)
FeS2
2、反应原理
① 制备 SO2 :_______________________________;
② 制备 SO3 :_______________________________;
③ 吸收 SO3 :_______________________________。
4FeS2 + 11O2 2Fe2O3 + 8SO2
点燃
(或 )
S + O2 SO2
点燃
催化剂
2SO2 + O2 2SO3
SO3 + H2O H2SO4
吸收速率快
硫酸的性质
(1)纯硫酸是一种无色油状液体。
(2)沸点:338 ℃ (难挥性发酸),沸点高,难挥发。
密度:1.84 g / cm3 (比水大)
(3)溶解性:浓 H2SO4 与水以任意比互溶,
溶解时可放出大量的热。
1、物理性质
2、化学性质
1) 稀硫酸的化学性质
硫酸属于二元强酸,具有酸的通性。
① 稀硫酸发生完全电离:
H2SO4 = 2H+ + SO42-
② 酸的通性:
a、使酸碱指示剂显色; b、跟活泼金属反应;
c、跟碱性氧化物反应; d、跟碱起中和反应;
e、跟某些盐反应。
试一试:写出下列反应的化学方程式:
a、稀硫酸能使紫色石蕊试液变____ 色。
b、稀硫酸与活泼金属反应,如 Zn :____________________。
c、稀硫酸与金属氧化物反应,如 CuO :_______________________。
d、稀硫酸与碱反应,如 NaOH :__________________________。
e、稀硫酸与部分盐反应,如 Na2CO3 : ________________________。
红
2) 浓硫酸的化学性质
浓硫酸:主要以分子形式存在,所以具有稀硫酸不
具有的化学特性。
① 吸水性:浓硫酸能吸收物质周围环境中的水分,
常用做干燥剂。
可干燥
中性气体:H2、O2、N2、CO
酸性气体:CO2、SO2、SO3、NO2、HCl...
不能干燥:碱性气体:NH3 ,还原性气体:H2S、
HI、HBr等。
② 脱水性:浓硫酸能将有机物中的氢、氧元素
按水的组成比(2:1)脱去。
如:蔗糖脱水
C12H22O11 (蔗糖)
浓硫酸
12C + 11H2O
现象:蔗糖变黑,黑色物质急剧膨胀,变成疏松多孔的海绵状,并放出有刺激性气味的气体。
[问题探讨]黑色物质急剧膨胀,变成疏松多孔的海绵状的原因是什么?
C + 2H2SO4 (浓) CO2↑ + 2SO2↑ + 2H2O
体现了浓硫酸的强氧化性,浓硫酸在加热的条件下能与某些非金属单质反应(C, S)。
如何正确理解吸水性、脱水性
吸水性 脱水性
原理 浓硫酸能吸收物质周围环境中的水分。 浓硫酸能将有机物中的氢、氧元素按水的组成比脱去。
区别 _______________ ________________________
____________________
应用 _________
物质中含有H2O,包括结晶水
作干燥剂
物质中不含有H2O,只含有氢元素和氧元素
有水则吸,无水则脱
浓硫酸能使蓝色胆矾变为白色,该过程体现了浓硫酸的脱水性还是吸水性
思考讨论
吸水性
③ 强氧化性:
a、常温下,浓硫酸能使较活泼金属(Al、Fe)
发生钝化。
冷的浓硫酸使金属表面形成一层致密的氧化膜,阻止内层金属被进一步腐蚀。
b、加热下,浓硫酸与较活泼金属(Al、Fe)反应。
常温下,浓硫酸可以用铁制或铝制容器来储存和运输。
c、常温下,浓硫酸与较不活泼金属(Cu)不反应,
需加热才能反应。
实验展示
【实验5-3】仔细观察实验现象并分析
实验现象
a、试管中铜丝____________________________
b、试管中的品红溶液逐渐变为________
c、试管中的紫色石蕊溶液逐渐变为________
逐渐溶解,有气泡产生
无色
红色
蓝色
d、将a试管里的溶液慢慢倒入水中,溶液变为_____
实验原理
Cu+2H2SO4 (浓) CuSO4+SO2↑+2H2O
答一答:
1、在上述反应中,硫酸表现出了_________和______。
2、若铜过量,硫酸能否完全反应 为什么
强氧化性
酸性
答:不能完全反应,
浓硫酸因反应消耗变成稀硫酸,反应停止。
d、浓硫酸与非金属单质反应,反应需要加热
C + 2H2SO4 (浓) CO2↑ + 2SO2↑ + 2H2O
e、浓硫酸与具有还原性的物质反应,如 H2S、HI、HBr、 FeCl2等。
还原产物一般是SO2
S + 2H2SO4(浓) ===
3SO2↑+ 2H2O
设计一个实验检验C和浓硫酸反应产生的气体成分
品红溶液褪色检验SO2的存在
KMnO4颜色变浅除去SO2气体
不褪色
检验SO2是否除尽
浑浊
检验CO2
白色变为蓝色检验H2O的存在
1、浓硫酸与稀硫酸的氧化性区别在哪里 以Fe为例分析金属与浓、稀硫酸反应的区别。
深度思考
浓硫酸的氧化性是+6价的硫元素体现的,而稀硫酸的氧化性
是H体现的。
与Fe反应的物质 表现氧化性的元素 氧化产物 还原产物 性质
浓硫酸 +6价的 S Fe3+ SO2 强氧化性
稀硫酸 +1价的 H Fe2+ H2 弱氧化性
浓度影响物质的性质
亲爱的水:
请允许我这样叫你,每当我遇见你,我就有一种沸腾的感觉,全身会放出大量的热。当我见不到你时,我甚至会在空气中寻找你的气息,就算你让我变成稀硫酸,我对你的心也不会改变,因为我是不挥发的,这点我比硝酸强,请你不要逃避。水,没有了你,虽然我也和铁,铝接触过,但我选择了拒绝,虽然别人认为我的脾气不好,他们说我欺负金属,欺负硫化氢和硫。
亲爱的水:
天地可以证明,我只要两个电子,但这是由+6价的中心硫原子决定的,我无法改变我的脾气,我从来不欺负我的小弟二氧化硫,尽管他比我更弱,但我像对待小弟弟一样对待他,还说我欺负氢氧化钠、碳酸钠,那是因为遇到它们,可以得到你!水,请你不要再逃避,就是逃到有机物中,我也会夺取氢氧重新合成你,你逃到天涯海角,我也会找到你,水,我可以对门捷列夫发誓,我会追随你一辈子!
愿和你在一起的:98.3%浓硫酸
1、下列关于浓硫酸的叙述正确的是 ( )
A. 浓硫酸具有吸水性,因而能使蔗糖炭化
B. 浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体
C. 浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
D. 浓硫酸在常温下能够使铁、铝等金属钝化
课堂练习
D
2、实验证明铜在低温下不能和氧气发生反应,也不能和稀硫酸共热发生反应,但工业上却是将废铜屑倒入热的稀硫酸中并不断地通入空气来制取硫酸铜溶液的。铜屑在此状态下发生的一系列化学反应的方程式为:
_________________________________________________
利用铜和浓硫酸在加热条件下也能制备硫酸铜溶液,其化学方程式为_______________________________________
以上两种方法哪种好 ____________,
原因是____________________________________________
________________________________________________。
2Cu + O2 2CuO
CuO + H2SO4 CuSO4 + H2O
Cu+2H2SO4 (浓) CuSO4+SO2↑+2H2O
第一种方法
① 制得相同质量的产品,第一种方法消耗的硫酸少
② 第二种方法生成 SO2 ,会造成大气污染
硫酸
一、工业制硫酸
二、化学性质
1、稀硫酸:属于二元强酸,具有酸的通性
2、浓硫酸:1) 吸水性: 2) 脱水性:
3) 强氧化性:
a、常温下使 Fe、Al 钝化
b、加热下与 Fe、Al 直接反应
c、加热下与 Cu 反应
d、加热下与 C 反应
e、与还原性物质反应
1、原料:
2、步骤:
课堂总结
第1节 硫及其化合物
第2课时 硫 酸
课程学习目标
认识硫酸在相关反应中体现的性质
3
掌握浓硫酸的吸水性、脱水性、强氧化性
2
了解硫酸的生产原理
1
导入
同学们还记得浓硫酸稀释的实验操作吗
1.高沸点——制取挥发性酸
2.吸水性——做干燥剂
3.脱水性——做催化剂
4.酸性——去金属表面的氧化物、制取硫酸盐、制造化肥
5.强氧化性——制炸药
硫酸——化学工业之母
新课展示
硫酸的工业制备
1、原料:硫黄或硫矿物(黄铁矿)
FeS2
2、反应原理
① 制备 SO2 :_______________________________;
② 制备 SO3 :_______________________________;
③ 吸收 SO3 :_______________________________。
4FeS2 + 11O2 2Fe2O3 + 8SO2
点燃
(或 )
S + O2 SO2
点燃
催化剂
2SO2 + O2 2SO3
SO3 + H2O H2SO4
吸收速率快
硫酸的性质
(1)纯硫酸是一种无色油状液体。
(2)沸点:338 ℃ (难挥性发酸),沸点高,难挥发。
密度:1.84 g / cm3 (比水大)
(3)溶解性:浓 H2SO4 与水以任意比互溶,
溶解时可放出大量的热。
1、物理性质
2、化学性质
1) 稀硫酸的化学性质
硫酸属于二元强酸,具有酸的通性。
① 稀硫酸发生完全电离:
H2SO4 = 2H+ + SO42-
② 酸的通性:
a、使酸碱指示剂显色; b、跟活泼金属反应;
c、跟碱性氧化物反应; d、跟碱起中和反应;
e、跟某些盐反应。
试一试:写出下列反应的化学方程式:
a、稀硫酸能使紫色石蕊试液变____ 色。
b、稀硫酸与活泼金属反应,如 Zn :____________________。
c、稀硫酸与金属氧化物反应,如 CuO :_______________________。
d、稀硫酸与碱反应,如 NaOH :__________________________。
e、稀硫酸与部分盐反应,如 Na2CO3 : ________________________。
红
2) 浓硫酸的化学性质
浓硫酸:主要以分子形式存在,所以具有稀硫酸不
具有的化学特性。
① 吸水性:浓硫酸能吸收物质周围环境中的水分,
常用做干燥剂。
可干燥
中性气体:H2、O2、N2、CO
酸性气体:CO2、SO2、SO3、NO2、HCl...
不能干燥:碱性气体:NH3 ,还原性气体:H2S、
HI、HBr等。
② 脱水性:浓硫酸能将有机物中的氢、氧元素
按水的组成比(2:1)脱去。
如:蔗糖脱水
C12H22O11 (蔗糖)
浓硫酸
12C + 11H2O
现象:蔗糖变黑,黑色物质急剧膨胀,变成疏松多孔的海绵状,并放出有刺激性气味的气体。
[问题探讨]黑色物质急剧膨胀,变成疏松多孔的海绵状的原因是什么?
C + 2H2SO4 (浓) CO2↑ + 2SO2↑ + 2H2O
体现了浓硫酸的强氧化性,浓硫酸在加热的条件下能与某些非金属单质反应(C, S)。
如何正确理解吸水性、脱水性
吸水性 脱水性
原理 浓硫酸能吸收物质周围环境中的水分。 浓硫酸能将有机物中的氢、氧元素按水的组成比脱去。
区别 _______________ ________________________
____________________
应用 _________
物质中含有H2O,包括结晶水
作干燥剂
物质中不含有H2O,只含有氢元素和氧元素
有水则吸,无水则脱
浓硫酸能使蓝色胆矾变为白色,该过程体现了浓硫酸的脱水性还是吸水性
思考讨论
吸水性
③ 强氧化性:
a、常温下,浓硫酸能使较活泼金属(Al、Fe)
发生钝化。
冷的浓硫酸使金属表面形成一层致密的氧化膜,阻止内层金属被进一步腐蚀。
b、加热下,浓硫酸与较活泼金属(Al、Fe)反应。
常温下,浓硫酸可以用铁制或铝制容器来储存和运输。
c、常温下,浓硫酸与较不活泼金属(Cu)不反应,
需加热才能反应。
实验展示
【实验5-3】仔细观察实验现象并分析
实验现象
a、试管中铜丝____________________________
b、试管中的品红溶液逐渐变为________
c、试管中的紫色石蕊溶液逐渐变为________
逐渐溶解,有气泡产生
无色
红色
蓝色
d、将a试管里的溶液慢慢倒入水中,溶液变为_____
实验原理
Cu+2H2SO4 (浓) CuSO4+SO2↑+2H2O
答一答:
1、在上述反应中,硫酸表现出了_________和______。
2、若铜过量,硫酸能否完全反应 为什么
强氧化性
酸性
答:不能完全反应,
浓硫酸因反应消耗变成稀硫酸,反应停止。
d、浓硫酸与非金属单质反应,反应需要加热
C + 2H2SO4 (浓) CO2↑ + 2SO2↑ + 2H2O
e、浓硫酸与具有还原性的物质反应,如 H2S、HI、HBr、 FeCl2等。
还原产物一般是SO2
S + 2H2SO4(浓) ===
3SO2↑+ 2H2O
设计一个实验检验C和浓硫酸反应产生的气体成分
品红溶液褪色检验SO2的存在
KMnO4颜色变浅除去SO2气体
不褪色
检验SO2是否除尽
浑浊
检验CO2
白色变为蓝色检验H2O的存在
1、浓硫酸与稀硫酸的氧化性区别在哪里 以Fe为例分析金属与浓、稀硫酸反应的区别。
深度思考
浓硫酸的氧化性是+6价的硫元素体现的,而稀硫酸的氧化性
是H体现的。
与Fe反应的物质 表现氧化性的元素 氧化产物 还原产物 性质
浓硫酸 +6价的 S Fe3+ SO2 强氧化性
稀硫酸 +1价的 H Fe2+ H2 弱氧化性
浓度影响物质的性质
亲爱的水:
请允许我这样叫你,每当我遇见你,我就有一种沸腾的感觉,全身会放出大量的热。当我见不到你时,我甚至会在空气中寻找你的气息,就算你让我变成稀硫酸,我对你的心也不会改变,因为我是不挥发的,这点我比硝酸强,请你不要逃避。水,没有了你,虽然我也和铁,铝接触过,但我选择了拒绝,虽然别人认为我的脾气不好,他们说我欺负金属,欺负硫化氢和硫。
亲爱的水:
天地可以证明,我只要两个电子,但这是由+6价的中心硫原子决定的,我无法改变我的脾气,我从来不欺负我的小弟二氧化硫,尽管他比我更弱,但我像对待小弟弟一样对待他,还说我欺负氢氧化钠、碳酸钠,那是因为遇到它们,可以得到你!水,请你不要再逃避,就是逃到有机物中,我也会夺取氢氧重新合成你,你逃到天涯海角,我也会找到你,水,我可以对门捷列夫发誓,我会追随你一辈子!
愿和你在一起的:98.3%浓硫酸
1、下列关于浓硫酸的叙述正确的是 ( )
A. 浓硫酸具有吸水性,因而能使蔗糖炭化
B. 浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体
C. 浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
D. 浓硫酸在常温下能够使铁、铝等金属钝化
课堂练习
D
2、实验证明铜在低温下不能和氧气发生反应,也不能和稀硫酸共热发生反应,但工业上却是将废铜屑倒入热的稀硫酸中并不断地通入空气来制取硫酸铜溶液的。铜屑在此状态下发生的一系列化学反应的方程式为:
_________________________________________________
利用铜和浓硫酸在加热条件下也能制备硫酸铜溶液,其化学方程式为_______________________________________
以上两种方法哪种好 ____________,
原因是____________________________________________
________________________________________________。
2Cu + O2 2CuO
CuO + H2SO4 CuSO4 + H2O
Cu+2H2SO4 (浓) CuSO4+SO2↑+2H2O
第一种方法
① 制得相同质量的产品,第一种方法消耗的硫酸少
② 第二种方法生成 SO2 ,会造成大气污染
硫酸
一、工业制硫酸
二、化学性质
1、稀硫酸:属于二元强酸,具有酸的通性
2、浓硫酸:1) 吸水性: 2) 脱水性:
3) 强氧化性:
a、常温下使 Fe、Al 钝化
b、加热下与 Fe、Al 直接反应
c、加热下与 Cu 反应
d、加热下与 C 反应
e、与还原性物质反应
1、原料:
2、步骤:
课堂总结
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
