专题8 第二单元 第1课时 乙醇 课件(共89张PPT)
文档属性
| 名称 | 专题8 第二单元 第1课时 乙醇 课件(共89张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-10 21:22:53 | ||
图片预览











文档简介
(共89张PPT)
第1课时
DIYIKESHI
乙醇的物理性质及分子结构 / 乙醇的化学性质及用途 / 随堂演练 知识落实 / 课时对点练
乙醇
专题8
1.知道乙醇的组成、结构、物理性质及用途,培养宏观辨识与微观探析的能力。
2.了解烃的衍生物的概念及官能团与性质的关系,知道有机物之间在一定条件下是可以转化的,培养变化观念与平衡思想。
3.会运用乙醇的结构分析其性质,能设计实验探究乙醇的结构及性质,培养科学探究精神。
核心素养
发展目标
内容索引
一、乙醇的物理性质及分子结构
二、乙醇的化学性质及用途
随堂演练 知识落实
课时对点练
乙醇的物理性质及分子结构
一
1.乙醇
乙醇是由 三种元素组成的有机化合物,乙醇可以与水任意比例互溶,酒类饮料中含有浓度不等的乙醇,医疗上常用体积分数为
的乙醇溶液进行消毒。
碳、氢、氧
75%
特别提醒 常用无水CuSO4检验乙醇中是否有水,常用先加生石灰再蒸馏的方法提纯乙醇。
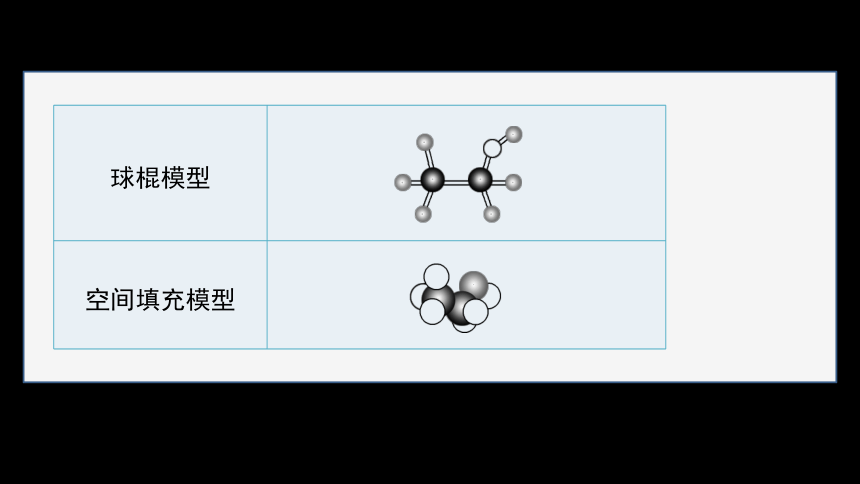
2.乙醇的组成与结构
分子式 C2H6O
结构式
结构简式 或_________
CH3CH2OH
C2H5OH
球棍模型
空间填充模型
特别提醒 乙醇分子中含有羟基(—OH),可以看成乙烷分子中的1个氢原子被羟基取代后的产物。有机化合物分子失去一个原子或原子团剩余的部分被称为基团,如乙醇可看作乙基和羟基组成。
正误判断
(1)乙醇是一种优良的有机溶剂,能溶解很多有机物和无机物( )
(2)乙烷(CH3CH3)可以看成CH4分子中的一个H原子被甲基(—CH3)所取代而生成的产物,故乙烷为烃的衍生物( )
(3)乙醇可以看作乙烷分子中氢原子被氢氧根(OH-)取代后的产物,故乙醇水溶液应呈碱性( )
(4)为提高消毒效果,医疗上可选择体积分数为95%的乙醇溶液进行消毒
( )
√
×
×
×
1.如何只用一种试剂鉴别乙醇、苯和四氯化碳?
深度思考
提示 分别取少许三种液体于三支试管中,分别加入适量的水,液体不分层的是乙醇,液体分层且水在上层的是四氯化碳,液体分层且水在下层的是苯。
2.如何检验乙醇中是否有水?怎样除去乙醇中的水?
深度思考
提示 向乙醇中加入无水CuSO4粉末,若有蓝色物质生成,说明乙醇中含有水分;若无蓝色物质生成,说明乙醇中没有水分。除去乙醇中的水需要先加入生石灰吸水,再蒸馏。
应用体验
1.下列有关乙醇的物理性质的应用中不正确的是
A.由于乙醇的密度比水小,所以乙醇中的水可以通过分液的方法除去
B.由于乙醇能够溶解很多有机物和无机物,所以可用乙醇提取中草药的
有效成分
C.由于乙醇能够以任意比溶于水,所以酒厂可以勾兑各种浓度的酒
D.由于乙醇易挥发,所以才有“酒香不怕巷子深”的说法
√
乙醇和水互溶,所以乙醇中的水不能通过分液的方法除去,而是先加入新制的生石灰,然后通过蒸馏法除去。
2.比较乙烷和乙醇的分子结构,下列说法错误的是
A.两个碳原子均以单键相连
B.分子里都含6个相同的氢原子
C.乙基与一个氢原子相连就是乙烷分子
D.乙基与一个羟基相连就是乙醇分子
√
乙烷和乙醇的结构简式分别为CH3CH3、CH3CH2OH,乙醇分子可以看作乙基与一个羟基相连的产物;乙醇分子的六个氢原子中,其中5个分别连接在两个碳原子上,1个连接在氧原子上,6个氢原子并不是完全相同的,B项错误。
返回
乙醇的化学性质及用途
二
1.乙醇的化学性质
(1)乙醇与金属钠的反应——置换反应
①基础实验
实验操作
实验现象 a.钠开始沉于试管底部,最终慢慢消失,产生_________
气体;
b.试管内壁有 产生;
c.向试管中加入澄清石灰水,石灰水_________
实验结论 乙醇与钠反应生成 ,化学方程式为_____________
___________________________
无色无味
水珠
不变浑浊
氢气
2CH3CH2OH
+2Na―→2CH3CH2ONa+H2↑
②反应实质
金属钠可以保存在煤油(多种烃的混合物)中,实验表明烷烃分子中
氢不能被金属钠置换,而乙醇分子中_______________
氢原子能被金属钠置换生成 气,但反应比钠与水要缓慢得多。
由结构决定性质可得,乙基对羟基的影响使得羟基氢的活性降低。
与碳原子相连的
羟基(—OH)上的
氢
(2)氧化反应
①乙醇的催化氧化
实验操作
实验现象
红色的铜丝 变为 变为 ,闻到
气味
黑色
红色
特殊
实验结论
乙醇被氧化为乙醛,化学方程式为_______________________
________________
2CH3CHO+2H2O
特别提醒 乙醇的催化氧化反应原理从结构上看,断开羟基上的氢氧键和与羟基相连的碳原子上的碳氢键,形成碳氧双键:
。
②乙醇还可以发生以下氧化反应
a.乙醇的燃烧
乙醇作为酒精灯的燃料,在空气中燃烧时,火焰呈 ,放出大量
的热,化学方程式为 。
b.被强氧化剂氧化
淡蓝色
2.官能团
对有机物的性质起着 作用的基团叫作官能团。
物质 CH3CH2OH CH3CHO CH2==CH2 CH≡CH CH3Cl
所含官能团 ______ —CHO —C≡C—
官能团的名称 羟基 _____ _________ _________ 碳氯键
—OH
醛基
碳碳双键
碳碳三键
决定性
3.乙醇的用途
(1)用作酒精灯、火锅、内燃机等的燃料。
(2)用作生产医药、香料、化妆品、涂料等的化工原料。
(3)医疗上常用体积分数为 的乙醇溶液作消毒剂。
4.乙醛
乙醛中所含官能团为醛基( ,可简写为 ),乙醛在适当条件下可进一步被氧气氧化,生成乙酸(CH3COOH),化学方程式为
。
—CHO
75%
(1)乙醇、水与钠反应的现象一样,钠都浮在液面上( )
(2)乙醇分子中羟基上的氢原子不如水中的氢原子活泼( )
正误判断
×
√
(3)乙醇的分子式为C2H6O,故1 mol乙醇和足量的钠反应,可生成3 mol
氢气( )
正误判断
×
解析 乙醇分子中只有羟基上的氢原子才能和钠反应,故1 mol乙醇与足量的钠反应只生成0.5 mol氢气。
(4)乙醇能使酸性高锰酸钾溶液褪色( )
(5)乙醇的官能团为羟基,其电子式为 ( )
(6)乙醇能电离出H+,所以乙醇是电解质,能与NaOH溶液反应( )
(7)羟基和氢氧根离子具有相同的化学式和电子式( )
正误判断
√
×
×
×
1.焊接铜器时,表面会生成黑色的氧化膜,铜匠说可以先把铜放在火上烧热,再立刻蘸一下酒精,铜会光亮如初。这一过程中发生了哪些反应?铜在反应中起到了什么作用?
深度思考
2. 能否催化氧化生成醛?
深度思考
提示 不能。该醇中羟基所连的碳原子上只有一个氢原子,不能催化氧化生成醛。
深度思考
3.乙醇的官能团为羟基,羟基(—OH)和OH-有哪些区别和联系?请把下列表格补充完整。
名称 氢氧根离子(OH-) 羟基(—OH)
电子式
电性 _______________ _______
稳定性 _____ _______
(10电子)
(9电子)
带负电的阴离子
电中性
稳定
不稳定
存在 存在于溶液或离子化合物中 存在,必须和其他基团或原子结合在一起
相同点 组成元素相同
深度思考
能独立
不能独立
应用体验
1.丙烯醇(CH2==CH—CH2OH)可发生的化学反应有
①加成反应 ②氧化反应 ③燃烧 ④与钠反应
A.①②③ B.②③④
C.①②③④ D.①③④
√
丙烯醇中含有碳碳双键和羟基两种官能团,碳碳双键可发生①②③,羟基可发生②③④,而丙烯醇兼有两者的性质,故C项正确。
2.现有甲、乙两种有机物,它们的结构简式分别为CH2==CHCH2CH2OH、
。
(1)乙的分子式为________。
(2)甲和乙中都含有的官能团为_______________,下列关于甲和乙两种有机物的叙述不正确的是_____(填字母)。
a.都能与金属钠反应放出氢气
b.都能在催化剂作用下与H2反应
c.都能与NaOH溶液反应
d.甲能被催化氧化生成含—CHO的有机物
e.甲和乙与HBr、溴水发生加成反应,产物都只有一种
C6H10O
碳碳双键和羟基
ce
甲和乙中都含有碳碳双键和—OH,所以甲和乙既有与乙烯相似的化学性质,又有与乙醇相似的化学性质。甲与乙醇相似,能被催化氧化为CH2==CHCH2CHO,甲和乙与Br2反应产物都只有一种,与HBr发生加成反应的产物都有两种。
归纳总结
(1)乙醇反应时化学键的断裂
化学反应 键的断裂
与钠反应 ①
燃烧 ①②③④⑤
催化氧化 ①③
归纳总结
(2)醇的催化氧化反应规律(R、R′、R″代表烃基)
①凡有R—CH2OH结构的醇,在一定条件下都能被氧化成醛(R—CHO)。
②凡有R—CH(OH)—R′结构的醇,在一定条件下也能被氧化,
但生成物不是醛,而是酮( )。
③凡有 结构的醇通常情况下不能被氧化。
返回
随堂演练 知识落实
1.下列有关乙醇的表述正确的是
A.乙醇分子中含有甲基,甲基的电子式为
B.乙醇的结构简式为C2H6O
C.乙醇分子中羟基的电子式为
D.乙醇分子的空间填充模型为
√
1
2
3
4
5
1
2
3
4
5
甲基的电子式为 ,A项错误;
乙醇的结构简式为CH3CH2OH或C2H5OH,B项错误;
羟基的电子式为 ,为中性基团,C项错误。
2.下列有关乙醇的说法错误的是
A.钠的密度大于乙醇,实验室可用乙醇保存金属钠
B.可用无水CuSO4检验工业酒精中是否含水
C.乙醇不能萃取出溴水中的溴
D.分离乙醇和水常用蒸馏的方法
√
1
2
3
4
5
1
2
3
4
钠可以和乙醇发生反应生成乙醇钠和氢气,故不能用乙醇保存金属钠,A错误;
无水CuSO4可以和水反应生成蓝色晶体,故用无水CuSO4可检验工业酒精中是否含水,B正确;
乙醇和水互溶,故乙醇不能萃取溴水中的溴,C正确;
乙醇和水的沸点不同,故可以用蒸馏的方法分离乙醇和水,D正确。
5
1
2
3
4
3.(2022·石家庄高一月考)下列说法正确的是
A.乙醇分子中有—OH基团,所以乙醇溶于水后溶液显碱性
B.乙醇与钠反应可以产生氢气,所以乙醇溶于水后溶液显酸性
C.乙醇在空气中燃烧生成二氧化碳和水,说明乙醇分子中含有C、H、
O三种元素
D.乙醇羟基中的氢原子比乙烷中的氢原子活泼
√
5
1
2
3
4
5
乙醇是非电解质,溶于水后不发生电离,因此乙醇溶液不显碱性或酸性,A、B错误;
物质燃烧生成二氧化碳和水,只能说明该物质中含有C、H元素,C错误;
根据乙醇能与Na反应,乙烷与Na不反应这一事实说明乙醇羟基中的氢原子比乙烷中的氢原子活泼,D正确。
1
2
3
4
4.乙醇分子中的各化学键如图所示,下列关于乙醇分子在各种反应中断裂键的说法不正确的是
A.和金属钠反应时键①断裂
B.在铜催化共热下与O2反应时断裂①和③
C.在空气中完全燃烧时断裂①②③④⑤
D.乙醇是电解质,在水中键①断裂电离出氢离子
√
5
1
2
3
4
5
乙醇与钠反应生成乙醇钠,是羟基中的O—H键断裂,A项正确;
乙醇催化氧化生成乙醛时,断裂①和③化学键,B项正确;
乙醇完全燃烧时,化学键①②③④⑤全部断裂,C项正确;
乙醇是非电解质,在水中键①不断裂,不能电离出氢离子。
5.(2022·昆明高一检测)某课外活动小组的同学为了提高制取乙醛时的乙醇转化率,利用如图所示的装置进行乙醇的催化氧化实验制取乙醛,图中铁架台等装置已略去,粗黑线表示乳胶管。
1
2
3
4
5
(1)该实验常对试管甲采取的加热方式是_________,其目的是_________
___________。
水浴加热
加快乙醇
汽化的速率
1
2
3
4
5
试管甲中盛放的为乙醇溶液,乙醇沸点较低,为加快乙醇汽化的速率,实验时常对试管甲采取水浴加热(70~80 ℃)。
1
2
3
4
5
(2)实验时,先加热玻璃管乙中的铜丝,约1分钟后鼓入空气,此时铜丝立即呈红热状态。若把酒精灯撤走,控制一定的鼓气速率,铜丝能长时间保持红热直到实验结束。
①铜丝能长时间保持红热的原因是__________________________;
乙醇的催化氧化是放热反应
乙醇发生催化氧化生成乙醛和水,该反应放热,所以若把酒精灯撤走,控制一定的鼓气速率,铜丝能长时间保持红热直到实验结束。
1
2
3
4
5
②控制鼓气速率的方法是_______________________________。
控制甲装置中单位时间内的气泡数
通过控制甲装置中单位时间内的气泡数控制鼓气速率。
1
2
3
4
5
(3)实验产物除用水吸收外,还可采用的收集方法是________________
_____________。
将试管丁直接浸
常温下,乙醛为液体,将试管丁直接浸在冰水中冷却,可收集乙醛。
在冰水中冷却
返回
课时对点练
题组一 乙醇的物理性质及用途
1.《本草纲目》“烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上……其清如水,味极浓烈,盖酒露也。”这里所用的“法”是指
A.过滤 B.蒸馏
C.分液 D.升华
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
由题给文字可知,文中的“法”是指我国古代制烧酒的方法,从浓酒中分离出乙醇,利用酒精和水的沸点不同,加热使乙醇挥发,冷凝得烧酒,故选B。
2.下列说法正确的是
①检测乙醇中是否含有水可加入少量的无水硫酸铜,若变蓝则含水 ②除去乙醇中微量的水可加入金属钠,使其完全反应 ③获得无水乙醇的方法是直接加热蒸馏 ④获得无水乙醇的方法通常是先用生石灰吸水,再加热蒸馏
A.①③ B.②④
C.①④ D.③④
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
用无水CuSO4可检验乙醇中是否有水存在,因为无水CuSO4遇水变蓝,故①正确;
乙醇和水均与金属钠反应生成H2,故②错误;
将含水的乙醇直接加热蒸馏,乙醇也会蒸出,所得乙醇不纯,故③错误、④正确。
题组二 乙醇的结构
3.有机物Ⅰ和Ⅱ的结构式如下,下列说法不正确的是
A.Ⅰ和Ⅱ互为同分异构体
B.Ⅰ和Ⅱ物理性质有所不同
C.Ⅰ和Ⅱ化学性质相同
D.Ⅰ和Ⅱ所含C元素的质量分数相同
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
Ⅰ为乙醇,Ⅱ为二甲醚,二者结构不同,分子式都为C2H6O,互为同分异构体,因为官能团不同,化学性质不相同,故C错误。
4.可以证明乙醇分子中有一个氢原子与另外的氢原子不同的方法是
A.1 mol乙醇燃烧生成3 mol水
B.乙醇可以制饮料
C.1 mol乙醇跟足量的Na反应制得0.5 mol H2
D.1 mol乙醇燃烧生成2 mol CO2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
若乙醇中的氢原子是相同的,则1 mol乙醇和金属钠反应,可以生成3 mol氢气,但实际上只能得到0.5 mol氢气,所以选项C是正确的。
5.下列有机物和乙醇具有相同官能团的是
A.苯乙烯( )
B.丙三醇( )
C.丙酮( )
D.乙醚(CH3CH2—O—CH2CH3)
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
苯乙烯含有 ,官能团和乙醇不同;
丙三醇含有—OH,官能团和乙醇相同;
丙酮含有 ,官能团和乙醇不同;
乙醚含有 ,官能团和乙醇不同,故选B。
题组三 乙醇的化学性质及相关应用
6.(2022·武汉高一月考)如图是某有机物分子的空间填充模型,黑色的是碳原子,白色的是氢原子,灰色的是氧原子。则该物质不具有的性质是
A.使紫色石蕊试液变红
B.与钠反应
C.与水互溶
D.发生氧化反应
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
根据该有机物分子的空间填充模型,黑色的是碳原子,白色的是氢原子,灰色的是氧原子,该物质是乙醇。乙醇是非电解质,不能使紫色石蕊试液变红,故A错误;
乙醇与钠反应生成乙醇钠和氢气,故B正确;
乙醇与水能以任意比例互溶,故C正确;
乙醇在铜作催化剂并加热条件下发生氧化反应生成乙醛和水,故D正确。
7.按下图装置,持续通入X气体,可看到a处有红色物质生成,b处变蓝,c处得到液体,X气体可能是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
A.H2 B.CO和H2
C.NH3 D.CH3CH2OH(g)
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
四个选项中的气体或蒸气都可还原CuO,且均有H2O产生,故都可满足a、b处的现象。但要在c处得到液体,只有D符合:CH3CH2OH+CuO
CH3CHO+H2O+Cu。
8.(2022·广州高一检测)某有机物6 g与足量Na反应,生成0.05 mol H2,该有机物可能是
A.CH3CH2OH B.CH3CHOHCH3
C.CH3OH D.CH3OCH2CH3
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
有机物能与Na反应放出H2,排除D;
6 g有机物提供0.1 mol羟基H原子,则一元醇的相对分子质量应为60,故选B。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
9.酒后驾车是引发交通事故的重要原因之一。交警对驾驶员进行呼气酒精检测的原理是橙色的酸性K2Cr2O7溶液遇乙醇迅速生成灰绿色的Cr3+。下列对乙醇的描述与此测定原理有关的是
①乙醇的沸点低 ②乙醇的密度比水的小 ③乙醇有还原性 ④乙醇的组成中含有氧元素
A.②④ B.②③
C.①③ D.①④
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
①乙醇的沸点低,易挥发,若饮酒,呼出的气体中含有乙醇,与测定原理有关;
②乙醇的密度比水的小,与测定原理无关;
③酸性K2Cr2O7遇乙醇迅速生成灰绿色的Cr3+,Cr元素的化合价由+6降为+3,K2Cr2O7被还原,则乙醇具有还原性,与测定原理有关;
④乙醇的组成中含有氧元素,与测定原理无关。
10.将质量为m g的铜丝燃烧变黑,立即放入下列物质中,能使铜丝变红,且质量仍为m g的是
A.盐酸 B.酒精
C.稀硫酸 D.二氧化碳
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
铜丝燃烧生成黑色的CuO,如遇稀硫酸和盐酸,发生反应CuO+2H+===Cu2++H2O,使质量减少,遇酒精又生成Cu单质,质量不变。
11.香叶醇是合成玫瑰香油的主要原料,其键线式如图所示。下列有关香叶醇的叙述正确的是
A.香叶醇的分子式为C10H18O
B.不能使溴的四氯化碳溶液褪色
C.不能使酸性高锰酸钾溶液褪色
D.能发生加成反应不能发生取代反应
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
A项,由香叶醇的结构简式可得分子式为C10H18O;
B项,分子中含有碳碳双键,能与溴发生加成反应,从而使溴的CCl4溶液褪色;
C项,分子中含有碳碳双键,能被酸性高锰酸钾溶液氧化,使酸性高锰酸钾溶液紫红色褪去;
D项,分子中碳碳双键可发生加成反应,醇羟基可发生取代反应。
12.(2022·杭州高一月考)某有机物的结构如图所示,这种有机物不可能具有的性质是
①可以燃烧 ②能使酸性KMnO4溶液褪色 ③能跟NaOH溶液反应 ④能发生氧化反应 ⑤能发生加成反应 ⑥在银作催化剂共热的条件下,能发生催化氧化反应
A.①④ B.只有⑥
C.只有③ D.②⑤
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
该分子只有“ ”和羟基,不能与NaOH溶液反应,③错误。
13.A、B、C三种醇与足量的金属钠反应,在相同条件下产生相同体积的氢气,消耗这三种醇的物质的量之比为3∶6∶2,则A、B、C三种醇分子中羟基数目之比是
A.3∶2∶1 B.2∶6∶3
C.3∶6∶2 D.2∶1∶3
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
由题意可知,三种醇消耗的羟基总数相等,设A、B、C三种醇分子中的羟基数分别为x、y、z,则3x=6y=2z,解得x∶y∶z=2∶1∶3。
14.肉桂醇,白色针状或块状结晶,有温和、持久而舒适的香气,可用作定香剂和除臭剂,其结构简式为 。下列有关肉桂醇的叙述正确的是
A.肉桂醇的摩尔质量为134 g
B.肉桂醇能使酸性KMnO4溶液褪色
C.肉桂醇能与溴水发生取代反应
D.1 mol肉桂醇完全燃烧消耗11.5 mol O2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
摩尔质量的单位为g·mol-1,A错误;
分子中含有碳碳双键和羟基,能被酸性KMnO4溶液氧化,B正确;
分子中含有碳碳双键,能与溴水发生加成反应,C错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
15.(2022·沈阳高一阶段练习)“对酒当歌,人生几何”“劝君更尽一杯酒,西出阳关无故人”“何以解忧,唯有杜康”等有关于酒的中国古诗词比比皆是,在历史长河中酒不仅是一种具体的物质,而且成了一种文化的象征。酒的主要成分是一种常见的有机物乙醇。
(1)乙醇是无色有特殊香味的液体,密度比水的_____。
小
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(2)工业上用乙烯与水反应可制得乙醇,该反应的化学方程式为
______________________________(不写反应条件)。
CH2==CH2+H2O―→CH3CH2OH
工业上用乙烯与水反应可制得乙醇,该反应的化学方程式为CH2==CH2+H2O―→CH3CH2OH。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(3)与乙醇互为同分异构体的是______(填字母)。
A.
B.
C.甲醇
D.CH3—O—CH3
E.HO—CH2CH2—OH
D
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
分子式相同而结构不同的化合物互为同分异构体。CH3—O—CH3和乙醇的分子式相同,均为C2H6O,但二者结构不同,所以该有机物与乙醇互为同分异构体,故D符合题意。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(4)乙醇能够发生氧化反应:
①46 g乙醇完全燃烧消耗_____mol氧气。
3
乙醇燃烧的化学方程式为CH3CH2OH+3O2 2CO2+3H2O,46 g乙醇的物质的量为1 mol,则46 g乙醇完全燃烧消耗3 mol氧气。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
②乙醇在铜作催化剂并加热的条件下可被氧气氧化为乙醛,反应的化学
方程式为_____________________________________。
乙醇在铜作催化剂并加热的条件下可被氧气氧化为乙醛,反应的化学方程式为2CH3CH2OH+O2 2CH3CHO+2H2O。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(5)乙醇和金属钠缓慢的反应,放出无色无味的气体,反应的方程式为______________________________________。
2CH3CH2OH+2Na―→2CH3CH2ONa+H2↑
乙醇和金属钠缓慢的反应,放出无色无味的气体,反应的化学方程式为2CH3CH2OH+2Na―→2CH3CH2ONa+H2↑。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
16.某实验小组用下列装置进行乙醇催化氧化的实验。已知:乙醛可被氧化为乙酸。
(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学
方程式:___________________、_______________________________
___________。
+Cu+H2O
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
乙醇的催化氧化反应实质是金属铜被氧气氧化为氧化铜,化学方程式为2Cu+O2 2CuO,氧化铜将乙醇氧化为乙醛,化学方程式为CH3CH2OH
+CuO CH3CHO+Cu+H2O。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(2)在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明乙醇催化氧化反应是______反应。进一步研究表明,鼓入空气的速率与反应体系温度的关系曲线如图所示。试解释出现图中现象的原因:_________________________________。
放热
空气流速过快,将体系中的热量带走
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
熄灭酒精灯,反应仍能继续进行,说明乙醇催化氧化反应是放热反应;根据图示曲线,反应放出热量的多少和乙醇以及氧气的量有关,鼓气速率较小时反应体系的温度随鼓气速率增大而升高,但是鼓气
速率过大时,过量的空气会将体系中的热量带走,所以空气流速过快时反应体系温度降低。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(3)甲和乙两个水浴作用不相同。甲的作用是______________________;乙的作用是____________________。
加热乙醇,使乙醇汽化
冷却,便于收集乙醛
甲和乙两个水浴作用不相同,甲是热水浴,作用是使乙醇汽化成乙醇蒸气,乙是冷水浴,目的是将乙醛冷凝,便于乙醛的收集。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(4)若试管a中收集的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有______。要除去该物质,可在混合液中加入_____(填字母),然后再进行_______(填实验操作名称)。
A.氯化钠溶液 B.苯
C.碳酸氢钠溶液 D.四氯化碳
乙酸
C
蒸馏
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有乙酸。碳酸氢钠溶液可以和乙酸反应,生成乙酸钠、水和二氧化碳;乙酸钠沸点较高,可用蒸馏法分离出乙醛。
返回
本课结束
专题8
第1课时
DIYIKESHI
乙醇的物理性质及分子结构 / 乙醇的化学性质及用途 / 随堂演练 知识落实 / 课时对点练
乙醇
专题8
1.知道乙醇的组成、结构、物理性质及用途,培养宏观辨识与微观探析的能力。
2.了解烃的衍生物的概念及官能团与性质的关系,知道有机物之间在一定条件下是可以转化的,培养变化观念与平衡思想。
3.会运用乙醇的结构分析其性质,能设计实验探究乙醇的结构及性质,培养科学探究精神。
核心素养
发展目标
内容索引
一、乙醇的物理性质及分子结构
二、乙醇的化学性质及用途
随堂演练 知识落实
课时对点练
乙醇的物理性质及分子结构
一
1.乙醇
乙醇是由 三种元素组成的有机化合物,乙醇可以与水任意比例互溶,酒类饮料中含有浓度不等的乙醇,医疗上常用体积分数为
的乙醇溶液进行消毒。
碳、氢、氧
75%
特别提醒 常用无水CuSO4检验乙醇中是否有水,常用先加生石灰再蒸馏的方法提纯乙醇。
2.乙醇的组成与结构
分子式 C2H6O
结构式
结构简式 或_________
CH3CH2OH
C2H5OH
球棍模型
空间填充模型
特别提醒 乙醇分子中含有羟基(—OH),可以看成乙烷分子中的1个氢原子被羟基取代后的产物。有机化合物分子失去一个原子或原子团剩余的部分被称为基团,如乙醇可看作乙基和羟基组成。
正误判断
(1)乙醇是一种优良的有机溶剂,能溶解很多有机物和无机物( )
(2)乙烷(CH3CH3)可以看成CH4分子中的一个H原子被甲基(—CH3)所取代而生成的产物,故乙烷为烃的衍生物( )
(3)乙醇可以看作乙烷分子中氢原子被氢氧根(OH-)取代后的产物,故乙醇水溶液应呈碱性( )
(4)为提高消毒效果,医疗上可选择体积分数为95%的乙醇溶液进行消毒
( )
√
×
×
×
1.如何只用一种试剂鉴别乙醇、苯和四氯化碳?
深度思考
提示 分别取少许三种液体于三支试管中,分别加入适量的水,液体不分层的是乙醇,液体分层且水在上层的是四氯化碳,液体分层且水在下层的是苯。
2.如何检验乙醇中是否有水?怎样除去乙醇中的水?
深度思考
提示 向乙醇中加入无水CuSO4粉末,若有蓝色物质生成,说明乙醇中含有水分;若无蓝色物质生成,说明乙醇中没有水分。除去乙醇中的水需要先加入生石灰吸水,再蒸馏。
应用体验
1.下列有关乙醇的物理性质的应用中不正确的是
A.由于乙醇的密度比水小,所以乙醇中的水可以通过分液的方法除去
B.由于乙醇能够溶解很多有机物和无机物,所以可用乙醇提取中草药的
有效成分
C.由于乙醇能够以任意比溶于水,所以酒厂可以勾兑各种浓度的酒
D.由于乙醇易挥发,所以才有“酒香不怕巷子深”的说法
√
乙醇和水互溶,所以乙醇中的水不能通过分液的方法除去,而是先加入新制的生石灰,然后通过蒸馏法除去。
2.比较乙烷和乙醇的分子结构,下列说法错误的是
A.两个碳原子均以单键相连
B.分子里都含6个相同的氢原子
C.乙基与一个氢原子相连就是乙烷分子
D.乙基与一个羟基相连就是乙醇分子
√
乙烷和乙醇的结构简式分别为CH3CH3、CH3CH2OH,乙醇分子可以看作乙基与一个羟基相连的产物;乙醇分子的六个氢原子中,其中5个分别连接在两个碳原子上,1个连接在氧原子上,6个氢原子并不是完全相同的,B项错误。
返回
乙醇的化学性质及用途
二
1.乙醇的化学性质
(1)乙醇与金属钠的反应——置换反应
①基础实验
实验操作
实验现象 a.钠开始沉于试管底部,最终慢慢消失,产生_________
气体;
b.试管内壁有 产生;
c.向试管中加入澄清石灰水,石灰水_________
实验结论 乙醇与钠反应生成 ,化学方程式为_____________
___________________________
无色无味
水珠
不变浑浊
氢气
2CH3CH2OH
+2Na―→2CH3CH2ONa+H2↑
②反应实质
金属钠可以保存在煤油(多种烃的混合物)中,实验表明烷烃分子中
氢不能被金属钠置换,而乙醇分子中_______________
氢原子能被金属钠置换生成 气,但反应比钠与水要缓慢得多。
由结构决定性质可得,乙基对羟基的影响使得羟基氢的活性降低。
与碳原子相连的
羟基(—OH)上的
氢
(2)氧化反应
①乙醇的催化氧化
实验操作
实验现象
红色的铜丝 变为 变为 ,闻到
气味
黑色
红色
特殊
实验结论
乙醇被氧化为乙醛,化学方程式为_______________________
________________
2CH3CHO+2H2O
特别提醒 乙醇的催化氧化反应原理从结构上看,断开羟基上的氢氧键和与羟基相连的碳原子上的碳氢键,形成碳氧双键:
。
②乙醇还可以发生以下氧化反应
a.乙醇的燃烧
乙醇作为酒精灯的燃料,在空气中燃烧时,火焰呈 ,放出大量
的热,化学方程式为 。
b.被强氧化剂氧化
淡蓝色
2.官能团
对有机物的性质起着 作用的基团叫作官能团。
物质 CH3CH2OH CH3CHO CH2==CH2 CH≡CH CH3Cl
所含官能团 ______ —CHO —C≡C—
官能团的名称 羟基 _____ _________ _________ 碳氯键
—OH
醛基
碳碳双键
碳碳三键
决定性
3.乙醇的用途
(1)用作酒精灯、火锅、内燃机等的燃料。
(2)用作生产医药、香料、化妆品、涂料等的化工原料。
(3)医疗上常用体积分数为 的乙醇溶液作消毒剂。
4.乙醛
乙醛中所含官能团为醛基( ,可简写为 ),乙醛在适当条件下可进一步被氧气氧化,生成乙酸(CH3COOH),化学方程式为
。
—CHO
75%
(1)乙醇、水与钠反应的现象一样,钠都浮在液面上( )
(2)乙醇分子中羟基上的氢原子不如水中的氢原子活泼( )
正误判断
×
√
(3)乙醇的分子式为C2H6O,故1 mol乙醇和足量的钠反应,可生成3 mol
氢气( )
正误判断
×
解析 乙醇分子中只有羟基上的氢原子才能和钠反应,故1 mol乙醇与足量的钠反应只生成0.5 mol氢气。
(4)乙醇能使酸性高锰酸钾溶液褪色( )
(5)乙醇的官能团为羟基,其电子式为 ( )
(6)乙醇能电离出H+,所以乙醇是电解质,能与NaOH溶液反应( )
(7)羟基和氢氧根离子具有相同的化学式和电子式( )
正误判断
√
×
×
×
1.焊接铜器时,表面会生成黑色的氧化膜,铜匠说可以先把铜放在火上烧热,再立刻蘸一下酒精,铜会光亮如初。这一过程中发生了哪些反应?铜在反应中起到了什么作用?
深度思考
2. 能否催化氧化生成醛?
深度思考
提示 不能。该醇中羟基所连的碳原子上只有一个氢原子,不能催化氧化生成醛。
深度思考
3.乙醇的官能团为羟基,羟基(—OH)和OH-有哪些区别和联系?请把下列表格补充完整。
名称 氢氧根离子(OH-) 羟基(—OH)
电子式
电性 _______________ _______
稳定性 _____ _______
(10电子)
(9电子)
带负电的阴离子
电中性
稳定
不稳定
存在 存在于溶液或离子化合物中 存在,必须和其他基团或原子结合在一起
相同点 组成元素相同
深度思考
能独立
不能独立
应用体验
1.丙烯醇(CH2==CH—CH2OH)可发生的化学反应有
①加成反应 ②氧化反应 ③燃烧 ④与钠反应
A.①②③ B.②③④
C.①②③④ D.①③④
√
丙烯醇中含有碳碳双键和羟基两种官能团,碳碳双键可发生①②③,羟基可发生②③④,而丙烯醇兼有两者的性质,故C项正确。
2.现有甲、乙两种有机物,它们的结构简式分别为CH2==CHCH2CH2OH、
。
(1)乙的分子式为________。
(2)甲和乙中都含有的官能团为_______________,下列关于甲和乙两种有机物的叙述不正确的是_____(填字母)。
a.都能与金属钠反应放出氢气
b.都能在催化剂作用下与H2反应
c.都能与NaOH溶液反应
d.甲能被催化氧化生成含—CHO的有机物
e.甲和乙与HBr、溴水发生加成反应,产物都只有一种
C6H10O
碳碳双键和羟基
ce
甲和乙中都含有碳碳双键和—OH,所以甲和乙既有与乙烯相似的化学性质,又有与乙醇相似的化学性质。甲与乙醇相似,能被催化氧化为CH2==CHCH2CHO,甲和乙与Br2反应产物都只有一种,与HBr发生加成反应的产物都有两种。
归纳总结
(1)乙醇反应时化学键的断裂
化学反应 键的断裂
与钠反应 ①
燃烧 ①②③④⑤
催化氧化 ①③
归纳总结
(2)醇的催化氧化反应规律(R、R′、R″代表烃基)
①凡有R—CH2OH结构的醇,在一定条件下都能被氧化成醛(R—CHO)。
②凡有R—CH(OH)—R′结构的醇,在一定条件下也能被氧化,
但生成物不是醛,而是酮( )。
③凡有 结构的醇通常情况下不能被氧化。
返回
随堂演练 知识落实
1.下列有关乙醇的表述正确的是
A.乙醇分子中含有甲基,甲基的电子式为
B.乙醇的结构简式为C2H6O
C.乙醇分子中羟基的电子式为
D.乙醇分子的空间填充模型为
√
1
2
3
4
5
1
2
3
4
5
甲基的电子式为 ,A项错误;
乙醇的结构简式为CH3CH2OH或C2H5OH,B项错误;
羟基的电子式为 ,为中性基团,C项错误。
2.下列有关乙醇的说法错误的是
A.钠的密度大于乙醇,实验室可用乙醇保存金属钠
B.可用无水CuSO4检验工业酒精中是否含水
C.乙醇不能萃取出溴水中的溴
D.分离乙醇和水常用蒸馏的方法
√
1
2
3
4
5
1
2
3
4
钠可以和乙醇发生反应生成乙醇钠和氢气,故不能用乙醇保存金属钠,A错误;
无水CuSO4可以和水反应生成蓝色晶体,故用无水CuSO4可检验工业酒精中是否含水,B正确;
乙醇和水互溶,故乙醇不能萃取溴水中的溴,C正确;
乙醇和水的沸点不同,故可以用蒸馏的方法分离乙醇和水,D正确。
5
1
2
3
4
3.(2022·石家庄高一月考)下列说法正确的是
A.乙醇分子中有—OH基团,所以乙醇溶于水后溶液显碱性
B.乙醇与钠反应可以产生氢气,所以乙醇溶于水后溶液显酸性
C.乙醇在空气中燃烧生成二氧化碳和水,说明乙醇分子中含有C、H、
O三种元素
D.乙醇羟基中的氢原子比乙烷中的氢原子活泼
√
5
1
2
3
4
5
乙醇是非电解质,溶于水后不发生电离,因此乙醇溶液不显碱性或酸性,A、B错误;
物质燃烧生成二氧化碳和水,只能说明该物质中含有C、H元素,C错误;
根据乙醇能与Na反应,乙烷与Na不反应这一事实说明乙醇羟基中的氢原子比乙烷中的氢原子活泼,D正确。
1
2
3
4
4.乙醇分子中的各化学键如图所示,下列关于乙醇分子在各种反应中断裂键的说法不正确的是
A.和金属钠反应时键①断裂
B.在铜催化共热下与O2反应时断裂①和③
C.在空气中完全燃烧时断裂①②③④⑤
D.乙醇是电解质,在水中键①断裂电离出氢离子
√
5
1
2
3
4
5
乙醇与钠反应生成乙醇钠,是羟基中的O—H键断裂,A项正确;
乙醇催化氧化生成乙醛时,断裂①和③化学键,B项正确;
乙醇完全燃烧时,化学键①②③④⑤全部断裂,C项正确;
乙醇是非电解质,在水中键①不断裂,不能电离出氢离子。
5.(2022·昆明高一检测)某课外活动小组的同学为了提高制取乙醛时的乙醇转化率,利用如图所示的装置进行乙醇的催化氧化实验制取乙醛,图中铁架台等装置已略去,粗黑线表示乳胶管。
1
2
3
4
5
(1)该实验常对试管甲采取的加热方式是_________,其目的是_________
___________。
水浴加热
加快乙醇
汽化的速率
1
2
3
4
5
试管甲中盛放的为乙醇溶液,乙醇沸点较低,为加快乙醇汽化的速率,实验时常对试管甲采取水浴加热(70~80 ℃)。
1
2
3
4
5
(2)实验时,先加热玻璃管乙中的铜丝,约1分钟后鼓入空气,此时铜丝立即呈红热状态。若把酒精灯撤走,控制一定的鼓气速率,铜丝能长时间保持红热直到实验结束。
①铜丝能长时间保持红热的原因是__________________________;
乙醇的催化氧化是放热反应
乙醇发生催化氧化生成乙醛和水,该反应放热,所以若把酒精灯撤走,控制一定的鼓气速率,铜丝能长时间保持红热直到实验结束。
1
2
3
4
5
②控制鼓气速率的方法是_______________________________。
控制甲装置中单位时间内的气泡数
通过控制甲装置中单位时间内的气泡数控制鼓气速率。
1
2
3
4
5
(3)实验产物除用水吸收外,还可采用的收集方法是________________
_____________。
将试管丁直接浸
常温下,乙醛为液体,将试管丁直接浸在冰水中冷却,可收集乙醛。
在冰水中冷却
返回
课时对点练
题组一 乙醇的物理性质及用途
1.《本草纲目》“烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上……其清如水,味极浓烈,盖酒露也。”这里所用的“法”是指
A.过滤 B.蒸馏
C.分液 D.升华
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
由题给文字可知,文中的“法”是指我国古代制烧酒的方法,从浓酒中分离出乙醇,利用酒精和水的沸点不同,加热使乙醇挥发,冷凝得烧酒,故选B。
2.下列说法正确的是
①检测乙醇中是否含有水可加入少量的无水硫酸铜,若变蓝则含水 ②除去乙醇中微量的水可加入金属钠,使其完全反应 ③获得无水乙醇的方法是直接加热蒸馏 ④获得无水乙醇的方法通常是先用生石灰吸水,再加热蒸馏
A.①③ B.②④
C.①④ D.③④
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
用无水CuSO4可检验乙醇中是否有水存在,因为无水CuSO4遇水变蓝,故①正确;
乙醇和水均与金属钠反应生成H2,故②错误;
将含水的乙醇直接加热蒸馏,乙醇也会蒸出,所得乙醇不纯,故③错误、④正确。
题组二 乙醇的结构
3.有机物Ⅰ和Ⅱ的结构式如下,下列说法不正确的是
A.Ⅰ和Ⅱ互为同分异构体
B.Ⅰ和Ⅱ物理性质有所不同
C.Ⅰ和Ⅱ化学性质相同
D.Ⅰ和Ⅱ所含C元素的质量分数相同
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
Ⅰ为乙醇,Ⅱ为二甲醚,二者结构不同,分子式都为C2H6O,互为同分异构体,因为官能团不同,化学性质不相同,故C错误。
4.可以证明乙醇分子中有一个氢原子与另外的氢原子不同的方法是
A.1 mol乙醇燃烧生成3 mol水
B.乙醇可以制饮料
C.1 mol乙醇跟足量的Na反应制得0.5 mol H2
D.1 mol乙醇燃烧生成2 mol CO2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
若乙醇中的氢原子是相同的,则1 mol乙醇和金属钠反应,可以生成3 mol氢气,但实际上只能得到0.5 mol氢气,所以选项C是正确的。
5.下列有机物和乙醇具有相同官能团的是
A.苯乙烯( )
B.丙三醇( )
C.丙酮( )
D.乙醚(CH3CH2—O—CH2CH3)
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
苯乙烯含有 ,官能团和乙醇不同;
丙三醇含有—OH,官能团和乙醇相同;
丙酮含有 ,官能团和乙醇不同;
乙醚含有 ,官能团和乙醇不同,故选B。
题组三 乙醇的化学性质及相关应用
6.(2022·武汉高一月考)如图是某有机物分子的空间填充模型,黑色的是碳原子,白色的是氢原子,灰色的是氧原子。则该物质不具有的性质是
A.使紫色石蕊试液变红
B.与钠反应
C.与水互溶
D.发生氧化反应
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
根据该有机物分子的空间填充模型,黑色的是碳原子,白色的是氢原子,灰色的是氧原子,该物质是乙醇。乙醇是非电解质,不能使紫色石蕊试液变红,故A错误;
乙醇与钠反应生成乙醇钠和氢气,故B正确;
乙醇与水能以任意比例互溶,故C正确;
乙醇在铜作催化剂并加热条件下发生氧化反应生成乙醛和水,故D正确。
7.按下图装置,持续通入X气体,可看到a处有红色物质生成,b处变蓝,c处得到液体,X气体可能是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
A.H2 B.CO和H2
C.NH3 D.CH3CH2OH(g)
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
四个选项中的气体或蒸气都可还原CuO,且均有H2O产生,故都可满足a、b处的现象。但要在c处得到液体,只有D符合:CH3CH2OH+CuO
CH3CHO+H2O+Cu。
8.(2022·广州高一检测)某有机物6 g与足量Na反应,生成0.05 mol H2,该有机物可能是
A.CH3CH2OH B.CH3CHOHCH3
C.CH3OH D.CH3OCH2CH3
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
有机物能与Na反应放出H2,排除D;
6 g有机物提供0.1 mol羟基H原子,则一元醇的相对分子质量应为60,故选B。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
9.酒后驾车是引发交通事故的重要原因之一。交警对驾驶员进行呼气酒精检测的原理是橙色的酸性K2Cr2O7溶液遇乙醇迅速生成灰绿色的Cr3+。下列对乙醇的描述与此测定原理有关的是
①乙醇的沸点低 ②乙醇的密度比水的小 ③乙醇有还原性 ④乙醇的组成中含有氧元素
A.②④ B.②③
C.①③ D.①④
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
①乙醇的沸点低,易挥发,若饮酒,呼出的气体中含有乙醇,与测定原理有关;
②乙醇的密度比水的小,与测定原理无关;
③酸性K2Cr2O7遇乙醇迅速生成灰绿色的Cr3+,Cr元素的化合价由+6降为+3,K2Cr2O7被还原,则乙醇具有还原性,与测定原理有关;
④乙醇的组成中含有氧元素,与测定原理无关。
10.将质量为m g的铜丝燃烧变黑,立即放入下列物质中,能使铜丝变红,且质量仍为m g的是
A.盐酸 B.酒精
C.稀硫酸 D.二氧化碳
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
铜丝燃烧生成黑色的CuO,如遇稀硫酸和盐酸,发生反应CuO+2H+===Cu2++H2O,使质量减少,遇酒精又生成Cu单质,质量不变。
11.香叶醇是合成玫瑰香油的主要原料,其键线式如图所示。下列有关香叶醇的叙述正确的是
A.香叶醇的分子式为C10H18O
B.不能使溴的四氯化碳溶液褪色
C.不能使酸性高锰酸钾溶液褪色
D.能发生加成反应不能发生取代反应
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
A项,由香叶醇的结构简式可得分子式为C10H18O;
B项,分子中含有碳碳双键,能与溴发生加成反应,从而使溴的CCl4溶液褪色;
C项,分子中含有碳碳双键,能被酸性高锰酸钾溶液氧化,使酸性高锰酸钾溶液紫红色褪去;
D项,分子中碳碳双键可发生加成反应,醇羟基可发生取代反应。
12.(2022·杭州高一月考)某有机物的结构如图所示,这种有机物不可能具有的性质是
①可以燃烧 ②能使酸性KMnO4溶液褪色 ③能跟NaOH溶液反应 ④能发生氧化反应 ⑤能发生加成反应 ⑥在银作催化剂共热的条件下,能发生催化氧化反应
A.①④ B.只有⑥
C.只有③ D.②⑤
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
该分子只有“ ”和羟基,不能与NaOH溶液反应,③错误。
13.A、B、C三种醇与足量的金属钠反应,在相同条件下产生相同体积的氢气,消耗这三种醇的物质的量之比为3∶6∶2,则A、B、C三种醇分子中羟基数目之比是
A.3∶2∶1 B.2∶6∶3
C.3∶6∶2 D.2∶1∶3
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
由题意可知,三种醇消耗的羟基总数相等,设A、B、C三种醇分子中的羟基数分别为x、y、z,则3x=6y=2z,解得x∶y∶z=2∶1∶3。
14.肉桂醇,白色针状或块状结晶,有温和、持久而舒适的香气,可用作定香剂和除臭剂,其结构简式为 。下列有关肉桂醇的叙述正确的是
A.肉桂醇的摩尔质量为134 g
B.肉桂醇能使酸性KMnO4溶液褪色
C.肉桂醇能与溴水发生取代反应
D.1 mol肉桂醇完全燃烧消耗11.5 mol O2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
摩尔质量的单位为g·mol-1,A错误;
分子中含有碳碳双键和羟基,能被酸性KMnO4溶液氧化,B正确;
分子中含有碳碳双键,能与溴水发生加成反应,C错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
15.(2022·沈阳高一阶段练习)“对酒当歌,人生几何”“劝君更尽一杯酒,西出阳关无故人”“何以解忧,唯有杜康”等有关于酒的中国古诗词比比皆是,在历史长河中酒不仅是一种具体的物质,而且成了一种文化的象征。酒的主要成分是一种常见的有机物乙醇。
(1)乙醇是无色有特殊香味的液体,密度比水的_____。
小
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(2)工业上用乙烯与水反应可制得乙醇,该反应的化学方程式为
______________________________(不写反应条件)。
CH2==CH2+H2O―→CH3CH2OH
工业上用乙烯与水反应可制得乙醇,该反应的化学方程式为CH2==CH2+H2O―→CH3CH2OH。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(3)与乙醇互为同分异构体的是______(填字母)。
A.
B.
C.甲醇
D.CH3—O—CH3
E.HO—CH2CH2—OH
D
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
分子式相同而结构不同的化合物互为同分异构体。CH3—O—CH3和乙醇的分子式相同,均为C2H6O,但二者结构不同,所以该有机物与乙醇互为同分异构体,故D符合题意。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(4)乙醇能够发生氧化反应:
①46 g乙醇完全燃烧消耗_____mol氧气。
3
乙醇燃烧的化学方程式为CH3CH2OH+3O2 2CO2+3H2O,46 g乙醇的物质的量为1 mol,则46 g乙醇完全燃烧消耗3 mol氧气。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
②乙醇在铜作催化剂并加热的条件下可被氧气氧化为乙醛,反应的化学
方程式为_____________________________________。
乙醇在铜作催化剂并加热的条件下可被氧气氧化为乙醛,反应的化学方程式为2CH3CH2OH+O2 2CH3CHO+2H2O。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(5)乙醇和金属钠缓慢的反应,放出无色无味的气体,反应的方程式为______________________________________。
2CH3CH2OH+2Na―→2CH3CH2ONa+H2↑
乙醇和金属钠缓慢的反应,放出无色无味的气体,反应的化学方程式为2CH3CH2OH+2Na―→2CH3CH2ONa+H2↑。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
16.某实验小组用下列装置进行乙醇催化氧化的实验。已知:乙醛可被氧化为乙酸。
(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学
方程式:___________________、_______________________________
___________。
+Cu+H2O
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
乙醇的催化氧化反应实质是金属铜被氧气氧化为氧化铜,化学方程式为2Cu+O2 2CuO,氧化铜将乙醇氧化为乙醛,化学方程式为CH3CH2OH
+CuO CH3CHO+Cu+H2O。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(2)在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明乙醇催化氧化反应是______反应。进一步研究表明,鼓入空气的速率与反应体系温度的关系曲线如图所示。试解释出现图中现象的原因:_________________________________。
放热
空气流速过快,将体系中的热量带走
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
熄灭酒精灯,反应仍能继续进行,说明乙醇催化氧化反应是放热反应;根据图示曲线,反应放出热量的多少和乙醇以及氧气的量有关,鼓气速率较小时反应体系的温度随鼓气速率增大而升高,但是鼓气
速率过大时,过量的空气会将体系中的热量带走,所以空气流速过快时反应体系温度降低。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(3)甲和乙两个水浴作用不相同。甲的作用是______________________;乙的作用是____________________。
加热乙醇,使乙醇汽化
冷却,便于收集乙醛
甲和乙两个水浴作用不相同,甲是热水浴,作用是使乙醇汽化成乙醇蒸气,乙是冷水浴,目的是将乙醛冷凝,便于乙醛的收集。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(4)若试管a中收集的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有______。要除去该物质,可在混合液中加入_____(填字母),然后再进行_______(填实验操作名称)。
A.氯化钠溶液 B.苯
C.碳酸氢钠溶液 D.四氯化碳
乙酸
C
蒸馏
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有乙酸。碳酸氢钠溶液可以和乙酸反应,生成乙酸钠、水和二氧化碳;乙酸钠沸点较高,可用蒸馏法分离出乙醛。
返回
本课结束
专题8
