专题8 第一单元 第3课时 石油炼制 乙烯 课件(共97张PPT)
文档属性
| 名称 | 专题8 第一单元 第3课时 石油炼制 乙烯 课件(共97张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-10 21:42:29 | ||
图片预览









文档简介
(共97张PPT)
第3课时
DISANKESHI
石油炼制 / 乙烯的分子结构与性质 / 不饱和烃、乙炔的结构及性质 / 随堂演练 知识落实 / 课时对点练
石油炼制 乙烯
专题8
核心素养
发展目标
1.知道石油炼制的方法(分馏、催化裂化、裂解等)、目的、主要产品及在生产生活中的应用,培养“科学态度和社会责任”的学科素养。
2.掌握乙烯的组成、结构、性质和变化,形成“结构决定性质”的观念,培养“宏观辨识与微观探析”的能力。
3.掌握乙烯的化学性质,知道氧化反应、加成反应等反应类型,能通过分析推理认识乙烯发生加成反应时断键和成键情况,培养“证据推理与模型认知”的能力。
内容索引
一、石油炼制
二、乙烯的分子结构与性质
三、不饱和烃、乙炔的结构及性质
随堂演练 知识落实
课时对点练
石油炼制
一
石油是一种重要的化石燃料,其组成元素主要是碳和氢,同时还含有少量的硫、氧、氮等元素。石油中含多种 ,并溶有少量的_____
和 烃。分馏、催化裂化、裂解等都是炼制加工石油的常用手段。
液态烃
气态
固态
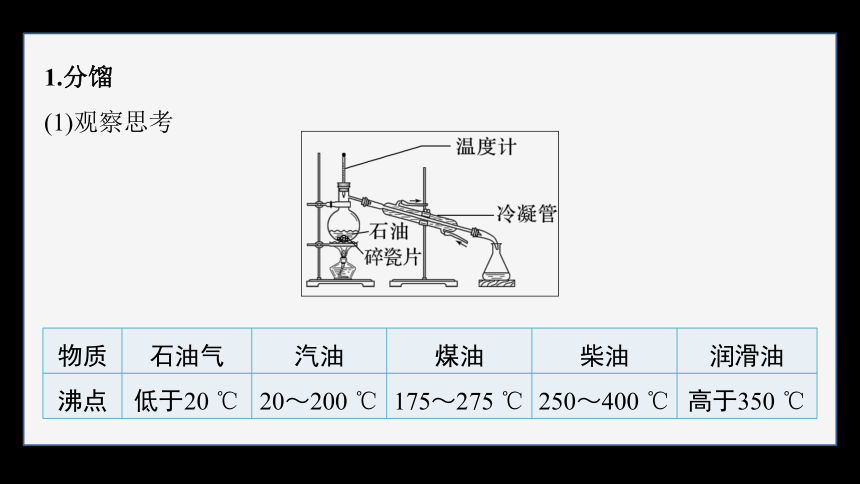
1.分馏
(1)观察思考
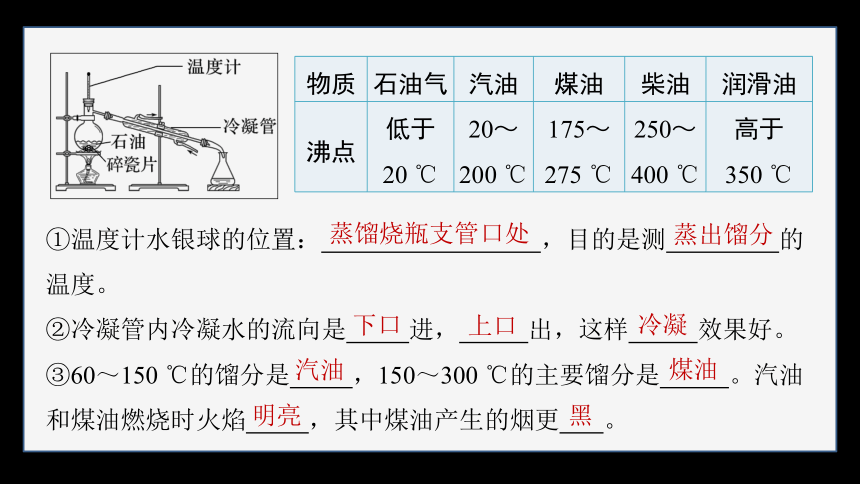
物质 石油气 汽油 煤油 柴油 润滑油
沸点 低于20 ℃ 20~200 ℃ 175~275 ℃ 250~400 ℃ 高于350 ℃
①温度计水银球的位置: ,目的是测 的温度。
②冷凝管内冷凝水的流向是 进, 出,这样 效果好。
③60~150 ℃的馏分是 ,150~300 ℃的主要馏分是 。汽油和煤油燃烧时火焰 ,其中煤油产生的烟更 。
物质 石油气 汽油 煤油 柴油 润滑油
沸点 低于 20 ℃ 20~200 ℃ 175~275 ℃ 250~400 ℃ 高于
350 ℃
蒸馏烧瓶支管口处
蒸出馏分
下口
上口
冷凝
汽油
煤油
明亮
黑
(2)分馏
根据各成分 不同,通过加热汽化,然后冷凝,可得到石油不同
范围内的产物,称为石油的分馏。随着馏分中烃分子含有的碳原子数增加,碳链 ,相对分子质量 ,它们的沸点逐渐 。
沸点
沸点
增长
增大
升高
2.催化裂化
(1)原理:用 中沸点较高的馏分为原料,在___________
存在条件下,使 较大、 较高的烃断裂为 较小、 较低的烃。
(2)目的:提高石油分馏产品中低沸点的 等轻质油的 和 。
(3)举例(十六烷的裂化)
化学方程式: 。
石油分馏产品
加热、加压
和催化剂
相对分子质量
沸点
相对分子质量
沸点
汽油
产量
质量
3.裂解
(1)原理:以比裂化更高的温度使石油分馏产物(包括石油气)中的_______
断裂为 、 等气态短链烃。
(2)目的:获得纯度较高的 、 等化工原料。目前石油裂解已经成为生产 的主要方法。因此, 的产量可以衡量一个国家石油化工发展水平。
长链烃
乙烯
丙烯
乙烯
丙烯
乙烯
乙烯
正误判断
(1)石油是一种重要的化石燃料,也是重要的化工原料( )
(2)在石油中只有液态烃,没有气态和固态烃( )
(3)石油的分馏为物理变化,获取的各种产品为混合物( )
(4)石油的裂化和裂解原理相同,目的也相同( )
(5)石油的裂化是生产乙烯的主要方法( )
(6)含C20以上的烷烃的重油经过催化裂化可以获得汽油( )
√
×
√
×
×
√
1.石油的分馏、催化裂化、裂解分别属于哪种变化类型?
深度思考
提示 石油的分馏属于物理变化,催化裂化、裂解属于化学变化。
2.教材中描述“石油在加工炼制过程中可以发生催化裂化反应”,直馏汽油与裂化汽油的主要成分有什么区别?
深度思考
提示 直馏汽油的主要成分是液态烷烃;裂化汽油的主要成分是液态烷烃和烯烃。
应用体验
1.右图是石油分馏塔的示意图。对a、b、c三种馏分的叙述正确的是
A.a的沸点最高
B.b的熔点最低
C.c的平均相对分子质量最大
D.每一种馏分都是纯净物
√
石油经加热后从下部进入分馏塔中,随着气体的上升温度逐渐降低,沸点高的馏分首先冷凝从下部流出,越往上馏分沸点越低,故a处馏分沸点最低,A错误;
b处馏分熔点介于a、c之间,B错误;
c处的平均相对分子质量是最大的,C正确;
石油分馏的馏分中都含有不同碳原子数的烃,所以石油分馏的馏分都是混合物,D错误。
2.实验室用下列仪器组装一套蒸馏石油的装置,并进行蒸馏得到汽油和煤油。
(1)写出下列仪器的名称:
①_______;②_________;③_______。
(2)将以上仪器按从左到右顺序,用字母a、b、c…进行连接:e接( );( )接( );( )接( )接( )。
冷凝管
蒸馏烧瓶
锥形瓶
c
d
a
b
f
g
(3)仪器的A口是_______,B口是_______。
(4)蒸馏时,温度计的水银球应在_________________。
(5)在②中注入原油后,加几片碎瓷片的目的是_________。
进水口
出水口
蒸馏烧瓶支管口处
防止暴沸
返回
乙烯的分子结构与性质
二
1.乙烯的组成与结构
乙烯是一种不饱和烃,分子中含有 。
碳碳双键
(1)乙烯的表示方式
分子式 电子式 结构式
_____
结构简式 球棍模型 空间填充模型
___________
C2H4
CH2==CH2
(2)乙烯的结构特点
特点提醒 碳碳双键决定着乙烯的重要化学性质,所以乙烯的结构简式不能写成CH2CH2(碳碳双键不能省略)。
2.乙烯的物理性质
乙烯是一种 色、 的气体,密度比空气的 , 溶于水,易溶于四氯化碳等有机溶剂。
3.乙烯的化学性质
乙烷的化学键都是单键。乙烯分子中含有 和 。乙烷的化学性质比较 ,乙烯相对 。
无
稍有气味
略小
难
碳碳双键
碳氢单键
稳定
活泼
(1)乙烯的氧化反应
实验 现象及反应
点燃乙烯 火焰明亮,且伴有黑烟,同时放出大量热,
化学方程式为___________________________
把乙烯气体通入酸性高锰酸钾溶液中 酸性高锰酸钾溶液 ,CH2==CH2
褪色
结论:乙烯可以与氧气反应(燃烧),也可以被高锰酸钾氧化。
(2)乙烯的加成反应
装置及现象
现象:溴的四氯化碳溶液_____
微观探析 乙烯分子双键中的 断裂,两个碳原子分别与一个溴原子结合,生成无色的1,2-二溴乙烷
一个键
褪色
化学方程式
+Br—Br―→
1,2-二溴乙烷
(3)加成反应
有机物分子中 连接的碳原子与其他原子或原子团直接结合生成新的化合物的反应。
乙烯不仅可以与溴发生加成反应,在一定条件下还可以与水、氢气、卤化氢等物质发生加成反应。
反应 化学方程式
与Cl2加成 _____________________________
与H2加成
_____________________________
双键(或三键)
CH2==CH2+Cl2―→CH2ClCH2Cl
与HCl加成
_________________________________
与H2O加成
_________________________________
(工业制乙醇)
4.乙烯的用途
(1)乙烯的产量可以用来衡量一个国家的石油化工发展水平。
(2)乙烯是一种植物生长调节剂,可作为果实催熟剂。
(3)乙烯是一种基本化工原料。
正误判断
(1)乙烯和乙烷都为碳氢化合物,因此性质相同( )
(2)乙烯的化学性质比乙烷的活泼( )
(3)乙烯能使酸性KMnO4溶液和溴水褪色,且反应原理相同( )
(4)用裂化汽油萃取溴水中的溴单质( )
(5)乙烷中混有乙烯,可通过与H2在一定条件下反应使乙烯转化为乙烷( )
(6)可以用CH2==CH2与Cl2反应制取较纯净的CH2ClCH2Cl( )
×
√
×
×
×
√
1.对比乙烷、乙烯的分子式和结构式,你能得出什么结论?
深度思考
提示 在烃分子中,每增加一个碳碳双键,氢原子数比相同碳原子数的饱和烃少2个。
2.能不能选用酸性KMnO4溶液除去乙烷中的乙烯?
深度思考
提示 除去乙烷中的乙烯只能选用溴水,而不能选用酸性KMnO4溶液,这是因为酸性KMnO4溶液氧化乙烯生成CO2,又引入了新的杂质CO2。
3.CH2==CHCl、CH2==CHCH3中的所有原子均共面吗?
深度思考
提示 CH2==CHCl可写为 ,所有原子共面。
CH2==CHCH3可写为 ,所有原子不共面。
应用体验
1.使1 mol乙烯与氯气发生完全加成反应,然后使该加成反应的产物与氯气在光照的条件下发生取代反应,则两个过程中消耗氯气的总物质的量最多是
A.3 mol B.4 mol C.5 mol D.6 mol
√
1 mol乙烯能与1 mol Cl2发生加成反应,而1 mol加成产物(CH2ClCH2Cl)中含有4 mol氢原子,被氯原子完全取代时消耗4 mol Cl2,所以共消耗5 mol Cl2。
2.下列物质不可能是乙烯的加成产物的是
A.CH3CH3 B.CH3CHCl2
C.CH3CH2OH D.CH3CH2Br
√
归纳总结
取代反应和加成反应的比较
取代反应 加成反应
反应物特征 含有易被取代的原子或原子团
不饱和有机化合物(含
或—C≡C—等)
生成物 两种 一种
碳碳键变化 无变化
或—C≡C—中一个或
两个键断裂
归纳总结
反应特点 一上一下 断一加二(或断二加四)
举例
返回
不饱和烃、乙炔的结构及性质
三
1.不饱和烃
碳原子所结合的氢原子数 饱和烃里的氢原子数的 属于不饱和烃,如烯烃和炔烃,乙炔是最简单的炔烃。
2.乙炔的组成与结构
(1)乙炔是一种不饱和烃,是最简单的炔烃,四个原子都在 上。
小于
碳氢化合物
同一条直线
(2)乙炔的表示方式
分子式 电子式 结构式
C2H2 ______________ H—C≡C—H
结构简式 球棍模型 空间填充模型
HC≡CH
3.乙炔的化学性质
(1)氧化反应
4CO2+2H2O
浓烟
褪色
(2)加成反应
乙炔与足量溴的四氯化碳溶液反应:
HC≡CH+Br2―→ ;
+Br2―→ 。
正误判断
(1)乙烷、乙烯和乙炔都是碳氢化合物,它们互为同系物( )
(2)乙炔能使酸性KMnO4溶液褪色,是因为乙炔能被KMnO4氧化( )
(3)乙炔分子中含有碳碳三键,键能大,故乙炔的化学性质非常稳定( )
(4)乙炔具有可燃性,在点燃前一定要验纯( )
(5)可用燃烧的方法鉴别乙烷和乙炔( )
(6)乙炔和乙烯都能使溴水褪色,且两者反应原理相同( )
×
√
×
√
√
√
应用体验
1.区别CH4、CH2==CH2、CH≡CH的最简易方法是
A.分别通入溴水
B.分别通入酸性高锰酸钾溶液
C.分别在空气中点燃
D.分别通入盛有碱石灰的干燥管
√
CH2==CH2和CH≡CH都能使溴水和酸性高锰酸钾溶液褪色,A、B错误;
三种气体通过盛有碱石灰的干燥管均无现象,D错误;
最简易的方法是点燃,因为燃烧时火焰的明亮程度和有无黑烟、浓烟这两个方面的现象区别是非常明显的,C正确。
2.下列关于乙炔性质的叙述中,既不同于乙烯又不同于乙烷的是
A.能燃烧生成二氧化碳和水
B.能发生加成反应
C.能使酸性KMnO4溶液褪色
D.能与氯化氢反应生成氯乙烯
√
乙烷、乙烯、乙炔均能燃烧生成二氧化碳和水;乙烯、乙炔中均含有碳碳不饱和键,既能与Br2、H2等物质发生加成反应,又能被酸性KMnO4溶液氧化,使酸性KMnO4溶液褪色;乙炔能与氯化氢发生加成反应生成氯乙烯,乙烷与氯化氢不反应,乙烯与氯化氢发生加成反应生成氯乙烷,故选项D符合题意。
归纳总结
乙烷、乙烯和乙炔的比较
名称 比较 乙烷 乙烯 乙炔
结构特点 碳碳单键,碳原子饱和,所有原子不在同一平面上 碳碳双键,碳原子不饱和,所有原子均在同一平面上 碳碳三键,碳原子不饱和,所有原子均在一条直线上
归纳总结
所属烃类通式 CnH2n+2(n≥1) CnH2n(n≥2) CnH2n-2(n≥2)
取代反应 与卤素单质间的反应 — —
加成反应 — 能够与H2、X2、HX、H2O等发生加成反应 氧化反应 不能使酸性高锰酸钾溶液褪色 能使酸性高锰酸钾溶液褪色
归纳总结
氧化反应 燃烧产生淡蓝色火焰 燃烧火焰明亮,且伴有黑烟 燃烧火焰很明亮,且伴有浓烟
鉴别 不能使溴水或酸性高锰酸钾溶液褪色 能使溴水或酸性高锰酸钾溶液褪色 返回
随堂演练 知识落实
1.石油是工业的“血液”,开发利用南海丰富的石油资源,对广东乃至全国的经济发展意义重大。下列关于石油的说法正确的是
A.石油的裂解属于物理变化
B.石油裂解的产物主要为饱和烃
C.石油的分馏属于化学变化
D.石油的主要成分是烃类物质
1
2
3
4
√
5
1
2
3
4
裂解为长链烃转化为乙烯、丙烯等,则石油裂解属于化学变化,故A错误;
石油裂解的产物主要是不饱和烃,故B错误;
石油分馏属于物理变化,故C错误。
5
2.(2022·上海市第二中学高二阶段练习)若要除去甲烷中混有的少量乙烯的杂质,可选择的方法有
A.催化加氢
B.通入足量溴水
C.通入足量酸性高锰酸钾溶液
D.通入足量氢氧化钠溶液
1
2
3
4
√
5
1
2
3
4
催化加氢,乙烯转化为乙烷,但又引入乙烷和未反应完的氢气杂质,故A不符合题意;
通入足量溴水,乙烯与Br2发生加成反应被除去且不引入杂质,故B符合题意;
通入足量酸性高锰酸钾溶液,乙烯被氧化为二氧化碳,引入了新的杂质,故C不符合题意;
通入足量氢氧化钠溶液,乙烯不与氢氧化钠反应,故D不符合题意。
5
3.乙烯和乙炔都能使溴的四氯化碳溶液褪色,这是由于乙烯和乙炔
A.是同系物
B.都属于烃
C.都易被氧化
D.都含有价键不饱和的碳原子
√
1
2
3
4
5
4.下列有关乙烯和乙烷的说法错误的是
A.乙烯分子中所有原子一定共平面而乙烷分子中所有原子不可能在同一
平面内
B.乙烯的化学性质比乙烷的活泼,乙烯中组成碳碳双键的两个化学键
活性完全相同
C.不能用酸性KMnO4溶液除去乙烷中混有的乙烯
D.可以用酸性KMnO4溶液鉴别乙烯和乙烷
1
2
3
4
√
5
1
2
3
4
乙烯含有碳碳双键,为不饱和烃,乙烷为立体空间构型,碳原子达到饱和,所有原子不可能在同一平面内,故A正确;
乙烯含有碳碳双键,可发生加成反应、氧化反应,乙烯的化学性质比乙烷的活泼,但乙烯中组成双键的两个化学键,活性不同,故B错误;
因为乙烯被高锰酸钾氧化为二氧化碳,引入新杂质,所以酸性KMnO4溶液不能除去乙烷中混有的乙烯,故C正确;
乙烯含有碳碳双键,可以使酸性高锰酸钾溶液褪色,乙烷为饱和烃,不能使酸性高锰酸钾溶液褪色,酸性KMnO4溶液可以鉴别乙烯和乙烷,故D正确。
5
5.(1)乙烯能使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色,其中,与高锰酸钾发生的反应是_______反应(填反应类型,下同);与溴发生的反应是______反应。
1
2
3
4
氧化
加成
乙烯分子中的碳碳双键易断裂,因此易被酸性高锰酸钾氧化,能与溴发生加成反应。
5
(2)一种能使溴水褪色的气态烃,标准状况下5.6 L该气态烃的质量为10.5 g,10.5 g该烃完全燃烧时生成16.8 L二氧化碳(标准状况)和13.5 g水。则该烃的分子式为_______。
C3H6
1
2
3
4
5
设该气态烃的分子式为CxHy,
1
2
3
4
5
0.25 mol 0.75 mol 0.75 mol
则x=3,y=6,该气态烃的分子式为C3H6。
返回
1
2
3
4
5
课时对点练
题组一 石油的炼制
1.下列有关石油的炼制及产品,说法正确的是
A.含C20以上烷烃的重油经减压分馏可以得到煤油和柴油
B.石油分馏所得的馏分都是混合物
C.通过石油分馏可以获得大量的短链烃
D.石油分馏得到汽油、煤油、乙烯等产品
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
2.(2022·南京高一检测)下列关于石油组成及炼制,说法错误的是
A.石油中含有C5~C12的烷烃,可以通过石油的分馏得到汽油
B.含C20以上的烷烃的重油经过催化裂化可以得到汽油
C.石油裂解产物中含有乙烯、丙烯等
D.石油裂解是为了得到高质量的轻质油
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
石油裂解的目的是得到所需纯度的乙烯、丙烯等气态短链烃。而催化裂化的目的是提高汽油等轻质油的产量和质量,二者不能混为一谈。
3.下列说法正确的是
A.汽油与水不相溶,故可用裂化汽油萃取碘水中的碘
B.裂化汽油和直馏汽油都可以与溴水反应使其褪色
C.石油的分馏为物理变化,裂化和裂解都为化学变化
D.石油分馏产品沸点范围:汽油>煤油>柴油>重油
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
裂化汽油是石油通过裂化得到的,含有不饱和烃,不饱和烃能和碘单质发生加成反应,所以裂化汽油不能萃取碘水中的碘,故A错误;
直馏汽油主要成分为饱和烃,不能与溴水反应使其褪色,故B错误;
石油的分馏为物理变化,裂化和裂解都为烃的分解反应为化学变化,故C正确;
石油分馏时,首先分馏出的是汽油,其次是煤油,再次是柴油、重油,故其沸点:汽油<煤油<柴油<重油,故D错误。
题组二 乙烯和乙炔的结构、性质与应用
4.能证明乙烯分子里含有一个碳碳双键的事实是
A.乙烯分子里碳、氢原子个数之比为1∶2
B.乙烯完全燃烧生成的CO2和H2O的物质的量相等
C.乙烯易与溴水发生加成反应,且1 mol乙烯完全加成消耗1 mol溴单质
D.乙烯能使酸性KMnO4溶液褪色
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
乙烯分子里碳、氢原子个数之比是由有机物的结构决定的,不能证明其含有一个碳碳双键;乙烯的燃烧产物不能证明其含有碳碳双键的个数;乙烯的加成反应与碳碳双键有直接关系,1 mol碳碳双键消耗1 mol溴单质;不饱和的碳碳双键或碳碳三键均能使酸性KMnO4溶液褪色。
5.(2022·广西南宁市第五十六中学高一期末)下列各组中的两个反应所属反应类型相同的是
A.光照条件下,甲烷和氯气混合气体颜色变浅;乙烯使溴水褪色
B.乙烯能使溴水褪色;乙烯能使酸性高锰酸钾溶液褪色
C.丁烷在氧气中燃烧;丙烯使酸性高锰酸钾溶液褪色
D.工业上由乙烯和水反应生成乙醇;乙烯在空气中燃烧
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
光照条件下甲烷和氯气发生取代反应,乙烯与溴水发生加成反应,反应类型不同,A错误;
乙烯能使溴水褪色发生加成反应,乙烯使高锰酸钾溶液褪色,乙烯发生氧化反应,反应类型不同,B错误;
丁烷在氧气中燃烧,丁烷发生氧化反应,丙烯使酸性高锰酸钾溶液褪色,丙烯发生氧化反应,C正确;
乙烯和水发生加成反应制乙醇,乙烯在空气中燃烧,乙烯发生氧化反应,反应类型不同,D错误。
6.下列叙述错误的是
A.1 mol CH2==CH2先与HCl发生加成反应,再与Cl2发生取代反应,最多
消耗2.5 mol Cl2
B.实验室中可用如图所示方法除去CH3CH3
气体中混有的CH2==CH2气体
C.实验室中可用酸性KMnO4溶液鉴别CH3CH3和CH2==CH2
D.工业上可利用CH2==CH2与HCl的加成反应制得纯净的CH3CH2Cl
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1 mol CH2==CH2和HCl反应生成1 mol CH3CH2Cl,1 mol CH3CH2Cl中含5 mol H原子,最多需要消耗5 mol Cl2,故A错误;
CH3CH3和溴水不发生反应,CH2==CH2可以和溴水发生反应生成液态的CH2BrCH2Br,B正确;
CH3CH3和酸性KMnO4溶液不发生反应,CH2==CH2能被酸性KMnO4溶液氧化,酸性KMnO4溶液褪色,C正确;
CH2==CH2和HCl发生加成反应生成唯一产物CH3CH2Cl,D正确。
7.甲烷、乙烯、乙炔都是常见的有机化合物。下列说法错误的是
A.无论是乙烯与Br2的加成,还是乙烯使酸性KMnO4溶液褪色,都与
分子内含有碳碳双键有关
B.用溴的四氯化碳溶液或酸性KMnO4溶液都可以鉴别乙烯和甲烷
C.相同质量的乙烯和甲烷完全燃烧后产生的水的质量相同
D.乙烯与乙炔都能使溴的四氯化碳溶液褪色,原理相同
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
乙烯的加成反应和氧化反应过程中碳碳双键断裂,A项正确;
乙烯能与Br2和酸性KMnO4溶液发生反应,但是甲烷不能,故能用溴的四氯化碳溶液或酸性KMnO4溶液鉴别乙烯和甲烷,B项正确;
乙烯和甲烷中氢元素的质量分数不同,故相同质量的乙烯和甲烷完全燃烧后产生的水的质量不同,C项错误;
乙烯、乙炔均能与Br2发生加成反应而使溴的四氯化碳溶液褪色,D项正确。
8.(2022·吉林吉化第一高级中学校高一期中)0.5 mol某气态烃能与0.5 mol Cl2完全加成,加成产物又可被3 mol Cl2完全取代,则此气态烃可能是
A.CH2==CH2
B.CH3—CH==CH2
C.CH2==CHCH2CH3
D.CH2==CH—CH==CH2
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
0.5 mol某气态烃能与0.5 mol Cl2完全加成,可知该烃分子中含1个碳碳双键,且0.5 mol加成产物又可被3 mol Cl2完全取代,则此气态烃中含6个H原子,则该气态烃为CH2==CHCH3,故合理选项是B。
题组三 加成反应的概念及判断
9.下列各反应不属于加成反应的是
A.CH2==CH2+H—OH CH3—CH2—OH
B.CH3CH==CH2+Br2―→CH3CHBrCH2Br
C. +H2 CH3—CH2—OH
D.CH3—CH3+2Cl2 CH2Cl—CH2Cl+2HCl
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
D项中反应为取代反应。
10.某烯烃与H2加成后的产物为 ,则该烯烃可能的结构简式有
A.1种 B.2种 C.3种 D.4种
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
将两个含有氢原子的相邻碳原子之间的单键变双键即可,
如 ,在①②③④处均可使碳碳单键变为碳碳
双键,但①②处位置是等效的,所以该烯烃可能的结构简式有3种。
11.将15 g CH4和C2H4的混合气体通入盛有足量溴水的容器中,溴水的质量增加了7 g,则混合气体中CH4和C2H4的体积之比为
A.1∶2 B.2∶1 C.3∶2 D.2∶3
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
甲烷不能与溴水反应,乙烯可与Br2发生加成反应,因此,溴水质量增加是因为吸收了乙烯,故乙烯的物质的量为 =0.25 mol,则甲烷的物质的量为 =0.5 mol,相同条件下气体体积之比等于其物质的量之比,即CH4与C2H4体积之比为2∶1。
12.从柑橘中炼制萜二烯( ),下列有关它的推测,不正确的是
A.分子式为C10H16
B.它能使酸性高锰酸钾溶液褪色
C.该分子中所有的碳原子可能在同一个平面上
D.与过量的溴的四氯化碳溶液反应后产物为
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
该有机物含有10个C原子、16个H原子,则其分子式为C10H16,A项正确;
该有机物中含有 ,能被高锰酸钾氧化,使酸性高锰酸钾溶液褪色,B项正确;
该分子六元环中含有 ,结合甲烷的正四面体结构,所以该分子中所有的碳原子不可能在同一个平面上,C项错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
该有机物中含有 ,可发生加成反应,与过量溴的CCl4溶液可发
生完全加成反应生成 ,D项正确。
13.角鲨烯是一种高度不饱和烃类化合物,最初是从鲨鱼的肝脏中发现的,分子中含有多个碳碳双键,分子式为C30H50,具有生物氧化还原作用,从而增强机体的耐力与改善心脏功能,可用于癌症的防治,是一种无毒性的具有防病治病作用的海洋生物活性物质。下列叙述正确的是
①角鲨烯能使酸性KMnO4溶液褪色 ②角鲨烯能与氢气发生加成反应 ③角鲨烯只含碳、氢两种元素 ④角鲨烯易被氧化
A.①②③ B.①③④
C.②③④ D.①②③④
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
角鲨烯含碳碳双键,能使酸性KMnO4溶液褪色,能与氢气发生加成反应,易被氧化;由分子式可知,角鲨烯只含碳、氢两种元素。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
14.A是一种最简单的不饱和烃,是一种石油裂解产物,且A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型。根据图回答下列问题:
(1)写出A、B、C、D的结构简式:
A.___________,B._________,
C.___________,D.____________。
CH2==CH2
CH3CH3
CH3CH2Cl
CH3CH2OH
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(2)写出②③④三步反应的化学方程式,
并注明反应类型。
②_________________________________,
_________;
③_________________________________,_________;
④________________________________,_________。
加成反应
加成反应
取代反应
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
由题意可知A为乙烯,由乙烯的性质可知B、C、D分别为CH3CH3、CH3CH2Cl、CH3CH2OH,①②③都是加成反应,④为CH3CH3与Cl2的取代反应。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
15.(2022·湖南高一期中)乙烯是石油化工的重要基本原料。通过一系列化学反应,可以由乙烯得到有机高分子材料、药物等成千上万种有用的物质。
根据上述装置,回答下列问题:
(1)已知:1,2-二溴乙烷的密度比水的大,难溶于水,易溶于四氯化碳。
预测:试管①中装有溴的四氯化碳溶液,可能出现的实验现象是_______________________。试管②中装有溴水,可能出现的实验现象为_____________________。
橙红色褪去,液体不分层
橙黄色褪去,液体分层
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
试管①中装有溴的四氯化碳溶液,乙烯通入溴的四氯化碳溶液中发生反应CH2==CH2+Br2―→
BrCH2CH2Br,1,2-二溴乙烷易溶于四氯化碳,故试
管①中可能出现的实验现象是橙红色褪去,液体不分层;
试管②中装有溴水,乙烯与Br2发生的反应为CH2==CH2+Br2―→BrCH2CH2Br,1,2-二溴乙烷的密度比水的大,难溶于水,故试管②中可能出现的实验现象为橙黄色褪去,液体分层。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(2)试管③中装的是酸性高锰酸钾溶液,发生的反应类型为__________。
氧化反应
试管③中装有的是酸性高锰酸钾溶液,乙烯使酸性高锰酸钾溶液褪色,乙烯发生氧化反应。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(3)写出试管①中发生反应的化学方程式:_______________________
_______________,反应类型为__________。
CH2==CH2+Br2―→
CH2Br—CH2Br
加成反应
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(4)做乙烯燃烧实验之前必须进行的操作是_______________,乙烯燃烧可能观察到的现象是_______________________。
检验乙烯的纯度
产生明亮火焰并伴有黑烟
不纯的乙烯燃烧时可能发生爆炸,故做乙烯燃烧实验之前必须进行的操作是检验乙烯的纯度;乙烯中含碳元素的质量分数较大,乙烯燃烧放出大量的热,则乙烯燃烧可能观察到的现象是产生明亮火焰并伴有黑烟。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
16.为探究乙烯与溴的加成反应,甲同学设计并进行了如下实验:先取一定量的工业用乙烯气体(在储气瓶中),使气体通入溴水中,发现溶液褪色,即证明乙烯与溴水发生了加成反应。
乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色浑浊物质,推测在工业上制得的乙烯中还可能含有少量还原性的气体杂质,由此他提出必须先除去杂质,然后再使乙烯与溴水反应。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
请回答下列问题:
(1)甲同学的实验中有关的化学方程式为______________________________。
(2)甲同学设计的实验______(填“能”或“不能”)验证乙烯与溴发生加成反应,其理由是______(填字母)。
A.使溴水褪色的反应,未必是加成反应
B.使溴水褪色的反应,就是加成反应
C.使溴水褪色的物质,未必是乙烯
D.使溴水褪色的物质就是乙烯
CH2==CH2+Br2―→CH2BrCH2Br
不能
AC
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(3)乙同学推测此乙烯中必定含有的一种杂质气体是______,它与溴水反应的化学方程式是______________________。在验证过程中必须全部除去,除去该杂质的试剂可选用__________________________。
(4)为了验证乙烯与溴水的反应是加成反应而不是取代反应,可采取方法有__________________________________________________________
_________。
H2S
H2S+Br2===2HBr+S↓
CuSO4溶液(或NaOH溶液等)
分别用pH计测量反应前后溴水的pH,若反应后pH明显减小,则是
取代反应
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
由“乙烯中还可能含有少量还原性的气体杂质”“褪色后的溶液里有少许淡黄色浑浊物质”可以推断还原性气体为H2S。如果乙烯与溴发生取代反应,必定生成溴化氢(HBr),溶液酸性将会明显增强,故可用pH计加以验证。
返回
本课结束
专题8
第3课时
DISANKESHI
石油炼制 / 乙烯的分子结构与性质 / 不饱和烃、乙炔的结构及性质 / 随堂演练 知识落实 / 课时对点练
石油炼制 乙烯
专题8
核心素养
发展目标
1.知道石油炼制的方法(分馏、催化裂化、裂解等)、目的、主要产品及在生产生活中的应用,培养“科学态度和社会责任”的学科素养。
2.掌握乙烯的组成、结构、性质和变化,形成“结构决定性质”的观念,培养“宏观辨识与微观探析”的能力。
3.掌握乙烯的化学性质,知道氧化反应、加成反应等反应类型,能通过分析推理认识乙烯发生加成反应时断键和成键情况,培养“证据推理与模型认知”的能力。
内容索引
一、石油炼制
二、乙烯的分子结构与性质
三、不饱和烃、乙炔的结构及性质
随堂演练 知识落实
课时对点练
石油炼制
一
石油是一种重要的化石燃料,其组成元素主要是碳和氢,同时还含有少量的硫、氧、氮等元素。石油中含多种 ,并溶有少量的_____
和 烃。分馏、催化裂化、裂解等都是炼制加工石油的常用手段。
液态烃
气态
固态
1.分馏
(1)观察思考
物质 石油气 汽油 煤油 柴油 润滑油
沸点 低于20 ℃ 20~200 ℃ 175~275 ℃ 250~400 ℃ 高于350 ℃
①温度计水银球的位置: ,目的是测 的温度。
②冷凝管内冷凝水的流向是 进, 出,这样 效果好。
③60~150 ℃的馏分是 ,150~300 ℃的主要馏分是 。汽油和煤油燃烧时火焰 ,其中煤油产生的烟更 。
物质 石油气 汽油 煤油 柴油 润滑油
沸点 低于 20 ℃ 20~200 ℃ 175~275 ℃ 250~400 ℃ 高于
350 ℃
蒸馏烧瓶支管口处
蒸出馏分
下口
上口
冷凝
汽油
煤油
明亮
黑
(2)分馏
根据各成分 不同,通过加热汽化,然后冷凝,可得到石油不同
范围内的产物,称为石油的分馏。随着馏分中烃分子含有的碳原子数增加,碳链 ,相对分子质量 ,它们的沸点逐渐 。
沸点
沸点
增长
增大
升高
2.催化裂化
(1)原理:用 中沸点较高的馏分为原料,在___________
存在条件下,使 较大、 较高的烃断裂为 较小、 较低的烃。
(2)目的:提高石油分馏产品中低沸点的 等轻质油的 和 。
(3)举例(十六烷的裂化)
化学方程式: 。
石油分馏产品
加热、加压
和催化剂
相对分子质量
沸点
相对分子质量
沸点
汽油
产量
质量
3.裂解
(1)原理:以比裂化更高的温度使石油分馏产物(包括石油气)中的_______
断裂为 、 等气态短链烃。
(2)目的:获得纯度较高的 、 等化工原料。目前石油裂解已经成为生产 的主要方法。因此, 的产量可以衡量一个国家石油化工发展水平。
长链烃
乙烯
丙烯
乙烯
丙烯
乙烯
乙烯
正误判断
(1)石油是一种重要的化石燃料,也是重要的化工原料( )
(2)在石油中只有液态烃,没有气态和固态烃( )
(3)石油的分馏为物理变化,获取的各种产品为混合物( )
(4)石油的裂化和裂解原理相同,目的也相同( )
(5)石油的裂化是生产乙烯的主要方法( )
(6)含C20以上的烷烃的重油经过催化裂化可以获得汽油( )
√
×
√
×
×
√
1.石油的分馏、催化裂化、裂解分别属于哪种变化类型?
深度思考
提示 石油的分馏属于物理变化,催化裂化、裂解属于化学变化。
2.教材中描述“石油在加工炼制过程中可以发生催化裂化反应”,直馏汽油与裂化汽油的主要成分有什么区别?
深度思考
提示 直馏汽油的主要成分是液态烷烃;裂化汽油的主要成分是液态烷烃和烯烃。
应用体验
1.右图是石油分馏塔的示意图。对a、b、c三种馏分的叙述正确的是
A.a的沸点最高
B.b的熔点最低
C.c的平均相对分子质量最大
D.每一种馏分都是纯净物
√
石油经加热后从下部进入分馏塔中,随着气体的上升温度逐渐降低,沸点高的馏分首先冷凝从下部流出,越往上馏分沸点越低,故a处馏分沸点最低,A错误;
b处馏分熔点介于a、c之间,B错误;
c处的平均相对分子质量是最大的,C正确;
石油分馏的馏分中都含有不同碳原子数的烃,所以石油分馏的馏分都是混合物,D错误。
2.实验室用下列仪器组装一套蒸馏石油的装置,并进行蒸馏得到汽油和煤油。
(1)写出下列仪器的名称:
①_______;②_________;③_______。
(2)将以上仪器按从左到右顺序,用字母a、b、c…进行连接:e接( );( )接( );( )接( )接( )。
冷凝管
蒸馏烧瓶
锥形瓶
c
d
a
b
f
g
(3)仪器的A口是_______,B口是_______。
(4)蒸馏时,温度计的水银球应在_________________。
(5)在②中注入原油后,加几片碎瓷片的目的是_________。
进水口
出水口
蒸馏烧瓶支管口处
防止暴沸
返回
乙烯的分子结构与性质
二
1.乙烯的组成与结构
乙烯是一种不饱和烃,分子中含有 。
碳碳双键
(1)乙烯的表示方式
分子式 电子式 结构式
_____
结构简式 球棍模型 空间填充模型
___________
C2H4
CH2==CH2
(2)乙烯的结构特点
特点提醒 碳碳双键决定着乙烯的重要化学性质,所以乙烯的结构简式不能写成CH2CH2(碳碳双键不能省略)。
2.乙烯的物理性质
乙烯是一种 色、 的气体,密度比空气的 , 溶于水,易溶于四氯化碳等有机溶剂。
3.乙烯的化学性质
乙烷的化学键都是单键。乙烯分子中含有 和 。乙烷的化学性质比较 ,乙烯相对 。
无
稍有气味
略小
难
碳碳双键
碳氢单键
稳定
活泼
(1)乙烯的氧化反应
实验 现象及反应
点燃乙烯 火焰明亮,且伴有黑烟,同时放出大量热,
化学方程式为___________________________
把乙烯气体通入酸性高锰酸钾溶液中 酸性高锰酸钾溶液 ,CH2==CH2
褪色
结论:乙烯可以与氧气反应(燃烧),也可以被高锰酸钾氧化。
(2)乙烯的加成反应
装置及现象
现象:溴的四氯化碳溶液_____
微观探析 乙烯分子双键中的 断裂,两个碳原子分别与一个溴原子结合,生成无色的1,2-二溴乙烷
一个键
褪色
化学方程式
+Br—Br―→
1,2-二溴乙烷
(3)加成反应
有机物分子中 连接的碳原子与其他原子或原子团直接结合生成新的化合物的反应。
乙烯不仅可以与溴发生加成反应,在一定条件下还可以与水、氢气、卤化氢等物质发生加成反应。
反应 化学方程式
与Cl2加成 _____________________________
与H2加成
_____________________________
双键(或三键)
CH2==CH2+Cl2―→CH2ClCH2Cl
与HCl加成
_________________________________
与H2O加成
_________________________________
(工业制乙醇)
4.乙烯的用途
(1)乙烯的产量可以用来衡量一个国家的石油化工发展水平。
(2)乙烯是一种植物生长调节剂,可作为果实催熟剂。
(3)乙烯是一种基本化工原料。
正误判断
(1)乙烯和乙烷都为碳氢化合物,因此性质相同( )
(2)乙烯的化学性质比乙烷的活泼( )
(3)乙烯能使酸性KMnO4溶液和溴水褪色,且反应原理相同( )
(4)用裂化汽油萃取溴水中的溴单质( )
(5)乙烷中混有乙烯,可通过与H2在一定条件下反应使乙烯转化为乙烷( )
(6)可以用CH2==CH2与Cl2反应制取较纯净的CH2ClCH2Cl( )
×
√
×
×
×
√
1.对比乙烷、乙烯的分子式和结构式,你能得出什么结论?
深度思考
提示 在烃分子中,每增加一个碳碳双键,氢原子数比相同碳原子数的饱和烃少2个。
2.能不能选用酸性KMnO4溶液除去乙烷中的乙烯?
深度思考
提示 除去乙烷中的乙烯只能选用溴水,而不能选用酸性KMnO4溶液,这是因为酸性KMnO4溶液氧化乙烯生成CO2,又引入了新的杂质CO2。
3.CH2==CHCl、CH2==CHCH3中的所有原子均共面吗?
深度思考
提示 CH2==CHCl可写为 ,所有原子共面。
CH2==CHCH3可写为 ,所有原子不共面。
应用体验
1.使1 mol乙烯与氯气发生完全加成反应,然后使该加成反应的产物与氯气在光照的条件下发生取代反应,则两个过程中消耗氯气的总物质的量最多是
A.3 mol B.4 mol C.5 mol D.6 mol
√
1 mol乙烯能与1 mol Cl2发生加成反应,而1 mol加成产物(CH2ClCH2Cl)中含有4 mol氢原子,被氯原子完全取代时消耗4 mol Cl2,所以共消耗5 mol Cl2。
2.下列物质不可能是乙烯的加成产物的是
A.CH3CH3 B.CH3CHCl2
C.CH3CH2OH D.CH3CH2Br
√
归纳总结
取代反应和加成反应的比较
取代反应 加成反应
反应物特征 含有易被取代的原子或原子团
不饱和有机化合物(含
或—C≡C—等)
生成物 两种 一种
碳碳键变化 无变化
或—C≡C—中一个或
两个键断裂
归纳总结
反应特点 一上一下 断一加二(或断二加四)
举例
返回
不饱和烃、乙炔的结构及性质
三
1.不饱和烃
碳原子所结合的氢原子数 饱和烃里的氢原子数的 属于不饱和烃,如烯烃和炔烃,乙炔是最简单的炔烃。
2.乙炔的组成与结构
(1)乙炔是一种不饱和烃,是最简单的炔烃,四个原子都在 上。
小于
碳氢化合物
同一条直线
(2)乙炔的表示方式
分子式 电子式 结构式
C2H2 ______________ H—C≡C—H
结构简式 球棍模型 空间填充模型
HC≡CH
3.乙炔的化学性质
(1)氧化反应
4CO2+2H2O
浓烟
褪色
(2)加成反应
乙炔与足量溴的四氯化碳溶液反应:
HC≡CH+Br2―→ ;
+Br2―→ 。
正误判断
(1)乙烷、乙烯和乙炔都是碳氢化合物,它们互为同系物( )
(2)乙炔能使酸性KMnO4溶液褪色,是因为乙炔能被KMnO4氧化( )
(3)乙炔分子中含有碳碳三键,键能大,故乙炔的化学性质非常稳定( )
(4)乙炔具有可燃性,在点燃前一定要验纯( )
(5)可用燃烧的方法鉴别乙烷和乙炔( )
(6)乙炔和乙烯都能使溴水褪色,且两者反应原理相同( )
×
√
×
√
√
√
应用体验
1.区别CH4、CH2==CH2、CH≡CH的最简易方法是
A.分别通入溴水
B.分别通入酸性高锰酸钾溶液
C.分别在空气中点燃
D.分别通入盛有碱石灰的干燥管
√
CH2==CH2和CH≡CH都能使溴水和酸性高锰酸钾溶液褪色,A、B错误;
三种气体通过盛有碱石灰的干燥管均无现象,D错误;
最简易的方法是点燃,因为燃烧时火焰的明亮程度和有无黑烟、浓烟这两个方面的现象区别是非常明显的,C正确。
2.下列关于乙炔性质的叙述中,既不同于乙烯又不同于乙烷的是
A.能燃烧生成二氧化碳和水
B.能发生加成反应
C.能使酸性KMnO4溶液褪色
D.能与氯化氢反应生成氯乙烯
√
乙烷、乙烯、乙炔均能燃烧生成二氧化碳和水;乙烯、乙炔中均含有碳碳不饱和键,既能与Br2、H2等物质发生加成反应,又能被酸性KMnO4溶液氧化,使酸性KMnO4溶液褪色;乙炔能与氯化氢发生加成反应生成氯乙烯,乙烷与氯化氢不反应,乙烯与氯化氢发生加成反应生成氯乙烷,故选项D符合题意。
归纳总结
乙烷、乙烯和乙炔的比较
名称 比较 乙烷 乙烯 乙炔
结构特点 碳碳单键,碳原子饱和,所有原子不在同一平面上 碳碳双键,碳原子不饱和,所有原子均在同一平面上 碳碳三键,碳原子不饱和,所有原子均在一条直线上
归纳总结
所属烃类通式 CnH2n+2(n≥1) CnH2n(n≥2) CnH2n-2(n≥2)
取代反应 与卤素单质间的反应 — —
加成反应 — 能够与H2、X2、HX、H2O等发生加成反应 氧化反应 不能使酸性高锰酸钾溶液褪色 能使酸性高锰酸钾溶液褪色
归纳总结
氧化反应 燃烧产生淡蓝色火焰 燃烧火焰明亮,且伴有黑烟 燃烧火焰很明亮,且伴有浓烟
鉴别 不能使溴水或酸性高锰酸钾溶液褪色 能使溴水或酸性高锰酸钾溶液褪色 返回
随堂演练 知识落实
1.石油是工业的“血液”,开发利用南海丰富的石油资源,对广东乃至全国的经济发展意义重大。下列关于石油的说法正确的是
A.石油的裂解属于物理变化
B.石油裂解的产物主要为饱和烃
C.石油的分馏属于化学变化
D.石油的主要成分是烃类物质
1
2
3
4
√
5
1
2
3
4
裂解为长链烃转化为乙烯、丙烯等,则石油裂解属于化学变化,故A错误;
石油裂解的产物主要是不饱和烃,故B错误;
石油分馏属于物理变化,故C错误。
5
2.(2022·上海市第二中学高二阶段练习)若要除去甲烷中混有的少量乙烯的杂质,可选择的方法有
A.催化加氢
B.通入足量溴水
C.通入足量酸性高锰酸钾溶液
D.通入足量氢氧化钠溶液
1
2
3
4
√
5
1
2
3
4
催化加氢,乙烯转化为乙烷,但又引入乙烷和未反应完的氢气杂质,故A不符合题意;
通入足量溴水,乙烯与Br2发生加成反应被除去且不引入杂质,故B符合题意;
通入足量酸性高锰酸钾溶液,乙烯被氧化为二氧化碳,引入了新的杂质,故C不符合题意;
通入足量氢氧化钠溶液,乙烯不与氢氧化钠反应,故D不符合题意。
5
3.乙烯和乙炔都能使溴的四氯化碳溶液褪色,这是由于乙烯和乙炔
A.是同系物
B.都属于烃
C.都易被氧化
D.都含有价键不饱和的碳原子
√
1
2
3
4
5
4.下列有关乙烯和乙烷的说法错误的是
A.乙烯分子中所有原子一定共平面而乙烷分子中所有原子不可能在同一
平面内
B.乙烯的化学性质比乙烷的活泼,乙烯中组成碳碳双键的两个化学键
活性完全相同
C.不能用酸性KMnO4溶液除去乙烷中混有的乙烯
D.可以用酸性KMnO4溶液鉴别乙烯和乙烷
1
2
3
4
√
5
1
2
3
4
乙烯含有碳碳双键,为不饱和烃,乙烷为立体空间构型,碳原子达到饱和,所有原子不可能在同一平面内,故A正确;
乙烯含有碳碳双键,可发生加成反应、氧化反应,乙烯的化学性质比乙烷的活泼,但乙烯中组成双键的两个化学键,活性不同,故B错误;
因为乙烯被高锰酸钾氧化为二氧化碳,引入新杂质,所以酸性KMnO4溶液不能除去乙烷中混有的乙烯,故C正确;
乙烯含有碳碳双键,可以使酸性高锰酸钾溶液褪色,乙烷为饱和烃,不能使酸性高锰酸钾溶液褪色,酸性KMnO4溶液可以鉴别乙烯和乙烷,故D正确。
5
5.(1)乙烯能使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色,其中,与高锰酸钾发生的反应是_______反应(填反应类型,下同);与溴发生的反应是______反应。
1
2
3
4
氧化
加成
乙烯分子中的碳碳双键易断裂,因此易被酸性高锰酸钾氧化,能与溴发生加成反应。
5
(2)一种能使溴水褪色的气态烃,标准状况下5.6 L该气态烃的质量为10.5 g,10.5 g该烃完全燃烧时生成16.8 L二氧化碳(标准状况)和13.5 g水。则该烃的分子式为_______。
C3H6
1
2
3
4
5
设该气态烃的分子式为CxHy,
1
2
3
4
5
0.25 mol 0.75 mol 0.75 mol
则x=3,y=6,该气态烃的分子式为C3H6。
返回
1
2
3
4
5
课时对点练
题组一 石油的炼制
1.下列有关石油的炼制及产品,说法正确的是
A.含C20以上烷烃的重油经减压分馏可以得到煤油和柴油
B.石油分馏所得的馏分都是混合物
C.通过石油分馏可以获得大量的短链烃
D.石油分馏得到汽油、煤油、乙烯等产品
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
2.(2022·南京高一检测)下列关于石油组成及炼制,说法错误的是
A.石油中含有C5~C12的烷烃,可以通过石油的分馏得到汽油
B.含C20以上的烷烃的重油经过催化裂化可以得到汽油
C.石油裂解产物中含有乙烯、丙烯等
D.石油裂解是为了得到高质量的轻质油
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
石油裂解的目的是得到所需纯度的乙烯、丙烯等气态短链烃。而催化裂化的目的是提高汽油等轻质油的产量和质量,二者不能混为一谈。
3.下列说法正确的是
A.汽油与水不相溶,故可用裂化汽油萃取碘水中的碘
B.裂化汽油和直馏汽油都可以与溴水反应使其褪色
C.石油的分馏为物理变化,裂化和裂解都为化学变化
D.石油分馏产品沸点范围:汽油>煤油>柴油>重油
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
裂化汽油是石油通过裂化得到的,含有不饱和烃,不饱和烃能和碘单质发生加成反应,所以裂化汽油不能萃取碘水中的碘,故A错误;
直馏汽油主要成分为饱和烃,不能与溴水反应使其褪色,故B错误;
石油的分馏为物理变化,裂化和裂解都为烃的分解反应为化学变化,故C正确;
石油分馏时,首先分馏出的是汽油,其次是煤油,再次是柴油、重油,故其沸点:汽油<煤油<柴油<重油,故D错误。
题组二 乙烯和乙炔的结构、性质与应用
4.能证明乙烯分子里含有一个碳碳双键的事实是
A.乙烯分子里碳、氢原子个数之比为1∶2
B.乙烯完全燃烧生成的CO2和H2O的物质的量相等
C.乙烯易与溴水发生加成反应,且1 mol乙烯完全加成消耗1 mol溴单质
D.乙烯能使酸性KMnO4溶液褪色
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
乙烯分子里碳、氢原子个数之比是由有机物的结构决定的,不能证明其含有一个碳碳双键;乙烯的燃烧产物不能证明其含有碳碳双键的个数;乙烯的加成反应与碳碳双键有直接关系,1 mol碳碳双键消耗1 mol溴单质;不饱和的碳碳双键或碳碳三键均能使酸性KMnO4溶液褪色。
5.(2022·广西南宁市第五十六中学高一期末)下列各组中的两个反应所属反应类型相同的是
A.光照条件下,甲烷和氯气混合气体颜色变浅;乙烯使溴水褪色
B.乙烯能使溴水褪色;乙烯能使酸性高锰酸钾溶液褪色
C.丁烷在氧气中燃烧;丙烯使酸性高锰酸钾溶液褪色
D.工业上由乙烯和水反应生成乙醇;乙烯在空气中燃烧
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
光照条件下甲烷和氯气发生取代反应,乙烯与溴水发生加成反应,反应类型不同,A错误;
乙烯能使溴水褪色发生加成反应,乙烯使高锰酸钾溶液褪色,乙烯发生氧化反应,反应类型不同,B错误;
丁烷在氧气中燃烧,丁烷发生氧化反应,丙烯使酸性高锰酸钾溶液褪色,丙烯发生氧化反应,C正确;
乙烯和水发生加成反应制乙醇,乙烯在空气中燃烧,乙烯发生氧化反应,反应类型不同,D错误。
6.下列叙述错误的是
A.1 mol CH2==CH2先与HCl发生加成反应,再与Cl2发生取代反应,最多
消耗2.5 mol Cl2
B.实验室中可用如图所示方法除去CH3CH3
气体中混有的CH2==CH2气体
C.实验室中可用酸性KMnO4溶液鉴别CH3CH3和CH2==CH2
D.工业上可利用CH2==CH2与HCl的加成反应制得纯净的CH3CH2Cl
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1 mol CH2==CH2和HCl反应生成1 mol CH3CH2Cl,1 mol CH3CH2Cl中含5 mol H原子,最多需要消耗5 mol Cl2,故A错误;
CH3CH3和溴水不发生反应,CH2==CH2可以和溴水发生反应生成液态的CH2BrCH2Br,B正确;
CH3CH3和酸性KMnO4溶液不发生反应,CH2==CH2能被酸性KMnO4溶液氧化,酸性KMnO4溶液褪色,C正确;
CH2==CH2和HCl发生加成反应生成唯一产物CH3CH2Cl,D正确。
7.甲烷、乙烯、乙炔都是常见的有机化合物。下列说法错误的是
A.无论是乙烯与Br2的加成,还是乙烯使酸性KMnO4溶液褪色,都与
分子内含有碳碳双键有关
B.用溴的四氯化碳溶液或酸性KMnO4溶液都可以鉴别乙烯和甲烷
C.相同质量的乙烯和甲烷完全燃烧后产生的水的质量相同
D.乙烯与乙炔都能使溴的四氯化碳溶液褪色,原理相同
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
乙烯的加成反应和氧化反应过程中碳碳双键断裂,A项正确;
乙烯能与Br2和酸性KMnO4溶液发生反应,但是甲烷不能,故能用溴的四氯化碳溶液或酸性KMnO4溶液鉴别乙烯和甲烷,B项正确;
乙烯和甲烷中氢元素的质量分数不同,故相同质量的乙烯和甲烷完全燃烧后产生的水的质量不同,C项错误;
乙烯、乙炔均能与Br2发生加成反应而使溴的四氯化碳溶液褪色,D项正确。
8.(2022·吉林吉化第一高级中学校高一期中)0.5 mol某气态烃能与0.5 mol Cl2完全加成,加成产物又可被3 mol Cl2完全取代,则此气态烃可能是
A.CH2==CH2
B.CH3—CH==CH2
C.CH2==CHCH2CH3
D.CH2==CH—CH==CH2
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
0.5 mol某气态烃能与0.5 mol Cl2完全加成,可知该烃分子中含1个碳碳双键,且0.5 mol加成产物又可被3 mol Cl2完全取代,则此气态烃中含6个H原子,则该气态烃为CH2==CHCH3,故合理选项是B。
题组三 加成反应的概念及判断
9.下列各反应不属于加成反应的是
A.CH2==CH2+H—OH CH3—CH2—OH
B.CH3CH==CH2+Br2―→CH3CHBrCH2Br
C. +H2 CH3—CH2—OH
D.CH3—CH3+2Cl2 CH2Cl—CH2Cl+2HCl
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
D项中反应为取代反应。
10.某烯烃与H2加成后的产物为 ,则该烯烃可能的结构简式有
A.1种 B.2种 C.3种 D.4种
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
将两个含有氢原子的相邻碳原子之间的单键变双键即可,
如 ,在①②③④处均可使碳碳单键变为碳碳
双键,但①②处位置是等效的,所以该烯烃可能的结构简式有3种。
11.将15 g CH4和C2H4的混合气体通入盛有足量溴水的容器中,溴水的质量增加了7 g,则混合气体中CH4和C2H4的体积之比为
A.1∶2 B.2∶1 C.3∶2 D.2∶3
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
甲烷不能与溴水反应,乙烯可与Br2发生加成反应,因此,溴水质量增加是因为吸收了乙烯,故乙烯的物质的量为 =0.25 mol,则甲烷的物质的量为 =0.5 mol,相同条件下气体体积之比等于其物质的量之比,即CH4与C2H4体积之比为2∶1。
12.从柑橘中炼制萜二烯( ),下列有关它的推测,不正确的是
A.分子式为C10H16
B.它能使酸性高锰酸钾溶液褪色
C.该分子中所有的碳原子可能在同一个平面上
D.与过量的溴的四氯化碳溶液反应后产物为
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
该有机物含有10个C原子、16个H原子,则其分子式为C10H16,A项正确;
该有机物中含有 ,能被高锰酸钾氧化,使酸性高锰酸钾溶液褪色,B项正确;
该分子六元环中含有 ,结合甲烷的正四面体结构,所以该分子中所有的碳原子不可能在同一个平面上,C项错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
该有机物中含有 ,可发生加成反应,与过量溴的CCl4溶液可发
生完全加成反应生成 ,D项正确。
13.角鲨烯是一种高度不饱和烃类化合物,最初是从鲨鱼的肝脏中发现的,分子中含有多个碳碳双键,分子式为C30H50,具有生物氧化还原作用,从而增强机体的耐力与改善心脏功能,可用于癌症的防治,是一种无毒性的具有防病治病作用的海洋生物活性物质。下列叙述正确的是
①角鲨烯能使酸性KMnO4溶液褪色 ②角鲨烯能与氢气发生加成反应 ③角鲨烯只含碳、氢两种元素 ④角鲨烯易被氧化
A.①②③ B.①③④
C.②③④ D.①②③④
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
角鲨烯含碳碳双键,能使酸性KMnO4溶液褪色,能与氢气发生加成反应,易被氧化;由分子式可知,角鲨烯只含碳、氢两种元素。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
14.A是一种最简单的不饱和烃,是一种石油裂解产物,且A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型。根据图回答下列问题:
(1)写出A、B、C、D的结构简式:
A.___________,B._________,
C.___________,D.____________。
CH2==CH2
CH3CH3
CH3CH2Cl
CH3CH2OH
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(2)写出②③④三步反应的化学方程式,
并注明反应类型。
②_________________________________,
_________;
③_________________________________,_________;
④________________________________,_________。
加成反应
加成反应
取代反应
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
由题意可知A为乙烯,由乙烯的性质可知B、C、D分别为CH3CH3、CH3CH2Cl、CH3CH2OH,①②③都是加成反应,④为CH3CH3与Cl2的取代反应。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
15.(2022·湖南高一期中)乙烯是石油化工的重要基本原料。通过一系列化学反应,可以由乙烯得到有机高分子材料、药物等成千上万种有用的物质。
根据上述装置,回答下列问题:
(1)已知:1,2-二溴乙烷的密度比水的大,难溶于水,易溶于四氯化碳。
预测:试管①中装有溴的四氯化碳溶液,可能出现的实验现象是_______________________。试管②中装有溴水,可能出现的实验现象为_____________________。
橙红色褪去,液体不分层
橙黄色褪去,液体分层
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
试管①中装有溴的四氯化碳溶液,乙烯通入溴的四氯化碳溶液中发生反应CH2==CH2+Br2―→
BrCH2CH2Br,1,2-二溴乙烷易溶于四氯化碳,故试
管①中可能出现的实验现象是橙红色褪去,液体不分层;
试管②中装有溴水,乙烯与Br2发生的反应为CH2==CH2+Br2―→BrCH2CH2Br,1,2-二溴乙烷的密度比水的大,难溶于水,故试管②中可能出现的实验现象为橙黄色褪去,液体分层。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(2)试管③中装的是酸性高锰酸钾溶液,发生的反应类型为__________。
氧化反应
试管③中装有的是酸性高锰酸钾溶液,乙烯使酸性高锰酸钾溶液褪色,乙烯发生氧化反应。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(3)写出试管①中发生反应的化学方程式:_______________________
_______________,反应类型为__________。
CH2==CH2+Br2―→
CH2Br—CH2Br
加成反应
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(4)做乙烯燃烧实验之前必须进行的操作是_______________,乙烯燃烧可能观察到的现象是_______________________。
检验乙烯的纯度
产生明亮火焰并伴有黑烟
不纯的乙烯燃烧时可能发生爆炸,故做乙烯燃烧实验之前必须进行的操作是检验乙烯的纯度;乙烯中含碳元素的质量分数较大,乙烯燃烧放出大量的热,则乙烯燃烧可能观察到的现象是产生明亮火焰并伴有黑烟。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
16.为探究乙烯与溴的加成反应,甲同学设计并进行了如下实验:先取一定量的工业用乙烯气体(在储气瓶中),使气体通入溴水中,发现溶液褪色,即证明乙烯与溴水发生了加成反应。
乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色浑浊物质,推测在工业上制得的乙烯中还可能含有少量还原性的气体杂质,由此他提出必须先除去杂质,然后再使乙烯与溴水反应。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
请回答下列问题:
(1)甲同学的实验中有关的化学方程式为______________________________。
(2)甲同学设计的实验______(填“能”或“不能”)验证乙烯与溴发生加成反应,其理由是______(填字母)。
A.使溴水褪色的反应,未必是加成反应
B.使溴水褪色的反应,就是加成反应
C.使溴水褪色的物质,未必是乙烯
D.使溴水褪色的物质就是乙烯
CH2==CH2+Br2―→CH2BrCH2Br
不能
AC
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(3)乙同学推测此乙烯中必定含有的一种杂质气体是______,它与溴水反应的化学方程式是______________________。在验证过程中必须全部除去,除去该杂质的试剂可选用__________________________。
(4)为了验证乙烯与溴水的反应是加成反应而不是取代反应,可采取方法有__________________________________________________________
_________。
H2S
H2S+Br2===2HBr+S↓
CuSO4溶液(或NaOH溶液等)
分别用pH计测量反应前后溴水的pH,若反应后pH明显减小,则是
取代反应
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
由“乙烯中还可能含有少量还原性的气体杂质”“褪色后的溶液里有少许淡黄色浑浊物质”可以推断还原性气体为H2S。如果乙烯与溴发生取代反应,必定生成溴化氢(HBr),溶液酸性将会明显增强,故可用pH计加以验证。
返回
本课结束
专题8
