专题9 第二单元 第2课时 反应条件的控制 课件(共78张PPT)
文档属性
| 名称 | 专题9 第二单元 第2课时 反应条件的控制 课件(共78张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-10 22:38:07 | ||
图片预览









文档简介
(共78张PPT)
第2课时
DIERKESHI
Fe(OH)2制备条件的控制 / 铁及其化合物的相互转化 / 随堂演练 知识落实 / 课时对点练
反应条件的控制
专题9
核心素养
发展目标
1.通过实验掌握Fe(OH)2的制备原理及化学性质。
3.学习认识Fe(OH)2的性质,改进Fe(OH)2的制备方法。
2.在制备物质时,学会合理选择并控制好反应的条件。
4.学习认识元素及其化合物性质的视角及一般方法,能预测物质的性质和设计物质间转化的途径。
内容索引
一、Fe(OH)2制备条件的控制
二、铁及其化合物的相互转化
随堂演练 知识落实
课时对点练
Fe(OH)2制备条件的控制
一
1.反应条件对化学反应的 、 和 都会有不同程度的影响。在研究物质的性质和制备时,应依据 和____________
,合理选择并控制好反应条件,才能达到预期的效果。
方向
速率
限度
化学反应的规律
反应物、生成
物的特点
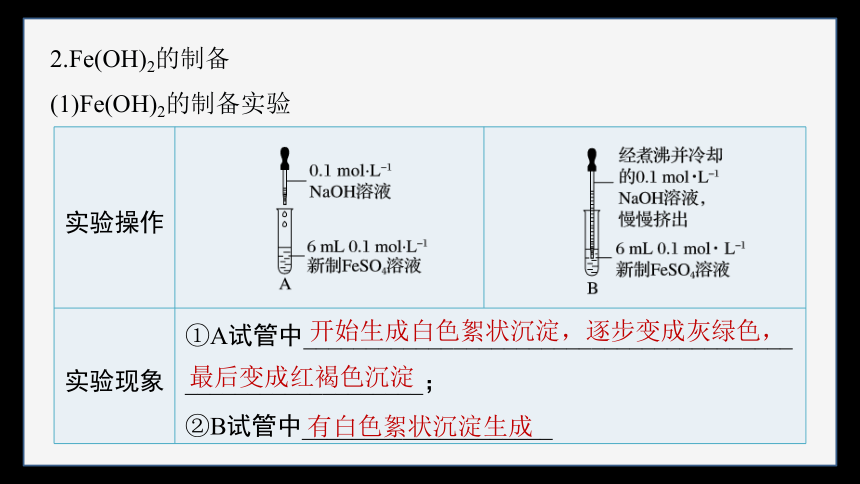
2.Fe(OH)2的制备
(1)Fe(OH)2的制备实验
实验操作
实验现象 ①A试管中_______________________________________ ___________________; ②B试管中____________________ 开始生成白色絮状沉淀,逐步变成灰绿色,
最后变成红褐色沉淀
有白色絮状沉淀生成
化学反 应方程式 FeSO4+2NaOH===Fe(OH)2↓+Na2SO4、4Fe(OH)2+O2+2H2O===4Fe(OH)3
实验结论 在不同的反应条件下,FeSO4溶液与NaOH溶液反应的实验现象不同,得到的产物也不同
B试管中成功制取Fe(OH)2的三个关键措施:
① 。
② 。
③ 。
煮沸NaOH溶液赶走溶解的氧
采用铁粉和稀H2SO4新制备FeSO4溶液
将吸有NaOH溶液的长胶头滴管插入液面以下,再将NaOH溶液挤出
(2)改进的常用方法
①有机层覆盖法
加入汽油、苯等比水轻的有机溶剂(如图)。由于苯的液封作用,可防止生成的Fe(OH)2被氧化,因而可较长时间观察到白色的Fe(OH)2沉淀。
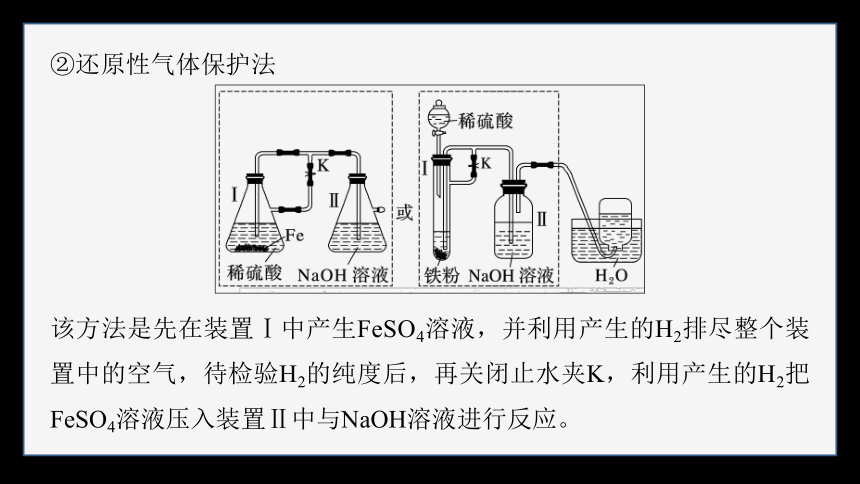
②还原性气体保护法
该方法是先在装置Ⅰ中产生FeSO4溶液,并利用产生的H2排尽整个装置中的空气,待检验H2的纯度后,再关闭止水夹K,利用产生的H2把FeSO4溶液压入装置Ⅱ中与NaOH溶液进行反应。
a
3.在化学研究和化学工业中,控制反应条件十分重要。需要严格控制反应的 、 ,选择合适的 ,确定 ,才能使物质制备的过程得以顺利进行。
温度
压强
催化剂
反应物的配比
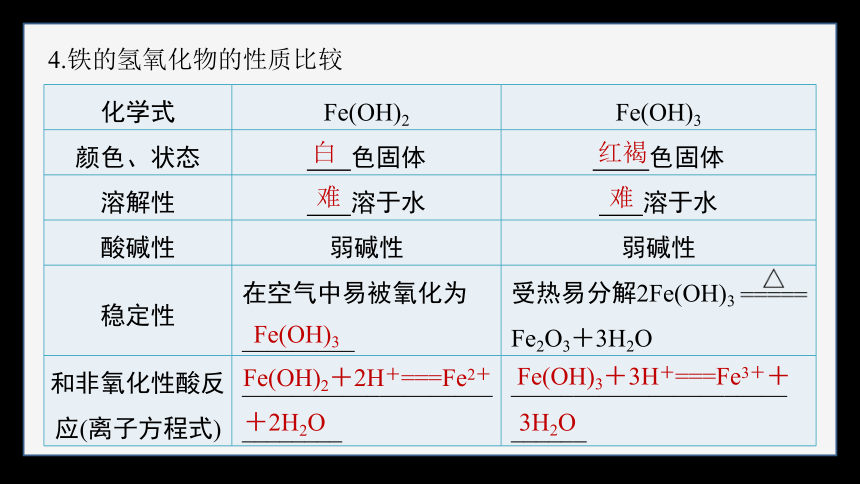
4.铁的氢氧化物的性质比较
化学式 Fe(OH)2 Fe(OH)3
颜色、状态 色固体 色固体
溶解性 溶于水 溶于水
酸碱性 弱碱性 弱碱性
稳定性 在空气中易被氧化为 _________ 受热易分解2Fe(OH)3
Fe2O3+3H2O
和非氧化性酸反应(离子方程式) ____________________ ________ ______________________
______
白
红褐
难
难
Fe(OH)3
Fe(OH)2+2H+===Fe2+
+2H2O
Fe(OH)3+3H+===Fe3++
3H2O
(1)向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅拌,即可制得白色的氢氧化亚铁( )
(2)Fe3O4中铁的化合价有+2和+3价,是一种混合物( )
(3)Fe(OH)3不能利用化合反应生成( )
(4)由于Fe(OH)2易被氧化,所以在制备时要隔绝空气( )
×
×
×
正误判断
√
深度思考
用不含Fe3+的FeSO4溶液与不含O2的蒸馏水配制的NaOH溶液反应制备Fe(OH)2沉淀。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时,除加硫酸防止生成Fe(OH)2外,还需加入______。
(2)除去蒸馏水中溶解的O2,常采用_____的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长胶头滴管吸取不含O2的NaOH溶液,插入FeSO4溶液的液面以下,再慢慢挤出NaOH溶液。这样操作的理由是_____________________________________________。
铁粉
煮沸
避免生成的Fe(OH)2沉淀接触O2转化成Fe(OH)3沉淀
应用体验
1.下列各图示中能较长时间看到Fe(OH)2白色沉淀的是
A.①②④ B.①②③
C.①② D.②③④
√
Fe(OH)2在空气中很容易被氧化为红褐色的Fe(OH)3沉淀,即发生反应:4Fe(OH)2+O2+2H2O===4Fe(OH)3。想要较长时间看到Fe(OH)2白色沉淀,就要排出装置中的氧气或空气。①②原理一样,都是先用氢气将装置中的空气排尽,并使生成的Fe(OH)2处在氢气的保护中;③由于溶液与空气直接接触,空气中的氧气能迅速将Fe(OH)2氧化,因而不能较长时间看到白色沉淀;④中苯阻止了空气的进入,能较长时间看到白色沉淀。
2.氢氧化铁在化学工业中可用作吸收剂,也可用于制药。实验室能够制得氢氧化铁的一组试剂是
A.氯化铁溶液和烧碱溶液 B.氧化铁和烧碱溶液
C.氧化铁和水 D.铁和水蒸气
√
氧化铁和烧碱溶液、水都不反应,铁和高温下的水蒸气反应生成Fe3O4。
归纳总结
制备Fe(OH)2的关键是隔绝空气(O2),可采取的措施有:
(1)Fe2+极易被氧化,所以FeSO4溶液要现用现配。
(2)为了防止Fe2+被氧化,配制FeSO4溶液的蒸馏水和NaOH溶液要煮沸,尽可能除去O2。
(3)为了防止滴加NaOH溶液时带入空气,可将吸有NaOH溶液的长滴管伸入FeSO4溶液的液面下,再挤出NaOH溶液。
(4)为防止Fe2+被氧化,还可以向盛有FeSO4溶液的试管中加入少量的煤油或其他密度小于水而不溶于水的有机物,以隔绝空气。
返回
铁及其化合物的相互转化
二
1.基于物质类别和元素价态的视角,构建铁及其化合物相互转化的铁元素的价类二维图如图所示:
①__________________________
②________________________
③ ____________________________
④ _____________________
⑤ _________________________
⑥ __________________
Fe2O3+6H+===2Fe3++3H2O
Fe3++3OH-===Fe(OH)3↓
Fe(OH)3+3H+===Fe3++3H2O
Fe+2H+===Fe2++H2↑
Cl2+2Fe2+===2Fe3++2Cl-
Fe+2Fe3+===3Fe2+
对于陌生物质,先依据物质类别的通性预测其性质,再依据元素价态预测其是否具有氧化性或还原性。如预测Fe2O3的性质:从物质类别来看,属于金属氧化物,预测其可与酸反应;从元素价态来看,铁元素
为高价态,预测其有氧化性,可与还原性物质反应。
2.铁元素与人体健康
(1)铁元素在人体膳食结构中分为血红素铁和非血红素铁。血红素铁是与血红蛋白、肌红蛋白中的卟啉结合的 ,而非血红素铁则主要以 形式存在于植物中。
(2)血红素铁容易被人体吸收利用,而非血红素铁则需要将三价铁还原为二价铁才能被吸收。维生素C具有 性,能将三价铁转化为二价铁,因此进食含铁的植物食品时,要补充一定量的维生素C以促进铁的吸收。
二价铁
三价铁
还原
应用体验
1.元素的价类二维图是我们学习元素及其化合物相关知识的重要模型和工具,它指的是以元素的化合价为纵坐标,以物质类别为横坐标所绘制的二维平面图像。如图为铁元素的价类二维图,其中的箭头表示部分物质间的转化关系,下列说法正确的是
A.铁与高温水蒸气的反应可实现上述转化①
B.灼烧Fe(OH)3发生转化⑥,加水溶解
可实现转化③
C.FeO是一种黑色粉末,不稳定,在空
气中受热,迅速发生转化②生成红棕
色粉末
D.由图可预测:高铁酸盐 具有强氧化性,可用于消毒,
与水反应最终可生成Fe(OH)3胶体,从而吸附水中的悬浮物,故高
铁酸盐可用作净水剂
√
高铁酸盐 中Fe元素的化合价为+6价,具有强氧化性,可用于杀菌消毒,与水反应最终生成Fe(OH)3胶体,吸附水中的悬浮物,可用于净水,D正确。
铁与高温水蒸气反应时生成Fe3O4,A错误;
灼烧Fe(OH)3分解生成Fe2O3,而Fe(OH)3不溶于水,B错误;
FeO是一种黑色粉末,不稳定,在空气中受热,迅速反应生成Fe3O4,C错误;
2.为探究铁和铁的化合物的一些化学性质,某实验小组学生设计了以下实验。
(1)往A、B溶液中分别滴入几滴KSCN溶液,溶液的颜色:A_______,B________。
(2)写出上述过程中有关反应的化学方程式:
Fe2O3→A:____________________________;
A→B:_____________________。
血红色
浅绿色
Fe2O3+6HCl===2FeCl3+3H2O
Fe+2FeCl3===3FeCl2
(3)B→C可看到的现象是_______________________________________
_______________。
(4)将A的饱和溶液滴入沸水中并不断加热,可制得________胶体;当光束通过该胶体时,可看到一条光亮的“通路”,这种现象称为_______效应。
先生成白色絮状沉淀,然后逐步变为灰绿色,
最终变成红褐色
Fe(OH)3
丁达尔
返回
随堂演练 知识落实
1.下列物质不能既由化合反应制得,又由复分解反应制得的是
A.FeCl2 B.FeCl3
C.Fe(OH)2 D.Fe(OH)3
√
1
2
3
4
1
2
3
4
A项,FeCl2可由化合反应Fe+2FeCl3===3FeCl2制得,也可由复分解反应如FeSO4+BaCl2===BaSO4↓+FeCl2制得;
B项,FeCl3可由化合反应2Fe+3Cl2 2FeCl3制得,也可由复分解反应如Fe2(SO4)3+3BaCl2===3BaSO4↓+2FeCl3制得;
C项,Fe(OH)2不能由化合反应制得,可由复分解反应如FeCl2+2NaOH===Fe(OH)2↓+2NaCl制得;
D项,Fe(OH)3可由化合反应4Fe(OH)2+O2+2H2O===4Fe(OH)3制得,也可由复分解反应如FeCl3+3NaOH===Fe(OH)3↓+3NaCl制得。
2.在空气中氢氧化亚铁白色沉淀可转化为红褐色沉淀。关于该反应的下列叙述不正确的是
A.生成物为氢氧化铁
B.该反应是化合反应
C.该反应是氧化还原反应
D.氢氧化亚铁作氧化剂
1
2
3
4
√
3.(2022·广东清远高一期末)铁元素的价类二维图如图,其中箭头表示部分物质间的转化关系,下列说法错误的是
A.Fe3O4是一种黑色有磁性的铁的氧化物,
可由Fe与水蒸气在高温下反应制得
B.为实现Fe2+向Fe3+的转化,可向含Fe2+
的溶液中通入Cl2或者滴加H2O2溶液
C.由图可预测:高铁酸盐 具有强氧化性,可将Fe2+转化为Fe3+
D.FeO、Fe2O3、Fe3O4均是碱性氧化物,均可与酸反应生成盐和水
√
1
2
3
4
1
2
3
4
Fe3O4是一种黑色有磁性的铁的氧化物,铁单质与水蒸气在高温下发生反应:3Fe+4H2O(g) Fe3O4+4H2,故A说法正确;
Fe2+转化成Fe3+,铁元素的化合价升高,需要加入氧化剂才能实现转化,如O2、Cl2、
H2O2等,故B说法正确;
中铁元素显+6价,具有强氧化性,能将Fe2+氧化成Fe3+,故C说法正确;
Fe3O4不是碱性氧化物,故D说法错误。
4.有人设计出一种在隔绝空气条件下让钠与FeSO4溶液反应的方法以验证其反应实质。实验时,往100 mL的大试管中先加40 mL煤油,取3粒米粒大小的金属钠放入大试管后塞上橡胶塞,通过长颈漏斗加入FeSO4溶液使煤油的液面上升至橡胶塞,并夹紧弹簧夹
(如图所示)。仔细观察,回答下列问题:
1
2
3
4
(1)大试管的下层溶液中出现的现象为__________________。
产生白色絮状沉淀
1
2
3
4
由于金属Na的密度比H2O的小,比煤油的大,故钠粒应位于两种液体的交界处,Na与FeSO4溶液接触的部分与H2O发生反应生成NaOH和H2,NaOH与FeSO4发生反应生成白色絮状沉淀Fe(OH)2,因隔绝了空气,制得的白色Fe(OH)2可以保存较长时间。
1
2
3
4
(2)装置中长颈漏斗内液面________(填“下降”或“上升”)。
上升
由于大试管内产生H2,大试管内压强增大,把大试管内的液体压入长颈漏斗中,故长颈漏斗内的液面上升。
1
2
3
4
(3)写出钠与FeSO4溶液反应的化学方程式:
_______________________________________
_______。
反应的化学方程式为2Na+2H2O===2NaOH+H2↑、2NaOH+FeSO4===Fe(OH)2↓+Na2SO4,将两个化学方程式相加得2Na+FeSO4+2H2O===Fe(OH)2↓+Na2SO4+H2↑。
2Na+FeSO4+2H2O===Fe(OH)2↓+Na2SO4
+H2↑
返回
课时对点练
题组一 Fe(OH)2的制备
1.下列实验操作能够制取Fe(OH)2并能较长时间观察到白色沉淀的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
B项中CCl4的密度比水大,应在下层,不能长时间观察到白色沉淀;
D项中的操作可防止氧气氧化Fe(OH)2,能较长时间观察到白色沉淀。
√
2.1 mol氢氧化亚铁在空气中变质,理论上需要标准状况下的空气(假设氧气占空气体积的 )
A.5.6 L B.22.4 L
C.28 L D.2.8 L
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
3.(2022·上海高一检测)实验室用FeCl2和烧碱制备Fe(OH)2,为了生成的产物不容易被氧化,下列说法不正确的是
A.配制FeCl2和烧碱溶液所用的蒸馏水通常要煮沸
B.可在FeCl2溶液的上面加一层苯,以隔绝空气
C.向FeCl2溶液中滴加烧碱溶液时,胶头滴管尖嘴不能伸入到试管内
D.产生Fe(OH)2沉淀后,不能震荡试管
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
FeCl2和烧碱溶液要现用现配,且配制溶液的蒸馏水要煮沸以除去氧气,确保在无氧的环境里生成Fe(OH)2,故A正确;
在FeCl2溶液的上面加一层苯或一层油,以隔绝空气防止氧气溶入,故B正确;
向FeCl2溶液中滴加烧碱溶液时,要将胶头滴管尖嘴伸入到FeCl2溶液中,防止氢氧化钠溶液在滴入时接触空气而溶有氧气,故C错误;
产生Fe(OH)2沉淀后,若震荡试管,会增大沉淀与空气接触的机会,使沉淀更易被氧化,故D正确。
4.如图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化。实验提供的试剂:铁屑、6 mol·L-1硫酸、NaOH溶液。下列说法错误的是
A.B中盛有一定量的NaOH溶液,A中应预先
加入的试剂是铁屑
B.实验开始时应先将活塞E关闭
C.生成Fe(OH)2的操作为关闭E,使A中溶液压入B瓶中
D.取下装置B中的橡皮塞,使空气进入,颜色变化为白色变成灰绿色,
最终变成红褐色
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
实验开始时应先将活塞E打开,用氢气排尽装置中的空气,B错误;
生成Fe(OH)2的操作为关闭E,使A中溶液压入B瓶中,C正确;
取下装置B中的橡皮塞,使空气进入,颜色变化为白色变成灰绿色,最终变成红褐色,D正确。
B中盛有一定量的NaOH溶液,A中Fe与稀硫酸反应产生FeSO4和H2,关闭E时,A中的H2将FeSO4压入B中与NaOH反应产生Fe(OH)2白色沉淀,A正确;
题组二 铁及其化合物的转化
5.(2022·南京月考)在指定条件下,下列有关铁单质的转化不能实现的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
Cl2具有强氧化性,可以把Fe氧化生成FeCl3,A不符合题意;
Fe与水蒸气反应生成Fe3O4,B符合题意;
HNO3具有强氧化性且足量,故此时Fe与硝酸反应生成Fe(NO3)3,C不符合题意;
Fe与CuSO4发生置换反应生成Cu和FeSO4,D不符合题意。
6.如图是物质间发生化学反应的颜色变化,下表选项中的物质对应正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选项 M N P Q
A NH3·H2O Ba(OH)2 铜 KSCN
B Na BaCl2 FeO KSCN
C NaOH Ba(NO3)2 锌粉 KSCN
D Na2O2 MgCl2 Fe KSCN
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
Ba(OH)2与Fe2(SO4)3反应得到的是Fe(OH)3与BaSO4的混合物,沉淀不是白色的,A项错误;
FeO不能还原Fe3+,B项错误;
MgCl2与Fe2(SO4)3不反应,D项错误。
7.铁的常见化合物有①FeO;②Fe2O3;③FeS;④Fe(OH)3; ⑤NH4Fe(SO4)2·12H2O;⑥FeSO4。将上述物质分别溶于足量的稀硫酸后进行实验。下列说法不正确的是
A.滴加KSCN溶液后无明显现象,滴加新制氯水后显血红色的有①③⑥
B.加入铜片,能发生反应的只有②④
C.滴加少量酸性KMnO4溶液紫红色褪去的有①③⑥
D.滴加KSCN溶液,溶液显血红色的有②④⑤
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
①FeO;②Fe2O3;③FeS;④Fe(OH)3;⑤NH4Fe(SO4)2·12H2O;⑥FeSO4
分别溶于足量稀硫酸后所得溶液依次为FeSO4、Fe2(SO4)3、FeSO4、Fe2(SO4)3、NH4Fe(SO4)2、FeSO4;滴加KSCN溶液后无明显现象的有①③⑥,其中的Fe2+具有还原性,能被新制氯水氧化为Fe3+,Fe3+遇KSCN溶液显血红色,故滴加新制氯水后显血红色的有①③⑥,A正确;
②④⑤中都有Fe3+,Fe3+具有氧化性,能够与Cu发生反应产生Fe2+、Cu2+,故加入铜片,能发生反应的有②④⑤,B错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
①③⑥中都有Fe2+,Fe2+具有还原性,会被酸性KMnO4溶液氧化而使酸性KMnO4溶液褪色,故滴加少量酸性KMnO4溶液紫红色褪去的有①③⑥,C正确;
滴加KSCN溶液,溶液显血红色,说明溶液中含有Fe3+,溶液中含Fe3+的有②④⑤,D正确。
8.下列除杂试剂或方法不正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选项 被提纯物质 杂质 除杂试剂或方法
A FeCl3溶液 FeCl2 通入适量Cl2
B FeCl2溶液 FeCl3 加入过量铁粉并过滤
C 铜粉 铁粉 加入过量盐酸并过滤
D Fe(OH)3 Fe(OH)2 在空气中灼烧
√
FeCl2与Cl2反应生成FeCl3,FeCl3与Fe粉反应生成FeCl2,A、B都正确;
Fe(OH)3、Fe(OH)2受热都易分解,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
9.联合国卫生组织经过考核和研究,认为我国使用的铁锅是有益于人类健康的理想炊具,并向全世界推广。其主要原因是
A.价格便宜,不易生锈
B.铁锅含有碳元素
C.烹调的食物中留有人体需要的铁元素
D.传热慢,保温性能好
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
价格是物质用途需考虑的因素之一,但不是有益于健康的理由,铁锅为铁合金,易发生电化学腐蚀生锈,A项错误;
铁锅为铁的合金,主要成分为铁,还含有碳等其他元素,使用铁锅主要是获得铁元素,不是为了获得碳元素,B项错误;
使用铁锅烹调的食物中留有人体需要的铁元素,铁是合成血红蛋白的主要元素,缺乏会患贫血,C项正确;
铁合金具有良好的导热性能,但保温性能差,D项错误。
10.某学生以铁丝和Cl2为原料进行下列三个实验。从反应条件的控制分析,下列说法不正确的是
A.实验①中不管Cl2是否足量,
产物均为FeCl3
B.实验②中,搅拌可加速FeCl3
的溶解
C.实验③中,必须严格控制好反应条件,才能制得Fe(OH)3胶体
D.实验③中,没有不断搅拌,故得不到Fe(OH)3胶体
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
Cl2具有强氧化性,和Fe反应,产物为FeCl3,故A正确;
搅拌可加速物质的溶解,故B正确;
严格控制好条件,才能制得Fe(OH)3胶体,故C正确、D错误。
11.下列中学常见实验的现象或表述正确的是
A.过量的铁投入到一定量的稀硝酸中,充分反应后取上层清液于试管
中,滴加KSCN溶液,溶液显血红色
B.制备氢氧化亚铁时,向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边
搅拌,即可制得白色的氢氧化亚铁
C.检验红砖中的氧化铁成分,向红砖粉末中加入盐酸,充分反应后取
上层清液于试管中,滴加KSCN溶液2~3滴即可
D.向FeCl3和BaCl2的混合溶液中通入SO2,溶液颜色由棕黄色变为浅绿
色,同时有白色沉淀生成,表明FeCl3具有还原性
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
过量的铁投入到一定量的稀硝酸中,铁先被硝酸氧化为三价铁,然后铁和三价铁反应生成亚铁离子,铁元素最终被氧化为+2价,滴加KSCN溶液,溶液不会显血红色,故A错误;
向硫酸亚铁溶液中滴加氢氧化钠溶液发生复分解反应生成氢氧化亚铁白色沉淀,搅拌后,氢氧化亚铁很容易被空气中的氧气氧化为氢氧化铁,得不到白色沉淀,故B错误;
氧化铁和盐酸反应生成氯化铁溶液和水,三价铁遇KSCN溶液会变血红色,故C正确。
12.(2022·沈阳高一下期末)H2S有剧毒,不能排放到空气中,将H2S和O2的混合气体通入FeCl3、CuCl2的混合溶液中反应回收S,其物质转化如图所示。下列说法错误的是
A.腐败的鱼、肉、蛋中都有硫化氢气体产生
B.O2在转化过程中发生的反应为O2+4Fe2++
4H+===4Fe3++2H2O
C.图示转化中,有三种元素的化合价未发生改变
D.为避免混合液失效,混合气体中 应大于2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
图示转化中,Cu、H、Cl的化合价没有变化,C项正确;
由图可知,总反应为2H2S+O2===2S↓+2H2O,Fe3+是混合液的成分之一,为避免混合液失效,混合气体中O2的含量要大一些,以保证Fe3+不会损失,故 应小于2,D项错误。
鱼、肉、蛋腐败时均能产生H2S,A项正确;
由题图可以看出,Fe2+在O2的作用下变成Fe3+,发生的反应为O2+4Fe2++4H+===4Fe3++2H2O,B项正确;
13.电子工业上使用的印刷电路板,是在敷有铜膜的塑料板上以涂层保护所要的线路,然后用三氯化铁浓溶液作用掉(腐蚀)未受保护的铜膜后形成的。某工程师为了从使用过的腐蚀废液(含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费)中回收铜,并将铁的化合物全部转化为FeCl3溶液作为腐蚀液原料循环使用,准备采用下列步骤:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(1)步骤Ⅰ的操作名称:_______;所需玻璃仪器:_______、______、
_______。
(2)写出FeCl3溶液与铜箔发生反应的离子方程式:_________________
_______。
(3)检验废腐蚀液中是否含有Fe3+所需试剂名称:_____________,实验现象:_______________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
过滤
烧杯
漏斗
玻璃棒
2Fe3++Cu===2Fe2+
+Cu2+
硫氰化钾溶液
溶液由棕黄色变为血红色
(4)向②中加入NaOH溶液并长时间暴露在空气中,此过程的现象:_______________________________________________________,此转化的化学方程式为__________________________________________
______________________。
(5)写出③中所含物质:________,⑥发生反应的离子方程式:__________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
先产生白色絮状沉淀,然后逐步变为灰绿色,最终变为红褐色
FeCl2+2NaOH===Fe(OH)2↓+2NaCl、4Fe(OH)2
+O2+2H2O===4Fe(OH)3
Fe、Cu
2Fe2++Cl2===2Fe3++2Cl-
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
废液中含有FeCl2、CuCl2、FeCl3,向废液中加入过量Fe,发生反应2Fe3++Fe===3Fe2+、Cu2++Fe===Fe2++Cu,然后过滤,滤液中含有FeCl2,滤渣中含有Cu、Fe,向滤渣中加入过量盐酸,Fe溶解,Cu不溶解,然后过滤得到金属单质Cu,滤液中含有FeCl2,向滤液中通入过量Cl2,发生的反应为2Fe2++Cl2===2Fe3++2Cl-,从而得到FeCl3溶液,以此解答该题。
14.铁是人体必需的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
试回答下列问题:
(1)试剂1是_______,试剂2是__________,加入新制氯水后溶液中发生反应的离子方程式是____________________________、_________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
稀盐酸
KSCN溶液
2Fe2++Cl2===2Fe3++2Cl-
Fe3++3SCN-===Fe(SCN)3
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
该药品不溶于水但能溶于人体中的胃酸,试剂1用于溶解样品,可以选用稀盐酸;试剂2用于检验三价铁离子,可以选用KSCN溶液;氯气氧化亚铁离子生成铁离子,离子方程式为2Fe2++Cl2===2Fe3++2Cl-;铁离子与硫氰根离子结合生成硫氰化铁,离子方程式为Fe3++3SCN-===Fe(SCN)3。
(2)加入试剂2后溶液中颜色由淡黄色转变为淡红色是因为___________
__________,写出+2价Fe在空气中转化为+3价Fe的化学方程式:________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
少量的Fe2+
转化为Fe3+
4FeCl2+O2+4HCl===4FeCl3+2H2O
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
Fe3+遇KSCN溶液变血红色,溶液由淡黄色变为淡红色,说明少量Fe2+被氧化成Fe3+;亚铁离子被空气中的氧气氧化为铁离子,化学方程式为4FeCl2+4HCl+O2===4FeCl3+2H2O。
(3)该同学猜想红色溶液变为无色溶液的原因是溶液中的+3价铁被还原为+2价铁,你认为该同学的猜想合理吗?_______。若你认为合理,请说明理由(若你认为不合理,该空不作答):_________;若你认为不合理请提出你的猜想并设计一个简单的实验加以验证(若你认为合理,该空不作答):_________________________________________________________________________________________________________________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
不合理
猜想:Fe(SCN)3中的SCN-被过量的氯水氧化;设计的实验为在褪色后的溶液中加入FeCl3溶液,不变红色或在褪色后的溶液中加入KSCN溶液,变血红色
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
因为氯水氧化性强,不会还原Fe3+,该同学的猜想不合理;可能是SCN-被过量的氯水氧化,可取少量褪色后的溶液,加入FeCl3溶液,不变红色(或取少量褪色后的溶液,加入KSCN溶液,变血红色)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
15.某研究小组同学欲探究某袋敞口放置一段时间的名为“硫酸亚铁家庭园艺精品肥料”的化肥的主要成分及相关性质。首先对该化肥的成分进行了如下假设:
a.只含有FeSO4 b.含有FeSO4和Fe2(SO4)3 c.只含有Fe2(SO4)3
将化肥固体粉末溶于水中得到溶液(记为X),进行如下实验:
序号 操作 现象
ⅰ 取2 mL溶液X,加入1 mL 1 mol·L-1 NaOH溶液 产生红褐色沉淀
ⅱ 取2 mL溶液X,加入1滴KSCN溶液 溶液显血红色
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(1)对实验ⅰ的预期现象是先产生白色沉淀,后逐步变为灰绿色,最后出现红褐色沉淀,预期产生该现象的依据是(用化学方程式或离子方程式表示)__________________________、__________________________
_________。
序号 操作 现象
ⅰ 取2 mL溶液X,加入1 mL 1 mol·L-1 NaOH溶液 产生红褐色沉淀
ⅱ 取2 mL溶液X,加入1滴KSCN溶液 溶液显血红色
Fe2++2OH-===Fe(OH)2↓
4Fe(OH)2+O2+2H2O===
4Fe(OH)3
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
FeSO4溶液与NaOH溶液反应生成白色沉淀Fe(OH)2,Fe(OH)2易被氧化为Fe(OH)3,所以预期现象是先产生白色沉淀,后逐步变为灰绿色,最后出现红褐色沉淀。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(2)由实验ⅱ得出的结论是___________________________________。为进一步验证假设,该小组同学进行了以下实验:
化肥中肯定有Fe2(SO4)3(或假设a不成立)
序号 操作 现象
ⅲ 取2 mL溶液X,加入1滴KSCN溶液,再加入1 mL水 溶液显血红色
ⅳ 取2 mL溶液X,加入1滴KSCN溶液,再加入1 mL氯水 溶液显血红色,颜色比ⅲ深
向溶液X中加入1滴KSCN溶液,溶液显血红色,说明含有Fe2(SO4)3,则假设a不成立。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
序号 操作 现象
ⅲ 取2 mL溶液X,加入1滴KSCN溶液,再加入1 mL水 溶液显血红色
ⅳ 取2 mL溶液X,加入1滴KSCN溶液,再加入1 mL氯水 溶液显血红色,颜色比ⅲ深
(3)实验ⅳ中氯水参加反应的离子方程式是_________________________。
Cl2+2Fe2+===2Cl-+2Fe3+
实验ⅳ说明溶液X中含有Fe2+,且Fe2+被氯水中的氯气氧化为Fe3+。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(4)通过以上实验,可得到的结论是_______________________________
___________。
实验ⅲ说明溶液X中含有Fe3+,综合实验ⅲ、ⅳ,可得到的结论是该化肥中含有FeSO4和Fe2(SO4)3或假设b成立。
该化肥中含有FeSO4和Fe2(SO4)3(或
假设b成立)
返回
本课结束
专题9
第2课时
DIERKESHI
Fe(OH)2制备条件的控制 / 铁及其化合物的相互转化 / 随堂演练 知识落实 / 课时对点练
反应条件的控制
专题9
核心素养
发展目标
1.通过实验掌握Fe(OH)2的制备原理及化学性质。
3.学习认识Fe(OH)2的性质,改进Fe(OH)2的制备方法。
2.在制备物质时,学会合理选择并控制好反应的条件。
4.学习认识元素及其化合物性质的视角及一般方法,能预测物质的性质和设计物质间转化的途径。
内容索引
一、Fe(OH)2制备条件的控制
二、铁及其化合物的相互转化
随堂演练 知识落实
课时对点练
Fe(OH)2制备条件的控制
一
1.反应条件对化学反应的 、 和 都会有不同程度的影响。在研究物质的性质和制备时,应依据 和____________
,合理选择并控制好反应条件,才能达到预期的效果。
方向
速率
限度
化学反应的规律
反应物、生成
物的特点
2.Fe(OH)2的制备
(1)Fe(OH)2的制备实验
实验操作
实验现象 ①A试管中_______________________________________ ___________________; ②B试管中____________________ 开始生成白色絮状沉淀,逐步变成灰绿色,
最后变成红褐色沉淀
有白色絮状沉淀生成
化学反 应方程式 FeSO4+2NaOH===Fe(OH)2↓+Na2SO4、4Fe(OH)2+O2+2H2O===4Fe(OH)3
实验结论 在不同的反应条件下,FeSO4溶液与NaOH溶液反应的实验现象不同,得到的产物也不同
B试管中成功制取Fe(OH)2的三个关键措施:
① 。
② 。
③ 。
煮沸NaOH溶液赶走溶解的氧
采用铁粉和稀H2SO4新制备FeSO4溶液
将吸有NaOH溶液的长胶头滴管插入液面以下,再将NaOH溶液挤出
(2)改进的常用方法
①有机层覆盖法
加入汽油、苯等比水轻的有机溶剂(如图)。由于苯的液封作用,可防止生成的Fe(OH)2被氧化,因而可较长时间观察到白色的Fe(OH)2沉淀。
②还原性气体保护法
该方法是先在装置Ⅰ中产生FeSO4溶液,并利用产生的H2排尽整个装置中的空气,待检验H2的纯度后,再关闭止水夹K,利用产生的H2把FeSO4溶液压入装置Ⅱ中与NaOH溶液进行反应。
a
3.在化学研究和化学工业中,控制反应条件十分重要。需要严格控制反应的 、 ,选择合适的 ,确定 ,才能使物质制备的过程得以顺利进行。
温度
压强
催化剂
反应物的配比
4.铁的氢氧化物的性质比较
化学式 Fe(OH)2 Fe(OH)3
颜色、状态 色固体 色固体
溶解性 溶于水 溶于水
酸碱性 弱碱性 弱碱性
稳定性 在空气中易被氧化为 _________ 受热易分解2Fe(OH)3
Fe2O3+3H2O
和非氧化性酸反应(离子方程式) ____________________ ________ ______________________
______
白
红褐
难
难
Fe(OH)3
Fe(OH)2+2H+===Fe2+
+2H2O
Fe(OH)3+3H+===Fe3++
3H2O
(1)向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅拌,即可制得白色的氢氧化亚铁( )
(2)Fe3O4中铁的化合价有+2和+3价,是一种混合物( )
(3)Fe(OH)3不能利用化合反应生成( )
(4)由于Fe(OH)2易被氧化,所以在制备时要隔绝空气( )
×
×
×
正误判断
√
深度思考
用不含Fe3+的FeSO4溶液与不含O2的蒸馏水配制的NaOH溶液反应制备Fe(OH)2沉淀。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时,除加硫酸防止生成Fe(OH)2外,还需加入______。
(2)除去蒸馏水中溶解的O2,常采用_____的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长胶头滴管吸取不含O2的NaOH溶液,插入FeSO4溶液的液面以下,再慢慢挤出NaOH溶液。这样操作的理由是_____________________________________________。
铁粉
煮沸
避免生成的Fe(OH)2沉淀接触O2转化成Fe(OH)3沉淀
应用体验
1.下列各图示中能较长时间看到Fe(OH)2白色沉淀的是
A.①②④ B.①②③
C.①② D.②③④
√
Fe(OH)2在空气中很容易被氧化为红褐色的Fe(OH)3沉淀,即发生反应:4Fe(OH)2+O2+2H2O===4Fe(OH)3。想要较长时间看到Fe(OH)2白色沉淀,就要排出装置中的氧气或空气。①②原理一样,都是先用氢气将装置中的空气排尽,并使生成的Fe(OH)2处在氢气的保护中;③由于溶液与空气直接接触,空气中的氧气能迅速将Fe(OH)2氧化,因而不能较长时间看到白色沉淀;④中苯阻止了空气的进入,能较长时间看到白色沉淀。
2.氢氧化铁在化学工业中可用作吸收剂,也可用于制药。实验室能够制得氢氧化铁的一组试剂是
A.氯化铁溶液和烧碱溶液 B.氧化铁和烧碱溶液
C.氧化铁和水 D.铁和水蒸气
√
氧化铁和烧碱溶液、水都不反应,铁和高温下的水蒸气反应生成Fe3O4。
归纳总结
制备Fe(OH)2的关键是隔绝空气(O2),可采取的措施有:
(1)Fe2+极易被氧化,所以FeSO4溶液要现用现配。
(2)为了防止Fe2+被氧化,配制FeSO4溶液的蒸馏水和NaOH溶液要煮沸,尽可能除去O2。
(3)为了防止滴加NaOH溶液时带入空气,可将吸有NaOH溶液的长滴管伸入FeSO4溶液的液面下,再挤出NaOH溶液。
(4)为防止Fe2+被氧化,还可以向盛有FeSO4溶液的试管中加入少量的煤油或其他密度小于水而不溶于水的有机物,以隔绝空气。
返回
铁及其化合物的相互转化
二
1.基于物质类别和元素价态的视角,构建铁及其化合物相互转化的铁元素的价类二维图如图所示:
①__________________________
②________________________
③ ____________________________
④ _____________________
⑤ _________________________
⑥ __________________
Fe2O3+6H+===2Fe3++3H2O
Fe3++3OH-===Fe(OH)3↓
Fe(OH)3+3H+===Fe3++3H2O
Fe+2H+===Fe2++H2↑
Cl2+2Fe2+===2Fe3++2Cl-
Fe+2Fe3+===3Fe2+
对于陌生物质,先依据物质类别的通性预测其性质,再依据元素价态预测其是否具有氧化性或还原性。如预测Fe2O3的性质:从物质类别来看,属于金属氧化物,预测其可与酸反应;从元素价态来看,铁元素
为高价态,预测其有氧化性,可与还原性物质反应。
2.铁元素与人体健康
(1)铁元素在人体膳食结构中分为血红素铁和非血红素铁。血红素铁是与血红蛋白、肌红蛋白中的卟啉结合的 ,而非血红素铁则主要以 形式存在于植物中。
(2)血红素铁容易被人体吸收利用,而非血红素铁则需要将三价铁还原为二价铁才能被吸收。维生素C具有 性,能将三价铁转化为二价铁,因此进食含铁的植物食品时,要补充一定量的维生素C以促进铁的吸收。
二价铁
三价铁
还原
应用体验
1.元素的价类二维图是我们学习元素及其化合物相关知识的重要模型和工具,它指的是以元素的化合价为纵坐标,以物质类别为横坐标所绘制的二维平面图像。如图为铁元素的价类二维图,其中的箭头表示部分物质间的转化关系,下列说法正确的是
A.铁与高温水蒸气的反应可实现上述转化①
B.灼烧Fe(OH)3发生转化⑥,加水溶解
可实现转化③
C.FeO是一种黑色粉末,不稳定,在空
气中受热,迅速发生转化②生成红棕
色粉末
D.由图可预测:高铁酸盐 具有强氧化性,可用于消毒,
与水反应最终可生成Fe(OH)3胶体,从而吸附水中的悬浮物,故高
铁酸盐可用作净水剂
√
高铁酸盐 中Fe元素的化合价为+6价,具有强氧化性,可用于杀菌消毒,与水反应最终生成Fe(OH)3胶体,吸附水中的悬浮物,可用于净水,D正确。
铁与高温水蒸气反应时生成Fe3O4,A错误;
灼烧Fe(OH)3分解生成Fe2O3,而Fe(OH)3不溶于水,B错误;
FeO是一种黑色粉末,不稳定,在空气中受热,迅速反应生成Fe3O4,C错误;
2.为探究铁和铁的化合物的一些化学性质,某实验小组学生设计了以下实验。
(1)往A、B溶液中分别滴入几滴KSCN溶液,溶液的颜色:A_______,B________。
(2)写出上述过程中有关反应的化学方程式:
Fe2O3→A:____________________________;
A→B:_____________________。
血红色
浅绿色
Fe2O3+6HCl===2FeCl3+3H2O
Fe+2FeCl3===3FeCl2
(3)B→C可看到的现象是_______________________________________
_______________。
(4)将A的饱和溶液滴入沸水中并不断加热,可制得________胶体;当光束通过该胶体时,可看到一条光亮的“通路”,这种现象称为_______效应。
先生成白色絮状沉淀,然后逐步变为灰绿色,
最终变成红褐色
Fe(OH)3
丁达尔
返回
随堂演练 知识落实
1.下列物质不能既由化合反应制得,又由复分解反应制得的是
A.FeCl2 B.FeCl3
C.Fe(OH)2 D.Fe(OH)3
√
1
2
3
4
1
2
3
4
A项,FeCl2可由化合反应Fe+2FeCl3===3FeCl2制得,也可由复分解反应如FeSO4+BaCl2===BaSO4↓+FeCl2制得;
B项,FeCl3可由化合反应2Fe+3Cl2 2FeCl3制得,也可由复分解反应如Fe2(SO4)3+3BaCl2===3BaSO4↓+2FeCl3制得;
C项,Fe(OH)2不能由化合反应制得,可由复分解反应如FeCl2+2NaOH===Fe(OH)2↓+2NaCl制得;
D项,Fe(OH)3可由化合反应4Fe(OH)2+O2+2H2O===4Fe(OH)3制得,也可由复分解反应如FeCl3+3NaOH===Fe(OH)3↓+3NaCl制得。
2.在空气中氢氧化亚铁白色沉淀可转化为红褐色沉淀。关于该反应的下列叙述不正确的是
A.生成物为氢氧化铁
B.该反应是化合反应
C.该反应是氧化还原反应
D.氢氧化亚铁作氧化剂
1
2
3
4
√
3.(2022·广东清远高一期末)铁元素的价类二维图如图,其中箭头表示部分物质间的转化关系,下列说法错误的是
A.Fe3O4是一种黑色有磁性的铁的氧化物,
可由Fe与水蒸气在高温下反应制得
B.为实现Fe2+向Fe3+的转化,可向含Fe2+
的溶液中通入Cl2或者滴加H2O2溶液
C.由图可预测:高铁酸盐 具有强氧化性,可将Fe2+转化为Fe3+
D.FeO、Fe2O3、Fe3O4均是碱性氧化物,均可与酸反应生成盐和水
√
1
2
3
4
1
2
3
4
Fe3O4是一种黑色有磁性的铁的氧化物,铁单质与水蒸气在高温下发生反应:3Fe+4H2O(g) Fe3O4+4H2,故A说法正确;
Fe2+转化成Fe3+,铁元素的化合价升高,需要加入氧化剂才能实现转化,如O2、Cl2、
H2O2等,故B说法正确;
中铁元素显+6价,具有强氧化性,能将Fe2+氧化成Fe3+,故C说法正确;
Fe3O4不是碱性氧化物,故D说法错误。
4.有人设计出一种在隔绝空气条件下让钠与FeSO4溶液反应的方法以验证其反应实质。实验时,往100 mL的大试管中先加40 mL煤油,取3粒米粒大小的金属钠放入大试管后塞上橡胶塞,通过长颈漏斗加入FeSO4溶液使煤油的液面上升至橡胶塞,并夹紧弹簧夹
(如图所示)。仔细观察,回答下列问题:
1
2
3
4
(1)大试管的下层溶液中出现的现象为__________________。
产生白色絮状沉淀
1
2
3
4
由于金属Na的密度比H2O的小,比煤油的大,故钠粒应位于两种液体的交界处,Na与FeSO4溶液接触的部分与H2O发生反应生成NaOH和H2,NaOH与FeSO4发生反应生成白色絮状沉淀Fe(OH)2,因隔绝了空气,制得的白色Fe(OH)2可以保存较长时间。
1
2
3
4
(2)装置中长颈漏斗内液面________(填“下降”或“上升”)。
上升
由于大试管内产生H2,大试管内压强增大,把大试管内的液体压入长颈漏斗中,故长颈漏斗内的液面上升。
1
2
3
4
(3)写出钠与FeSO4溶液反应的化学方程式:
_______________________________________
_______。
反应的化学方程式为2Na+2H2O===2NaOH+H2↑、2NaOH+FeSO4===Fe(OH)2↓+Na2SO4,将两个化学方程式相加得2Na+FeSO4+2H2O===Fe(OH)2↓+Na2SO4+H2↑。
2Na+FeSO4+2H2O===Fe(OH)2↓+Na2SO4
+H2↑
返回
课时对点练
题组一 Fe(OH)2的制备
1.下列实验操作能够制取Fe(OH)2并能较长时间观察到白色沉淀的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
B项中CCl4的密度比水大,应在下层,不能长时间观察到白色沉淀;
D项中的操作可防止氧气氧化Fe(OH)2,能较长时间观察到白色沉淀。
√
2.1 mol氢氧化亚铁在空气中变质,理论上需要标准状况下的空气(假设氧气占空气体积的 )
A.5.6 L B.22.4 L
C.28 L D.2.8 L
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
3.(2022·上海高一检测)实验室用FeCl2和烧碱制备Fe(OH)2,为了生成的产物不容易被氧化,下列说法不正确的是
A.配制FeCl2和烧碱溶液所用的蒸馏水通常要煮沸
B.可在FeCl2溶液的上面加一层苯,以隔绝空气
C.向FeCl2溶液中滴加烧碱溶液时,胶头滴管尖嘴不能伸入到试管内
D.产生Fe(OH)2沉淀后,不能震荡试管
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
FeCl2和烧碱溶液要现用现配,且配制溶液的蒸馏水要煮沸以除去氧气,确保在无氧的环境里生成Fe(OH)2,故A正确;
在FeCl2溶液的上面加一层苯或一层油,以隔绝空气防止氧气溶入,故B正确;
向FeCl2溶液中滴加烧碱溶液时,要将胶头滴管尖嘴伸入到FeCl2溶液中,防止氢氧化钠溶液在滴入时接触空气而溶有氧气,故C错误;
产生Fe(OH)2沉淀后,若震荡试管,会增大沉淀与空气接触的机会,使沉淀更易被氧化,故D正确。
4.如图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化。实验提供的试剂:铁屑、6 mol·L-1硫酸、NaOH溶液。下列说法错误的是
A.B中盛有一定量的NaOH溶液,A中应预先
加入的试剂是铁屑
B.实验开始时应先将活塞E关闭
C.生成Fe(OH)2的操作为关闭E,使A中溶液压入B瓶中
D.取下装置B中的橡皮塞,使空气进入,颜色变化为白色变成灰绿色,
最终变成红褐色
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
实验开始时应先将活塞E打开,用氢气排尽装置中的空气,B错误;
生成Fe(OH)2的操作为关闭E,使A中溶液压入B瓶中,C正确;
取下装置B中的橡皮塞,使空气进入,颜色变化为白色变成灰绿色,最终变成红褐色,D正确。
B中盛有一定量的NaOH溶液,A中Fe与稀硫酸反应产生FeSO4和H2,关闭E时,A中的H2将FeSO4压入B中与NaOH反应产生Fe(OH)2白色沉淀,A正确;
题组二 铁及其化合物的转化
5.(2022·南京月考)在指定条件下,下列有关铁单质的转化不能实现的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
Cl2具有强氧化性,可以把Fe氧化生成FeCl3,A不符合题意;
Fe与水蒸气反应生成Fe3O4,B符合题意;
HNO3具有强氧化性且足量,故此时Fe与硝酸反应生成Fe(NO3)3,C不符合题意;
Fe与CuSO4发生置换反应生成Cu和FeSO4,D不符合题意。
6.如图是物质间发生化学反应的颜色变化,下表选项中的物质对应正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选项 M N P Q
A NH3·H2O Ba(OH)2 铜 KSCN
B Na BaCl2 FeO KSCN
C NaOH Ba(NO3)2 锌粉 KSCN
D Na2O2 MgCl2 Fe KSCN
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
Ba(OH)2与Fe2(SO4)3反应得到的是Fe(OH)3与BaSO4的混合物,沉淀不是白色的,A项错误;
FeO不能还原Fe3+,B项错误;
MgCl2与Fe2(SO4)3不反应,D项错误。
7.铁的常见化合物有①FeO;②Fe2O3;③FeS;④Fe(OH)3; ⑤NH4Fe(SO4)2·12H2O;⑥FeSO4。将上述物质分别溶于足量的稀硫酸后进行实验。下列说法不正确的是
A.滴加KSCN溶液后无明显现象,滴加新制氯水后显血红色的有①③⑥
B.加入铜片,能发生反应的只有②④
C.滴加少量酸性KMnO4溶液紫红色褪去的有①③⑥
D.滴加KSCN溶液,溶液显血红色的有②④⑤
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
①FeO;②Fe2O3;③FeS;④Fe(OH)3;⑤NH4Fe(SO4)2·12H2O;⑥FeSO4
分别溶于足量稀硫酸后所得溶液依次为FeSO4、Fe2(SO4)3、FeSO4、Fe2(SO4)3、NH4Fe(SO4)2、FeSO4;滴加KSCN溶液后无明显现象的有①③⑥,其中的Fe2+具有还原性,能被新制氯水氧化为Fe3+,Fe3+遇KSCN溶液显血红色,故滴加新制氯水后显血红色的有①③⑥,A正确;
②④⑤中都有Fe3+,Fe3+具有氧化性,能够与Cu发生反应产生Fe2+、Cu2+,故加入铜片,能发生反应的有②④⑤,B错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
①③⑥中都有Fe2+,Fe2+具有还原性,会被酸性KMnO4溶液氧化而使酸性KMnO4溶液褪色,故滴加少量酸性KMnO4溶液紫红色褪去的有①③⑥,C正确;
滴加KSCN溶液,溶液显血红色,说明溶液中含有Fe3+,溶液中含Fe3+的有②④⑤,D正确。
8.下列除杂试剂或方法不正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选项 被提纯物质 杂质 除杂试剂或方法
A FeCl3溶液 FeCl2 通入适量Cl2
B FeCl2溶液 FeCl3 加入过量铁粉并过滤
C 铜粉 铁粉 加入过量盐酸并过滤
D Fe(OH)3 Fe(OH)2 在空气中灼烧
√
FeCl2与Cl2反应生成FeCl3,FeCl3与Fe粉反应生成FeCl2,A、B都正确;
Fe(OH)3、Fe(OH)2受热都易分解,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
9.联合国卫生组织经过考核和研究,认为我国使用的铁锅是有益于人类健康的理想炊具,并向全世界推广。其主要原因是
A.价格便宜,不易生锈
B.铁锅含有碳元素
C.烹调的食物中留有人体需要的铁元素
D.传热慢,保温性能好
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
价格是物质用途需考虑的因素之一,但不是有益于健康的理由,铁锅为铁合金,易发生电化学腐蚀生锈,A项错误;
铁锅为铁的合金,主要成分为铁,还含有碳等其他元素,使用铁锅主要是获得铁元素,不是为了获得碳元素,B项错误;
使用铁锅烹调的食物中留有人体需要的铁元素,铁是合成血红蛋白的主要元素,缺乏会患贫血,C项正确;
铁合金具有良好的导热性能,但保温性能差,D项错误。
10.某学生以铁丝和Cl2为原料进行下列三个实验。从反应条件的控制分析,下列说法不正确的是
A.实验①中不管Cl2是否足量,
产物均为FeCl3
B.实验②中,搅拌可加速FeCl3
的溶解
C.实验③中,必须严格控制好反应条件,才能制得Fe(OH)3胶体
D.实验③中,没有不断搅拌,故得不到Fe(OH)3胶体
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
Cl2具有强氧化性,和Fe反应,产物为FeCl3,故A正确;
搅拌可加速物质的溶解,故B正确;
严格控制好条件,才能制得Fe(OH)3胶体,故C正确、D错误。
11.下列中学常见实验的现象或表述正确的是
A.过量的铁投入到一定量的稀硝酸中,充分反应后取上层清液于试管
中,滴加KSCN溶液,溶液显血红色
B.制备氢氧化亚铁时,向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边
搅拌,即可制得白色的氢氧化亚铁
C.检验红砖中的氧化铁成分,向红砖粉末中加入盐酸,充分反应后取
上层清液于试管中,滴加KSCN溶液2~3滴即可
D.向FeCl3和BaCl2的混合溶液中通入SO2,溶液颜色由棕黄色变为浅绿
色,同时有白色沉淀生成,表明FeCl3具有还原性
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
过量的铁投入到一定量的稀硝酸中,铁先被硝酸氧化为三价铁,然后铁和三价铁反应生成亚铁离子,铁元素最终被氧化为+2价,滴加KSCN溶液,溶液不会显血红色,故A错误;
向硫酸亚铁溶液中滴加氢氧化钠溶液发生复分解反应生成氢氧化亚铁白色沉淀,搅拌后,氢氧化亚铁很容易被空气中的氧气氧化为氢氧化铁,得不到白色沉淀,故B错误;
氧化铁和盐酸反应生成氯化铁溶液和水,三价铁遇KSCN溶液会变血红色,故C正确。
12.(2022·沈阳高一下期末)H2S有剧毒,不能排放到空气中,将H2S和O2的混合气体通入FeCl3、CuCl2的混合溶液中反应回收S,其物质转化如图所示。下列说法错误的是
A.腐败的鱼、肉、蛋中都有硫化氢气体产生
B.O2在转化过程中发生的反应为O2+4Fe2++
4H+===4Fe3++2H2O
C.图示转化中,有三种元素的化合价未发生改变
D.为避免混合液失效,混合气体中 应大于2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
图示转化中,Cu、H、Cl的化合价没有变化,C项正确;
由图可知,总反应为2H2S+O2===2S↓+2H2O,Fe3+是混合液的成分之一,为避免混合液失效,混合气体中O2的含量要大一些,以保证Fe3+不会损失,故 应小于2,D项错误。
鱼、肉、蛋腐败时均能产生H2S,A项正确;
由题图可以看出,Fe2+在O2的作用下变成Fe3+,发生的反应为O2+4Fe2++4H+===4Fe3++2H2O,B项正确;
13.电子工业上使用的印刷电路板,是在敷有铜膜的塑料板上以涂层保护所要的线路,然后用三氯化铁浓溶液作用掉(腐蚀)未受保护的铜膜后形成的。某工程师为了从使用过的腐蚀废液(含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费)中回收铜,并将铁的化合物全部转化为FeCl3溶液作为腐蚀液原料循环使用,准备采用下列步骤:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(1)步骤Ⅰ的操作名称:_______;所需玻璃仪器:_______、______、
_______。
(2)写出FeCl3溶液与铜箔发生反应的离子方程式:_________________
_______。
(3)检验废腐蚀液中是否含有Fe3+所需试剂名称:_____________,实验现象:_______________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
过滤
烧杯
漏斗
玻璃棒
2Fe3++Cu===2Fe2+
+Cu2+
硫氰化钾溶液
溶液由棕黄色变为血红色
(4)向②中加入NaOH溶液并长时间暴露在空气中,此过程的现象:_______________________________________________________,此转化的化学方程式为__________________________________________
______________________。
(5)写出③中所含物质:________,⑥发生反应的离子方程式:__________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
先产生白色絮状沉淀,然后逐步变为灰绿色,最终变为红褐色
FeCl2+2NaOH===Fe(OH)2↓+2NaCl、4Fe(OH)2
+O2+2H2O===4Fe(OH)3
Fe、Cu
2Fe2++Cl2===2Fe3++2Cl-
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
废液中含有FeCl2、CuCl2、FeCl3,向废液中加入过量Fe,发生反应2Fe3++Fe===3Fe2+、Cu2++Fe===Fe2++Cu,然后过滤,滤液中含有FeCl2,滤渣中含有Cu、Fe,向滤渣中加入过量盐酸,Fe溶解,Cu不溶解,然后过滤得到金属单质Cu,滤液中含有FeCl2,向滤液中通入过量Cl2,发生的反应为2Fe2++Cl2===2Fe3++2Cl-,从而得到FeCl3溶液,以此解答该题。
14.铁是人体必需的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
试回答下列问题:
(1)试剂1是_______,试剂2是__________,加入新制氯水后溶液中发生反应的离子方程式是____________________________、_________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
稀盐酸
KSCN溶液
2Fe2++Cl2===2Fe3++2Cl-
Fe3++3SCN-===Fe(SCN)3
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
该药品不溶于水但能溶于人体中的胃酸,试剂1用于溶解样品,可以选用稀盐酸;试剂2用于检验三价铁离子,可以选用KSCN溶液;氯气氧化亚铁离子生成铁离子,离子方程式为2Fe2++Cl2===2Fe3++2Cl-;铁离子与硫氰根离子结合生成硫氰化铁,离子方程式为Fe3++3SCN-===Fe(SCN)3。
(2)加入试剂2后溶液中颜色由淡黄色转变为淡红色是因为___________
__________,写出+2价Fe在空气中转化为+3价Fe的化学方程式:________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
少量的Fe2+
转化为Fe3+
4FeCl2+O2+4HCl===4FeCl3+2H2O
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
Fe3+遇KSCN溶液变血红色,溶液由淡黄色变为淡红色,说明少量Fe2+被氧化成Fe3+;亚铁离子被空气中的氧气氧化为铁离子,化学方程式为4FeCl2+4HCl+O2===4FeCl3+2H2O。
(3)该同学猜想红色溶液变为无色溶液的原因是溶液中的+3价铁被还原为+2价铁,你认为该同学的猜想合理吗?_______。若你认为合理,请说明理由(若你认为不合理,该空不作答):_________;若你认为不合理请提出你的猜想并设计一个简单的实验加以验证(若你认为合理,该空不作答):_________________________________________________________________________________________________________________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
不合理
猜想:Fe(SCN)3中的SCN-被过量的氯水氧化;设计的实验为在褪色后的溶液中加入FeCl3溶液,不变红色或在褪色后的溶液中加入KSCN溶液,变血红色
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
因为氯水氧化性强,不会还原Fe3+,该同学的猜想不合理;可能是SCN-被过量的氯水氧化,可取少量褪色后的溶液,加入FeCl3溶液,不变红色(或取少量褪色后的溶液,加入KSCN溶液,变血红色)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
15.某研究小组同学欲探究某袋敞口放置一段时间的名为“硫酸亚铁家庭园艺精品肥料”的化肥的主要成分及相关性质。首先对该化肥的成分进行了如下假设:
a.只含有FeSO4 b.含有FeSO4和Fe2(SO4)3 c.只含有Fe2(SO4)3
将化肥固体粉末溶于水中得到溶液(记为X),进行如下实验:
序号 操作 现象
ⅰ 取2 mL溶液X,加入1 mL 1 mol·L-1 NaOH溶液 产生红褐色沉淀
ⅱ 取2 mL溶液X,加入1滴KSCN溶液 溶液显血红色
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(1)对实验ⅰ的预期现象是先产生白色沉淀,后逐步变为灰绿色,最后出现红褐色沉淀,预期产生该现象的依据是(用化学方程式或离子方程式表示)__________________________、__________________________
_________。
序号 操作 现象
ⅰ 取2 mL溶液X,加入1 mL 1 mol·L-1 NaOH溶液 产生红褐色沉淀
ⅱ 取2 mL溶液X,加入1滴KSCN溶液 溶液显血红色
Fe2++2OH-===Fe(OH)2↓
4Fe(OH)2+O2+2H2O===
4Fe(OH)3
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
FeSO4溶液与NaOH溶液反应生成白色沉淀Fe(OH)2,Fe(OH)2易被氧化为Fe(OH)3,所以预期现象是先产生白色沉淀,后逐步变为灰绿色,最后出现红褐色沉淀。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(2)由实验ⅱ得出的结论是___________________________________。为进一步验证假设,该小组同学进行了以下实验:
化肥中肯定有Fe2(SO4)3(或假设a不成立)
序号 操作 现象
ⅲ 取2 mL溶液X,加入1滴KSCN溶液,再加入1 mL水 溶液显血红色
ⅳ 取2 mL溶液X,加入1滴KSCN溶液,再加入1 mL氯水 溶液显血红色,颜色比ⅲ深
向溶液X中加入1滴KSCN溶液,溶液显血红色,说明含有Fe2(SO4)3,则假设a不成立。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
序号 操作 现象
ⅲ 取2 mL溶液X,加入1滴KSCN溶液,再加入1 mL水 溶液显血红色
ⅳ 取2 mL溶液X,加入1滴KSCN溶液,再加入1 mL氯水 溶液显血红色,颜色比ⅲ深
(3)实验ⅳ中氯水参加反应的离子方程式是_________________________。
Cl2+2Fe2+===2Cl-+2Fe3+
实验ⅳ说明溶液X中含有Fe2+,且Fe2+被氯水中的氯气氧化为Fe3+。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(4)通过以上实验,可得到的结论是_______________________________
___________。
实验ⅲ说明溶液X中含有Fe3+,综合实验ⅲ、ⅳ,可得到的结论是该化肥中含有FeSO4和Fe2(SO4)3或假设b成立。
该化肥中含有FeSO4和Fe2(SO4)3(或
假设b成立)
返回
本课结束
专题9
