专题9 第一单元 金属的冶炼方法 课件(共92张PPT)
文档属性
| 名称 | 专题9 第一单元 金属的冶炼方法 课件(共92张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-10 22:54:32 | ||
图片预览











文档简介
(共92张PPT)
第一单元
DIYIDANYUAN
金属的存在形式 / 金属的冶炼 / 随堂演练 知识落实 / 课时对点练
金属的冶炼方法
专题9
核心素养
发展目标
1.熟知铁、铝的冶炼原理和方法。
2.知道金属在自然界中的存在形态和金属冶炼的一般方法,会写相关的化学方程式。
3.认识我国古代文明与金属冶炼的关系,感受物质制备中丰富的化学思想。
内容索引
一、金属的存在形式
二、金属的冶炼
随堂演练 知识落实
课时对点练
金属的存在形式
一
1.金属的存在形式
(1)金属材料既有良好的 性,坚固耐用,而且还有 、导热等诸多优良性能。
(2)大量的金属元素存在于地壳的 中,地壳中的大部分金属元素都是以 形式存在的。如铁元素存在于赤铁矿(主要成分为 )中,铝元素存在于铝土矿(主要成分为 )中。
(3)在自然界中,只有少量的金属元素以游离态形式存在于地壳中,如自然 和自然 等。
(4)除了地壳外,还有一些金属以离子或矿石的形式分布于海洋中,如钠、镁、锰等。
可塑
导电
矿石
化合态
Fe2O3
Al2O3
金
银
2.金属的存在形式与其活动性的关系
(1)活动性较 的金属,在自然界以各种各样的 存在。
(2)活动性较 的金属,有可能以 形式存在。
3.铁、银元素的存在形式
(1)铁元素在自然界中存在形式既有 也有 ,主要以_______的形式存在。铁元素有 (主要存在于 中)、 和_______等存在形式。
(2)银元素有 、 、 等存在形式。
强
化合态
弱
游离态
游离态
化合态
化合态
单质
陨石
氧化物
硫酸盐
自然银
辉银矿(Ag2S)
碲银矿(Ag2Te)
(1)由于铁性质比较活泼,所以自然界中没有游离态的铁单质( )
(2)金属元素主要存在于地壳的矿石中,海洋中几乎没有金属元素( )
(3)由于银的活动性较弱,在自然界中,只有游离态的自然银没有化合态的银矿石( )
(4)铝的活动性较强,所以铝被人类开发利用的年限较早( )
(5)金属铜是人类使用和开发比较早的金属之一( )
正误判断
×
×
√
×
×
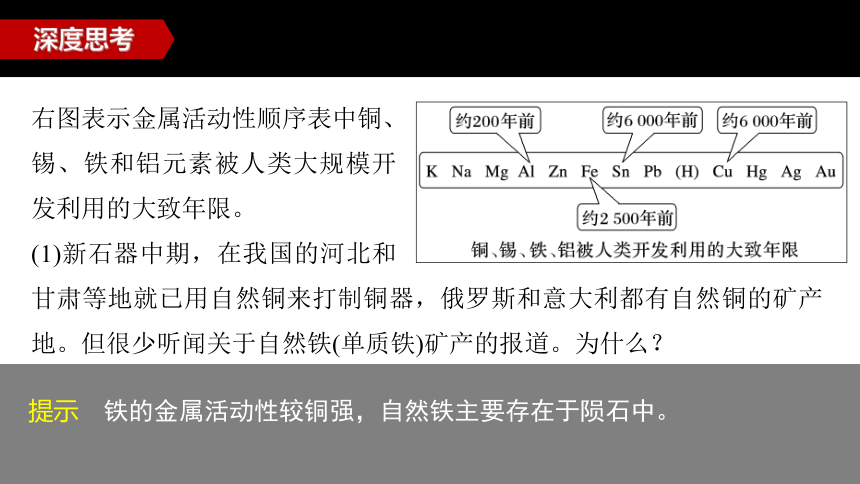
甘肃等地就已用自然铜来打制铜器,俄罗斯和意大利都有自然铜的矿产地。但很少听闻关于自然铁(单质铁)矿产的报道。为什么?
深度思考
右图表示金属活动性顺序表中铜、锡、铁和铝元素被人类大规模开发利用的大致年限。
(1)新石器中期,在我国的河北和
提示 铁的金属活动性较铜强,自然铁主要存在于陨石中。
(2)根据以上金属的活动性和人类开发利用这些金属时间的数据,你发现了什么规律?
深度思考
提示 金属的活动性越弱,人类开发、利用它的时间越早;金属的活动性越强,人类开发、利用它的时间越晚。
(3)找出你熟悉的2~3种金属单质,说明它们的制备方法,写出有关的化学方程式。
深度思考
应用体验
1.下列关于金属在自然界中存在形态的说法不正确的是
A.地壳中含量最高的金属是铁,其次是铝
B.铝在自然界中主要存在于铝土矿(主要成分是氧化铝)中
C.铁主要存在于铁矿石(磁铁矿、赤铁矿、菱铁矿等)中
D.金、铂等不活泼的金属以游离态形式存在
√
地壳中含量最高的金属是铝,其次是铁;金属在自然界中的存在形态与其化学活动性有关,铝、铁在自然界中以化合态形式存在,金、铂在自然界中以游离态形式存在。
2.下列叙述正确的是
A.所有金属元素都只存在于地壳中
B.铁元素主要以化合态存在于自然界
C.常温下所有的金属都是固态
D.金属元素大多数以游离态存在于自然界
√
返回
金属的冶炼
二
1.金属冶炼
(1)定义:利用 使金属元素从 变为 的过程。
(2)金属冶炼的实质
化学反应
化合态
游离态
(3)金属的冶炼方法
①热分解法:适合冶炼 的金属。
金属活动性较差
②高温还原法:用 还原金属化合物,适合冶炼金属活动性顺序表中锌到铜之间的大多数金属。
③电解法:适合冶炼 的金属(一般为金属活动性顺序表中铝及铝前面的金属)。
还原剂(CO、C、H2和活泼金属等)
金属活动性较强
例如:MgCl2(熔融) ___________,
2NaCl(熔融) ___________,
2Al2O3(熔融) ___________。
Mg+Cl2↑
2Na+Cl2↑
4Al+3O2↑
2.铁的冶炼(高炉炼铁)
(1)原料: 、 、 等。
(2)设备:炼铁高炉。
(3)原理:高温下用还原剂将铁从其化合物中 出来。
铁矿石
焦炭
石灰石
还原
(4)冶炼过程
3.铝热反应
(1)铝热反应实验中的有关问题
实验装置
实验现象 ①镁条 ,氧化铁与铝粉在较高温度下发生剧烈的反应;②纸漏斗_____________________________
为铝热反应提供高温条件
产生氧气,引发反应
氧化铁和铝粉的混合物
剧烈燃烧,放出大量的热,并发出耀眼的白光
下部被烧穿,有熔融物落入沙中
实验结论 高温下,铝与氧化铁发生反应,放出大量的热,反应的化学方程式:________________________
原理应用 ①冶炼 、活动性 于Al的金属,如钒、铬、锰、钨等;
②金属焊接,如 等
熔点较高
焊接钢轨
弱
(2)概念
①铝热反应是指工业上用 来还原一些 (如V2O5、Cr2O3、MnO2等)得到金属 的一类反应。
②铝热剂: 与某些难熔的 (如Fe2O3等)以 形成的混合物。
铝粉
金属氧化物
单质
铝粉
金属氧化物
一定比例
4.知识拓展:冶炼铝的两种工艺流程
(1)
有关反应的化学方程式:
①碱溶:______________________________;
②酸化:______________________________________________;
③灼烧:_________________________;
④电解:____________________________。
Al2O3+2NaOH===2NaAlO2+H2O
NaAlO2+CO2(过量)+2H2O===Al(OH)3↓+NaHCO3
(2)
有关反应的化学方程式:
①酸溶:___________________________;
②碱化:_____________________________________;
Al2O3+6HCl===2AlCl3+3H2O
AlCl3+3NH3·H2O===Al(OH)3↓+3NH4Cl
(1)化合态的金属元素被还原时,一定得到相应的金属单质( )
(2)金属冶炼过程中,被冶炼的金属既可被氧化,也可被还原( )
(3)Na、K等活泼金属可用CO还原法冶炼( )
(4)Al与MgO也能发生铝热反应( )
(5)铁元素只以化合态形式存在于矿石中( )
正误判断
×
×
×
×
×
1.工业上利用电解熔融MgCl2来制取Mg,而MgO比MgCl2更易获得,为什么不电解熔融MgO制取镁呢?(MgO的熔点:2 852 ℃,MgCl2的熔点:714 ℃)
提示 由于MgO的熔点远远高于MgCl2的熔点,将MgO熔融需要的能量较多,所以采用电解熔融MgCl2的方法制取Mg,冶炼金属也要考虑节能减排。
深度思考
深度思考
2.如图所示进行铝热反应:
观察发生的现象,回答下列问题:
(1)写出该反应的化学方程式:
__________________________,在该反应中_______是氧化剂,____是还原剂。
Fe2O3
Al
铝热反应为2Al+Fe2O3 2Fe+Al2O3,该反应中Fe2O3作氧化剂,Al作还原剂。
深度思考
(2)某同学为研究该实验,查阅有关资料得到如表数据:
物质 Al Al2O3 Fe Fe2O3
熔点/℃ 660 2 054 1 535 1 462
沸点/℃ 2 467 2 980 2 750 —
①该同学推测,铝热反应所得到的熔融物是铁铝合金。理由是该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?_____(填“合理”或“不合理”)。
②设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用的试剂是_____________,反应的离子方程式为_____________
______________________。
合理
氢氧化钠溶液
2Al+2OH-
根据提供的铁和铝的熔点可知,该同学的推测合理。利用Al能与强碱反应而铁不与强碱反应的特性,可以检验熔融物中是否含有铝。
应用体验
1.《天工开物》中如下描述“共煅五个时辰,其中砂末尽化为汞,布于满釜”。下列金属的冶炼方法与此相同的是
A.钠 B.铝
C.银 D.铁
由题意知描述的是汞的冶炼,采用热分解的方法,银也是不活泼金属,采用热分解法冶炼。
√
2.下列关于金属冶炼的说法正确的是
A.金属冶炼的本质是将化合态金属还原为游离态,冶炼方法由金属的
活动性决定
B.铜的湿法冶炼是将金属钠投入到CuSO4溶液中,从而置换出铜
C.铁通常采用高温还原法冶炼,加入石灰石的目的是除去过量的碳
D.用海水为原料制得精盐,再电解纯净的NaCl溶液可制得金属钠
√
B项,湿法炼铜是用铁置换出铜;
C项,炼铁中加入石灰石是为了除去二氧化硅杂质;
D项,工业上电解熔融的NaCl来制取Na。
3.请写出冶炼下列金属的化学方程式。
(1)加热氧化汞可以得到单质汞,同时生成氧气:_____________________。
(2)在高温下,一氧化碳与氧化铁反应可以制得金属铁:____________
________________。
(3)湿法炼铜(将铁加入硫酸铜溶液中):_______________________。
(4)电解熔融氯化钠制得金属钠:__________________________。
3CO+Fe2O3
Fe+CuSO4===FeSO4+Cu
归纳总结
(1)金属的冶炼方法与金属活动性的关系
(2)在工业上还有一种冶炼方法叫做湿法冶金,即利用活泼金属把不活泼金属从它的盐溶液中置换出来。例如:CuSO4+Fe===Cu+FeSO4。
返回
随堂演练 知识落实
1.(2022·重庆高一期末)下列元素中,在自然界只以化合态形式存在的是
A.氮元素 B.铁元素
C.硫元素 D.钠元素
√
1
2
3
4
5
1
2
3
4
5
自然界中存在游离态的氮元素,如氮气,故不选A;
自然界中存在游离态的铁元素,如从陨石中能找到游离态的铁,故不选B;
自然界中存在游离态的硫元素,如硫黄,故不选C;
钠元素性质活泼,钠元素在自然界只能以化合态形式存在,故选D。
2.下列有关高炉炼铁的说法正确的是
A.还原氧化铁的还原剂是焦炭
B.采用富氧空气可以得到纯铁
C.加入的石灰石只会产生炉渣无其他作用
D.用于冶炼生铁的矿石主要有磁铁矿、赤铁矿
1
2
3
4
√
5
1
2
3
4
高炉炼铁得到的只是含碳量为2%~4.5%的生铁,不会得到纯铁,B项错误;
加入石灰石的目的是它在高温下分解成生石灰,生石灰再与SiO2反应生成CaSiO3炉渣,除去杂质SiO2,C项错误。
5
3.在冶金工业上,均能用化学还原剂制得的一组金属是
A.Na、Mg、Al B.Na、Zn、Fe
C.Zn、Fe、Cu D.Mg、Al、Zn、Fe
√
1
2
3
4
5
Na、Mg、Al的冶炼方法为电解法;Zn、Fe、Cu的冶炼方法为化学还原剂还原法。
4.工业上制备下列金属,采用的化学反应原理正确的是
1
2
3
4
5
√
1
2
3
4
工业上电解熔融的氯化镁来制取金属Mg,A错误;
钙的工业制法与镁相似,电解熔融的氯化钙,B错误;
工业制取Mn用高温还原法,单质Al与二氧化锰发生置换反应,C正确;
汞单质的制取用热分解法,分解HgO得到Hg单质,D错误。
5
1
2
3
4
5.金属与人类生活和社会发展的关系非常密切。
(1)如图表示金属活动性顺序表中铜、铁和铝元素被人类大规模开发、利用的大致年限。
5
图中信息可以说明:铜、铁和铝的金属活动性强弱与人类开发、利用它们的时间先后的关系是____________________________________________。金属铬(Cr)能溶解在热的盐酸中,放出H2,同时生成CrCl2,预测:铬____(填“能”或“不能”)与硫酸铜溶液反应,理由是_________________________
_________________。
金属的活动性越弱,人类开发利用它的时间越早
能
铬排在氢前,而铜排在氢后,
铬的活动性大于铜
1
2
3
4
5
(2)炼铁的原理是高温下,利用一氧化碳与氧化铁的反应,其反应的化学方程式为Fe2O3+3CO 2Fe+3X,则X的化学式是_____。
(3)工业上,采用电解熔融氧化铝(Al2O3)的方法冶炼铝,电解熔融氧化
铝生成铝和氧气,写出反应的化学方程式:_______________________
______。
CO2
4Al +
3O2↑
返回
课时对点练
题组一 金属的冶炼
1.冶炼是一种提炼技术,是指用焙烧、熔炼、电解以及使用化学药剂等方法把矿石中的金属提取出来;减少金属中所含的杂质或增加金属中某种成分,炼成所需要的金属。下列说法正确的是
A.加热HgO制取Hg
B.电解熔融氯化铝制取铝
C.电解饱和食盐水来制取金属钠
D.能利用铝热反应制取镁
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
工业上常用电解熔融的Al2O3、NaCl制取铝、钠,Mg活泼性比Al强,不能利用铝热反应制取镁,故B、C、D错误。
17
18
2.下列说法正确的是
A.金属的冶炼原理,就是利用氧化还原反应原理,在一定条件下将金
属从其化合物中还原出来
B.冶炼金属时,必须加入一种物质作为还原剂
C.金属由化合态变为游离态,可能被还原,也可能被氧化
D.金属单质被发现和利用得越早,其在地壳中的含量越大
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
A项,金属冶炼是将金属化合物转化为金属单质,正确;
B项,冶炼金属并不一定要加入还原剂,如电解法制取钠和镁,错误;
C项,金属由化合态变为游离态,都是由高价态降低到0价,故一定被还原,错误;
D项,金属被发现的早晚与其在地壳中的含量无关,如在地壳的金属中铝的含量虽然最大,但被发现的时间却比铁、铜晚得多,错误。
17
18
3.下表中金属冶炼的原理与方法错误的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
选项 冶炼原理 方法
A 热分解法
B 电解法
C 热分解法
D 高温还原法
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
活泼金属K、Ca、Na、Mg、Al等用电解法冶炼,中等活泼金属Zn、Fe、Sn、Pb、Cu等用高温还原法冶炼,不活泼金属Hg、Ag等用热分解法冶炼,故A、B、D三项正确,C项错误。
17
18
题组二 铝热反应
4.(2022·天津高一阶段练习)下列氧化物中不能与铝粉发生铝热反应的是
A.V2O5 B.Cr2O3
C.MnO2 D.Na2O
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
铝热反应的实质为金属单质之间的置换反应,能跟铝粉组成铝热剂的金属氧化物对应的金属活动性应比铝弱。V的活动性弱于Al,V2O5可与Al发生铝热反应,故A不选;
Cr的活动性弱于Al,Cr2O3可与Al发生铝热反应,故B不选;
Mn的活动性弱于Al,MnO2可与Al发生铝热反应,故C不选;
Na的活动性强于Al,Na2O不能与Al发生铝热反应,故D选。
17
18
5.下列关于铝热剂和铝热反应的叙述错误的是
A.铝热剂的反应原理是利用铝的强还原性
B.铝热剂只是指铝和氧化铁混合后的物质
C.铝热反应常用于冶炼高熔点金属
D.铝热反应需用镁条和氯酸钾引燃,但铝热反应是一个放热反应
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
铝热剂是指铝和活动性比铝差的高温难熔的金属的氧化物的混合物,如Cr2O3、MnO2等,并不只指铝和氧化铁的混合物。
17
18
6.铝热反应(2Al+Fe2O3 Al2O3+2Fe)的实验装置如图所示,有关该反应的下列说法正确的是
A.a为镁条
B.b为氧化铁与铝粉的混合物
C.2 mol氧化剂参与反应转移电子的数目为6NA
D.还原剂与氧化产物的物质的量之比为1∶2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
a为镁条,起引燃作用,A项正确;
b为氯酸钾,B项错误;
该反应中的氧化剂是氧化铁,2 mol氧化铁参与反应转移电子的数目为12NA,C项错误;
该反应中还原剂是铝,氧化产物是氧化铝,还原剂和氧化产物的物质的量之比为2∶1,D项错误。
17
18
题组三 金属冶炼在新情境下的应用
7.生物炼铜是利用某些具有特殊本领的微生物帮助我们从矿石中提取铜,这些“吃岩石的细菌”能利用空气中的氧气将不溶性的CuS转化为可溶性的铜的化合物,这种可溶性的铜化合物是
A.碳酸铜 B.硝酸铜
C.硫酸铜 D.氢氧化铜
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
生物炼铜是一项成本低、污染小、反应简单、前景广阔的新兴炼铜技术,其利用“吃岩石的细菌”将不溶性的硫化铜转化为可溶性的硫酸铜,而使铜的冶炼变得简单。
17
18
8.钛是一种活泼金属,具有密度小,熔点高、可塑性强、机械强度高等性能。工业上常用硫酸分解铁钛矿石来制备二氧化钛,用来冶炼钛,主要有以下五个反应:
①FeTiO3+2H2SO4===TiOSO4+FeSO4+2H2O
②TiOSO4+2H2O===H2TiO3↓+H2SO4
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
针对题述五个反应,下列叙述错误的是
A.反应①是非氧化还原反应
B.反应②生成了两种酸
C.反应④中的TiO2是氧化剂
D.反应⑤表现了金属镁比金属钛的还原性强
√
在反应①中没有元素化合价的变化;
反应④中钛元素和氧元素化合价不变,Cl2是氧化剂;
反应⑤中,镁是还原剂,钛是还原产物,所以镁的还原性强于钛。
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
题组四 高炉炼铁及有关计算
9.用H2、C、CO分别与等质量的氧化铁在高温下反应,使氧化铁中的铁全部还原出来,消耗氢气、碳、一氧化碳的质量比可能为
①1∶1∶1 ②1∶3∶14 ③1∶6∶14 ④2∶1∶2
A.①③ B.①④
C.②③ D.②④
√
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
用H2、C、CO还原等质量的Fe2O3且产物分别为H2O、CO、CO2时,消耗三者的物质的量之比为1∶1∶1,质量比为1∶6∶14;当产物分别为H2O、CO2、CO2时,三者物质的量之比为2∶1∶2,质量比为1∶3∶14。
17
18
10.在高温下用一氧化碳还原m g四氧化三铁得到n g铁。已知氧的相对原子质量为16,则铁的相对原子质量为
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
设铁的相对原子质量为x,则
Fe3O4+4CO 3Fe+4CO2
3x+64 3x
m n
17
18
11.(2022·济南高一检测)下列元素在自然界中既有游离态又有化合态存在的是
①N ②O ③Fe ④C ⑤Na ⑥Ca
A.①②③④ B.①②④
C.①③④⑥ D.全部
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
①N在自然界中既有游离态又有化合态存在,如N2、硝酸盐,符合题意;
②O在自然界中既有游离态又有化合态存在,如O2、氧化物,符合题意;
③Fe在自然界中既有游离态又有化合态存在,如陨铁、铁的氧化物,符合题意;
④C在自然界中既有游离态又有化合态存在,如金刚石、CO2,符合题意;
⑤Na、⑥Ca非常活泼,在自然界中都以化合态存在,无游离态的Na、Ca,不符合题意。
17
18
12.下列关于金属的说法不正确的是
A.工业上电解熔融状态的Al2O3制备Al涉及氧化还原反应
B.工业上金属Mg、Cu都是用高温还原法制得的
C.金属冶炼的本质是金属阳离子得到电子变成金属原子
D.越活泼的金属越难冶炼
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
在工业上Mg用电解法冶炼,Cu用高温还原法冶炼,B项错误。
17
18
13.用足量的CO还原32.0 g某种氧化物,将生成的气体通入足量澄清石灰水中,得到60 g沉淀,则该氧化物是
A.FeO B.Fe2O3
C.CuO D.Cu2O
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
14.火法炼铜首先要焙烧黄铜矿,其反应为2CuFeS2+O2 Cu2S+2FeS+SO2,下列说法正确的是
A.SO2只是氧化产物
B.CuFeS2只是还原剂,硫元素被氧化
C.每生成1 mol Cu2S,有4 mol硫被氧化
D.每转移1.2 mol电子,有0.2 mol硫被氧化
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
由反应的化学方程式知,CuFeS2中Cu化合价降低被还原为Cu2S,CuFeS2中 的S化合价升高,被氧化为SO2;O2中的O化合价降低,被还原为SO2,因此可知SO2既是氧化产物又是还原产物,A项错误;
CuFeS2既是氧化剂又是还原剂,B项错误;
每生成1 mol Cu2S,有1 mol硫被氧化,C项错误;
利用反应知每转移6 mol e-,有1 mol硫被氧化,D项正确。
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
15.工业上以铝土矿(主要成分是氧化铝,含氧化铁杂质)为原料冶炼铝的工艺流程如下:
下列叙述正确的是
A.反应①中试剂X是氢氧化钠溶液
B.Y是HCl,过量的HCl与 反
应生成氢氧化铝
C.图中所示转化反应中包含2个氧化还原反应
D.将试剂X与Y进行对换,最终可以达到相同结果
√
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
D项,试剂X为氢氧化钠溶液,沉淀C为氧化铁,溶液A为偏铝酸钠和氢氧化钠溶液,通入过量二氧化碳气体,发生反应:NaAlO2+CO2+2H2O===Al(OH)3↓+NaHCO3,不能对换,错误。
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
16.钢铁工业对促进经济和社会的发展具有重要的意义,现代炼铁的主要方法是高炉炼铁。其设备如图所示。炼铁的炉料(铁矿石、焦炭、石灰石等)由高炉的顶部投入,原料在下降过程中与高炉气气流在炉身部分发生作用。请回答下列问题:
(1)焦炭在炼铁的过程中所起的作用是_____________________________。
既提供热量,又产生还原剂CO
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
焦炭在炼铁的过程中既作为能源提供反应所需要的能量,同时生成CO作为还原剂,还原出铁矿石中的Fe。
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(2)采用炉料从上部加入,热空气从下部通入的工艺,其目的是____________________
_________________________________。
采用逆流接触操作,
使矿石与还原性气体充分接触、反应
采用炉料从上部加入,热空气从下部通入的工艺,主要是采用逆流操作,不仅利于矿石与还原性气体充分接触,还增加了接触时间,利于反应。
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(3)写出以赤铁矿为原料的炼铁高炉中发生的主要化学反应:______________________
______________________________________。
炼铁高炉中发生的主要反应就是还原剂的生成及生成铁的反应。
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(4)高炉气中含有的主要气态污染物是____,若直接排放将污染空气,因此应回收利用,请写出该污染物的一种用途:__________________。
高炉气的主要成分有CO、CO2等,其主要气态污染物是有毒的CO;回收利用CO,可用作燃料或还原剂等。
CO
用作燃料(或还原剂)
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17.用教材中的实验装置进行铝热反应实验时,存在纸漏斗易燃烧、火星四射等问题,某校化学兴趣小组同学为了解决这些问题将实验装置做了如下改进(如图A所示)。取磁性氧化铁在图A装置中进行铝热反应,冷却后得到“铁块”混合物。
(1)实验中可以用蔗糖和浓硫酸代替镁条作引火剂,其原因是______________
___________________。
蔗糖在浓硫酸中
脱水并放出大量的热
浓硫酸能使蔗糖脱水并放出大量的热,可作引火剂。
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(2)该铝热反应的化学方程式为_____________________________。
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(3)取反应后的“铁块”研碎取样称量,放入如图B所示装置中,滴入足量NaOH溶液充分反应,测量生成气体的体积以求得样品中残留铝的质量分数。
试回答下列问题:
①量气管在读数时必须进行的操作是_____
________________________________。
因为气体的体积受温度和压强影响,所以量气管在读数时必须进行的操作是:冷却至常温并调节量气管使左右液面相平。
冷却
至常温并调节量气管使左右液面相平
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
②取1 g样品进行上述实验,共收集到44.8 mL(标准状况下)气体,则“铁块”中铝的质量分数为______。
3.6%
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
③图B装置中分液漏斗上端和试管用橡胶管连通,除了可以平衡压强让液体顺利滴入试管之外,还可以起到降低实验误差的作用。如果装置没有橡胶管,则测得的“铁块”中铝的质量分数将会_____(填“偏大”或“偏小”)。
偏大
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
如果装置没有橡胶管,随着长颈漏斗中液体流下,试管中压强增大,会导致排入量气管中的液体增多,造成气体读数偏大,即“铁块”中铝的质量分数偏大。
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
18.铝土矿(主要成分为Al2O3,还有少量杂质,杂质不溶于NaOH溶液)是提取氧化铝的原料。提取氧化铝的工艺流程如下:
Al2O3和氢氧化钠反应生成偏铝酸钠和水,反应的实质是Al2O3+ 2OH-=== +H2O。
(1)请用离子方程式表示以上工艺流程中第①步反应:
___________________________。
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
向偏铝酸钠中通入过量的二氧化碳可以生成氢氧化铝沉淀和碳酸氢钠,发生的反应为NaAlO2+CO2+2H2O===Al(OH)3↓+NaHCO3。
(2)写出以上工艺流程中第③步反应的化学方程式:________________
___________________________。
NaAlO2+CO2+
2H2O===Al(OH)3↓+NaHCO3
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
上述分析可知步骤④是过滤得到氢氧化铝沉淀的操作。
(3)步骤④所需进行的实验操作是_______。
过滤
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(4)金属铝与氧化铁混合在高温下会发生剧烈的反应。该反应的化学方程式为__________________________。请举一例该反应的用途______
_____。
焊接
钢轨
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
金属铝在高温下可以和氧化铁发生铝热反应,反应的化学方程式为2Al+Fe2O3 2Fe+Al2O3,获得金属铁,铁以铁水的形式生成,这样可以用来焊接钢轨。
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(5)电解熔融氧化铝制取金属铝,若有0.6 mol电子发生转移。理论上能得到金属铝的质量是______。
5.4 g
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
返回
17
18
本课结束
专题9
第一单元
DIYIDANYUAN
金属的存在形式 / 金属的冶炼 / 随堂演练 知识落实 / 课时对点练
金属的冶炼方法
专题9
核心素养
发展目标
1.熟知铁、铝的冶炼原理和方法。
2.知道金属在自然界中的存在形态和金属冶炼的一般方法,会写相关的化学方程式。
3.认识我国古代文明与金属冶炼的关系,感受物质制备中丰富的化学思想。
内容索引
一、金属的存在形式
二、金属的冶炼
随堂演练 知识落实
课时对点练
金属的存在形式
一
1.金属的存在形式
(1)金属材料既有良好的 性,坚固耐用,而且还有 、导热等诸多优良性能。
(2)大量的金属元素存在于地壳的 中,地壳中的大部分金属元素都是以 形式存在的。如铁元素存在于赤铁矿(主要成分为 )中,铝元素存在于铝土矿(主要成分为 )中。
(3)在自然界中,只有少量的金属元素以游离态形式存在于地壳中,如自然 和自然 等。
(4)除了地壳外,还有一些金属以离子或矿石的形式分布于海洋中,如钠、镁、锰等。
可塑
导电
矿石
化合态
Fe2O3
Al2O3
金
银
2.金属的存在形式与其活动性的关系
(1)活动性较 的金属,在自然界以各种各样的 存在。
(2)活动性较 的金属,有可能以 形式存在。
3.铁、银元素的存在形式
(1)铁元素在自然界中存在形式既有 也有 ,主要以_______的形式存在。铁元素有 (主要存在于 中)、 和_______等存在形式。
(2)银元素有 、 、 等存在形式。
强
化合态
弱
游离态
游离态
化合态
化合态
单质
陨石
氧化物
硫酸盐
自然银
辉银矿(Ag2S)
碲银矿(Ag2Te)
(1)由于铁性质比较活泼,所以自然界中没有游离态的铁单质( )
(2)金属元素主要存在于地壳的矿石中,海洋中几乎没有金属元素( )
(3)由于银的活动性较弱,在自然界中,只有游离态的自然银没有化合态的银矿石( )
(4)铝的活动性较强,所以铝被人类开发利用的年限较早( )
(5)金属铜是人类使用和开发比较早的金属之一( )
正误判断
×
×
√
×
×
甘肃等地就已用自然铜来打制铜器,俄罗斯和意大利都有自然铜的矿产地。但很少听闻关于自然铁(单质铁)矿产的报道。为什么?
深度思考
右图表示金属活动性顺序表中铜、锡、铁和铝元素被人类大规模开发利用的大致年限。
(1)新石器中期,在我国的河北和
提示 铁的金属活动性较铜强,自然铁主要存在于陨石中。
(2)根据以上金属的活动性和人类开发利用这些金属时间的数据,你发现了什么规律?
深度思考
提示 金属的活动性越弱,人类开发、利用它的时间越早;金属的活动性越强,人类开发、利用它的时间越晚。
(3)找出你熟悉的2~3种金属单质,说明它们的制备方法,写出有关的化学方程式。
深度思考
应用体验
1.下列关于金属在自然界中存在形态的说法不正确的是
A.地壳中含量最高的金属是铁,其次是铝
B.铝在自然界中主要存在于铝土矿(主要成分是氧化铝)中
C.铁主要存在于铁矿石(磁铁矿、赤铁矿、菱铁矿等)中
D.金、铂等不活泼的金属以游离态形式存在
√
地壳中含量最高的金属是铝,其次是铁;金属在自然界中的存在形态与其化学活动性有关,铝、铁在自然界中以化合态形式存在,金、铂在自然界中以游离态形式存在。
2.下列叙述正确的是
A.所有金属元素都只存在于地壳中
B.铁元素主要以化合态存在于自然界
C.常温下所有的金属都是固态
D.金属元素大多数以游离态存在于自然界
√
返回
金属的冶炼
二
1.金属冶炼
(1)定义:利用 使金属元素从 变为 的过程。
(2)金属冶炼的实质
化学反应
化合态
游离态
(3)金属的冶炼方法
①热分解法:适合冶炼 的金属。
金属活动性较差
②高温还原法:用 还原金属化合物,适合冶炼金属活动性顺序表中锌到铜之间的大多数金属。
③电解法:适合冶炼 的金属(一般为金属活动性顺序表中铝及铝前面的金属)。
还原剂(CO、C、H2和活泼金属等)
金属活动性较强
例如:MgCl2(熔融) ___________,
2NaCl(熔融) ___________,
2Al2O3(熔融) ___________。
Mg+Cl2↑
2Na+Cl2↑
4Al+3O2↑
2.铁的冶炼(高炉炼铁)
(1)原料: 、 、 等。
(2)设备:炼铁高炉。
(3)原理:高温下用还原剂将铁从其化合物中 出来。
铁矿石
焦炭
石灰石
还原
(4)冶炼过程
3.铝热反应
(1)铝热反应实验中的有关问题
实验装置
实验现象 ①镁条 ,氧化铁与铝粉在较高温度下发生剧烈的反应;②纸漏斗_____________________________
为铝热反应提供高温条件
产生氧气,引发反应
氧化铁和铝粉的混合物
剧烈燃烧,放出大量的热,并发出耀眼的白光
下部被烧穿,有熔融物落入沙中
实验结论 高温下,铝与氧化铁发生反应,放出大量的热,反应的化学方程式:________________________
原理应用 ①冶炼 、活动性 于Al的金属,如钒、铬、锰、钨等;
②金属焊接,如 等
熔点较高
焊接钢轨
弱
(2)概念
①铝热反应是指工业上用 来还原一些 (如V2O5、Cr2O3、MnO2等)得到金属 的一类反应。
②铝热剂: 与某些难熔的 (如Fe2O3等)以 形成的混合物。
铝粉
金属氧化物
单质
铝粉
金属氧化物
一定比例
4.知识拓展:冶炼铝的两种工艺流程
(1)
有关反应的化学方程式:
①碱溶:______________________________;
②酸化:______________________________________________;
③灼烧:_________________________;
④电解:____________________________。
Al2O3+2NaOH===2NaAlO2+H2O
NaAlO2+CO2(过量)+2H2O===Al(OH)3↓+NaHCO3
(2)
有关反应的化学方程式:
①酸溶:___________________________;
②碱化:_____________________________________;
Al2O3+6HCl===2AlCl3+3H2O
AlCl3+3NH3·H2O===Al(OH)3↓+3NH4Cl
(1)化合态的金属元素被还原时,一定得到相应的金属单质( )
(2)金属冶炼过程中,被冶炼的金属既可被氧化,也可被还原( )
(3)Na、K等活泼金属可用CO还原法冶炼( )
(4)Al与MgO也能发生铝热反应( )
(5)铁元素只以化合态形式存在于矿石中( )
正误判断
×
×
×
×
×
1.工业上利用电解熔融MgCl2来制取Mg,而MgO比MgCl2更易获得,为什么不电解熔融MgO制取镁呢?(MgO的熔点:2 852 ℃,MgCl2的熔点:714 ℃)
提示 由于MgO的熔点远远高于MgCl2的熔点,将MgO熔融需要的能量较多,所以采用电解熔融MgCl2的方法制取Mg,冶炼金属也要考虑节能减排。
深度思考
深度思考
2.如图所示进行铝热反应:
观察发生的现象,回答下列问题:
(1)写出该反应的化学方程式:
__________________________,在该反应中_______是氧化剂,____是还原剂。
Fe2O3
Al
铝热反应为2Al+Fe2O3 2Fe+Al2O3,该反应中Fe2O3作氧化剂,Al作还原剂。
深度思考
(2)某同学为研究该实验,查阅有关资料得到如表数据:
物质 Al Al2O3 Fe Fe2O3
熔点/℃ 660 2 054 1 535 1 462
沸点/℃ 2 467 2 980 2 750 —
①该同学推测,铝热反应所得到的熔融物是铁铝合金。理由是该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?_____(填“合理”或“不合理”)。
②设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用的试剂是_____________,反应的离子方程式为_____________
______________________。
合理
氢氧化钠溶液
2Al+2OH-
根据提供的铁和铝的熔点可知,该同学的推测合理。利用Al能与强碱反应而铁不与强碱反应的特性,可以检验熔融物中是否含有铝。
应用体验
1.《天工开物》中如下描述“共煅五个时辰,其中砂末尽化为汞,布于满釜”。下列金属的冶炼方法与此相同的是
A.钠 B.铝
C.银 D.铁
由题意知描述的是汞的冶炼,采用热分解的方法,银也是不活泼金属,采用热分解法冶炼。
√
2.下列关于金属冶炼的说法正确的是
A.金属冶炼的本质是将化合态金属还原为游离态,冶炼方法由金属的
活动性决定
B.铜的湿法冶炼是将金属钠投入到CuSO4溶液中,从而置换出铜
C.铁通常采用高温还原法冶炼,加入石灰石的目的是除去过量的碳
D.用海水为原料制得精盐,再电解纯净的NaCl溶液可制得金属钠
√
B项,湿法炼铜是用铁置换出铜;
C项,炼铁中加入石灰石是为了除去二氧化硅杂质;
D项,工业上电解熔融的NaCl来制取Na。
3.请写出冶炼下列金属的化学方程式。
(1)加热氧化汞可以得到单质汞,同时生成氧气:_____________________。
(2)在高温下,一氧化碳与氧化铁反应可以制得金属铁:____________
________________。
(3)湿法炼铜(将铁加入硫酸铜溶液中):_______________________。
(4)电解熔融氯化钠制得金属钠:__________________________。
3CO+Fe2O3
Fe+CuSO4===FeSO4+Cu
归纳总结
(1)金属的冶炼方法与金属活动性的关系
(2)在工业上还有一种冶炼方法叫做湿法冶金,即利用活泼金属把不活泼金属从它的盐溶液中置换出来。例如:CuSO4+Fe===Cu+FeSO4。
返回
随堂演练 知识落实
1.(2022·重庆高一期末)下列元素中,在自然界只以化合态形式存在的是
A.氮元素 B.铁元素
C.硫元素 D.钠元素
√
1
2
3
4
5
1
2
3
4
5
自然界中存在游离态的氮元素,如氮气,故不选A;
自然界中存在游离态的铁元素,如从陨石中能找到游离态的铁,故不选B;
自然界中存在游离态的硫元素,如硫黄,故不选C;
钠元素性质活泼,钠元素在自然界只能以化合态形式存在,故选D。
2.下列有关高炉炼铁的说法正确的是
A.还原氧化铁的还原剂是焦炭
B.采用富氧空气可以得到纯铁
C.加入的石灰石只会产生炉渣无其他作用
D.用于冶炼生铁的矿石主要有磁铁矿、赤铁矿
1
2
3
4
√
5
1
2
3
4
高炉炼铁得到的只是含碳量为2%~4.5%的生铁,不会得到纯铁,B项错误;
加入石灰石的目的是它在高温下分解成生石灰,生石灰再与SiO2反应生成CaSiO3炉渣,除去杂质SiO2,C项错误。
5
3.在冶金工业上,均能用化学还原剂制得的一组金属是
A.Na、Mg、Al B.Na、Zn、Fe
C.Zn、Fe、Cu D.Mg、Al、Zn、Fe
√
1
2
3
4
5
Na、Mg、Al的冶炼方法为电解法;Zn、Fe、Cu的冶炼方法为化学还原剂还原法。
4.工业上制备下列金属,采用的化学反应原理正确的是
1
2
3
4
5
√
1
2
3
4
工业上电解熔融的氯化镁来制取金属Mg,A错误;
钙的工业制法与镁相似,电解熔融的氯化钙,B错误;
工业制取Mn用高温还原法,单质Al与二氧化锰发生置换反应,C正确;
汞单质的制取用热分解法,分解HgO得到Hg单质,D错误。
5
1
2
3
4
5.金属与人类生活和社会发展的关系非常密切。
(1)如图表示金属活动性顺序表中铜、铁和铝元素被人类大规模开发、利用的大致年限。
5
图中信息可以说明:铜、铁和铝的金属活动性强弱与人类开发、利用它们的时间先后的关系是____________________________________________。金属铬(Cr)能溶解在热的盐酸中,放出H2,同时生成CrCl2,预测:铬____(填“能”或“不能”)与硫酸铜溶液反应,理由是_________________________
_________________。
金属的活动性越弱,人类开发利用它的时间越早
能
铬排在氢前,而铜排在氢后,
铬的活动性大于铜
1
2
3
4
5
(2)炼铁的原理是高温下,利用一氧化碳与氧化铁的反应,其反应的化学方程式为Fe2O3+3CO 2Fe+3X,则X的化学式是_____。
(3)工业上,采用电解熔融氧化铝(Al2O3)的方法冶炼铝,电解熔融氧化
铝生成铝和氧气,写出反应的化学方程式:_______________________
______。
CO2
4Al +
3O2↑
返回
课时对点练
题组一 金属的冶炼
1.冶炼是一种提炼技术,是指用焙烧、熔炼、电解以及使用化学药剂等方法把矿石中的金属提取出来;减少金属中所含的杂质或增加金属中某种成分,炼成所需要的金属。下列说法正确的是
A.加热HgO制取Hg
B.电解熔融氯化铝制取铝
C.电解饱和食盐水来制取金属钠
D.能利用铝热反应制取镁
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
工业上常用电解熔融的Al2O3、NaCl制取铝、钠,Mg活泼性比Al强,不能利用铝热反应制取镁,故B、C、D错误。
17
18
2.下列说法正确的是
A.金属的冶炼原理,就是利用氧化还原反应原理,在一定条件下将金
属从其化合物中还原出来
B.冶炼金属时,必须加入一种物质作为还原剂
C.金属由化合态变为游离态,可能被还原,也可能被氧化
D.金属单质被发现和利用得越早,其在地壳中的含量越大
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
A项,金属冶炼是将金属化合物转化为金属单质,正确;
B项,冶炼金属并不一定要加入还原剂,如电解法制取钠和镁,错误;
C项,金属由化合态变为游离态,都是由高价态降低到0价,故一定被还原,错误;
D项,金属被发现的早晚与其在地壳中的含量无关,如在地壳的金属中铝的含量虽然最大,但被发现的时间却比铁、铜晚得多,错误。
17
18
3.下表中金属冶炼的原理与方法错误的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
选项 冶炼原理 方法
A 热分解法
B 电解法
C 热分解法
D 高温还原法
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
活泼金属K、Ca、Na、Mg、Al等用电解法冶炼,中等活泼金属Zn、Fe、Sn、Pb、Cu等用高温还原法冶炼,不活泼金属Hg、Ag等用热分解法冶炼,故A、B、D三项正确,C项错误。
17
18
题组二 铝热反应
4.(2022·天津高一阶段练习)下列氧化物中不能与铝粉发生铝热反应的是
A.V2O5 B.Cr2O3
C.MnO2 D.Na2O
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
铝热反应的实质为金属单质之间的置换反应,能跟铝粉组成铝热剂的金属氧化物对应的金属活动性应比铝弱。V的活动性弱于Al,V2O5可与Al发生铝热反应,故A不选;
Cr的活动性弱于Al,Cr2O3可与Al发生铝热反应,故B不选;
Mn的活动性弱于Al,MnO2可与Al发生铝热反应,故C不选;
Na的活动性强于Al,Na2O不能与Al发生铝热反应,故D选。
17
18
5.下列关于铝热剂和铝热反应的叙述错误的是
A.铝热剂的反应原理是利用铝的强还原性
B.铝热剂只是指铝和氧化铁混合后的物质
C.铝热反应常用于冶炼高熔点金属
D.铝热反应需用镁条和氯酸钾引燃,但铝热反应是一个放热反应
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
铝热剂是指铝和活动性比铝差的高温难熔的金属的氧化物的混合物,如Cr2O3、MnO2等,并不只指铝和氧化铁的混合物。
17
18
6.铝热反应(2Al+Fe2O3 Al2O3+2Fe)的实验装置如图所示,有关该反应的下列说法正确的是
A.a为镁条
B.b为氧化铁与铝粉的混合物
C.2 mol氧化剂参与反应转移电子的数目为6NA
D.还原剂与氧化产物的物质的量之比为1∶2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
a为镁条,起引燃作用,A项正确;
b为氯酸钾,B项错误;
该反应中的氧化剂是氧化铁,2 mol氧化铁参与反应转移电子的数目为12NA,C项错误;
该反应中还原剂是铝,氧化产物是氧化铝,还原剂和氧化产物的物质的量之比为2∶1,D项错误。
17
18
题组三 金属冶炼在新情境下的应用
7.生物炼铜是利用某些具有特殊本领的微生物帮助我们从矿石中提取铜,这些“吃岩石的细菌”能利用空气中的氧气将不溶性的CuS转化为可溶性的铜的化合物,这种可溶性的铜化合物是
A.碳酸铜 B.硝酸铜
C.硫酸铜 D.氢氧化铜
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
生物炼铜是一项成本低、污染小、反应简单、前景广阔的新兴炼铜技术,其利用“吃岩石的细菌”将不溶性的硫化铜转化为可溶性的硫酸铜,而使铜的冶炼变得简单。
17
18
8.钛是一种活泼金属,具有密度小,熔点高、可塑性强、机械强度高等性能。工业上常用硫酸分解铁钛矿石来制备二氧化钛,用来冶炼钛,主要有以下五个反应:
①FeTiO3+2H2SO4===TiOSO4+FeSO4+2H2O
②TiOSO4+2H2O===H2TiO3↓+H2SO4
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
针对题述五个反应,下列叙述错误的是
A.反应①是非氧化还原反应
B.反应②生成了两种酸
C.反应④中的TiO2是氧化剂
D.反应⑤表现了金属镁比金属钛的还原性强
√
在反应①中没有元素化合价的变化;
反应④中钛元素和氧元素化合价不变,Cl2是氧化剂;
反应⑤中,镁是还原剂,钛是还原产物,所以镁的还原性强于钛。
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
题组四 高炉炼铁及有关计算
9.用H2、C、CO分别与等质量的氧化铁在高温下反应,使氧化铁中的铁全部还原出来,消耗氢气、碳、一氧化碳的质量比可能为
①1∶1∶1 ②1∶3∶14 ③1∶6∶14 ④2∶1∶2
A.①③ B.①④
C.②③ D.②④
√
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
用H2、C、CO还原等质量的Fe2O3且产物分别为H2O、CO、CO2时,消耗三者的物质的量之比为1∶1∶1,质量比为1∶6∶14;当产物分别为H2O、CO2、CO2时,三者物质的量之比为2∶1∶2,质量比为1∶3∶14。
17
18
10.在高温下用一氧化碳还原m g四氧化三铁得到n g铁。已知氧的相对原子质量为16,则铁的相对原子质量为
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
设铁的相对原子质量为x,则
Fe3O4+4CO 3Fe+4CO2
3x+64 3x
m n
17
18
11.(2022·济南高一检测)下列元素在自然界中既有游离态又有化合态存在的是
①N ②O ③Fe ④C ⑤Na ⑥Ca
A.①②③④ B.①②④
C.①③④⑥ D.全部
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
①N在自然界中既有游离态又有化合态存在,如N2、硝酸盐,符合题意;
②O在自然界中既有游离态又有化合态存在,如O2、氧化物,符合题意;
③Fe在自然界中既有游离态又有化合态存在,如陨铁、铁的氧化物,符合题意;
④C在自然界中既有游离态又有化合态存在,如金刚石、CO2,符合题意;
⑤Na、⑥Ca非常活泼,在自然界中都以化合态存在,无游离态的Na、Ca,不符合题意。
17
18
12.下列关于金属的说法不正确的是
A.工业上电解熔融状态的Al2O3制备Al涉及氧化还原反应
B.工业上金属Mg、Cu都是用高温还原法制得的
C.金属冶炼的本质是金属阳离子得到电子变成金属原子
D.越活泼的金属越难冶炼
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
在工业上Mg用电解法冶炼,Cu用高温还原法冶炼,B项错误。
17
18
13.用足量的CO还原32.0 g某种氧化物,将生成的气体通入足量澄清石灰水中,得到60 g沉淀,则该氧化物是
A.FeO B.Fe2O3
C.CuO D.Cu2O
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
14.火法炼铜首先要焙烧黄铜矿,其反应为2CuFeS2+O2 Cu2S+2FeS+SO2,下列说法正确的是
A.SO2只是氧化产物
B.CuFeS2只是还原剂,硫元素被氧化
C.每生成1 mol Cu2S,有4 mol硫被氧化
D.每转移1.2 mol电子,有0.2 mol硫被氧化
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
由反应的化学方程式知,CuFeS2中Cu化合价降低被还原为Cu2S,CuFeS2中 的S化合价升高,被氧化为SO2;O2中的O化合价降低,被还原为SO2,因此可知SO2既是氧化产物又是还原产物,A项错误;
CuFeS2既是氧化剂又是还原剂,B项错误;
每生成1 mol Cu2S,有1 mol硫被氧化,C项错误;
利用反应知每转移6 mol e-,有1 mol硫被氧化,D项正确。
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
15.工业上以铝土矿(主要成分是氧化铝,含氧化铁杂质)为原料冶炼铝的工艺流程如下:
下列叙述正确的是
A.反应①中试剂X是氢氧化钠溶液
B.Y是HCl,过量的HCl与 反
应生成氢氧化铝
C.图中所示转化反应中包含2个氧化还原反应
D.将试剂X与Y进行对换,最终可以达到相同结果
√
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
D项,试剂X为氢氧化钠溶液,沉淀C为氧化铁,溶液A为偏铝酸钠和氢氧化钠溶液,通入过量二氧化碳气体,发生反应:NaAlO2+CO2+2H2O===Al(OH)3↓+NaHCO3,不能对换,错误。
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
16.钢铁工业对促进经济和社会的发展具有重要的意义,现代炼铁的主要方法是高炉炼铁。其设备如图所示。炼铁的炉料(铁矿石、焦炭、石灰石等)由高炉的顶部投入,原料在下降过程中与高炉气气流在炉身部分发生作用。请回答下列问题:
(1)焦炭在炼铁的过程中所起的作用是_____________________________。
既提供热量,又产生还原剂CO
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
焦炭在炼铁的过程中既作为能源提供反应所需要的能量,同时生成CO作为还原剂,还原出铁矿石中的Fe。
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(2)采用炉料从上部加入,热空气从下部通入的工艺,其目的是____________________
_________________________________。
采用逆流接触操作,
使矿石与还原性气体充分接触、反应
采用炉料从上部加入,热空气从下部通入的工艺,主要是采用逆流操作,不仅利于矿石与还原性气体充分接触,还增加了接触时间,利于反应。
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(3)写出以赤铁矿为原料的炼铁高炉中发生的主要化学反应:______________________
______________________________________。
炼铁高炉中发生的主要反应就是还原剂的生成及生成铁的反应。
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(4)高炉气中含有的主要气态污染物是____,若直接排放将污染空气,因此应回收利用,请写出该污染物的一种用途:__________________。
高炉气的主要成分有CO、CO2等,其主要气态污染物是有毒的CO;回收利用CO,可用作燃料或还原剂等。
CO
用作燃料(或还原剂)
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17.用教材中的实验装置进行铝热反应实验时,存在纸漏斗易燃烧、火星四射等问题,某校化学兴趣小组同学为了解决这些问题将实验装置做了如下改进(如图A所示)。取磁性氧化铁在图A装置中进行铝热反应,冷却后得到“铁块”混合物。
(1)实验中可以用蔗糖和浓硫酸代替镁条作引火剂,其原因是______________
___________________。
蔗糖在浓硫酸中
脱水并放出大量的热
浓硫酸能使蔗糖脱水并放出大量的热,可作引火剂。
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(2)该铝热反应的化学方程式为_____________________________。
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(3)取反应后的“铁块”研碎取样称量,放入如图B所示装置中,滴入足量NaOH溶液充分反应,测量生成气体的体积以求得样品中残留铝的质量分数。
试回答下列问题:
①量气管在读数时必须进行的操作是_____
________________________________。
因为气体的体积受温度和压强影响,所以量气管在读数时必须进行的操作是:冷却至常温并调节量气管使左右液面相平。
冷却
至常温并调节量气管使左右液面相平
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
②取1 g样品进行上述实验,共收集到44.8 mL(标准状况下)气体,则“铁块”中铝的质量分数为______。
3.6%
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
③图B装置中分液漏斗上端和试管用橡胶管连通,除了可以平衡压强让液体顺利滴入试管之外,还可以起到降低实验误差的作用。如果装置没有橡胶管,则测得的“铁块”中铝的质量分数将会_____(填“偏大”或“偏小”)。
偏大
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
如果装置没有橡胶管,随着长颈漏斗中液体流下,试管中压强增大,会导致排入量气管中的液体增多,造成气体读数偏大,即“铁块”中铝的质量分数偏大。
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
18.铝土矿(主要成分为Al2O3,还有少量杂质,杂质不溶于NaOH溶液)是提取氧化铝的原料。提取氧化铝的工艺流程如下:
Al2O3和氢氧化钠反应生成偏铝酸钠和水,反应的实质是Al2O3+ 2OH-=== +H2O。
(1)请用离子方程式表示以上工艺流程中第①步反应:
___________________________。
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
向偏铝酸钠中通入过量的二氧化碳可以生成氢氧化铝沉淀和碳酸氢钠,发生的反应为NaAlO2+CO2+2H2O===Al(OH)3↓+NaHCO3。
(2)写出以上工艺流程中第③步反应的化学方程式:________________
___________________________。
NaAlO2+CO2+
2H2O===Al(OH)3↓+NaHCO3
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
上述分析可知步骤④是过滤得到氢氧化铝沉淀的操作。
(3)步骤④所需进行的实验操作是_______。
过滤
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(4)金属铝与氧化铁混合在高温下会发生剧烈的反应。该反应的化学方程式为__________________________。请举一例该反应的用途______
_____。
焊接
钢轨
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
金属铝在高温下可以和氧化铁发生铝热反应,反应的化学方程式为2Al+Fe2O3 2Fe+Al2O3,获得金属铁,铁以铁水的形式生成,这样可以用来焊接钢轨。
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(5)电解熔融氧化铝制取金属铝,若有0.6 mol电子发生转移。理论上能得到金属铝的质量是______。
5.4 g
17
18
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
返回
17
18
本课结束
专题9
