专题9 金属与人类文明 专题知识体系构建与核心素养提升 课件(共24张PPT)
文档属性
| 名称 | 专题9 金属与人类文明 专题知识体系构建与核心素养提升 课件(共24张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-10 00:00:00 | ||
图片预览







文档简介
(共24张PPT)
知识体系构建 / 核心素养提升
专题知识体系构建与核心素养提升
专题9
内容索引
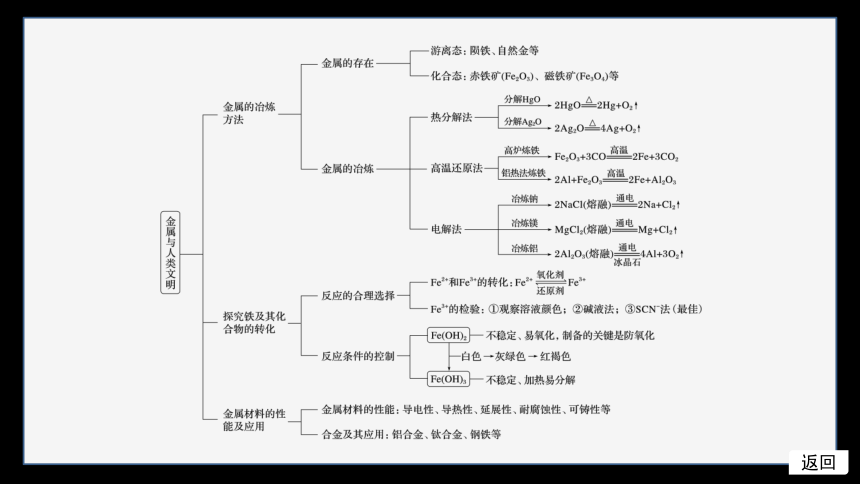
知识体系构建
核心素养提升
知识体系构建
返回
核心素养提升
通过本专题的学习,结合真实情境中的应用实例和通过实验探究,知道铁及其重要化合物的主要性质,了解它们在生产、生活中的应用。能从物质分类、化合价的角度归纳铁、铁盐、亚铁盐的相互转化关系。
能依据金属及其化合物的性质提出物质间的转化思路;能从多个方面对可能的转化路径进行优选;能运用变量控制方法设计转化的实验方案,根据实验现象进行推理。
能联系合金的组成解释合金性质,认识合金对人类社会的贡献,能用简单实验控制反应的条件,制备Fe(OH)2,能设计简单实验检验Fe2+、Fe3+。
例1
(2021·河北,1)“灌钢法”是我国古代劳动人民对钢铁冶炼技术的重大贡献,陶弘景在其《本草经集注》中提到“钢铁是杂炼生鍒作刀镰者”。“灌钢法”主要是将生铁和熟铁(含碳量约0.1%)混合加热,生铁熔化灌入熟铁,再锻打成钢。下列说法错误的是
A.钢是以铁为主的含碳合金
B.钢的含碳量越高,硬度和脆性越大
C.生铁由于含碳量高,熔点比熟铁高
D.冶炼铁的原料之一赤铁矿的主要成分为Fe2O3
√
钢是含碳量低的铁合金,故A正确;
钢的硬度和脆性与含碳量有关,随着含碳量的增加而增大,故B正确;
由题意可知,生铁熔化灌入熟铁,再锻打成钢,说明生铁的熔点低于熟铁,故C错误;
赤铁矿的主要成分是Fe2O3,可用于冶炼铁,故D正确。
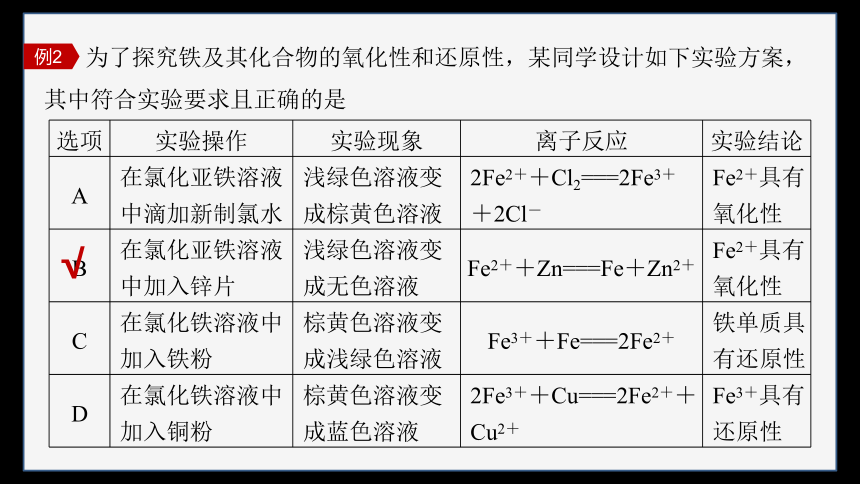
为了探究铁及其化合物的氧化性和还原性,某同学设计如下实验方案,其中符合实验要求且正确的是
例2
选项 实验操作 实验现象 离子反应 实验结论
A 在氯化亚铁溶液中滴加新制氯水 浅绿色溶液变成棕黄色溶液 2Fe2++Cl2===2Fe3++2Cl- Fe2+具有氧化性
B 在氯化亚铁溶液中加入锌片 浅绿色溶液变成无色溶液 Fe2++Zn===Fe+Zn2+ Fe2+具有氧化性
C 在氯化铁溶液中加入铁粉 棕黄色溶液变成浅绿色溶液 Fe3++Fe===2Fe2+ 铁单质具有还原性
D 在氯化铁溶液中加入铜粉 棕黄色溶液变成蓝色溶液 2Fe3++Cu===2Fe2++Cu2+ Fe3+具有还原性
√
Fe2+具有还原性,在氯化亚铁溶液中滴加新制氯水,Fe2+被氯水氧化生成Fe3+,溶液由浅绿色变成棕黄色,故A错误;
Fe2+具有氧化性,Zn具有还原性,在氯化亚铁溶液中加入锌片,锌与Fe2+发生置换反应生成Fe和无色的Zn2+,溶液由浅绿色变成无色,故B正确;
氯化铁溶液与铁粉反应生成氯化亚铁,反应的离子方程式为2Fe3++Fe===3Fe2+,故C错误;
氯化铁溶液与铜粉反应生成氯化亚铁和氯化铜,反应前氯化铁溶液为棕黄色,反应后氯化亚铁溶液为浅绿色,氯化铜溶液为淡蓝色,氯化亚铁和氯化铜的混合溶液为蓝绿色,说明Fe3+具有氧化性,故D错误。
(2021·广东,10)部分含铁物质的分类与相应化合价关系如图所示。下列推断不合理的是
A.a可与e反应生成b
B.b既可被氧化,也可被还原
C.可将e加入浓碱液中制得d的胶体
D.可存在b→c→d→e→b的循环转化关系
例3
√
Fe与Fe(Ⅲ)的盐类物质可发生反应生成Fe(Ⅱ)的盐类物质,如Fe+2FeCl3===3FeCl2,故不选A;
Fe(Ⅱ)为铁元素的中间价态,既有还原性又有氧化性,因此既可被氧化,也可被还原,故不选B;
Fe(Ⅲ)的盐类物质与浓碱液反应生成Fe(OH)3沉淀,制备Fe(OH)3胶体的操作为向沸水中逐滴加入饱和FeCl3溶液,继续煮沸至溶液呈红褐色,停止加热,故选C;
实验小组研究二价铁的氧化反应,设计如下实验。
例4
实验序号 试剂及操作 现象
Ⅰ 现象a:生成白色沉淀,最终转变为红褐色沉淀
现象b:……
Ⅱ 现象c:溶液略呈黄色
现象d:溶液呈血红色
实验序号 试剂及操作 现象
Ⅰ 现象a:生成白色沉淀,最终转变为红褐色沉淀
现象b:……
Ⅱ 现象c:溶液略呈黄色
现象d:溶液呈血红色
(1)实验所用的Fe(NO3)2溶液由Fe(NO3)3溶液和足量铁粉反应制得,离子方程式是___________________。
2Fe3++Fe===3Fe2+
Fe3+与Fe发生氧化还原反应生成Fe2+,离子方程式为2Fe3++Fe===3Fe2+。
实验序号 试剂及操作 现象
Ⅰ 现象a:生成白色沉淀,最终转变为红褐色沉淀
现象b:……
Ⅱ 现象c:溶液略呈黄色
现象d:溶液呈血红色
(2)实验Ⅰ中白色沉淀转变为红褐色沉淀的化学方程式是____________
___________________。
4Fe(OH)2+O2
+2H2O===4Fe(OH)3
实验Ⅰ中Fe(NO3)2与氢氧化钠反应生成Fe(OH)2白色沉淀,迅速被空气中的氧气氧化,逐步变为灰绿色,最终变为红褐色,化学方程式为4Fe(OH)2+O2+2H2O===4Fe(OH)3。
实验序号 试剂及操作 现象
Ⅰ 现象a:生成白色沉淀,最终转变为红褐色沉淀
现象b:……
Ⅱ 现象c:溶液略呈黄色
现象d:溶液呈血红色
(3)现象b是_____________________________。
红褐色沉淀溶解,溶液呈棕黄色
Fe(NO3)2与氢氧化钠反应生成Fe(OH)2白色沉淀,被氧化变为红褐色沉淀Fe(OH)3,加入H2SO4溶液后发生酸碱中和反应,红褐色沉淀溶解,溶液变为棕黄色。
(4)实验小组对实验Ⅱ中何种物质氧化Fe2+进行研究,提出两种假设:
ⅰ.酸性条件下,O2氧化了Fe2+;
ⅱ.酸性条件下,_______________。
①将假设ⅱ补充完整。
②设计实验,证实假设ⅰ不是实验Ⅱ中氧化Fe2+的主要原因。将实验方案和现象补充完整。
步骤1:向1.0 mL__________________溶液中滴加1.5 mL 1.0 mol·L-1 H2SO4溶液;
步骤2:向上述所得溶液中滴加KSCN溶液,观察到________________。
③向步骤2所得溶液中滴加NaOH溶液至pH约为5,检测到有Fe3+产生。
0.1 mol·L-1 FeSO4
溶液无明显变化
根据控制变量法可知,要证明氧化剂为氧气,需要排除硝酸根离子的干扰,因此,可以改为向1.0 mL 0.1 mol·L-1 FeSO4溶液中滴加1.5 mL 1.0 mol·L-1 H2SO4溶液。
(5)综合上述实验,说明二价铁的氧化反应与______________________
___________________________因素有关。
根据实验的过程和实验现象可知,二价铁的氧化反应与溶液的酸碱性、氧化剂种类及二价铁的存在形式等因素有关。
溶液酸碱性强弱、氧化
剂种类及二价铁的存在形式等
返回
本课结束
专题9
知识体系构建 / 核心素养提升
专题知识体系构建与核心素养提升
专题9
内容索引
知识体系构建
核心素养提升
知识体系构建
返回
核心素养提升
通过本专题的学习,结合真实情境中的应用实例和通过实验探究,知道铁及其重要化合物的主要性质,了解它们在生产、生活中的应用。能从物质分类、化合价的角度归纳铁、铁盐、亚铁盐的相互转化关系。
能依据金属及其化合物的性质提出物质间的转化思路;能从多个方面对可能的转化路径进行优选;能运用变量控制方法设计转化的实验方案,根据实验现象进行推理。
能联系合金的组成解释合金性质,认识合金对人类社会的贡献,能用简单实验控制反应的条件,制备Fe(OH)2,能设计简单实验检验Fe2+、Fe3+。
例1
(2021·河北,1)“灌钢法”是我国古代劳动人民对钢铁冶炼技术的重大贡献,陶弘景在其《本草经集注》中提到“钢铁是杂炼生鍒作刀镰者”。“灌钢法”主要是将生铁和熟铁(含碳量约0.1%)混合加热,生铁熔化灌入熟铁,再锻打成钢。下列说法错误的是
A.钢是以铁为主的含碳合金
B.钢的含碳量越高,硬度和脆性越大
C.生铁由于含碳量高,熔点比熟铁高
D.冶炼铁的原料之一赤铁矿的主要成分为Fe2O3
√
钢是含碳量低的铁合金,故A正确;
钢的硬度和脆性与含碳量有关,随着含碳量的增加而增大,故B正确;
由题意可知,生铁熔化灌入熟铁,再锻打成钢,说明生铁的熔点低于熟铁,故C错误;
赤铁矿的主要成分是Fe2O3,可用于冶炼铁,故D正确。
为了探究铁及其化合物的氧化性和还原性,某同学设计如下实验方案,其中符合实验要求且正确的是
例2
选项 实验操作 实验现象 离子反应 实验结论
A 在氯化亚铁溶液中滴加新制氯水 浅绿色溶液变成棕黄色溶液 2Fe2++Cl2===2Fe3++2Cl- Fe2+具有氧化性
B 在氯化亚铁溶液中加入锌片 浅绿色溶液变成无色溶液 Fe2++Zn===Fe+Zn2+ Fe2+具有氧化性
C 在氯化铁溶液中加入铁粉 棕黄色溶液变成浅绿色溶液 Fe3++Fe===2Fe2+ 铁单质具有还原性
D 在氯化铁溶液中加入铜粉 棕黄色溶液变成蓝色溶液 2Fe3++Cu===2Fe2++Cu2+ Fe3+具有还原性
√
Fe2+具有还原性,在氯化亚铁溶液中滴加新制氯水,Fe2+被氯水氧化生成Fe3+,溶液由浅绿色变成棕黄色,故A错误;
Fe2+具有氧化性,Zn具有还原性,在氯化亚铁溶液中加入锌片,锌与Fe2+发生置换反应生成Fe和无色的Zn2+,溶液由浅绿色变成无色,故B正确;
氯化铁溶液与铁粉反应生成氯化亚铁,反应的离子方程式为2Fe3++Fe===3Fe2+,故C错误;
氯化铁溶液与铜粉反应生成氯化亚铁和氯化铜,反应前氯化铁溶液为棕黄色,反应后氯化亚铁溶液为浅绿色,氯化铜溶液为淡蓝色,氯化亚铁和氯化铜的混合溶液为蓝绿色,说明Fe3+具有氧化性,故D错误。
(2021·广东,10)部分含铁物质的分类与相应化合价关系如图所示。下列推断不合理的是
A.a可与e反应生成b
B.b既可被氧化,也可被还原
C.可将e加入浓碱液中制得d的胶体
D.可存在b→c→d→e→b的循环转化关系
例3
√
Fe与Fe(Ⅲ)的盐类物质可发生反应生成Fe(Ⅱ)的盐类物质,如Fe+2FeCl3===3FeCl2,故不选A;
Fe(Ⅱ)为铁元素的中间价态,既有还原性又有氧化性,因此既可被氧化,也可被还原,故不选B;
Fe(Ⅲ)的盐类物质与浓碱液反应生成Fe(OH)3沉淀,制备Fe(OH)3胶体的操作为向沸水中逐滴加入饱和FeCl3溶液,继续煮沸至溶液呈红褐色,停止加热,故选C;
实验小组研究二价铁的氧化反应,设计如下实验。
例4
实验序号 试剂及操作 现象
Ⅰ 现象a:生成白色沉淀,最终转变为红褐色沉淀
现象b:……
Ⅱ 现象c:溶液略呈黄色
现象d:溶液呈血红色
实验序号 试剂及操作 现象
Ⅰ 现象a:生成白色沉淀,最终转变为红褐色沉淀
现象b:……
Ⅱ 现象c:溶液略呈黄色
现象d:溶液呈血红色
(1)实验所用的Fe(NO3)2溶液由Fe(NO3)3溶液和足量铁粉反应制得,离子方程式是___________________。
2Fe3++Fe===3Fe2+
Fe3+与Fe发生氧化还原反应生成Fe2+,离子方程式为2Fe3++Fe===3Fe2+。
实验序号 试剂及操作 现象
Ⅰ 现象a:生成白色沉淀,最终转变为红褐色沉淀
现象b:……
Ⅱ 现象c:溶液略呈黄色
现象d:溶液呈血红色
(2)实验Ⅰ中白色沉淀转变为红褐色沉淀的化学方程式是____________
___________________。
4Fe(OH)2+O2
+2H2O===4Fe(OH)3
实验Ⅰ中Fe(NO3)2与氢氧化钠反应生成Fe(OH)2白色沉淀,迅速被空气中的氧气氧化,逐步变为灰绿色,最终变为红褐色,化学方程式为4Fe(OH)2+O2+2H2O===4Fe(OH)3。
实验序号 试剂及操作 现象
Ⅰ 现象a:生成白色沉淀,最终转变为红褐色沉淀
现象b:……
Ⅱ 现象c:溶液略呈黄色
现象d:溶液呈血红色
(3)现象b是_____________________________。
红褐色沉淀溶解,溶液呈棕黄色
Fe(NO3)2与氢氧化钠反应生成Fe(OH)2白色沉淀,被氧化变为红褐色沉淀Fe(OH)3,加入H2SO4溶液后发生酸碱中和反应,红褐色沉淀溶解,溶液变为棕黄色。
(4)实验小组对实验Ⅱ中何种物质氧化Fe2+进行研究,提出两种假设:
ⅰ.酸性条件下,O2氧化了Fe2+;
ⅱ.酸性条件下,_______________。
①将假设ⅱ补充完整。
②设计实验,证实假设ⅰ不是实验Ⅱ中氧化Fe2+的主要原因。将实验方案和现象补充完整。
步骤1:向1.0 mL__________________溶液中滴加1.5 mL 1.0 mol·L-1 H2SO4溶液;
步骤2:向上述所得溶液中滴加KSCN溶液,观察到________________。
③向步骤2所得溶液中滴加NaOH溶液至pH约为5,检测到有Fe3+产生。
0.1 mol·L-1 FeSO4
溶液无明显变化
根据控制变量法可知,要证明氧化剂为氧气,需要排除硝酸根离子的干扰,因此,可以改为向1.0 mL 0.1 mol·L-1 FeSO4溶液中滴加1.5 mL 1.0 mol·L-1 H2SO4溶液。
(5)综合上述实验,说明二价铁的氧化反应与______________________
___________________________因素有关。
根据实验的过程和实验现象可知,二价铁的氧化反应与溶液的酸碱性、氧化剂种类及二价铁的存在形式等因素有关。
溶液酸碱性强弱、氧化
剂种类及二价铁的存在形式等
返回
本课结束
专题9
