1.3 元素性质及其变化规律 第1课时 课件(共28张PPT) 2022-2023学年高二下学期化学鲁科版(2019)选择性必修2
文档属性
| 名称 | 1.3 元素性质及其变化规律 第1课时 课件(共28张PPT) 2022-2023学年高二下学期化学鲁科版(2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-12 00:00:00 | ||
图片预览





文档简介
(共28张PPT)
第3 元素性质及其变化规律
第1课时
电离能及其变化规律
鲁科版高中化学选择性必修2
第1章 原子结构与元素性质
回顾已学
随着原子序数的递增
元素原子的核外电子排布
元素原子半径
元素主要化合价
呈现周期性变化
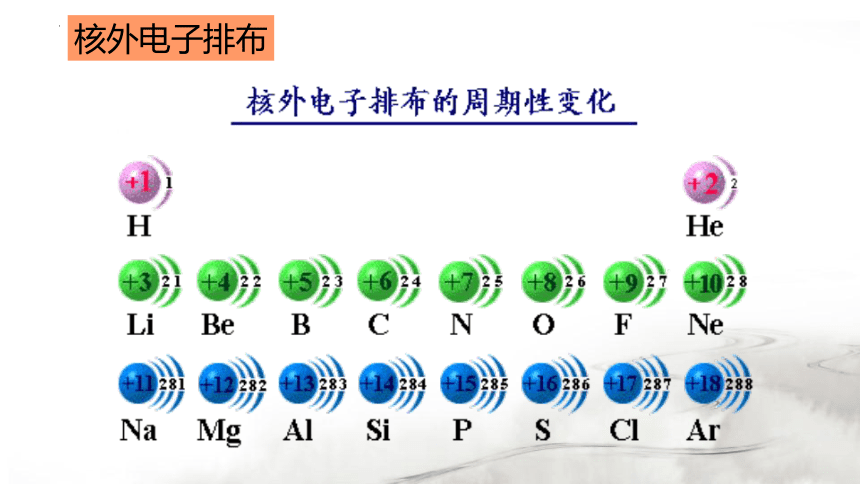
核外电子排布
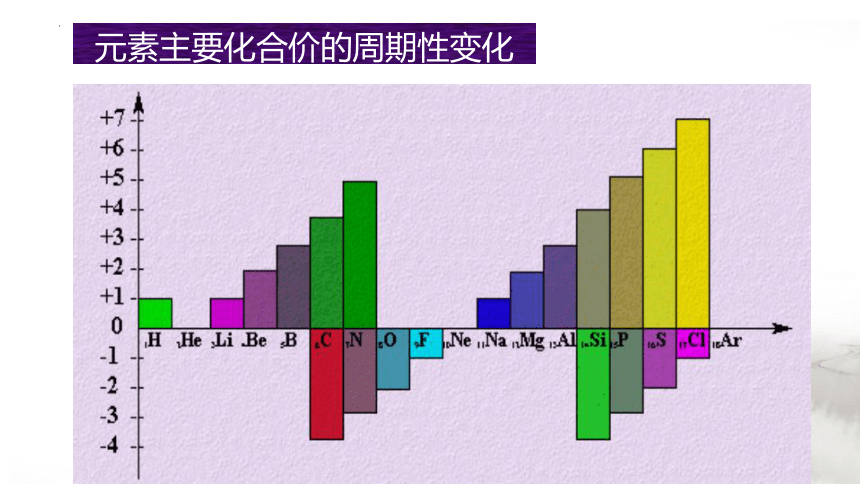
元素主要化合价的周期性变化
得电子能力递 增
得
电
子
能
力
递
增
失电子能力最 强
得电子能力最强
失电子能力递增
原子失电子能力递增
原子半径是如何测定的?
假定原子是一个实心球体,用统计方法测定的半径。
(1)共价半径
(2)金属半径
(3)范德华半径
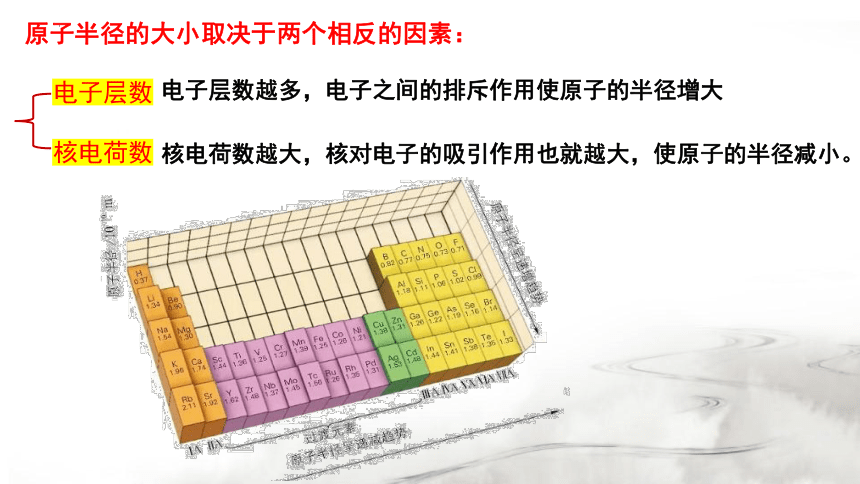
一、原子半径及其变化规律
1.原子半径的概念
依据量子力学理论,在原子核外,从原子核附近到离核很远的地方,电子都有可能出现,因此原子并不是一个具有明确“边界”的实体,也就是说,原子并没有经典意义上的半径。
原子半径的大小取决于两个相反的因素:
电子层数
核电荷数
核电荷数越大,核对电子的吸引作用也就越大,使原子的半径减小。
电子层数越多,电子之间的排斥作用使原子的半径增大
2.原子半径的周期性变化
(1)主族元素
同周期
从左到右,原子半径逐渐减小。
同主族
自上到下,原子半径逐渐增大。
增加的电子排布在同一层上,增加的电子产生的电子间的排斥作用小于核电荷增加导致的核对外层电子的吸引作用,结果使原子半径逐渐减小。
为随着电子层数的增加,离核更远的外层轨道填入电子,电子层数的影响大于核电荷增加的影响,导致原子半径增大。
同一周期自左至右原子半径变化幅度不大。
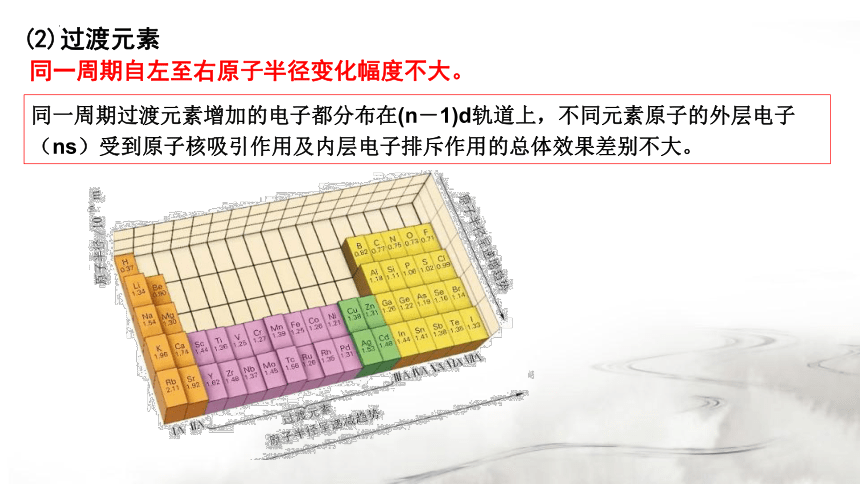
(2)过渡元素
同一周期过渡元素增加的电子都分布在(n-1)d轨道上,不同元素原子的外层电子(ns)受到原子核吸引作用及内层电子排斥作用的总体效果差别不大。
“一看”电子层数:
电子层数越多,半径越大。(层多径大)
当电子层数相同时,“二看”核电荷数:
核电荷数越大,半径越小。(序大径小)
当核电荷数相同时,“三看”核外电子数:
核外电子数越多,半径越大。(数多径大)
3.“三看”比较微粒半径的大小
10e-:O2- F- Na+ Mg2+ Al3+
Fe3+ Fe2+ Fe
Na+ Mg2+ Al3+ S2- Cl-
>
>
>
>
<
>
>
>
<
<
一
二
三
四
五
六
七
B
Si
As
Te
Po
Sb
Ge
Al
At
定性描述元素周期表中元素原子得失电子能力的变化规律
族
周期
IA IIA IIIA IVA VA VIA VIIA
同周期元素原子的电子层数______,从左到右原子半径逐渐____,
原子核对电子的吸引能力逐渐_____。
同主族元素原子的价电子数_____,自上而下原子半径逐渐_____,
原子核对电子的吸引能力逐渐_____。
相同
减小
增强
相同
增大
减弱
原子得电子能力(非金属性)增强
原子失电子能力(金属性)减弱
r↓
原
子
失
电
子
能
力
增
强
原
子
得
电
子
能
力
减弱
r↑
位于元素周期表中金属元素与非金属元素分界线周围元素的原子获得或失去电子的能力都不强。
在科学研究和生产实践中,仅有定性的分析往往是不够的,为此人们用电离能、电负性等来定量的衡量或比较原子得失电子能力的强弱。
阅读课本第23页内容,了解电离能的概念和含义,分析电离能描述的是元素的哪种性质?并分析第一电离能的数值和性质的关系?
阅读学习
二、电离能及其变化规律
1.定义:
2.符号: 单位:
3.意义:
I2
I1
I3
电离能
气态基态原子或气态基态离子失去一个电子所需要的最小能量叫做电离能。
I
kJ/mol或kJ·mol-1
表示在气态时原子或离子失电子的难易程度。
电离能越小,该气态原子越 失去电子;
故可判断金属原子失电子的难易程度。
容易
M(g)
第一电离能
I1
-e-
M+(g)
第二电离能
I2
-e-
M2+(g)
第三电离能
I3
-e-
M3+(g)……
逐级电离能
预测:元素周期表同周期、同主族元素第一电离能变化规律?
观察分析下图元素第一电离能的变化情况,寻找它们的变化有哪些规律?同时你是否还能发现一些问题?请讨论总结。
4.元素第一电离能的递变规律
同周期:
1、 元素的I1最小, 元素的I1最大。
2、从左到右,元素的I1在总体上呈现_________ 的变化趋势。
3. 反常: 。
由小到大
碱金属
稀有气体
ⅡA ⅤA元素 比左右大
同主族:自上而下,元素的I1 。
逐渐减小
过渡元素I1变化不太规则,随原子序数增加I1从左到右略有增加。
4.元素第一电离能的递变规律
随着核电荷数的增大和原子半径的减小,核对外层电子的有效吸引作用依次增强。
原因?
原因?
同主族元素原子的价电子数相同,原子半径逐渐增大,原子核核外电子的有吸引作用逐渐减弱
同主族元素原子的价电子数相同,但自上而下,原子半径逐渐增大,原子核对外层电子的有效吸引作用逐渐减弱。
I1的大小与原子半径和核外电子排布密切相关
思考探究
为什么同周期元素,随着核电荷数的增加,I1增大趋势?
为什么ⅡA、ⅤA的I1反常大?为什么稀有气体的I1最大?
同主族元素,随着n的增加,I1减小?
同周期元素原子电子层数相同,但随着核电荷数增大,原子半径减小,原子核对外层电子的有效吸引作用增强。
ⅡA、ⅤA族元素原子的价排布分别为ns2、ns2np3,为全充满和半充满结构,难失电子。
稀有气体元素原子的价排布为ns2、ns2np6,达到全充满稳定结构,难失电子。
请同学们分析:P和S的电离能
P(1s22s22p63s23p3)半满状态,比较稳定,所以不易失去电子。
为什么ⅡA、ⅤA的电离能特殊?
Mg(1s22s22p63s23p0)正处于全空状态,能量较低,比较稳定,所以不易失去电子。
思考:
第一电离能:Mg____Al 金属活动性顺序:Mg____Al
>
>
第一电离能小的元素的金属性一定强( )
正误判断
×
运用某种规律分析问题时一定要注意具体条件。
1. 判断下列元素间的第一电离能的大小:
Na K N P F Ne
Cl S Mg Al O N
练习
>
>
<
>
>
<
2. 在下列空格中,填上适当的元素符号(除放射性元素):
(1) 在第3周期中,
第一电离能最小的元素是 ,第一电离能最大的元素是 ;
(2)在元素周期表中,
第一电离能最小的元素是 ,第一电离能最大的元素是 ;
Na
Ar
Cs
He
3. 在第3周期中,第一电离能比S大的元素有_____种,分别是____________。
3
P Cl Ar
I2
I1
I3
Be电离能
M(g)
I1
-e-
M+(g)
I2
-e-
M2+(g)
I3
-e-
M3+(g)……
规律:通常对同种元素 I3>I2>I1,有突跃。
5.逐级电离能变化规律
原子失去电子后变成阳离子,离子半径变小而核电荷数没变,原子核对电子的引力增强,从而使电离能逐级增大。
同一原子 I 突变,则电子层变化。
Be(g)
1s22s2
Be+(g)
1s22s1
-e-
I1
Be2+(g)
1s2
-e-
I2
Be3+(g)
1s1
-e-
I3
从表中数据可知:
①Na元素的I2远大于I1,因此Na容易失去第一个电子,而不易失去第二个电子;即Na易形成Na+,而不易形成Na2+
②镁元素的I1、I2相差不大,I3远大于它们,说明镁容易失去两个电子,而不易失去第三个电子,因此镁易形成Mg2+,而不易形成Mg3+。
思考:Na2+、Mg3+为什么不易形成?
元素 I1 I2 I3
Na 496 4562 6912
Mg 738 1451 7733
练习
某元素X的逐级电离能如图所示,下列说法正确的是
A.元素X可能显+4价
B.X为非金属元素
C.X为第5周期元素
D.X的单质在化学反应时最可能生成的
阳离子为X3+
√
练习
520
练习
1. 从元素原子的第一电离能数据的大小可以判断出( )
A. 元素原子得电子的难易
B. 元素的主要化合价
C. 元素原子失电子的难易
D. 核外电子是分层排布的
2.下列元素中,第一电离能最小的( )
A. K B. Na C. P D. Cl
A
c
练习
2.将下列元素按第一电离能按由大到小的顺序排列:
①K Na Li
②B C Be N
③He Ne Ar
④Na Al S P
Li>Na> K
N>C>Be>B
He>Ne>Ar
P>S>Al>Na
练习
根据下列五种元素的电离能数据(单位:kJ/mol),你能得到哪些信息?
元素代号 I1 I2 I3 I4
Q 2080 4000 6100 9400
R 500 4600 6900 9500
S 740 1500 7700 10500
T 580 1800 2700 11600
U 420 3100 4400 5900
根据你得到的信息,回答下面问题。
(1)在周期表中,最可能处于同一族的是( )
A . Q和R B .S和T C . T和U D . R和T E .R和U
(2)它们的氯化物的化学式,最可能正确的是( )
A . QCl2 B .RCl C . SCl3 D. TCl E. UCl4
(3)下列元素中,化学性质和物理性质最像Q元素的是( )
A . 硼(1s22s22p1) B . 铍(1s22s2)
C . 锂(1s22s1) D .氢(1s1) E . 氦(1s2)
能力提升
E
B
E
同一周期的元素,碱金属元素的第一电离能最小,稀有气体元素的第一电离能最大
从左到右,元素的第一电离能在总体上呈现由小到大的变化趋势,表示元素原子越来越难失去电子
同周期、同主族元素的递变规律
项目 同周期(左-右) 同主族(上-下)
原 子结构 核电荷数
最外层电子数
电子层数
原子半径
性质 化合价
元素的得失电子能力
单质的氧化性还原性
最高价化合物对应水化物的酸碱性
气态氢化物的稳定性
依次增大
逐渐增多
相同
逐渐减小
周期性变化
非金属性减↑,金属性↓
氧化性↑,还原性↓
酸性↑,碱性↓
逐渐↑
逐渐增大
相同
依次递增
逐渐增大
基本相同
金属性↑,非金属性↓
还原性↑,氧化性↓
碱性↑,酸性↓
逐渐↓
得电子↑,失电子能力↓
失电子能力↑,得电子↓
第3 元素性质及其变化规律
第1课时
电离能及其变化规律
鲁科版高中化学选择性必修2
第1章 原子结构与元素性质
回顾已学
随着原子序数的递增
元素原子的核外电子排布
元素原子半径
元素主要化合价
呈现周期性变化
核外电子排布
元素主要化合价的周期性变化
得电子能力递 增
得
电
子
能
力
递
增
失电子能力最 强
得电子能力最强
失电子能力递增
原子失电子能力递增
原子半径是如何测定的?
假定原子是一个实心球体,用统计方法测定的半径。
(1)共价半径
(2)金属半径
(3)范德华半径
一、原子半径及其变化规律
1.原子半径的概念
依据量子力学理论,在原子核外,从原子核附近到离核很远的地方,电子都有可能出现,因此原子并不是一个具有明确“边界”的实体,也就是说,原子并没有经典意义上的半径。
原子半径的大小取决于两个相反的因素:
电子层数
核电荷数
核电荷数越大,核对电子的吸引作用也就越大,使原子的半径减小。
电子层数越多,电子之间的排斥作用使原子的半径增大
2.原子半径的周期性变化
(1)主族元素
同周期
从左到右,原子半径逐渐减小。
同主族
自上到下,原子半径逐渐增大。
增加的电子排布在同一层上,增加的电子产生的电子间的排斥作用小于核电荷增加导致的核对外层电子的吸引作用,结果使原子半径逐渐减小。
为随着电子层数的增加,离核更远的外层轨道填入电子,电子层数的影响大于核电荷增加的影响,导致原子半径增大。
同一周期自左至右原子半径变化幅度不大。
(2)过渡元素
同一周期过渡元素增加的电子都分布在(n-1)d轨道上,不同元素原子的外层电子(ns)受到原子核吸引作用及内层电子排斥作用的总体效果差别不大。
“一看”电子层数:
电子层数越多,半径越大。(层多径大)
当电子层数相同时,“二看”核电荷数:
核电荷数越大,半径越小。(序大径小)
当核电荷数相同时,“三看”核外电子数:
核外电子数越多,半径越大。(数多径大)
3.“三看”比较微粒半径的大小
10e-:O2- F- Na+ Mg2+ Al3+
Fe3+ Fe2+ Fe
Na+ Mg2+ Al3+ S2- Cl-
>
>
>
>
<
>
>
>
<
<
一
二
三
四
五
六
七
B
Si
As
Te
Po
Sb
Ge
Al
At
定性描述元素周期表中元素原子得失电子能力的变化规律
族
周期
IA IIA IIIA IVA VA VIA VIIA
同周期元素原子的电子层数______,从左到右原子半径逐渐____,
原子核对电子的吸引能力逐渐_____。
同主族元素原子的价电子数_____,自上而下原子半径逐渐_____,
原子核对电子的吸引能力逐渐_____。
相同
减小
增强
相同
增大
减弱
原子得电子能力(非金属性)增强
原子失电子能力(金属性)减弱
r↓
原
子
失
电
子
能
力
增
强
原
子
得
电
子
能
力
减弱
r↑
位于元素周期表中金属元素与非金属元素分界线周围元素的原子获得或失去电子的能力都不强。
在科学研究和生产实践中,仅有定性的分析往往是不够的,为此人们用电离能、电负性等来定量的衡量或比较原子得失电子能力的强弱。
阅读课本第23页内容,了解电离能的概念和含义,分析电离能描述的是元素的哪种性质?并分析第一电离能的数值和性质的关系?
阅读学习
二、电离能及其变化规律
1.定义:
2.符号: 单位:
3.意义:
I2
I1
I3
电离能
气态基态原子或气态基态离子失去一个电子所需要的最小能量叫做电离能。
I
kJ/mol或kJ·mol-1
表示在气态时原子或离子失电子的难易程度。
电离能越小,该气态原子越 失去电子;
故可判断金属原子失电子的难易程度。
容易
M(g)
第一电离能
I1
-e-
M+(g)
第二电离能
I2
-e-
M2+(g)
第三电离能
I3
-e-
M3+(g)……
逐级电离能
预测:元素周期表同周期、同主族元素第一电离能变化规律?
观察分析下图元素第一电离能的变化情况,寻找它们的变化有哪些规律?同时你是否还能发现一些问题?请讨论总结。
4.元素第一电离能的递变规律
同周期:
1、 元素的I1最小, 元素的I1最大。
2、从左到右,元素的I1在总体上呈现_________ 的变化趋势。
3. 反常: 。
由小到大
碱金属
稀有气体
ⅡA ⅤA元素 比左右大
同主族:自上而下,元素的I1 。
逐渐减小
过渡元素I1变化不太规则,随原子序数增加I1从左到右略有增加。
4.元素第一电离能的递变规律
随着核电荷数的增大和原子半径的减小,核对外层电子的有效吸引作用依次增强。
原因?
原因?
同主族元素原子的价电子数相同,原子半径逐渐增大,原子核核外电子的有吸引作用逐渐减弱
同主族元素原子的价电子数相同,但自上而下,原子半径逐渐增大,原子核对外层电子的有效吸引作用逐渐减弱。
I1的大小与原子半径和核外电子排布密切相关
思考探究
为什么同周期元素,随着核电荷数的增加,I1增大趋势?
为什么ⅡA、ⅤA的I1反常大?为什么稀有气体的I1最大?
同主族元素,随着n的增加,I1减小?
同周期元素原子电子层数相同,但随着核电荷数增大,原子半径减小,原子核对外层电子的有效吸引作用增强。
ⅡA、ⅤA族元素原子的价排布分别为ns2、ns2np3,为全充满和半充满结构,难失电子。
稀有气体元素原子的价排布为ns2、ns2np6,达到全充满稳定结构,难失电子。
请同学们分析:P和S的电离能
P(1s22s22p63s23p3)半满状态,比较稳定,所以不易失去电子。
为什么ⅡA、ⅤA的电离能特殊?
Mg(1s22s22p63s23p0)正处于全空状态,能量较低,比较稳定,所以不易失去电子。
思考:
第一电离能:Mg____Al 金属活动性顺序:Mg____Al
>
>
第一电离能小的元素的金属性一定强( )
正误判断
×
运用某种规律分析问题时一定要注意具体条件。
1. 判断下列元素间的第一电离能的大小:
Na K N P F Ne
Cl S Mg Al O N
练习
>
>
<
>
>
<
2. 在下列空格中,填上适当的元素符号(除放射性元素):
(1) 在第3周期中,
第一电离能最小的元素是 ,第一电离能最大的元素是 ;
(2)在元素周期表中,
第一电离能最小的元素是 ,第一电离能最大的元素是 ;
Na
Ar
Cs
He
3. 在第3周期中,第一电离能比S大的元素有_____种,分别是____________。
3
P Cl Ar
I2
I1
I3
Be电离能
M(g)
I1
-e-
M+(g)
I2
-e-
M2+(g)
I3
-e-
M3+(g)……
规律:通常对同种元素 I3>I2>I1,有突跃。
5.逐级电离能变化规律
原子失去电子后变成阳离子,离子半径变小而核电荷数没变,原子核对电子的引力增强,从而使电离能逐级增大。
同一原子 I 突变,则电子层变化。
Be(g)
1s22s2
Be+(g)
1s22s1
-e-
I1
Be2+(g)
1s2
-e-
I2
Be3+(g)
1s1
-e-
I3
从表中数据可知:
①Na元素的I2远大于I1,因此Na容易失去第一个电子,而不易失去第二个电子;即Na易形成Na+,而不易形成Na2+
②镁元素的I1、I2相差不大,I3远大于它们,说明镁容易失去两个电子,而不易失去第三个电子,因此镁易形成Mg2+,而不易形成Mg3+。
思考:Na2+、Mg3+为什么不易形成?
元素 I1 I2 I3
Na 496 4562 6912
Mg 738 1451 7733
练习
某元素X的逐级电离能如图所示,下列说法正确的是
A.元素X可能显+4价
B.X为非金属元素
C.X为第5周期元素
D.X的单质在化学反应时最可能生成的
阳离子为X3+
√
练习
520
练习
1. 从元素原子的第一电离能数据的大小可以判断出( )
A. 元素原子得电子的难易
B. 元素的主要化合价
C. 元素原子失电子的难易
D. 核外电子是分层排布的
2.下列元素中,第一电离能最小的( )
A. K B. Na C. P D. Cl
A
c
练习
2.将下列元素按第一电离能按由大到小的顺序排列:
①K Na Li
②B C Be N
③He Ne Ar
④Na Al S P
Li>Na> K
N>C>Be>B
He>Ne>Ar
P>S>Al>Na
练习
根据下列五种元素的电离能数据(单位:kJ/mol),你能得到哪些信息?
元素代号 I1 I2 I3 I4
Q 2080 4000 6100 9400
R 500 4600 6900 9500
S 740 1500 7700 10500
T 580 1800 2700 11600
U 420 3100 4400 5900
根据你得到的信息,回答下面问题。
(1)在周期表中,最可能处于同一族的是( )
A . Q和R B .S和T C . T和U D . R和T E .R和U
(2)它们的氯化物的化学式,最可能正确的是( )
A . QCl2 B .RCl C . SCl3 D. TCl E. UCl4
(3)下列元素中,化学性质和物理性质最像Q元素的是( )
A . 硼(1s22s22p1) B . 铍(1s22s2)
C . 锂(1s22s1) D .氢(1s1) E . 氦(1s2)
能力提升
E
B
E
同一周期的元素,碱金属元素的第一电离能最小,稀有气体元素的第一电离能最大
从左到右,元素的第一电离能在总体上呈现由小到大的变化趋势,表示元素原子越来越难失去电子
同周期、同主族元素的递变规律
项目 同周期(左-右) 同主族(上-下)
原 子结构 核电荷数
最外层电子数
电子层数
原子半径
性质 化合价
元素的得失电子能力
单质的氧化性还原性
最高价化合物对应水化物的酸碱性
气态氢化物的稳定性
依次增大
逐渐增多
相同
逐渐减小
周期性变化
非金属性减↑,金属性↓
氧化性↑,还原性↓
酸性↑,碱性↓
逐渐↑
逐渐增大
相同
依次递增
逐渐增大
基本相同
金属性↑,非金属性↓
还原性↑,氧化性↓
碱性↑,酸性↓
逐渐↓
得电子↑,失电子能力↓
失电子能力↑,得电子↓
