2.3.1 共价键的极性 课件(共22张PPT)
文档属性
| 名称 | 2.3.1 共价键的极性 课件(共22张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-12 22:20:44 | ||
图片预览





文档简介
(共22张PPT)
第1课时 共价键的极性
学习目标
能判断共价键的极性及分子的极性。
2.能据此对分子的一些共性或典型性质及其应用作出解释。
一、共价键的极性
1. 键的极性
基础回顾
分 类 标 准 类 型
原子轨道重叠方式 σ 键、 π 键
共用电子对是否偏移
极性键、非极性键
共用电子对数目
单键、双键、三键
(1) 不同的分类法
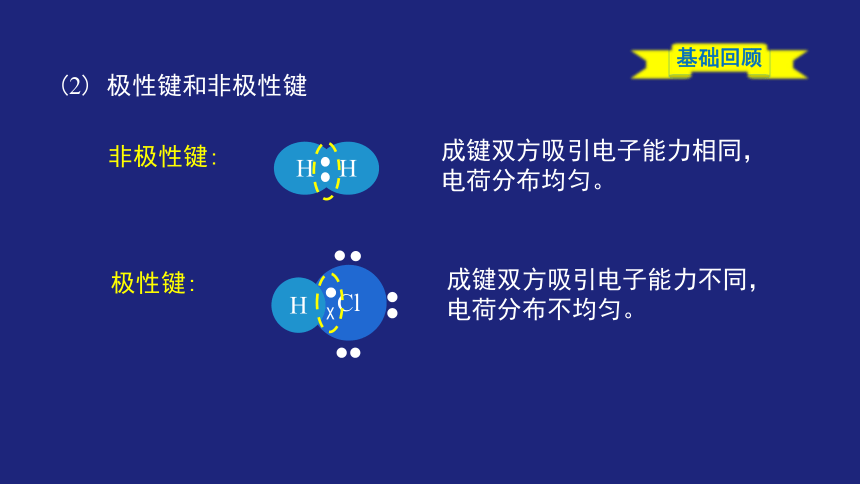
非极性键:
H
H
基础回顾
(2) 极性键和非极性键
成键双方吸引电子能力相同,电荷分布均匀。
极性键:
Cl
X
H
成键双方吸引电子能力不同,电荷分布不均匀。
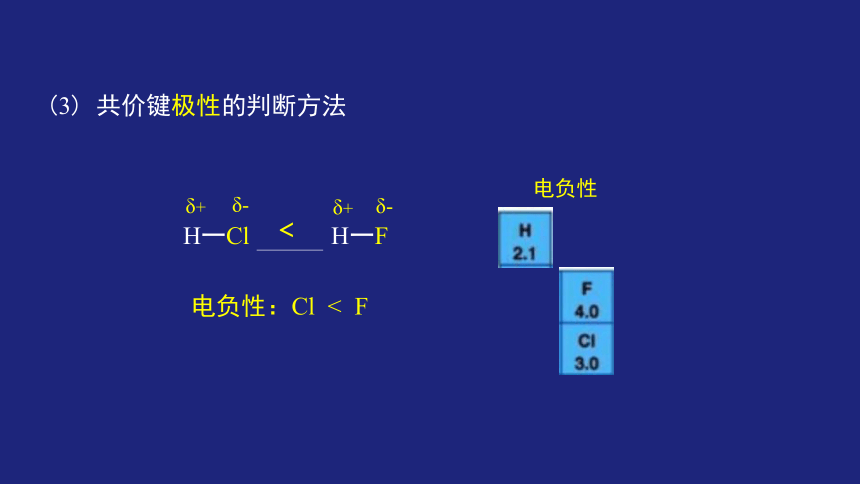
(3) 共价键极性的判断方法
H一Cl H一F
电负性
δ+
δ-
δ+
δ-
电负性:Cl < F
<
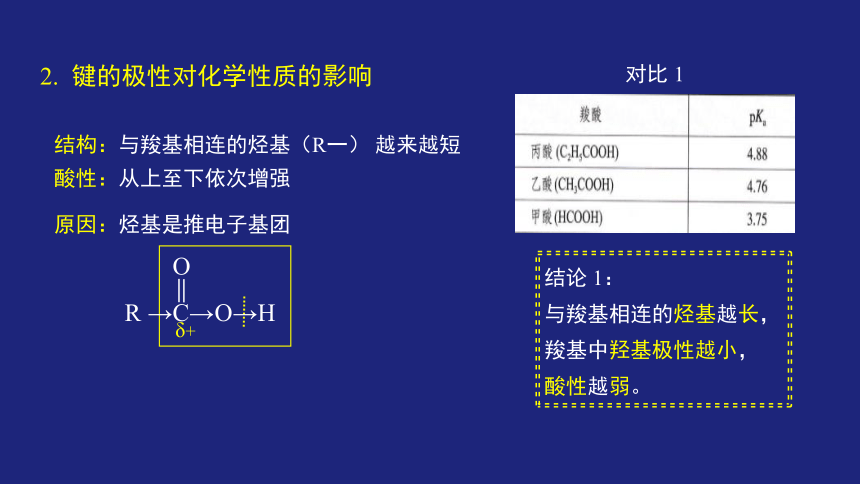
2. 键的极性对化学性质的影响
羧基中的羟基极性越大→羧基易电离出氢离子→羧酸酸性越强。
一 C 一 O 一 H
O
CH3
一 C 一 O
O
CH3
+ H +
乙酸(CH3COOH)
δ+
-
2. 键的极性对化学性质的影响
酸性增强
思考讨论
pKa = - lgKa( 同 pH 计算方法 )
相同温度下
一 C 一 O 一 H
O
一 C 一 O
O
+ H +
分析:
物质的组成和结构如何影响羧酸的酸性?
δ+
-
结论 1:
与羧基相连的烃基越长,
羧基中羟基极性越小,
酸性越弱。
对比 1
结构:与羧基相连的烃基(R一) 越来越短
酸性:从上至下依次增强
原因:烃基是推电子基团
δ+
R →C→O→H
O
2. 键的极性对化学性质的影响
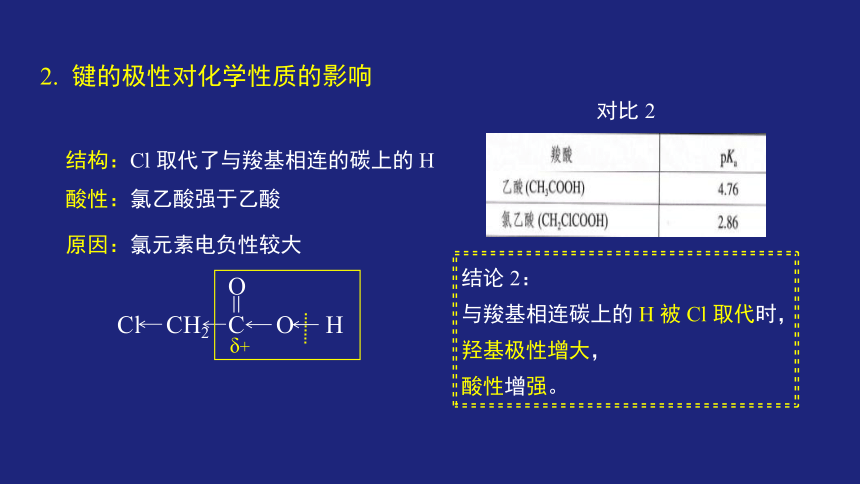
对比 2
结构:Cl 取代了与羧基相连的碳上的 H
酸性:氯乙酸强于乙酸
结论 2:
与羧基相连碳上的 H 被 Cl 取代时,
羟基极性增大,
酸性增强。
原因:氯元素电负性较大
Cl CH2 C O H
O
δ+
2. 键的极性对化学性质的影响
对比 3
结构:取代基“ 一Cl ”数目依次增多
酸性:从上至下依次增强
结论 3:
与羧基相连的碳原子上取代的氯原子越多,
羟基极性越大,酸性越强。
δ-
Cl
Cl C C O H
O
原因: 氯原子越多,羟基极性越大
δ+
Cl
δ-
δ-
2. 键的极性对化学性质的影响
2. 键的极性对化学性质的影响
结论 4:
与羧基相连的碳原子上
取代基电负性越大,
羟基极性越大,酸性越强。
对比 4
结构:与羧基相连的取代基不同
酸性:三氟乙酸酸性较强
原因:F 的电负性大于 Cl
δ-
F C C O H
O
δ+
F
F
δ-
δ-
3. 分子的极性
极性分子:正电中心和负电中心不重合,分子一部分呈正
电性(δ+),另一部分呈负电性(δ-)。
非极性分子:正电中心与负电中心重合的分子。
(1) 概念
思考讨论
δ+
δ-
极性分子 H一Cl
非极性分子 H2 O2 Cl2
均为仅含非极性键的单质,
因此为非极性分子。
(1)以下双原子分子中,哪些是极性分子,哪些是非极性分子?
H2 O2 Cl2 HCl
(2)P4 和 C60 是极性分子还是非极性分子?
C60
P4
思考讨论
非极性分子
极性分子
(3)以下化合物分子中,哪些是极性分子,哪些是非极性分子?
CO2 HCN H2O NH3 BF3 CH4 CH3Cl
CO2
δ+
δ-
δ-
O C O
H2O
O
H H
δ-
δ+
δ+
直线结构
+
V 形结构
非极性分子
极性分子
(2) 分子极性的判断方法
CO2
δ+
δ-
δ-
O C O
H2O
O
H H
δ-
δ+
δ+
直线结构
+
V 形结构
非极性分子
极性分子
(2) 分子极性的判断方法
向量画法:正电性原子→负电性原子
O
H H
δ-
δ+
δ+
O C O
δ-
δ-
δ+
F
F
F
B
δ-
δ-
δ-
δ+
BF3
(2) 分子极性的 判断方法
δ-
N
H
H
H
δ+
δ+
δ+
NH3
+
非极性分子
极性分子
(3) 规律小结
① 仅含非极性键的分子为非极性分子。
② 含极性键的分子可根据正、负电中心是否重合
或借助极性键的向量和是否为零进行判断。
注意:O3 结构特殊,其含有极性键,属于极性分子。
本课小结
分子的手性
极性分子
非极性分子
不重合
重合
分子正负电荷
中心是否重合
共价键的极性
分子的空间结构
决定
物质的性质
如:羧酸的酸性
检测反馈
1.下列各组物质中,都是由极性键形成的极性分子的一组是( )
A.CH4和Br2 B.NH3和H2O
C.H2S和CCl4 D.CO2和HC
解析 CH4、CCl4、CO2都是由极性键形成的非极性分子,NH3、H2O、H2S都是由极性键形成的极性分子,Br2是由非极性键形成的非极性分子。
B
检测反馈
2.已知 O3 的空间结构为 V 形,分子中正电中心和负电中心不重合,则下列关于 O3 和 O2 在水中的溶解度叙述正确的是( )
A. O3 在水中的溶解度和 O2 一样 B. O3 在水中的溶解度比 O2 小
C. O3 在水中的溶解度比 O2 大 D. 无法比较
C
极性分子 O3 H2O
非极性分子 O2
依据:相似相溶原理判断
本节内容结束
第1课时 共价键的极性
学习目标
能判断共价键的极性及分子的极性。
2.能据此对分子的一些共性或典型性质及其应用作出解释。
一、共价键的极性
1. 键的极性
基础回顾
分 类 标 准 类 型
原子轨道重叠方式 σ 键、 π 键
共用电子对是否偏移
极性键、非极性键
共用电子对数目
单键、双键、三键
(1) 不同的分类法
非极性键:
H
H
基础回顾
(2) 极性键和非极性键
成键双方吸引电子能力相同,电荷分布均匀。
极性键:
Cl
X
H
成键双方吸引电子能力不同,电荷分布不均匀。
(3) 共价键极性的判断方法
H一Cl H一F
电负性
δ+
δ-
δ+
δ-
电负性:Cl < F
<
2. 键的极性对化学性质的影响
羧基中的羟基极性越大→羧基易电离出氢离子→羧酸酸性越强。
一 C 一 O 一 H
O
CH3
一 C 一 O
O
CH3
+ H +
乙酸(CH3COOH)
δ+
-
2. 键的极性对化学性质的影响
酸性增强
思考讨论
pKa = - lgKa( 同 pH 计算方法 )
相同温度下
一 C 一 O 一 H
O
一 C 一 O
O
+ H +
分析:
物质的组成和结构如何影响羧酸的酸性?
δ+
-
结论 1:
与羧基相连的烃基越长,
羧基中羟基极性越小,
酸性越弱。
对比 1
结构:与羧基相连的烃基(R一) 越来越短
酸性:从上至下依次增强
原因:烃基是推电子基团
δ+
R →C→O→H
O
2. 键的极性对化学性质的影响
对比 2
结构:Cl 取代了与羧基相连的碳上的 H
酸性:氯乙酸强于乙酸
结论 2:
与羧基相连碳上的 H 被 Cl 取代时,
羟基极性增大,
酸性增强。
原因:氯元素电负性较大
Cl CH2 C O H
O
δ+
2. 键的极性对化学性质的影响
对比 3
结构:取代基“ 一Cl ”数目依次增多
酸性:从上至下依次增强
结论 3:
与羧基相连的碳原子上取代的氯原子越多,
羟基极性越大,酸性越强。
δ-
Cl
Cl C C O H
O
原因: 氯原子越多,羟基极性越大
δ+
Cl
δ-
δ-
2. 键的极性对化学性质的影响
2. 键的极性对化学性质的影响
结论 4:
与羧基相连的碳原子上
取代基电负性越大,
羟基极性越大,酸性越强。
对比 4
结构:与羧基相连的取代基不同
酸性:三氟乙酸酸性较强
原因:F 的电负性大于 Cl
δ-
F C C O H
O
δ+
F
F
δ-
δ-
3. 分子的极性
极性分子:正电中心和负电中心不重合,分子一部分呈正
电性(δ+),另一部分呈负电性(δ-)。
非极性分子:正电中心与负电中心重合的分子。
(1) 概念
思考讨论
δ+
δ-
极性分子 H一Cl
非极性分子 H2 O2 Cl2
均为仅含非极性键的单质,
因此为非极性分子。
(1)以下双原子分子中,哪些是极性分子,哪些是非极性分子?
H2 O2 Cl2 HCl
(2)P4 和 C60 是极性分子还是非极性分子?
C60
P4
思考讨论
非极性分子
极性分子
(3)以下化合物分子中,哪些是极性分子,哪些是非极性分子?
CO2 HCN H2O NH3 BF3 CH4 CH3Cl
CO2
δ+
δ-
δ-
O C O
H2O
O
H H
δ-
δ+
δ+
直线结构
+
V 形结构
非极性分子
极性分子
(2) 分子极性的判断方法
CO2
δ+
δ-
δ-
O C O
H2O
O
H H
δ-
δ+
δ+
直线结构
+
V 形结构
非极性分子
极性分子
(2) 分子极性的判断方法
向量画法:正电性原子→负电性原子
O
H H
δ-
δ+
δ+
O C O
δ-
δ-
δ+
F
F
F
B
δ-
δ-
δ-
δ+
BF3
(2) 分子极性的 判断方法
δ-
N
H
H
H
δ+
δ+
δ+
NH3
+
非极性分子
极性分子
(3) 规律小结
① 仅含非极性键的分子为非极性分子。
② 含极性键的分子可根据正、负电中心是否重合
或借助极性键的向量和是否为零进行判断。
注意:O3 结构特殊,其含有极性键,属于极性分子。
本课小结
分子的手性
极性分子
非极性分子
不重合
重合
分子正负电荷
中心是否重合
共价键的极性
分子的空间结构
决定
物质的性质
如:羧酸的酸性
检测反馈
1.下列各组物质中,都是由极性键形成的极性分子的一组是( )
A.CH4和Br2 B.NH3和H2O
C.H2S和CCl4 D.CO2和HC
解析 CH4、CCl4、CO2都是由极性键形成的非极性分子,NH3、H2O、H2S都是由极性键形成的极性分子,Br2是由非极性键形成的非极性分子。
B
检测反馈
2.已知 O3 的空间结构为 V 形,分子中正电中心和负电中心不重合,则下列关于 O3 和 O2 在水中的溶解度叙述正确的是( )
A. O3 在水中的溶解度和 O2 一样 B. O3 在水中的溶解度比 O2 小
C. O3 在水中的溶解度比 O2 大 D. 无法比较
C
极性分子 O3 H2O
非极性分子 O2
依据:相似相溶原理判断
本节内容结束
