2.3.2 分子间作用力 分子的手性 课件(共25张PPT)
文档属性
| 名称 | 2.3.2 分子间作用力 分子的手性 课件(共25张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 21.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-12 22:22:14 | ||
图片预览




文档简介
(共25张PPT)
第2课时 分子间作用力 分子的手性
学习目标
1. 能说明分子间作用力(含氢键)对物质熔、沸点等性质的
影响,能列举含有氢键的物质及其性质特点。
2. 能认识手性分子并了解其在药物研究中的应用。
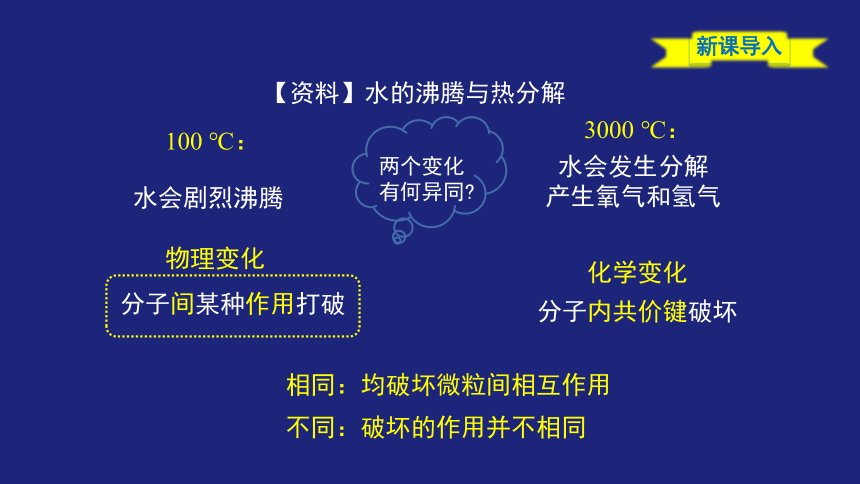
相同:均破坏微粒间相互作用
不同:破坏的作用并不相同
【资料】水的沸腾与热分解
3000 ℃:
水会发生分解
产生氧气和氢气
100 ℃:
水会剧烈沸腾
化学变化
分子内共价键破坏
分子间某种作用打破
物理变化
两个变化
有何异同
新课导入
1. 范德华力及其对物质性质的影响
一、分子间作用力
(1) 含义
把分子聚集在一起的作用力称为分子间作用力,
又叫范德华力。
(2) 特点
范德华力很弱,
约比化学键键能小 1 - 2 个数量级。
微粒间 作用力 能量
kJ·mol -1
化学键 100 - 600
范德华力 2 - 20
新知梳理
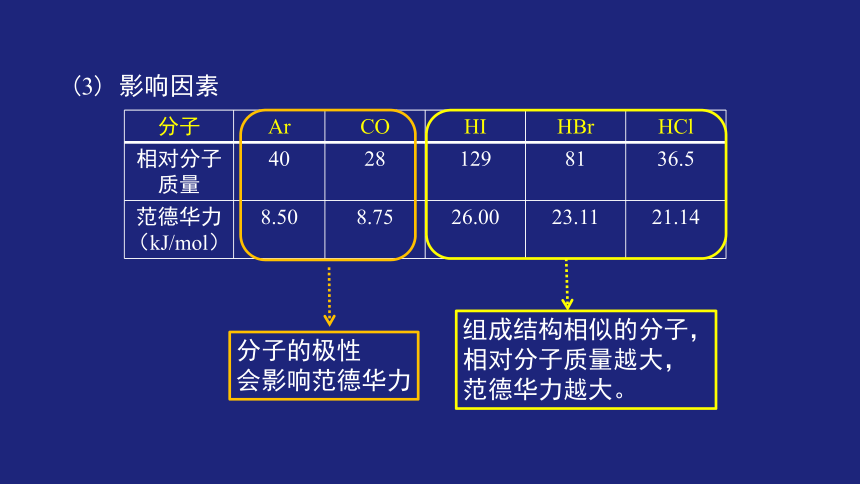
(3) 影响因素
分子 Ar CO HI HBr HCl
相对分子质量 40 28 129 81 36.5
范德华力 (kJ/mol) 8.50 8.75 26.00 23.11 21.14
组成结构相似的分子,
相对分子质量越大,
范德华力越大。
分子的极性
会影响范德华力
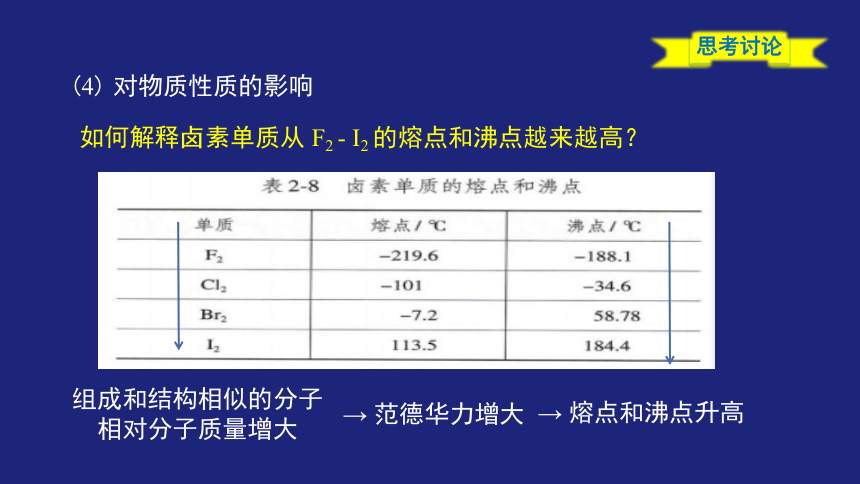
思考讨论
如何解释卤素单质从 F2 - I2 的熔点和沸点越来越高?
(4) 对物质性质的影响
组成和结构相似的分子
相对分子质量增大
→ 范德华力增大
→ 熔点和沸点升高
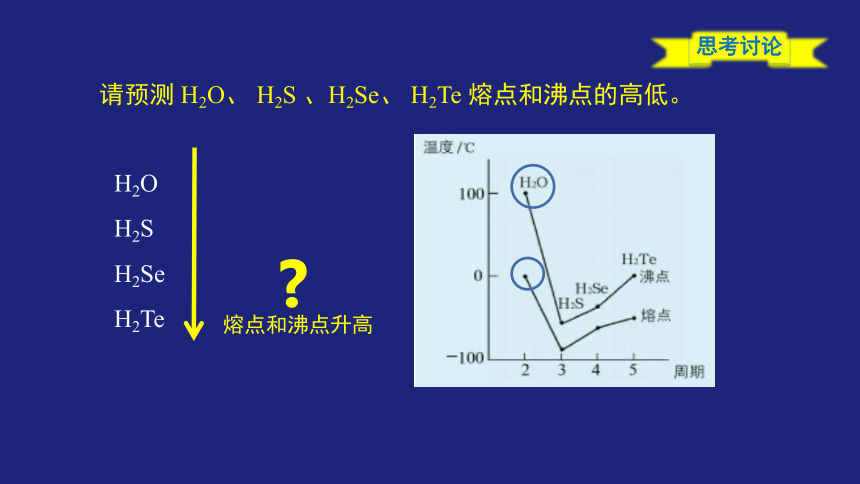
思考讨论
请预测 H2O、 H2S 、H2Se、 H2Te 熔点和沸点的高低。
H2O
H2S
H2Se
H2Te
熔点和沸点升高
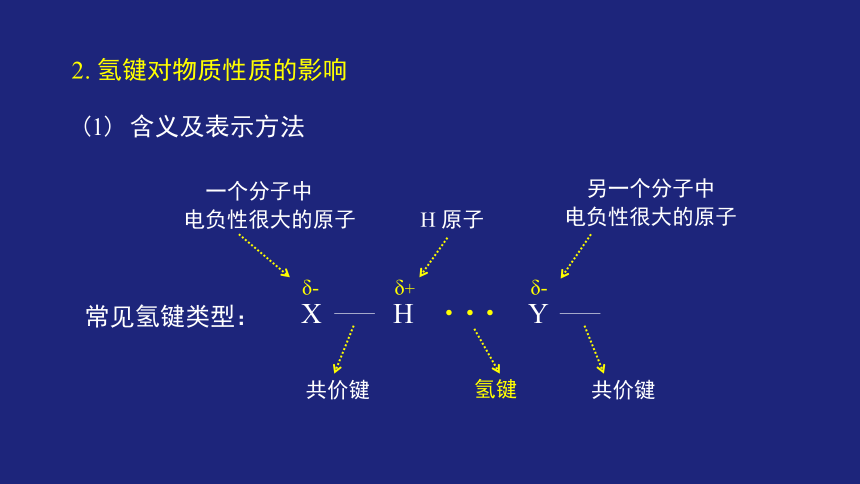
(1) 含义及表示方法
2. 氢键对物质性质的影响
δ+
X H
常见氢键类型:
一个分子中
电负性很大的原子 H 原子
共价键
δ-
···
氢键
Y
另一个分子中
电负性很大的原子
δ-
共价键
例:水分子间的氢键
O - H … O
吸引
2. 氢键对物质性质的影响
如: NH3分子间、HF 分子间存在氢键,
它们和水分子间也存在氢键。
(2) 特点
① 氢键属于分子间作用力。
② 比化学键弱,比范德华力强。
2. 氢键对物质性质的影响
(3) 对物质性质的影响
水分子间
氢键形成
分子间作用力增大
沸点高于
同族氢化物
水分子间间隙增大
冰的密度比水小
DNA 的双螺旋结构就是由两条 DNA 大分子的碱基通过氢键形成配对
氢键对维持生物大分子的空间构型和生理活性具有重要意义
科学视野
(4) 分类
① 分子间氢键:H2O NH3 HF
② 分子内氢键
沸点:邻羟基苯甲醛 < 对羟基苯甲醛
图 1
分子内氢键
图 2
分子间氢键
资料
3. 溶解性
“相似相溶”实验
思考:
碘在哪种溶剂中的
溶解性好?
实验现象
实验结论:I2 在 CCl4 中溶解性比在水中好。
I2 溶于水中
溶液呈黄色
加入 CCl4
振荡
I2 溶于 CCl4 中
溶液呈紫红色
3. 溶解性
相似?
非极性分子:I2 和 CCl4
极性分子:水
物质的极性
“相似相溶”实验
(1) “相似相溶”规律
非极性溶质一般易溶于非极性溶剂,
极性溶质一般易溶于极性溶剂。
3. 溶解性
实验结论:KI3 易溶于水,碘单质参与发生反应 。
I2 溶于水中
溶液呈黄色
加入 CCl4
I2 溶于 CCl4 中
溶液呈紫红色
加入 KI 溶液
溶液
紫红色变浅
已知:
I2 + I- I3-
振荡
振荡
(2) 适用条件
3. 溶解性
① 溶质和溶剂极性相似
② 分子结构相似
乙醇: CH3CH2一 OH
水: H 一 OH
戊醇:CH3CH2CH2CH2CH2一 OH
乙醇与水互溶
戊醇溶解度减小
比较 NH3 和 CH4 在水中的溶解度,
怎样利用“相似相溶”规律理解它们的溶解度不同?
思考讨论
NH3 与水分子之间还可以形成氢键,使 NH3 更易溶于水。
溶质与溶剂间的氢键作用也会影响物质的溶解性
极性分子:NH3 、H2O
非极性分子:CH4
相似相溶
NH3 易溶于水
CH4 难溶于水
二、分子的手性
1. 手性异构体
具有完全相同的组成和原子排列的一对分子,如同左右手一样互为镜像,却在三维空间里不能重叠。
2. 手性分子
有手性异构体的分子。
3. 手性碳原子判断
有机物碳原子结合的 4 个原子或原子团各不同,
该碳是手性碳原子,标记为﹡。
HOOC—CH—OH
CH3
﹡
4. 手性分子的应用
(1) 合成手性药物
(2) 合成手性催化剂
手性合成、手性催化方面做出贡献的科学家
本课小结
实验观
“相似相溶”规律
分子的手性
熔沸点
氢键
范德华力
分子
分子间作用力
影响
溶解性
比较观
检测反馈
1. 同样是直线形非极性分子,常温下二氧化碳是气体而二硫化碳是液体。
2. 同样是三角锥形氢化物,氨气在水中极易溶解,并且很容易液化。而
同主族的磷化氢( PH3 )却没有这些性质。
请解释下列现象
二硫化碳相对分子质量较大 → 范德华力较大 → 沸点较高→常温液态。
PH3 无氢键作用
无这些性质
氨分子间存在氢键
氨气容易液化
氨分子为极性分子
氨分子与水分子间形成氢键
氨气在水中极易溶解
本节内容结束
第2课时 分子间作用力 分子的手性
学习目标
1. 能说明分子间作用力(含氢键)对物质熔、沸点等性质的
影响,能列举含有氢键的物质及其性质特点。
2. 能认识手性分子并了解其在药物研究中的应用。
相同:均破坏微粒间相互作用
不同:破坏的作用并不相同
【资料】水的沸腾与热分解
3000 ℃:
水会发生分解
产生氧气和氢气
100 ℃:
水会剧烈沸腾
化学变化
分子内共价键破坏
分子间某种作用打破
物理变化
两个变化
有何异同
新课导入
1. 范德华力及其对物质性质的影响
一、分子间作用力
(1) 含义
把分子聚集在一起的作用力称为分子间作用力,
又叫范德华力。
(2) 特点
范德华力很弱,
约比化学键键能小 1 - 2 个数量级。
微粒间 作用力 能量
kJ·mol -1
化学键 100 - 600
范德华力 2 - 20
新知梳理
(3) 影响因素
分子 Ar CO HI HBr HCl
相对分子质量 40 28 129 81 36.5
范德华力 (kJ/mol) 8.50 8.75 26.00 23.11 21.14
组成结构相似的分子,
相对分子质量越大,
范德华力越大。
分子的极性
会影响范德华力
思考讨论
如何解释卤素单质从 F2 - I2 的熔点和沸点越来越高?
(4) 对物质性质的影响
组成和结构相似的分子
相对分子质量增大
→ 范德华力增大
→ 熔点和沸点升高
思考讨论
请预测 H2O、 H2S 、H2Se、 H2Te 熔点和沸点的高低。
H2O
H2S
H2Se
H2Te
熔点和沸点升高
(1) 含义及表示方法
2. 氢键对物质性质的影响
δ+
X H
常见氢键类型:
一个分子中
电负性很大的原子 H 原子
共价键
δ-
···
氢键
Y
另一个分子中
电负性很大的原子
δ-
共价键
例:水分子间的氢键
O - H … O
吸引
2. 氢键对物质性质的影响
如: NH3分子间、HF 分子间存在氢键,
它们和水分子间也存在氢键。
(2) 特点
① 氢键属于分子间作用力。
② 比化学键弱,比范德华力强。
2. 氢键对物质性质的影响
(3) 对物质性质的影响
水分子间
氢键形成
分子间作用力增大
沸点高于
同族氢化物
水分子间间隙增大
冰的密度比水小
DNA 的双螺旋结构就是由两条 DNA 大分子的碱基通过氢键形成配对
氢键对维持生物大分子的空间构型和生理活性具有重要意义
科学视野
(4) 分类
① 分子间氢键:H2O NH3 HF
② 分子内氢键
沸点:邻羟基苯甲醛 < 对羟基苯甲醛
图 1
分子内氢键
图 2
分子间氢键
资料
3. 溶解性
“相似相溶”实验
思考:
碘在哪种溶剂中的
溶解性好?
实验现象
实验结论:I2 在 CCl4 中溶解性比在水中好。
I2 溶于水中
溶液呈黄色
加入 CCl4
振荡
I2 溶于 CCl4 中
溶液呈紫红色
3. 溶解性
相似?
非极性分子:I2 和 CCl4
极性分子:水
物质的极性
“相似相溶”实验
(1) “相似相溶”规律
非极性溶质一般易溶于非极性溶剂,
极性溶质一般易溶于极性溶剂。
3. 溶解性
实验结论:KI3 易溶于水,碘单质参与发生反应 。
I2 溶于水中
溶液呈黄色
加入 CCl4
I2 溶于 CCl4 中
溶液呈紫红色
加入 KI 溶液
溶液
紫红色变浅
已知:
I2 + I- I3-
振荡
振荡
(2) 适用条件
3. 溶解性
① 溶质和溶剂极性相似
② 分子结构相似
乙醇: CH3CH2一 OH
水: H 一 OH
戊醇:CH3CH2CH2CH2CH2一 OH
乙醇与水互溶
戊醇溶解度减小
比较 NH3 和 CH4 在水中的溶解度,
怎样利用“相似相溶”规律理解它们的溶解度不同?
思考讨论
NH3 与水分子之间还可以形成氢键,使 NH3 更易溶于水。
溶质与溶剂间的氢键作用也会影响物质的溶解性
极性分子:NH3 、H2O
非极性分子:CH4
相似相溶
NH3 易溶于水
CH4 难溶于水
二、分子的手性
1. 手性异构体
具有完全相同的组成和原子排列的一对分子,如同左右手一样互为镜像,却在三维空间里不能重叠。
2. 手性分子
有手性异构体的分子。
3. 手性碳原子判断
有机物碳原子结合的 4 个原子或原子团各不同,
该碳是手性碳原子,标记为﹡。
HOOC—CH—OH
CH3
﹡
4. 手性分子的应用
(1) 合成手性药物
(2) 合成手性催化剂
手性合成、手性催化方面做出贡献的科学家
本课小结
实验观
“相似相溶”规律
分子的手性
熔沸点
氢键
范德华力
分子
分子间作用力
影响
溶解性
比较观
检测反馈
1. 同样是直线形非极性分子,常温下二氧化碳是气体而二硫化碳是液体。
2. 同样是三角锥形氢化物,氨气在水中极易溶解,并且很容易液化。而
同主族的磷化氢( PH3 )却没有这些性质。
请解释下列现象
二硫化碳相对分子质量较大 → 范德华力较大 → 沸点较高→常温液态。
PH3 无氢键作用
无这些性质
氨分子间存在氢键
氨气容易液化
氨分子为极性分子
氨分子与水分子间形成氢键
氨气在水中极易溶解
本节内容结束
