3.2.2 共价晶体 课件(共16张PPT)
文档属性
| 名称 | 3.2.2 共价晶体 课件(共16张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-12 00:00:00 | ||
图片预览






文档简介
(共16张PPT)
第2课时 共价晶体
1.知道共价晶体的结构特点。
2.能够从化学键的特征,分析理解共价晶体的物理特性。
学习目标
这些固体是晶体吗
情境引入
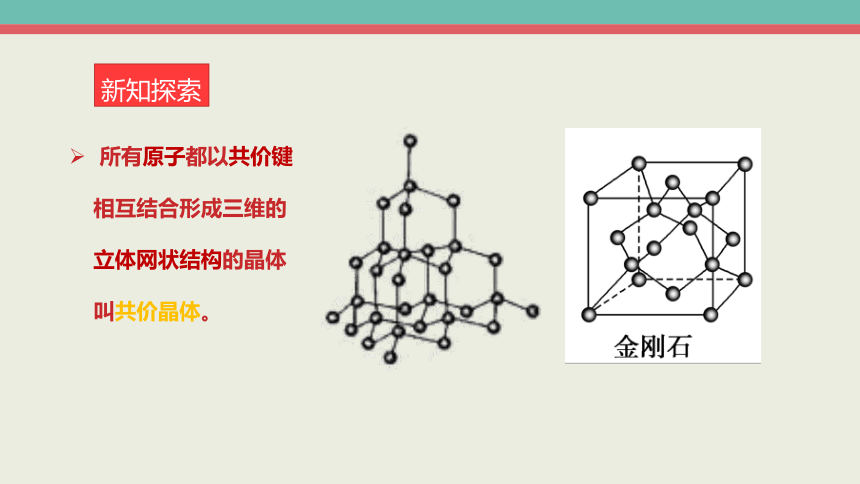
所有原子都以共价键相互结合形成三维的 立体网状结构的晶体叫共价晶体。
新知探索
共价晶体是由原子构成的,微粒间的作用力是共价键,气化或熔化时破坏的作用力为共价键。
常见的共价晶体
1. 某些单质:如硼(B)、硅(Si)、锗(Ge)和锡(Sn)等。
2. 某些非金属化合物:如碳化硅(SiC)、二氧化硅(SiO2)及氮化硅(Si3N4)等。
3. 极少数金属氧化物,如刚玉(Al2O3)。
共价晶体的物理性质
1.熔点很高。共价晶体中,原子间以较强的共价键相结合,要使物质熔化就
要克服共价键,需要很高的能量。
2.硬度很大。
3.一般不导电,但晶体硅是半导体。
4. 难溶于一般溶剂
金刚石晶体结构分析
在晶体中每个碳原子以4个共价单键与相邻的 个碳原子相结合,成为正四面体。晶体中C一C一C夹角为109°28',碳原子采取了sp3杂化。最小环上有6个碳原子。晶体中碳原子个数与C-C键数之比为1:2 。
思考探究1
二氧化硅晶体结构分析
每个硅原子与相邻的4个氧原子以共价键相结合构成正四面体结构,硅原子在正四面体的中心,4个氧原子在正四面体的4个顶点。每个Si原子与4个O原子成键,每个O原子与2个Si原子成键,最小的环是12元环。每个最小的环实际拥有的硅原子为6×1/12=1/2,氧原子数为6×1/6=1。1mol SiO2晶体中含Si-O键数目为4NA,在SiO2晶体中Si、O原子均采取sp3杂化。
思考探究2
判断共价晶体和分子晶体的方法
1.依据组成晶体的粒子和粒子间的作用力判断:组成共价晶体的粒子是原子,粒子间的作用力是共价键;组成分子晶体的粒子是分子,粒子间的的作用力是分子间作用力。
2.依据晶体的熔点判断: 共价晶体的熔沸点高,常在1000℃以上;分子晶体的熔、沸点低,常在数百摄氏度以下。
3.依据物质的状态判断: 一般常温常压下,呈气态或液态的单质与化合物,在固态时属于分子晶体。
4.依据物质的挥发性判断: 一般易挥发的物质呈固态时都属于分子晶体。
规律方法
分子晶体、共价晶体的熔、沸点比较
不同类型的晶体熔、沸点:原子晶体>分子晶体。
同一类型的晶体熔、沸点:
分子晶体——
①分子间作用力越大,物质的熔、沸点越高;非金属氢化物分子间含有氢键的分子晶体,熔、沸点比同族元素的氢化物反常得高。如H2O>H2Te>H2Se> H2S。
②组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高。
③组成和结构不相似的物质(相对分子质量接近),分子的极性越大,其熔、沸点越高。如CO>N2,CH3OH>CH3CH3。
规律方法
④同分异构体的支链越多,熔、沸点越低。
⑤ 烃、卤代烃、醇、醛、羧酸等有机物一般随分子里碳原子的增加,熔、沸点升高。
共价晶体——
①晶体的熔、沸点高低取决于共价键的键长和键能。键长越短,键能越大,共价键越稳定,物质的熔、沸点越高。
②若没有告知键长或键能数据时,可比较原子半径的大小。一般原子半径越小,键长越短,键能越大,晶体的熔点就越高。如比较金刚石、碳化硅、晶体硅的熔点高低:原子半径:C熔点:金刚石>碳化硅>晶体硅。
1. 晶体硅与金刚石结构类似
(1)由图中观察可知:每个硅原子被相邻的 个硅原子包围,以 键结合形成四面体。这些四面体向空间发展,构成一个坚实的、彼此联结的空间网状晶体。每个 Si-Si键长相等,键角均为 。
(2)晶体中最小环由____个Si组成且不共面。
6
(3)晶体中Si原子数与Si-Si 键数之比为: 。
1:2
4
共价
109 28
过关检测
2. 分析下列物质的物理性质,判断其晶体类型:
A.碳化铝,黄色晶体,熔点2200℃,熔融态不导电;________________
B.溴化铝,无色晶体,熔点98 ℃,熔融态不导电;
________________
C.五氟化钒,无色晶体,熔点19.5℃,易溶于乙醇、氯仿、丙酮中;_______________
原子晶体
分子晶体
分子晶体
3.在解释下列物质性质的变化规律与物质结构间的因果关系时,与键能无关的变化规律是( )
A. F2、C12、Br2、I2的熔沸点逐渐升高
B. H2S的熔沸点小于H2O的熔、沸点
C. 金刚石、SiC、晶体Si的熔点依次减低
D. HF、HCI、HBr、HI的热稳定性依次减弱
AB
4.干冰和二氧化硅晶体同属ⅣA元素的最高价氧化物,它们的熔沸点差别很大的原因是( )
A.相对分子质量:二氧化硅>二氧化碳
B.C=O键键能比Si-O键键能小
C.干冰为分子晶体,二氧化硅为原子晶体
D.干冰易升华,二氧化硅不能
C
本节内容结束
第2课时 共价晶体
1.知道共价晶体的结构特点。
2.能够从化学键的特征,分析理解共价晶体的物理特性。
学习目标
这些固体是晶体吗
情境引入
所有原子都以共价键相互结合形成三维的 立体网状结构的晶体叫共价晶体。
新知探索
共价晶体是由原子构成的,微粒间的作用力是共价键,气化或熔化时破坏的作用力为共价键。
常见的共价晶体
1. 某些单质:如硼(B)、硅(Si)、锗(Ge)和锡(Sn)等。
2. 某些非金属化合物:如碳化硅(SiC)、二氧化硅(SiO2)及氮化硅(Si3N4)等。
3. 极少数金属氧化物,如刚玉(Al2O3)。
共价晶体的物理性质
1.熔点很高。共价晶体中,原子间以较强的共价键相结合,要使物质熔化就
要克服共价键,需要很高的能量。
2.硬度很大。
3.一般不导电,但晶体硅是半导体。
4. 难溶于一般溶剂
金刚石晶体结构分析
在晶体中每个碳原子以4个共价单键与相邻的 个碳原子相结合,成为正四面体。晶体中C一C一C夹角为109°28',碳原子采取了sp3杂化。最小环上有6个碳原子。晶体中碳原子个数与C-C键数之比为1:2 。
思考探究1
二氧化硅晶体结构分析
每个硅原子与相邻的4个氧原子以共价键相结合构成正四面体结构,硅原子在正四面体的中心,4个氧原子在正四面体的4个顶点。每个Si原子与4个O原子成键,每个O原子与2个Si原子成键,最小的环是12元环。每个最小的环实际拥有的硅原子为6×1/12=1/2,氧原子数为6×1/6=1。1mol SiO2晶体中含Si-O键数目为4NA,在SiO2晶体中Si、O原子均采取sp3杂化。
思考探究2
判断共价晶体和分子晶体的方法
1.依据组成晶体的粒子和粒子间的作用力判断:组成共价晶体的粒子是原子,粒子间的作用力是共价键;组成分子晶体的粒子是分子,粒子间的的作用力是分子间作用力。
2.依据晶体的熔点判断: 共价晶体的熔沸点高,常在1000℃以上;分子晶体的熔、沸点低,常在数百摄氏度以下。
3.依据物质的状态判断: 一般常温常压下,呈气态或液态的单质与化合物,在固态时属于分子晶体。
4.依据物质的挥发性判断: 一般易挥发的物质呈固态时都属于分子晶体。
规律方法
分子晶体、共价晶体的熔、沸点比较
不同类型的晶体熔、沸点:原子晶体>分子晶体。
同一类型的晶体熔、沸点:
分子晶体——
①分子间作用力越大,物质的熔、沸点越高;非金属氢化物分子间含有氢键的分子晶体,熔、沸点比同族元素的氢化物反常得高。如H2O>H2Te>H2Se> H2S。
②组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高。
③组成和结构不相似的物质(相对分子质量接近),分子的极性越大,其熔、沸点越高。如CO>N2,CH3OH>CH3CH3。
规律方法
④同分异构体的支链越多,熔、沸点越低。
⑤ 烃、卤代烃、醇、醛、羧酸等有机物一般随分子里碳原子的增加,熔、沸点升高。
共价晶体——
①晶体的熔、沸点高低取决于共价键的键长和键能。键长越短,键能越大,共价键越稳定,物质的熔、沸点越高。
②若没有告知键长或键能数据时,可比较原子半径的大小。一般原子半径越小,键长越短,键能越大,晶体的熔点就越高。如比较金刚石、碳化硅、晶体硅的熔点高低:原子半径:C
1. 晶体硅与金刚石结构类似
(1)由图中观察可知:每个硅原子被相邻的 个硅原子包围,以 键结合形成四面体。这些四面体向空间发展,构成一个坚实的、彼此联结的空间网状晶体。每个 Si-Si键长相等,键角均为 。
(2)晶体中最小环由____个Si组成且不共面。
6
(3)晶体中Si原子数与Si-Si 键数之比为: 。
1:2
4
共价
109 28
过关检测
2. 分析下列物质的物理性质,判断其晶体类型:
A.碳化铝,黄色晶体,熔点2200℃,熔融态不导电;________________
B.溴化铝,无色晶体,熔点98 ℃,熔融态不导电;
________________
C.五氟化钒,无色晶体,熔点19.5℃,易溶于乙醇、氯仿、丙酮中;_______________
原子晶体
分子晶体
分子晶体
3.在解释下列物质性质的变化规律与物质结构间的因果关系时,与键能无关的变化规律是( )
A. F2、C12、Br2、I2的熔沸点逐渐升高
B. H2S的熔沸点小于H2O的熔、沸点
C. 金刚石、SiC、晶体Si的熔点依次减低
D. HF、HCI、HBr、HI的热稳定性依次减弱
AB
4.干冰和二氧化硅晶体同属ⅣA元素的最高价氧化物,它们的熔沸点差别很大的原因是( )
A.相对分子质量:二氧化硅>二氧化碳
B.C=O键键能比Si-O键键能小
C.干冰为分子晶体,二氧化硅为原子晶体
D.干冰易升华,二氧化硅不能
C
本节内容结束
