3.3.1 金属晶体 离子晶体 课件(共42张PPT)
文档属性
| 名称 | 3.3.1 金属晶体 离子晶体 课件(共42张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 4.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-12 22:56:35 | ||
图片预览







文档简介
第1课时 金属晶体 离子晶体
学习目标
1. 能说出金属键、离子键的特征和实质。
2. 能运用金属晶体模型,从微观视角解释金属晶体的
宏观性质。
3. 能以 NaCl、CsCl 为例解释典型离子化合物的某些性质。
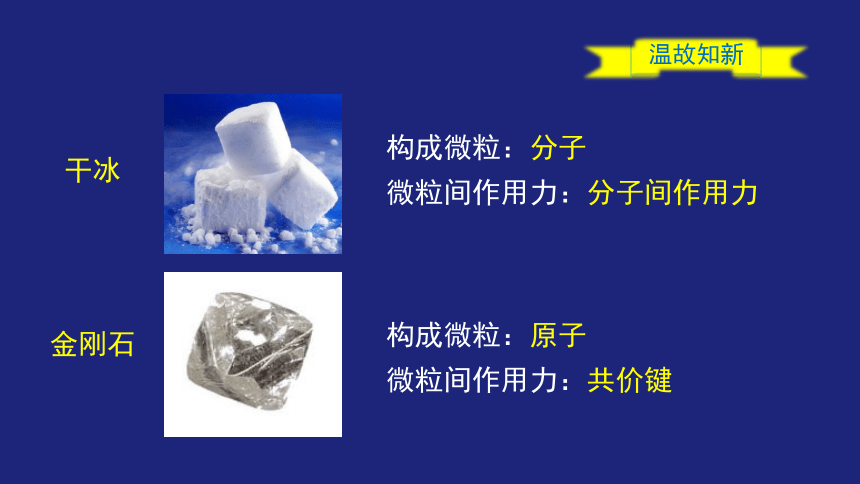
构成微粒:分子
微粒间作用力:分子间作用力
干冰
温故知新
金刚石
构成微粒:原子
微粒间作用力:共价键
丰富多彩的金属
新课引入
容易导电、导热、有延展性、有金属光泽等。
回顾思考:金属有哪些物理性质?
为什么金属能够导电、导热、有延展性、有金属光泽?
什么作用力使金属保持固定的形状?
一、金属晶体
1. 构成微粒:金属阳离子和自由电子
2. 微粒间作用:金属键
金属(除汞外)在常温下都是晶体,称其为金属晶体
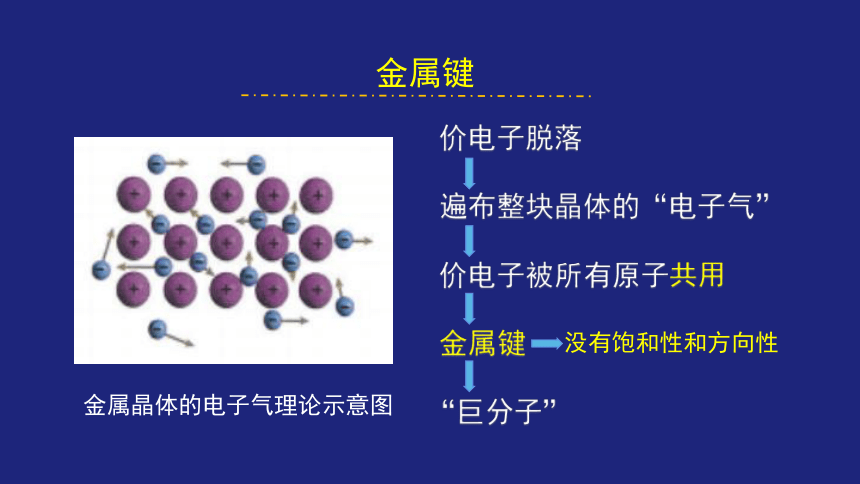
金属键
金属晶体的电子气理论示意图
价电子脱落
遍布整块晶体的“电子气”
价电子被所有原子共用
金属键
“巨分子”
没有饱和性和方向性
金属键无饱和性和方向性
铜晶体
水果的密堆积
金属晶体可以看作
X 射线衍射实验充分验证了这些事实
等径圆球
在三维空间堆积而成
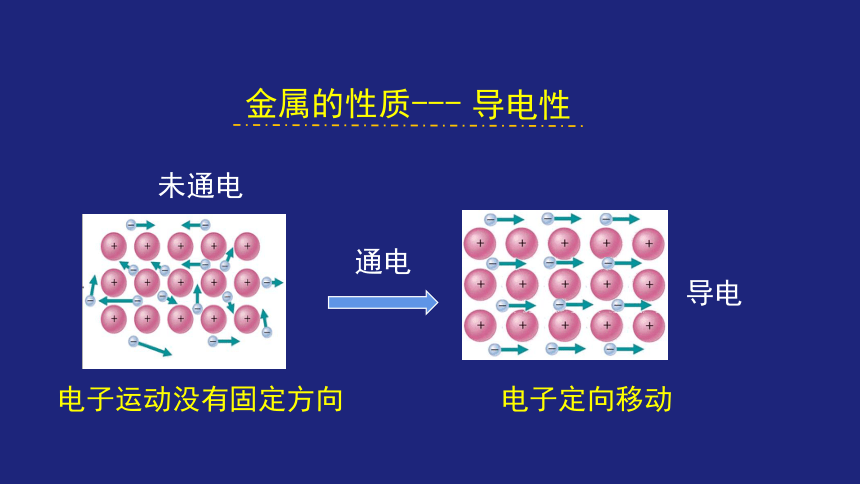
电子定向移动
通电
导电
电子运动没有固定方向
未通电
导电性
金属的性质---
不同金属导电能力不同,导电性较强的三种金属是
Ag、Cu、Al
Ag Cu Al
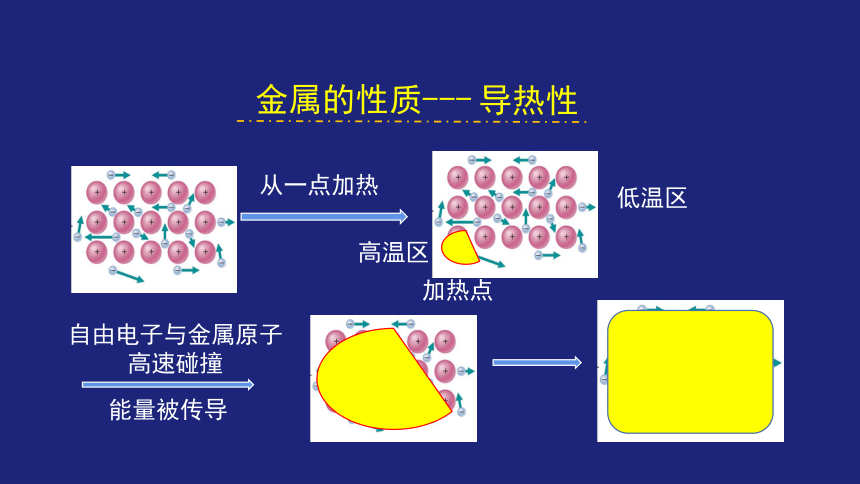
从一点加热
自由电子与金属原子高速碰撞
能量被传导
加热点
低温区
高温区
导热性
金属的性质---
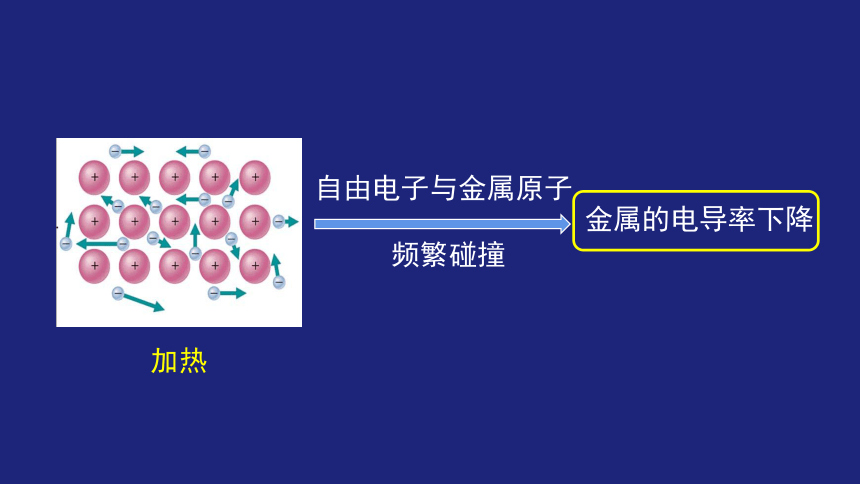
自由电子与金属原子
频繁碰撞
加热
金属的电导率下降
延展性
金属的性质---
外力
电子起到润滑剂的作用
各原子层发生相对滑动
光泽性
金属的性质---
金属晶体对辐射具有良好的反射性能,金属中自由电子可以吸收波长极广的光,并重新反射出来。
金属晶体
不透明
且有金属光泽
金属晶体有导电性,能导电的物质都属于金属晶体吗?
问题 1
不一定
常温下金属汞也能导电
NaCl 溶液、熔融态 NaCl
石墨、聚乙炔等也能导电
以上物质都不属于金属晶体
金属导电与电解质导电有什么不同?
自由移动的离子
自由电子
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}类别
电解质
金属晶体
导电时的状态
导电粒子
导电时发生的变化
化学变化
物理变化
水溶液或
熔融状态下
晶体状态
问题 2
合金的硬度一般比成分金属大,你知道其中的原因吗?
当向金属晶体中掺入不同的金属或非金属原子时,就像在滚珠之间掺入了细小而坚硬的沙土或碎石一样,会使这种金属的延展性和硬度发生改变。
问题 3
钠:熔点较低、硬度较小
钨:熔点最高
铬:硬度最大
问题 4
金属键
的强弱
离子半径越小
电荷越多
金属键
越强
熔沸点越高
硬度越大
{2D5ABB26-0587-4C30-8999-92F81FD0307C}ⅠA
ⅡA
Li
Na
Mg
K
Rb
Cs
{2D5ABB26-0587-4C30-8999-92F81FD0307C}
0
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
Al
s 区
ns1-2
熔点升高
熔点降低
为什么?
半径依次减小,阳离子电荷数依次增多,金属键强度增强
半径依次增大,阳离子电荷数相同,金属键强度减弱
熔点最低
汞
密度最小
锂
硬度最大
铬
金属的用途
硬度大
密度小
硬铝
重晶石
BaSO4
莹石
CaF2
胆矾
CuSO4·5H2O
明矾
KAl(SO4)2·12H2O
下列晶体构成微粒有什么共同点?
微粒之间存在哪种相同的作用力?
二、离子晶体
由阳离子与阴离子相互作用而形成的晶体,叫离子晶体
1. 构成微粒:
2. 微粒间相互作用:
离子键
阴、阳离子
阴、阳离子间的静电作用
2Na + Cl2 2NaCl
+
Na+ Cl–
Na
Cl
Cl–
Na+
?
3. NaCl 离子晶体及晶胞结构特点
离子键!
静电作用
NaCl 的晶胞
12× + 1 = 4
14
?
数 =
8× + 6× = 4
18
?
12
?
数 =
Na+
Cl-
Cl-
Na+
CsCl 的晶胞
数 = 1
18
?
数 = 8 × = 1
思考:CsCl 离子晶体的晶胞特点会怎样呢?
Cs+
Cl-
Cl-
Cs+
CaCO3 (NH4)2SO4 CuSO4·5H2O Cu(NH3)4SO4·H2O
观察以上离子晶体中都含有哪些微观粒子?晶体内部存在哪些类型的化学键?
问题 1
4. 常见离子晶体的结构
CaCO3 (NH4)2SO4 CuSO4·5H2O Cu(NH3)4SO4·H2O
4. 常见离子晶体的结构
离子晶体
阴、阳离子
(单原子或多原子)
电中性分子
构成微粒
离子键
共价键
氢键
范德华力
作用力
问题 1
NaCl、CsCl 的熔、沸点比 HCl 的明显高很多,结合晶体类型,你能推测其原因吗?
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}
HCl
NaCl
CsCl
熔点 /℃
–114.18
801
645
沸点 /℃
–85
1413
1290
问题 2
5. 离子晶体的性质
离子键强度较大,破坏它需要较多的能量
NaCl 和 CsCl 的晶体硬度较大,难以压缩,熔点和沸点较高
5. 离子晶体的性质
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}
HCl
NaCl
CsCl
熔点 /℃
–114.18
801
645
沸点 /℃
–85
1413
1290
思考 P 88
我们知道,金属的熔点差异很大,如钨的熔点为 3410 ℃。而常温下,汞却是液体。离子晶体的熔点是不是也差异很大呢?请从理化手册或互联网查找下列离子晶体的熔点数据,得出结论。
结论:
离子晶体的熔点差距也较大
思考 P 88
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}化合物
熔点 /℃
化合物
熔点 /℃
CaO
2613
Na2SO4
884
CuCl2
1326
Ca2SiO4
2130
NH4NO3
169.6
Na3PO4
340
BaSO4
1580
CH3COOCs
194
LiPF6
200分解温度
NaNO2
270
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}
分子晶体
共价晶体
金属晶体
离子晶体
构成微粒
微粒间
作用
典型晶体类型小结
典型晶体类型小结
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}
分子晶体
共价晶体
金属晶体
离子晶体
构成微粒
分子
原子
金属阳离子
自由电子
阴阳离子
微粒间
作用
典型晶体类型小结
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}
分子晶体
共价晶体
金属晶体
离子晶体
构成微粒
分子
原子
金属阳离子
自由电子
阴阳离子
微粒间
作用
分子间
作用力
共价键
金属键
离子键
典型晶体类型小结
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}
分子晶体
共价晶体
金属晶体
离子晶体
代表物
干冰、冰
金刚石、SiO2
铜、金
氯化钠、 氯化铯
典型
物理
性质
典型晶体类型小结
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}
分子晶体
共价晶体
金属晶体
离子晶体
代表物
干冰、冰
金刚石、SiO2
铜、金
氯化钠、 氯化铯
典型
物理
性质
熔沸点低
相似相溶
硬度小
难导电
熔沸点高
硬度大
难导电
难溶
金属光泽
导电性好
导热性好
延展性好
熔点差异较大
熔融态可导电
多数易溶于水
1.下列物质中,化学键类型相同,晶体类型也相同的是( )
A. C (金刚石)和 CO2
B. NaBr 和 HBr
C. CH4 和 H2O
D. Cl2 和 KCl
C
课堂反馈
共价晶体 分子晶体
离子晶体 分子晶体
分子晶体 分子晶体
分子晶体 离子晶体
√
×
×
×
2.在单质的晶体中,一定不存在( )
A. 离子键
B. 分子间作用力
C. 共价键
D. 金属离子与自由电子间的作用
A
课堂反馈
H2 O2 I2
金属晶体
×
×
×
√
离子晶体
3. 下列叙述中,正确的是( )
A. 离子晶体都是化合物
B. 共价晶体都是单质
C. 金属在常温下都以晶体形式存在
D. 分子晶体在常温下不可能为固态
A
课堂反馈
SiO2 SiC
Hg
I2
×
×
×
√
4.按构成晶体的粒子和粒子间作用的不同,将以下晶体进行分类
氯化铯 石英
金刚砂 水
苯酚(C6H5OH) 铁
氯酸钾 高锰酸钾
离子晶体
离子晶体
离子晶体
共价晶体
共价晶体
金属晶体
分子晶体
分子晶体
课堂反馈
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}
5.铜和氧形成的一种离子化合物的晶体结构如下图,则铜离子的电荷数为 。
氧原子数:8 × + 1 = 2
铜原子数:4
化学式:Cu2O
?
+ 1
课堂反馈
本节内容结束
学习目标
1. 能说出金属键、离子键的特征和实质。
2. 能运用金属晶体模型,从微观视角解释金属晶体的
宏观性质。
3. 能以 NaCl、CsCl 为例解释典型离子化合物的某些性质。
构成微粒:分子
微粒间作用力:分子间作用力
干冰
温故知新
金刚石
构成微粒:原子
微粒间作用力:共价键
丰富多彩的金属
新课引入
容易导电、导热、有延展性、有金属光泽等。
回顾思考:金属有哪些物理性质?
为什么金属能够导电、导热、有延展性、有金属光泽?
什么作用力使金属保持固定的形状?
一、金属晶体
1. 构成微粒:金属阳离子和自由电子
2. 微粒间作用:金属键
金属(除汞外)在常温下都是晶体,称其为金属晶体
金属键
金属晶体的电子气理论示意图
价电子脱落
遍布整块晶体的“电子气”
价电子被所有原子共用
金属键
“巨分子”
没有饱和性和方向性
金属键无饱和性和方向性
铜晶体
水果的密堆积
金属晶体可以看作
X 射线衍射实验充分验证了这些事实
等径圆球
在三维空间堆积而成
电子定向移动
通电
导电
电子运动没有固定方向
未通电
导电性
金属的性质---
不同金属导电能力不同,导电性较强的三种金属是
Ag、Cu、Al
Ag Cu Al
从一点加热
自由电子与金属原子高速碰撞
能量被传导
加热点
低温区
高温区
导热性
金属的性质---
自由电子与金属原子
频繁碰撞
加热
金属的电导率下降
延展性
金属的性质---
外力
电子起到润滑剂的作用
各原子层发生相对滑动
光泽性
金属的性质---
金属晶体对辐射具有良好的反射性能,金属中自由电子可以吸收波长极广的光,并重新反射出来。
金属晶体
不透明
且有金属光泽
金属晶体有导电性,能导电的物质都属于金属晶体吗?
问题 1
不一定
常温下金属汞也能导电
NaCl 溶液、熔融态 NaCl
石墨、聚乙炔等也能导电
以上物质都不属于金属晶体
金属导电与电解质导电有什么不同?
自由移动的离子
自由电子
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}类别
电解质
金属晶体
导电时的状态
导电粒子
导电时发生的变化
化学变化
物理变化
水溶液或
熔融状态下
晶体状态
问题 2
合金的硬度一般比成分金属大,你知道其中的原因吗?
当向金属晶体中掺入不同的金属或非金属原子时,就像在滚珠之间掺入了细小而坚硬的沙土或碎石一样,会使这种金属的延展性和硬度发生改变。
问题 3
钠:熔点较低、硬度较小
钨:熔点最高
铬:硬度最大
问题 4
金属键
的强弱
离子半径越小
电荷越多
金属键
越强
熔沸点越高
硬度越大
{2D5ABB26-0587-4C30-8999-92F81FD0307C}ⅠA
ⅡA
Li
Na
Mg
K
Rb
Cs
{2D5ABB26-0587-4C30-8999-92F81FD0307C}
0
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
Al
s 区
ns1-2
熔点升高
熔点降低
为什么?
半径依次减小,阳离子电荷数依次增多,金属键强度增强
半径依次增大,阳离子电荷数相同,金属键强度减弱
熔点最低
汞
密度最小
锂
硬度最大
铬
金属的用途
硬度大
密度小
硬铝
重晶石
BaSO4
莹石
CaF2
胆矾
CuSO4·5H2O
明矾
KAl(SO4)2·12H2O
下列晶体构成微粒有什么共同点?
微粒之间存在哪种相同的作用力?
二、离子晶体
由阳离子与阴离子相互作用而形成的晶体,叫离子晶体
1. 构成微粒:
2. 微粒间相互作用:
离子键
阴、阳离子
阴、阳离子间的静电作用
2Na + Cl2 2NaCl
+
Na+ Cl–
Na
Cl
Cl–
Na+
?
3. NaCl 离子晶体及晶胞结构特点
离子键!
静电作用
NaCl 的晶胞
12× + 1 = 4
14
?
数 =
8× + 6× = 4
18
?
12
?
数 =
Na+
Cl-
Cl-
Na+
CsCl 的晶胞
数 = 1
18
?
数 = 8 × = 1
思考:CsCl 离子晶体的晶胞特点会怎样呢?
Cs+
Cl-
Cl-
Cs+
CaCO3 (NH4)2SO4 CuSO4·5H2O Cu(NH3)4SO4·H2O
观察以上离子晶体中都含有哪些微观粒子?晶体内部存在哪些类型的化学键?
问题 1
4. 常见离子晶体的结构
CaCO3 (NH4)2SO4 CuSO4·5H2O Cu(NH3)4SO4·H2O
4. 常见离子晶体的结构
离子晶体
阴、阳离子
(单原子或多原子)
电中性分子
构成微粒
离子键
共价键
氢键
范德华力
作用力
问题 1
NaCl、CsCl 的熔、沸点比 HCl 的明显高很多,结合晶体类型,你能推测其原因吗?
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}
HCl
NaCl
CsCl
熔点 /℃
–114.18
801
645
沸点 /℃
–85
1413
1290
问题 2
5. 离子晶体的性质
离子键强度较大,破坏它需要较多的能量
NaCl 和 CsCl 的晶体硬度较大,难以压缩,熔点和沸点较高
5. 离子晶体的性质
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}
HCl
NaCl
CsCl
熔点 /℃
–114.18
801
645
沸点 /℃
–85
1413
1290
思考 P 88
我们知道,金属的熔点差异很大,如钨的熔点为 3410 ℃。而常温下,汞却是液体。离子晶体的熔点是不是也差异很大呢?请从理化手册或互联网查找下列离子晶体的熔点数据,得出结论。
结论:
离子晶体的熔点差距也较大
思考 P 88
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}化合物
熔点 /℃
化合物
熔点 /℃
CaO
2613
Na2SO4
884
CuCl2
1326
Ca2SiO4
2130
NH4NO3
169.6
Na3PO4
340
BaSO4
1580
CH3COOCs
194
LiPF6
200分解温度
NaNO2
270
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}
分子晶体
共价晶体
金属晶体
离子晶体
构成微粒
微粒间
作用
典型晶体类型小结
典型晶体类型小结
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}
分子晶体
共价晶体
金属晶体
离子晶体
构成微粒
分子
原子
金属阳离子
自由电子
阴阳离子
微粒间
作用
典型晶体类型小结
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}
分子晶体
共价晶体
金属晶体
离子晶体
构成微粒
分子
原子
金属阳离子
自由电子
阴阳离子
微粒间
作用
分子间
作用力
共价键
金属键
离子键
典型晶体类型小结
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}
分子晶体
共价晶体
金属晶体
离子晶体
代表物
干冰、冰
金刚石、SiO2
铜、金
氯化钠、 氯化铯
典型
物理
性质
典型晶体类型小结
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}
分子晶体
共价晶体
金属晶体
离子晶体
代表物
干冰、冰
金刚石、SiO2
铜、金
氯化钠、 氯化铯
典型
物理
性质
熔沸点低
相似相溶
硬度小
难导电
熔沸点高
硬度大
难导电
难溶
金属光泽
导电性好
导热性好
延展性好
熔点差异较大
熔融态可导电
多数易溶于水
1.下列物质中,化学键类型相同,晶体类型也相同的是( )
A. C (金刚石)和 CO2
B. NaBr 和 HBr
C. CH4 和 H2O
D. Cl2 和 KCl
C
课堂反馈
共价晶体 分子晶体
离子晶体 分子晶体
分子晶体 分子晶体
分子晶体 离子晶体
√
×
×
×
2.在单质的晶体中,一定不存在( )
A. 离子键
B. 分子间作用力
C. 共价键
D. 金属离子与自由电子间的作用
A
课堂反馈
H2 O2 I2
金属晶体
×
×
×
√
离子晶体
3. 下列叙述中,正确的是( )
A. 离子晶体都是化合物
B. 共价晶体都是单质
C. 金属在常温下都以晶体形式存在
D. 分子晶体在常温下不可能为固态
A
课堂反馈
SiO2 SiC
Hg
I2
×
×
×
√
4.按构成晶体的粒子和粒子间作用的不同,将以下晶体进行分类
氯化铯 石英
金刚砂 水
苯酚(C6H5OH) 铁
氯酸钾 高锰酸钾
离子晶体
离子晶体
离子晶体
共价晶体
共价晶体
金属晶体
分子晶体
分子晶体
课堂反馈
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}
5.铜和氧形成的一种离子化合物的晶体结构如下图,则铜离子的电荷数为 。
氧原子数:8 × + 1 = 2
铜原子数:4
化学式:Cu2O
?
+ 1
课堂反馈
本节内容结束
