3.3.2 过渡晶体与混合型晶体、晶体类型的比较 课件(共27张PPT)
文档属性
| 名称 | 3.3.2 过渡晶体与混合型晶体、晶体类型的比较 课件(共27张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-12 23:01:38 | ||
图片预览






文档简介
第2课时 过渡晶体与混合型晶体、晶体类型的比较
1.知道介于典型晶体之间的过渡晶体及混合型晶体是普遍存在的。
2.理解四种晶体类型的不同,会比较其性质。
学习目标
过渡晶体
典型晶体
分子晶体
共价晶体
金属晶体
离子晶体
纯粹的典型晶体是不多的!
大多数晶体是典型晶体之间的晶体
介于典型晶体之间的晶体
一、过渡晶体
氧化物
Na2O
MgO
Al2O3
SiO2
离子键的
百分数/%
62
50
41
33
第三周期元素的氧化物中,化学键中离子键成分的百分数
化学键既不是纯粹的离子键,也不是纯粹的共价键
P2O5
SO2
Cl2O7
既不是纯粹的离子晶体,也不是纯粹的共价晶体
当作离子晶体处理
当作共价晶体处理
离子晶体与共价晶体之间的过渡晶体
分子晶体
离子键成分的百分数更小
共价键不再贯穿整个晶体
离子键的百分数取决于电负性的差值,
电负性差值越大,离子键的百分数越大。
一、过渡晶体
钻石并不久远,至少在地表上无法达到永恒。它的同胞兄弟石墨其实更稳定,钻石最终都会变成石墨。
钻石恒久远,一颗永流传
《迷人的材料》
石墨
①所有碳原子均采取_______,形成____________结构
②碳原子与碳碳键个数比为________。
sp2杂化
平面六元并环
金刚石碳原子均采取_______,形成____________结构
sp3杂化
三维骨架
2︰3
金刚石中碳原子与碳碳键个数比为________。
1︰2
质量相同的金刚石与石墨,两者碳原子的个数比为_______。
两者碳碳键的个数比为_______。
1︰1
4︰3
石墨
石墨晶体中的二维平面结构
二、混合型晶体
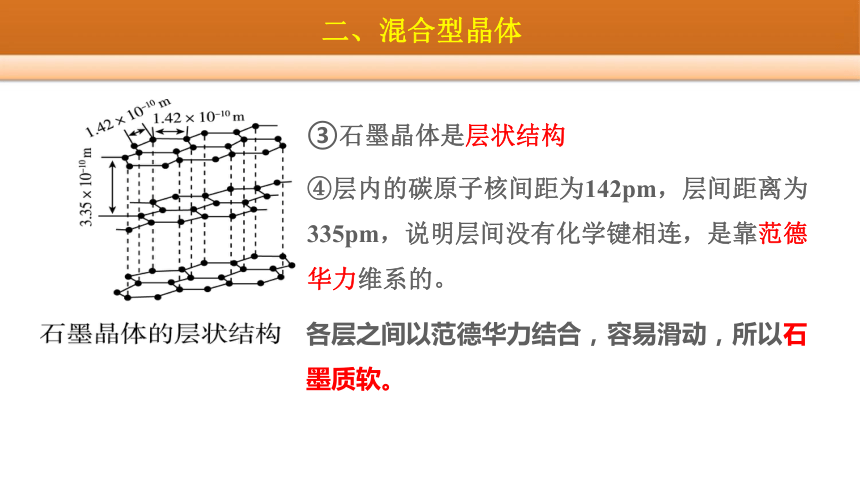
③石墨晶体是层状结构
④层内的碳原子核间距为142pm,层间距离为335pm,说明层间没有化学键相连,是靠范德华力维系的。
各层之间以范德华力结合,容易滑动,所以石墨质软。
二、混合型晶体
石墨结构中未参与杂化的p轨道
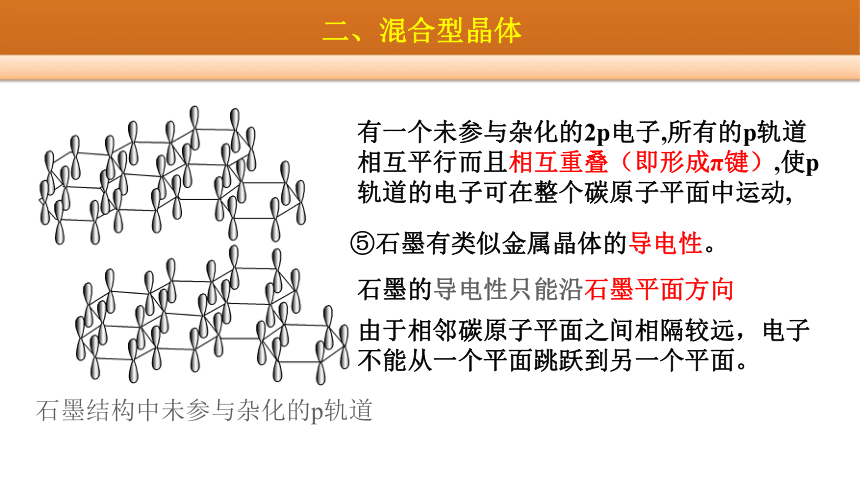
⑤石墨有类似金属晶体的导电性。
有一个未参与杂化的2p电子,所有的p轨道相互平行而且相互重叠(即形成π键),使p轨道的电子可在整个碳原子平面中运动,
由于相邻碳原子平面之间相隔较远,电子不能从一个平面跳跃到另一个平面。
石墨的导电性只能沿石墨平面方向
二、混合型晶体
混合型晶体
像石墨这样,既有共价键又有范德华力,同时还存在类似金属键的作用力,兼具共价晶体、分子晶体、金属晶体特征的晶体,称为混合型晶体。
二、混合型晶体
硅酸盐是地壳岩石的主要成分。硅酸盐的阴离子结构丰富多样,既有有限数目的硅氧四面体构建的简单阴离子,如SiO?????????、Si2O?????????、(SiO3)??????????????(六元环)等,也有以硅氧四面体为结构单元构成一维、二维、三维无限伸展的共价键骨架。金属离子则以离子键与阴离子或阴离子骨架结合。部分Si被Al取代则得到铝硅酸盐。
?
六元环
单链
双链
资料卡片
纳米晶体时晶体颗粒尺寸在纳米(10-9 m)量级的晶体。纳米晶体相对于通常的晶体,在声、光、电、磁、热等性能上常会呈现新的特性,有广阔的应用前景。仅以熔点为例,当晶体颗粒小至纳米量级,熔点会下降。
科学·技术·社会
????
金属铅的晶粒大小与熔点的关系如下表所示:
{8A107856-5554-42FB-B03E-39F5DBC370BA}r/nm
5
10
20
40
60
80
100
120
140
160
180
200
T/K
34.7
144
294
420
473
502
520
533
542
549
554
559
????
①从金属铅的晶粒大小与熔点的关系图和表中,能得出什么结论?
金属铅的晶粒大小与熔点的关系
50
100
150
200
200
400
600
0
T/K
r/nm
晶体颗粒小于200 nm时,晶粒越小,金属铅的熔点越低。因此,我们通常说纯物质有固定的熔点,但当纯物质晶体的颗粒小于200 nm(或者250 nm)时,其熔点会发生变化
主要原因是晶体的表面积增大。
②纳米晶体为什么会有不同于大块晶体的特性呢?
科学·技术·社会
1.依据构成晶体的微粒和微粒间的作用判断
(4)离子晶体的构成微粒是阴、阳离子,微粒间的作用是离子键。
(2)共价晶体的构成微粒是原子,微粒间的作用是共价键。
(1)分子晶体的构成微粒是分子,微粒间的作用为分子间作用力。
(3)金属晶体的构成微粒是金属阳离子和自由电子,微粒间的作用是金属键。
三、晶体类型的判断
2.依据物质的分类判断
(4)金属氧化物(如K2O、Na2O2等)、强碱(NaOH、KOH等)和绝大多数的盐类是离子晶体。
(2)金刚石、晶体硅、晶体硼、碳化硅、二氧化硅等是共价晶体。
(1)大多数非金属单质(除金刚石、石墨、晶体硅等)、非金属氢化物、非金属氧化物(除SiO2等外)、几乎所有的酸、绝大多数有机物(除有机盐外)是分子晶体。
(3)金属单质(除汞外)和合金是金属晶体
三、晶体类型的判断
3.依据晶体的熔点判断
(4)离子晶体的熔点较高
(2)共价晶体的熔点很高
(1)分子晶体的熔点低
(3)金属晶体的多数熔点高,但也有少数熔点相当低
合金的熔、沸点比其成分金属低
三、晶体类型的判断
4.依据导电性判断
(4)离子晶体溶于水及熔融状态时能导电
(2)共价晶体一般为非导体,但硅为半导体
(1)分子晶体为非导体,而分子晶体中的电解质(主要是酸和强极性非金属氢化物)溶于水,使分子内的化学键断裂形成自由移动的离子,也能导电
(3)金属晶体是电的良导体
三、晶体类型的判断
5.依据硬度和机械性能判断
(4)离子晶体硬度较大、硬而脆
(2)共价晶体硬度大
(1)分子晶体硬度小且较脆
(3)金属晶体多数硬度大,但也有较低的,且具有延展性
合金的硬度比其成分金属大
三、晶体类型的判断
分析下列物质的物理性质,判断其晶体类型。
(1)碳化铝,黄色晶体,熔点2 200 ℃,熔融态不导电:__________。
(2)溴化铝,无色晶体,熔点98 ℃,熔融态不导电:__________。
(3)五氟化矾,无色晶体,熔点19.5 ℃,易溶于乙醇、氯仿、丙酮等:____________。
(4)溴化钾,无色晶体,熔融时或溶于水中都能导电:__________。
共价晶体
分子晶体
分子晶体
离子晶体
跟踪训练
(5)SiI4:熔点120.5 ℃,沸点287.4 ℃,易水解:________。
(6)硼:熔点2 300 ℃,沸点2 550 ℃,硬度大:________。
(7)硒:熔点217 ℃,沸点685 ℃,溶于氯仿:________。
(8)锑:熔点630.74 ℃,沸点1 750 ℃,导电:________。
分子晶体
共价晶体
分子晶体
金属晶体
跟踪训练
1.首先看物质状态
一般情况下,固体>液体>气体
2.其次看物质所属晶体类型
一般情况下,共价晶体>离子晶体>分子晶体。
金属晶体的熔、沸点差别很大,如钨、铂等金属的熔、沸点很高,汞、铯等金属的熔、沸点很低。
四、物质熔沸点高低的比较
3.同种类型晶体的熔、沸点的比较
(1)分子晶体:
①看是否含有氢键
有分子间氢键的熔沸点高
有相同的分子间氢键,看氢键的个数,
个数越多,熔沸点越高
②比较范德华力
组成和结构相似,相对分子质量越大,熔沸点越高
③比较分子极性
相对分子质量相近,分子极性越大,熔沸点越高。
④同分异构体的支链越多,熔、沸点越低。
四、物质熔沸点高低的比较
(2)共价晶体:
①晶体的熔、沸点高低取决于共价键的键长和键能。
键长越短,键能越大,共价键越稳定,物质的熔、沸点越高。
②若没有告知键长或键能数据时,可比较原子半径的大小。
一般原子半径越小,键长越短,键能越大,晶体的熔点就越高。
四、物质熔沸点高低的比较
(3)金属晶体:
①金属离子半径越小,离子所带电荷数越多,其金属键越强,金属的熔、沸点越高
②合金的熔点比组成合金的纯金属低
四、物质熔沸点高低的比较
(4)离子晶体:
①一般地,离子所带的电荷数越多,离子半径越小,则离子间的作用力就越强,其离子晶体的熔、沸点就越高
②离子所带的电荷数的影响大于离子半径的影响
四、物质熔沸点高低的比较
1.下列物质的熔沸点高低顺序正确的是( )
A.金刚石>晶体硅>二氧化硅>碳化硅
B.CI4>CBr4>CCl4>CH4
C.MgO>H2O>N2>O2
D.金刚石>生铁>纯铁>钠
B
跟踪训练
2.下列晶体熔、沸点由高到低的顺序正确的是( )
①SiC ②Si ③HCl ④HBr ⑤HI ⑥CO ⑦N2 ⑧H2
A.①②③④⑤⑥⑦⑧ B.①②⑤④③⑥⑦⑧
C.①②⑤④③⑦⑥⑧ D.⑥⑤④③②①⑦⑧
B
跟踪训练
本节内容结束
1.知道介于典型晶体之间的过渡晶体及混合型晶体是普遍存在的。
2.理解四种晶体类型的不同,会比较其性质。
学习目标
过渡晶体
典型晶体
分子晶体
共价晶体
金属晶体
离子晶体
纯粹的典型晶体是不多的!
大多数晶体是典型晶体之间的晶体
介于典型晶体之间的晶体
一、过渡晶体
氧化物
Na2O
MgO
Al2O3
SiO2
离子键的
百分数/%
62
50
41
33
第三周期元素的氧化物中,化学键中离子键成分的百分数
化学键既不是纯粹的离子键,也不是纯粹的共价键
P2O5
SO2
Cl2O7
既不是纯粹的离子晶体,也不是纯粹的共价晶体
当作离子晶体处理
当作共价晶体处理
离子晶体与共价晶体之间的过渡晶体
分子晶体
离子键成分的百分数更小
共价键不再贯穿整个晶体
离子键的百分数取决于电负性的差值,
电负性差值越大,离子键的百分数越大。
一、过渡晶体
钻石并不久远,至少在地表上无法达到永恒。它的同胞兄弟石墨其实更稳定,钻石最终都会变成石墨。
钻石恒久远,一颗永流传
《迷人的材料》
石墨
①所有碳原子均采取_______,形成____________结构
②碳原子与碳碳键个数比为________。
sp2杂化
平面六元并环
金刚石碳原子均采取_______,形成____________结构
sp3杂化
三维骨架
2︰3
金刚石中碳原子与碳碳键个数比为________。
1︰2
质量相同的金刚石与石墨,两者碳原子的个数比为_______。
两者碳碳键的个数比为_______。
1︰1
4︰3
石墨
石墨晶体中的二维平面结构
二、混合型晶体
③石墨晶体是层状结构
④层内的碳原子核间距为142pm,层间距离为335pm,说明层间没有化学键相连,是靠范德华力维系的。
各层之间以范德华力结合,容易滑动,所以石墨质软。
二、混合型晶体
石墨结构中未参与杂化的p轨道
⑤石墨有类似金属晶体的导电性。
有一个未参与杂化的2p电子,所有的p轨道相互平行而且相互重叠(即形成π键),使p轨道的电子可在整个碳原子平面中运动,
由于相邻碳原子平面之间相隔较远,电子不能从一个平面跳跃到另一个平面。
石墨的导电性只能沿石墨平面方向
二、混合型晶体
混合型晶体
像石墨这样,既有共价键又有范德华力,同时还存在类似金属键的作用力,兼具共价晶体、分子晶体、金属晶体特征的晶体,称为混合型晶体。
二、混合型晶体
硅酸盐是地壳岩石的主要成分。硅酸盐的阴离子结构丰富多样,既有有限数目的硅氧四面体构建的简单阴离子,如SiO?????????、Si2O?????????、(SiO3)??????????????(六元环)等,也有以硅氧四面体为结构单元构成一维、二维、三维无限伸展的共价键骨架。金属离子则以离子键与阴离子或阴离子骨架结合。部分Si被Al取代则得到铝硅酸盐。
?
六元环
单链
双链
资料卡片
纳米晶体时晶体颗粒尺寸在纳米(10-9 m)量级的晶体。纳米晶体相对于通常的晶体,在声、光、电、磁、热等性能上常会呈现新的特性,有广阔的应用前景。仅以熔点为例,当晶体颗粒小至纳米量级,熔点会下降。
科学·技术·社会
????
金属铅的晶粒大小与熔点的关系如下表所示:
{8A107856-5554-42FB-B03E-39F5DBC370BA}r/nm
5
10
20
40
60
80
100
120
140
160
180
200
T/K
34.7
144
294
420
473
502
520
533
542
549
554
559
????
①从金属铅的晶粒大小与熔点的关系图和表中,能得出什么结论?
金属铅的晶粒大小与熔点的关系
50
100
150
200
200
400
600
0
T/K
r/nm
晶体颗粒小于200 nm时,晶粒越小,金属铅的熔点越低。因此,我们通常说纯物质有固定的熔点,但当纯物质晶体的颗粒小于200 nm(或者250 nm)时,其熔点会发生变化
主要原因是晶体的表面积增大。
②纳米晶体为什么会有不同于大块晶体的特性呢?
科学·技术·社会
1.依据构成晶体的微粒和微粒间的作用判断
(4)离子晶体的构成微粒是阴、阳离子,微粒间的作用是离子键。
(2)共价晶体的构成微粒是原子,微粒间的作用是共价键。
(1)分子晶体的构成微粒是分子,微粒间的作用为分子间作用力。
(3)金属晶体的构成微粒是金属阳离子和自由电子,微粒间的作用是金属键。
三、晶体类型的判断
2.依据物质的分类判断
(4)金属氧化物(如K2O、Na2O2等)、强碱(NaOH、KOH等)和绝大多数的盐类是离子晶体。
(2)金刚石、晶体硅、晶体硼、碳化硅、二氧化硅等是共价晶体。
(1)大多数非金属单质(除金刚石、石墨、晶体硅等)、非金属氢化物、非金属氧化物(除SiO2等外)、几乎所有的酸、绝大多数有机物(除有机盐外)是分子晶体。
(3)金属单质(除汞外)和合金是金属晶体
三、晶体类型的判断
3.依据晶体的熔点判断
(4)离子晶体的熔点较高
(2)共价晶体的熔点很高
(1)分子晶体的熔点低
(3)金属晶体的多数熔点高,但也有少数熔点相当低
合金的熔、沸点比其成分金属低
三、晶体类型的判断
4.依据导电性判断
(4)离子晶体溶于水及熔融状态时能导电
(2)共价晶体一般为非导体,但硅为半导体
(1)分子晶体为非导体,而分子晶体中的电解质(主要是酸和强极性非金属氢化物)溶于水,使分子内的化学键断裂形成自由移动的离子,也能导电
(3)金属晶体是电的良导体
三、晶体类型的判断
5.依据硬度和机械性能判断
(4)离子晶体硬度较大、硬而脆
(2)共价晶体硬度大
(1)分子晶体硬度小且较脆
(3)金属晶体多数硬度大,但也有较低的,且具有延展性
合金的硬度比其成分金属大
三、晶体类型的判断
分析下列物质的物理性质,判断其晶体类型。
(1)碳化铝,黄色晶体,熔点2 200 ℃,熔融态不导电:__________。
(2)溴化铝,无色晶体,熔点98 ℃,熔融态不导电:__________。
(3)五氟化矾,无色晶体,熔点19.5 ℃,易溶于乙醇、氯仿、丙酮等:____________。
(4)溴化钾,无色晶体,熔融时或溶于水中都能导电:__________。
共价晶体
分子晶体
分子晶体
离子晶体
跟踪训练
(5)SiI4:熔点120.5 ℃,沸点287.4 ℃,易水解:________。
(6)硼:熔点2 300 ℃,沸点2 550 ℃,硬度大:________。
(7)硒:熔点217 ℃,沸点685 ℃,溶于氯仿:________。
(8)锑:熔点630.74 ℃,沸点1 750 ℃,导电:________。
分子晶体
共价晶体
分子晶体
金属晶体
跟踪训练
1.首先看物质状态
一般情况下,固体>液体>气体
2.其次看物质所属晶体类型
一般情况下,共价晶体>离子晶体>分子晶体。
金属晶体的熔、沸点差别很大,如钨、铂等金属的熔、沸点很高,汞、铯等金属的熔、沸点很低。
四、物质熔沸点高低的比较
3.同种类型晶体的熔、沸点的比较
(1)分子晶体:
①看是否含有氢键
有分子间氢键的熔沸点高
有相同的分子间氢键,看氢键的个数,
个数越多,熔沸点越高
②比较范德华力
组成和结构相似,相对分子质量越大,熔沸点越高
③比较分子极性
相对分子质量相近,分子极性越大,熔沸点越高。
④同分异构体的支链越多,熔、沸点越低。
四、物质熔沸点高低的比较
(2)共价晶体:
①晶体的熔、沸点高低取决于共价键的键长和键能。
键长越短,键能越大,共价键越稳定,物质的熔、沸点越高。
②若没有告知键长或键能数据时,可比较原子半径的大小。
一般原子半径越小,键长越短,键能越大,晶体的熔点就越高。
四、物质熔沸点高低的比较
(3)金属晶体:
①金属离子半径越小,离子所带电荷数越多,其金属键越强,金属的熔、沸点越高
②合金的熔点比组成合金的纯金属低
四、物质熔沸点高低的比较
(4)离子晶体:
①一般地,离子所带的电荷数越多,离子半径越小,则离子间的作用力就越强,其离子晶体的熔、沸点就越高
②离子所带的电荷数的影响大于离子半径的影响
四、物质熔沸点高低的比较
1.下列物质的熔沸点高低顺序正确的是( )
A.金刚石>晶体硅>二氧化硅>碳化硅
B.CI4>CBr4>CCl4>CH4
C.MgO>H2O>N2>O2
D.金刚石>生铁>纯铁>钠
B
跟踪训练
2.下列晶体熔、沸点由高到低的顺序正确的是( )
①SiC ②Si ③HCl ④HBr ⑤HI ⑥CO ⑦N2 ⑧H2
A.①②③④⑤⑥⑦⑧ B.①②⑤④③⑥⑦⑧
C.①②⑤④③⑦⑥⑧ D.⑥⑤④③②①⑦⑧
B
跟踪训练
本节内容结束
