化学人教版(2019)选择性必修1 3.2.1水的电离(共36张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 3.2.1水的电离(共36张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-13 08:42:44 | ||
图片预览










文档简介
(共36张PPT)
第2节 水的电离和溶液的pH
第1课时:水的电离和溶液酸碱性
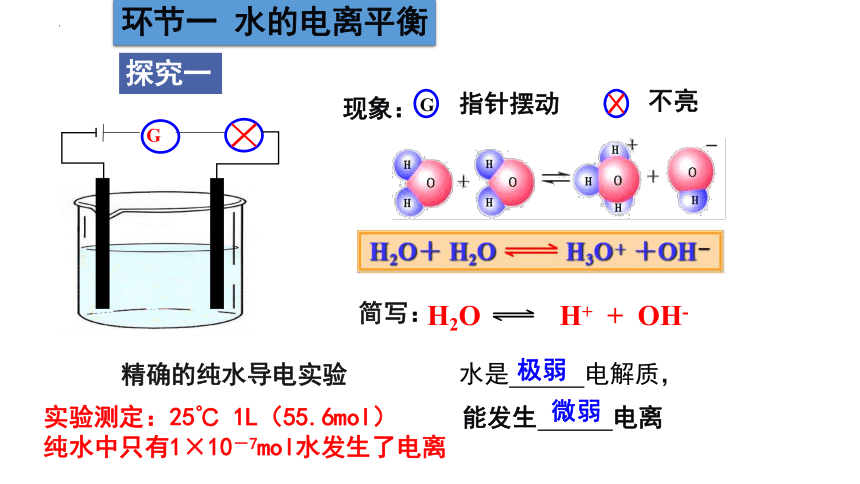
精确的纯水导电实验
G
现象:
指针摆动
不亮
水是 电解质,
能发生 电离
极弱
微弱
G
环节一 水的电离平衡
简写:
探究一
H2O H+ + OH-
实验测定:25℃ 1L(55.6mol)
纯水中只有1×10-7mol水发生了电离
水的导电性实验
新课导入
水的离子积常数
H2O H+ + OH-
K电离 =
c(H+) · c(OH-)
c(H2O)
c(H+) · c(OH-)
K电离 ·c(H2O) =
KW
水的离子积常数,简称水的离子积
整理得
常数
常数
新的常数
=c(H+) · c(OH-)
(1)推导过程
H2O + H2O H3O+ + OH-
T/℃ 0 10 20 25 40 50 100
Kw/10-14 0.115 0.296 0.687 1.01 2.87 5.31 54.5
100℃: Kw = 54.5×10-14 ≈ 1.0×10-12
KW 只受温度影响
H2O H+ + OH-
1.表达式:
2.数值:
3.室温时,纯水中:c(H+)=c(OH-)=10-7
Kw=c(H+)·c(OH-)
25℃,Kw=10-14
2.水的离子积常数
1)25℃时,某溶液中,c(H+)=1x10-6mol/L,问c(OH-)是多少?
2)25℃时,某溶液中,c(OH-)=1x10-1mol/L,问c(H+)是多少?
4.Kw的定量计算
1x10-8mol/L
1x10-13mol/L
例1.常温下,0.1mol/L的HCl溶液中,水电离出的
c(H+)和c(OH-)各是多少
变式训练:常温下,0.1mol/L的NaOH溶液中,水电离出的c(H+)和c(OH-)各是多少
1x10-13mol/L,1x10-13mol/L
1x10-13mol/L,1x10-13mol/L
4.Kw的定量计算
课堂练习2:某温度下,纯水中的c(H+)=2.0×10-7mol/L, 则此时溶液的c(OH-)为__________mol/L;若温度不变, 滴入稀盐酸使c(H+)=5.0×10-6mol/L,则c(OH-)= __________mol/L。
2.0×10-7
8.0×10-9
Kw 不仅适用于纯水,也适用于稀的电解质水溶液。
Kw=c(H+)·c(OH-)
①Kw 只受温度的影响,与溶液的酸碱性无关;
②Kw 不仅适用于纯水,也适用于稀的电解质水溶液。
③注意区分溶液中的c(H+)、由水电离产生的c(H+)。(前者指溶液中总的氢离子浓度,后者特指由水电离出来的氢离子浓度)
④任何溶液中,由水电离产生的c(H+)=由水电离产生的c(OH-)。
如:KW25℃=1×10-14 KW100℃=0.55×10-12
KW =c(H+)· c (OH-)
小结:水的电离和Kw注意事项
作业:大本61-62页
觉得作业量不够的有能力的同学可以再做小本182-183页(其中很多老师已经挑出来在课堂上讲解了)
外界条件对水的电离平衡的影响
(4)数值:
25℃时,Kw=c(H+)·c(OH-) =1×10-14
(3)表达式: Kw=c(H+)·c(OH-);
上节课总结:
(1)定义:在一定温度下,水中c(H+)和c(OH-)的乘积是一个常数,这个常数叫做水的离子积常数。
(2)符号: Kw
Kw既适用于纯水,也适应于稀的电解质水溶液
纯水中: c(H+)= c(OH-)
注意:
Kw既适用于纯水,也适应于稀的电解质水溶液
纯水中: c(H+)= c(OH-)
Kw只受温度影响, T不变, Kw不变。
水的电离过程是吸热,T↑, Kw↑
改变条件 溶液酸碱性 平衡移动方向 C(H+) C(OH-) C(H+)C(OH-)浓度大小关系 Kw
升温
加入盐酸
加入NaOH
H2O H+ +OH- H>0
中性
碱性
酸性
向左移动
向右移动
向左移动
增大
减小
增大
增大
增大
减小
C(H+)C(H+)=C(OH-)
C(H+)>C(OH-)
增大
不变
不变
加活泼金属
碱性
向右移动
减小
增大
C(H+)不变
4、影响水的电离平衡的因素
通CO2
酸性
向左移动
增大
减小
C(H+)>C(OH-)
不变
(1)升高温度,若Kw增大到1×10-12,则纯水电离出的c(H+)=1×10-6 mol·L-1( )
(2)在纯水中加入少量酸,水的电离平衡逆向移动,Kw减小( )
(3)25 ℃时,若溶液中c(H+)=1×10-6 mol·L-1,则溶液中c(OH-)=1×10-8 mol·L-1( )
(4)常温下,加水稀释稀醋酸溶液,溶液中所有的离子浓度都减小( )
(5)不同溶液中,c(H+)、c(OH-)可能不同,但任何溶液中由水电离出的c(H+)与c(OH-)总是相等的( )
×
√
正误判断
√
×
√
2.25 ℃时,水的电离达到平衡H2O H++OH- ΔH>0,下列叙述正确的是
A.将纯水加热到95 ℃时,Kw变大,pH不变,水仍呈中性
B.向纯水中加入稀氨水,平衡逆向移动,c(OH-)增大,Kw变小
C.向纯水中加入少量碳酸钠固体,影响水的电离平衡,c(H+)减小,Kw
不变
D.向纯水中加入氯化钠固体或盐酸,均可抑制水的电离,Kw不变
√
大本P62
题组三 水的电离平衡的应用
8.常温下,在0.01 mol·L-1 H2SO4溶液中,由水电离出的氢离子浓度是
A.5×10-13 mol·L-1 B.0.02 mol·L-1
C.1×10-7 mol·L-1 D.1×10-12 mol·L-1
√
6.25 ℃时,相同物质的量浓度的下列溶液:①NaCl、②NaOH、③H2SO4,其中水的电离程度按由大到小顺序排列的一组是
A.③>②>① B.②>③>①
C.①>②>③ D.③>①>②
√
小本P184
酸、碱抑制水的电离,Kw不变
2.常温下,某溶液中由水电离出来的c(H+)=1.0×10-11 mol·L-1,该溶液可能是( )。
A.二氧化硫的水溶液
B.氯化钠水溶液
C.硝酸钠水溶液
D.氢氧化钠水溶液
AD
酸、碱抑制水的电离,Kw不变
2.(双选)常温下,某溶液中由水电离出来的c(H+)=1.0×10-11 mol·L-1,该溶液可能是( )。
A.二氧化硫的水溶液
B.氯化钠水溶液
C.硝酸钠水溶液
D.氢氧化钠水溶液
AD
酸、碱抑制水的电离,Kw不变
1. 温度升高,促进水的电离,Kw增大;
2. 酸、碱抑制水的电离,Kw不变;
3. 外加能与H+、OH- 反应的物质,会促进水的电离,能和水反应且产物为酸或者碱,会抑制水的电离,Kw不变。
小结:水的电离的影响因素
课堂练习3:25 ℃时,水的电离达到平衡: H2O H+ + OH- ΔH>0。下列叙述正确的是( )
A.向水中通氨气,平衡逆向移动,c(OH-)减小
B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
C.向水中加入少量固体钠,平衡逆向移动,c(H+)减小
D.将水加热,KW增大,c(H+)不变
B
1、下列说法正确的是( )
A.升高温度,水的电离平衡右移,溶液中的c(H+)和c(OH-)均增大,但Kw不变。
B.25 ℃时,水的离子积Kw=1.0×10-14,35 ℃时水的离子积Kw=2.1×10-14,则35 ℃时纯水中的c(H+)>c(OH-)。
C.任何水溶液中均存在H+和OH-,且水电离出的c(H+)和c(OH-)相等。
D.向水中加入酸抑制水的电离,向水中加入碱促进水的电离。
C
3、室温下,由水电离产生的c(OH-)=10-11mol/L的溶液中,一定大量共存的离子组( )
A.Na+ 、 NH4+ 、Cl- 、SO42-
B.S2- 、CH3COO- 、Na+ 、Cs+
C.K+ 、 Na+ 、 I- 、NO3-
D.K+ 、 Na+ 、NO3- 、 SO42-
B
酸、碱抑制水的电离,Kw不变
4、下表是不同温度下水的离子积数据:试回答下列问题:
(1)若25”“<”或“=”)1×10-14,做出此判断的理由是
_____________________________________________________________。
(2)在t1℃时,测得纯水中的c(H+)=2.4×10-7mol·L-1,则c(OH-)为
_________________。该温度下,测得某H2SO4溶液中c( )=5×10-6mol·L-1,该溶液中c(OH-)=_______________mol·L-1。
温度/℃ 25 t1 t2
水的离子积常数 1×10-14 Kw 1×10-12
水的电离是吸热过程,升高温度,平衡向电离方向移动,c(H+)增大,c(OH-)增大,Kw=c(H+)·c(OH-),Kw增大
>
5.76×10-9
2.4×10-7mol·L-1
Kw的应用
课堂练习5:室温下,0.1 mol/L的稀盐酸中, c(H+)与c(OH-)各多少?由水电离出的c(H+)水与c(OH-)水各多少
Kw应用1:溶液中水电离出的c(H+)或c(OH-)的计算方法
H2O H+ + OH-
HCl = H+ + Cl-
c(H+) = c(H+) 酸+ c(H+) 水≈ c(H+) 酸= 0.1 mol/L
c(OH-) = Kw /c(H+)= 1.0×10-13mol/L
室温下, Kw = c(H+) c(OH-) = 1.0×10-14
由水电离出的c(H+)水=c(OH-)水= 1.0×10-13 mol/L
c(H+) 酸》 c(H+) 水
酸溶液中的全部c(OH-)是水电离产生的
【解析】
课堂练习6:常温下,浓度为0.1 mol·L-1的NaOH溶液中, c(H+)与c(OH-)各多少?由水电离出的c(H+)水与c(OH-)水各多少
由水电离出的c(H+)水=c(OH-)水= 1.0×10-13 mol/L
碱溶液中的全部c(H+)是水电离产生的
课堂练习2:某温度下,纯水中的c(H+)=2.0×10-7mol/L, 则此时溶液的c(OH-)为__________mol/L;若温度不变, 滴入稀盐酸使c(H+)=5.0×10-6mol/L,则c(OH-)= __________mol/L。
2.0×10-7
8.0×10-9
Kw 不仅适用于纯水,也适用于稀的电解质水溶液。
Kw=c(H+)·c(OH-)
(1)曲线上的任意点(如a,b,c)的Kw都 ,即c(H+)·c(OH-) ,温度 。
(2)曲线外的任意点(如d)与曲线上任意点的Kw ,温度 。
(3)实现曲线上点之间的转化需保持温度不变,改变 ;实现曲线上点与曲线外点之间的转化一定改变 。
相同
相同
相同
不同
不同
酸碱性
温度
Kw应用2:水的电离平衡曲线的理解与识别
1.一定温度下,水溶液中H+和OH-的浓度变化曲线如图,下列说法正确的是
A.该温度下,a点溶液呈碱性
B.该温度下,0.01 mol·L-1NaOH溶液中c(H+)
=1.0×10-12 mol·L-1
C.该温度下,加入NaOH可能引起由d向b的变化
D.b点时,升高温度,可能引起由b向c的变化
√
大本P63
该温度下, Kw = c(H+) c(OH-) = 1.0×10-12
Kw应用2:水的电离平衡曲线的理解与识别
2.如图表示水中c(H+)和c(OH-)的关系,下列判断错误的是
A.两条曲线间任意点均有c(H+)·c(OH-)=Kw
B.M区域内(不包括边界)任意点均有c(H+)<
c(OH-)
C.图中T1D.XZ线上任意点的c(H+)都相等
√
大本P63
12.水的电离常数如图所示,曲线上的点都符合c(H+)·c(OH-)=常数,下列说法错误的是
A.图中温度:T1>T2
B.图中五点Kw间的关系:B>C>A=D=E
C.曲线a、b均代表纯水的电离情况
D.若处在B点时,将0.005 mol·L-1的硫酸溶
液与由水电离的c(H+)=1.0×10-12 mol·L-1的KOH溶液等体积混合后,
溶液显碱性
√
小本P184
Kw应用2:水的电离平衡曲线的理解与识别
10.25 ℃时,在等体积的①0.5 mol·L-1的H2SO4溶液;②0.05 mol·L-1的Ba(OH)2溶液;③1 mol·L-1的NaCl溶液;④纯水中由水电离出的H+的物质的量之比是
A.1∶10∶107∶107 B.107∶107∶1∶1
C.107∶106∶2∶2 D.107∶106∶(2×107)∶2
√
小本P184
14.某学生为探究Kw的影响因素,做了以下实验。
(1)查阅资料,不同温度下水的离子积常数如表所示。
t/ ℃ 0 10 20 25 40 50 90 100
Kw/10-14 0.115 0.296 0.687 1.01 2.87 5.31 37.1 54.5
由此推出:随着温度的升高,Kw (填“增大”或“减小”,下同),水的电离程度 ;水的电离平衡向 (填“左”或“右”)移动,水的电离过程是 (填“吸热”或“放热”)过程。
增大
增大
右
吸热
(2)取三只烧杯A、B、C,分别加入适量水,再向B、C烧杯中分别加入少量盐酸和NaOH溶液,分析并填写下表。
A(纯水) B(加少量盐酸) C(加少量NaOH溶液)
c(H+) 1.0×10-7 mol·L-1 增大
c(OH-) 1.0×10-7 mol·L-1 增大
c(H+)和c(OH-)大小比较 c(H+)=c(OH-) c(H+) c(OH-) c(H+) c(OH-)
水的电离平衡移动方向
Kw 1.0×10-14
减小
减小
>
<
向左
向左
1.0×10-14
1.0×10-14
①温度、 、 均能影响水的电离平衡。②Kw只受 的影响,而与其他因素无关。
酸
碱
温度
作业:大本62-63页
觉得作业量不够的有能力的同学可以再做小本184-185页(其中很多老师已经挑出来在课堂上讲解了)
第2节 水的电离和溶液的pH
第1课时:水的电离和溶液酸碱性
精确的纯水导电实验
G
现象:
指针摆动
不亮
水是 电解质,
能发生 电离
极弱
微弱
G
环节一 水的电离平衡
简写:
探究一
H2O H+ + OH-
实验测定:25℃ 1L(55.6mol)
纯水中只有1×10-7mol水发生了电离
水的导电性实验
新课导入
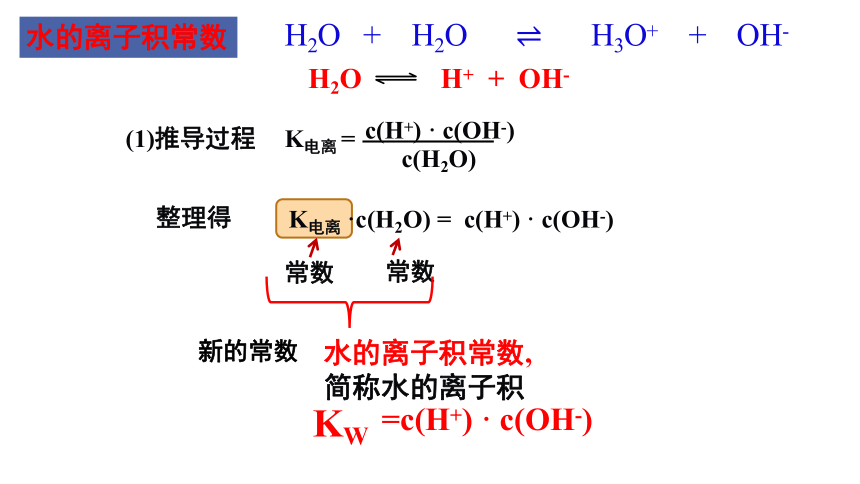
水的离子积常数
H2O H+ + OH-
K电离 =
c(H+) · c(OH-)
c(H2O)
c(H+) · c(OH-)
K电离 ·c(H2O) =
KW
水的离子积常数,简称水的离子积
整理得
常数
常数
新的常数
=c(H+) · c(OH-)
(1)推导过程
H2O + H2O H3O+ + OH-
T/℃ 0 10 20 25 40 50 100
Kw/10-14 0.115 0.296 0.687 1.01 2.87 5.31 54.5
100℃: Kw = 54.5×10-14 ≈ 1.0×10-12
KW 只受温度影响
H2O H+ + OH-
1.表达式:
2.数值:
3.室温时,纯水中:c(H+)=c(OH-)=10-7
Kw=c(H+)·c(OH-)
25℃,Kw=10-14
2.水的离子积常数
1)25℃时,某溶液中,c(H+)=1x10-6mol/L,问c(OH-)是多少?
2)25℃时,某溶液中,c(OH-)=1x10-1mol/L,问c(H+)是多少?
4.Kw的定量计算
1x10-8mol/L
1x10-13mol/L
例1.常温下,0.1mol/L的HCl溶液中,水电离出的
c(H+)和c(OH-)各是多少
变式训练:常温下,0.1mol/L的NaOH溶液中,水电离出的c(H+)和c(OH-)各是多少
1x10-13mol/L,1x10-13mol/L
1x10-13mol/L,1x10-13mol/L
4.Kw的定量计算
课堂练习2:某温度下,纯水中的c(H+)=2.0×10-7mol/L, 则此时溶液的c(OH-)为__________mol/L;若温度不变, 滴入稀盐酸使c(H+)=5.0×10-6mol/L,则c(OH-)= __________mol/L。
2.0×10-7
8.0×10-9
Kw 不仅适用于纯水,也适用于稀的电解质水溶液。
Kw=c(H+)·c(OH-)
①Kw 只受温度的影响,与溶液的酸碱性无关;
②Kw 不仅适用于纯水,也适用于稀的电解质水溶液。
③注意区分溶液中的c(H+)、由水电离产生的c(H+)。(前者指溶液中总的氢离子浓度,后者特指由水电离出来的氢离子浓度)
④任何溶液中,由水电离产生的c(H+)=由水电离产生的c(OH-)。
如:KW25℃=1×10-14 KW100℃=0.55×10-12
KW =c(H+)· c (OH-)
小结:水的电离和Kw注意事项
作业:大本61-62页
觉得作业量不够的有能力的同学可以再做小本182-183页(其中很多老师已经挑出来在课堂上讲解了)
外界条件对水的电离平衡的影响
(4)数值:
25℃时,Kw=c(H+)·c(OH-) =1×10-14
(3)表达式: Kw=c(H+)·c(OH-);
上节课总结:
(1)定义:在一定温度下,水中c(H+)和c(OH-)的乘积是一个常数,这个常数叫做水的离子积常数。
(2)符号: Kw
Kw既适用于纯水,也适应于稀的电解质水溶液
纯水中: c(H+)= c(OH-)
注意:
Kw既适用于纯水,也适应于稀的电解质水溶液
纯水中: c(H+)= c(OH-)
Kw只受温度影响, T不变, Kw不变。
水的电离过程是吸热,T↑, Kw↑
改变条件 溶液酸碱性 平衡移动方向 C(H+) C(OH-) C(H+)C(OH-)浓度大小关系 Kw
升温
加入盐酸
加入NaOH
H2O H+ +OH- H>0
中性
碱性
酸性
向左移动
向右移动
向左移动
增大
减小
增大
增大
增大
减小
C(H+)
C(H+)>C(OH-)
增大
不变
不变
加活泼金属
碱性
向右移动
减小
增大
C(H+)
4、影响水的电离平衡的因素
通CO2
酸性
向左移动
增大
减小
C(H+)>C(OH-)
不变
(1)升高温度,若Kw增大到1×10-12,则纯水电离出的c(H+)=1×10-6 mol·L-1( )
(2)在纯水中加入少量酸,水的电离平衡逆向移动,Kw减小( )
(3)25 ℃时,若溶液中c(H+)=1×10-6 mol·L-1,则溶液中c(OH-)=1×10-8 mol·L-1( )
(4)常温下,加水稀释稀醋酸溶液,溶液中所有的离子浓度都减小( )
(5)不同溶液中,c(H+)、c(OH-)可能不同,但任何溶液中由水电离出的c(H+)与c(OH-)总是相等的( )
×
√
正误判断
√
×
√
2.25 ℃时,水的电离达到平衡H2O H++OH- ΔH>0,下列叙述正确的是
A.将纯水加热到95 ℃时,Kw变大,pH不变,水仍呈中性
B.向纯水中加入稀氨水,平衡逆向移动,c(OH-)增大,Kw变小
C.向纯水中加入少量碳酸钠固体,影响水的电离平衡,c(H+)减小,Kw
不变
D.向纯水中加入氯化钠固体或盐酸,均可抑制水的电离,Kw不变
√
大本P62
题组三 水的电离平衡的应用
8.常温下,在0.01 mol·L-1 H2SO4溶液中,由水电离出的氢离子浓度是
A.5×10-13 mol·L-1 B.0.02 mol·L-1
C.1×10-7 mol·L-1 D.1×10-12 mol·L-1
√
6.25 ℃时,相同物质的量浓度的下列溶液:①NaCl、②NaOH、③H2SO4,其中水的电离程度按由大到小顺序排列的一组是
A.③>②>① B.②>③>①
C.①>②>③ D.③>①>②
√
小本P184
酸、碱抑制水的电离,Kw不变
2.常温下,某溶液中由水电离出来的c(H+)=1.0×10-11 mol·L-1,该溶液可能是( )。
A.二氧化硫的水溶液
B.氯化钠水溶液
C.硝酸钠水溶液
D.氢氧化钠水溶液
AD
酸、碱抑制水的电离,Kw不变
2.(双选)常温下,某溶液中由水电离出来的c(H+)=1.0×10-11 mol·L-1,该溶液可能是( )。
A.二氧化硫的水溶液
B.氯化钠水溶液
C.硝酸钠水溶液
D.氢氧化钠水溶液
AD
酸、碱抑制水的电离,Kw不变
1. 温度升高,促进水的电离,Kw增大;
2. 酸、碱抑制水的电离,Kw不变;
3. 外加能与H+、OH- 反应的物质,会促进水的电离,能和水反应且产物为酸或者碱,会抑制水的电离,Kw不变。
小结:水的电离的影响因素
课堂练习3:25 ℃时,水的电离达到平衡: H2O H+ + OH- ΔH>0。下列叙述正确的是( )
A.向水中通氨气,平衡逆向移动,c(OH-)减小
B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
C.向水中加入少量固体钠,平衡逆向移动,c(H+)减小
D.将水加热,KW增大,c(H+)不变
B
1、下列说法正确的是( )
A.升高温度,水的电离平衡右移,溶液中的c(H+)和c(OH-)均增大,但Kw不变。
B.25 ℃时,水的离子积Kw=1.0×10-14,35 ℃时水的离子积Kw=2.1×10-14,则35 ℃时纯水中的c(H+)>c(OH-)。
C.任何水溶液中均存在H+和OH-,且水电离出的c(H+)和c(OH-)相等。
D.向水中加入酸抑制水的电离,向水中加入碱促进水的电离。
C
3、室温下,由水电离产生的c(OH-)=10-11mol/L的溶液中,一定大量共存的离子组( )
A.Na+ 、 NH4+ 、Cl- 、SO42-
B.S2- 、CH3COO- 、Na+ 、Cs+
C.K+ 、 Na+ 、 I- 、NO3-
D.K+ 、 Na+ 、NO3- 、 SO42-
B
酸、碱抑制水的电离,Kw不变
4、下表是不同温度下水的离子积数据:试回答下列问题:
(1)若25
_____________________________________________________________。
(2)在t1℃时,测得纯水中的c(H+)=2.4×10-7mol·L-1,则c(OH-)为
_________________。该温度下,测得某H2SO4溶液中c( )=5×10-6mol·L-1,该溶液中c(OH-)=_______________mol·L-1。
温度/℃ 25 t1 t2
水的离子积常数 1×10-14 Kw 1×10-12
水的电离是吸热过程,升高温度,平衡向电离方向移动,c(H+)增大,c(OH-)增大,Kw=c(H+)·c(OH-),Kw增大
>
5.76×10-9
2.4×10-7mol·L-1
Kw的应用
课堂练习5:室温下,0.1 mol/L的稀盐酸中, c(H+)与c(OH-)各多少?由水电离出的c(H+)水与c(OH-)水各多少
Kw应用1:溶液中水电离出的c(H+)或c(OH-)的计算方法
H2O H+ + OH-
HCl = H+ + Cl-
c(H+) = c(H+) 酸+ c(H+) 水≈ c(H+) 酸= 0.1 mol/L
c(OH-) = Kw /c(H+)= 1.0×10-13mol/L
室温下, Kw = c(H+) c(OH-) = 1.0×10-14
由水电离出的c(H+)水=c(OH-)水= 1.0×10-13 mol/L
c(H+) 酸》 c(H+) 水
酸溶液中的全部c(OH-)是水电离产生的
【解析】
课堂练习6:常温下,浓度为0.1 mol·L-1的NaOH溶液中, c(H+)与c(OH-)各多少?由水电离出的c(H+)水与c(OH-)水各多少
由水电离出的c(H+)水=c(OH-)水= 1.0×10-13 mol/L
碱溶液中的全部c(H+)是水电离产生的
课堂练习2:某温度下,纯水中的c(H+)=2.0×10-7mol/L, 则此时溶液的c(OH-)为__________mol/L;若温度不变, 滴入稀盐酸使c(H+)=5.0×10-6mol/L,则c(OH-)= __________mol/L。
2.0×10-7
8.0×10-9
Kw 不仅适用于纯水,也适用于稀的电解质水溶液。
Kw=c(H+)·c(OH-)
(1)曲线上的任意点(如a,b,c)的Kw都 ,即c(H+)·c(OH-) ,温度 。
(2)曲线外的任意点(如d)与曲线上任意点的Kw ,温度 。
(3)实现曲线上点之间的转化需保持温度不变,改变 ;实现曲线上点与曲线外点之间的转化一定改变 。
相同
相同
相同
不同
不同
酸碱性
温度
Kw应用2:水的电离平衡曲线的理解与识别
1.一定温度下,水溶液中H+和OH-的浓度变化曲线如图,下列说法正确的是
A.该温度下,a点溶液呈碱性
B.该温度下,0.01 mol·L-1NaOH溶液中c(H+)
=1.0×10-12 mol·L-1
C.该温度下,加入NaOH可能引起由d向b的变化
D.b点时,升高温度,可能引起由b向c的变化
√
大本P63
该温度下, Kw = c(H+) c(OH-) = 1.0×10-12
Kw应用2:水的电离平衡曲线的理解与识别
2.如图表示水中c(H+)和c(OH-)的关系,下列判断错误的是
A.两条曲线间任意点均有c(H+)·c(OH-)=Kw
B.M区域内(不包括边界)任意点均有c(H+)<
c(OH-)
C.图中T1
√
大本P63
12.水的电离常数如图所示,曲线上的点都符合c(H+)·c(OH-)=常数,下列说法错误的是
A.图中温度:T1>T2
B.图中五点Kw间的关系:B>C>A=D=E
C.曲线a、b均代表纯水的电离情况
D.若处在B点时,将0.005 mol·L-1的硫酸溶
液与由水电离的c(H+)=1.0×10-12 mol·L-1的KOH溶液等体积混合后,
溶液显碱性
√
小本P184
Kw应用2:水的电离平衡曲线的理解与识别
10.25 ℃时,在等体积的①0.5 mol·L-1的H2SO4溶液;②0.05 mol·L-1的Ba(OH)2溶液;③1 mol·L-1的NaCl溶液;④纯水中由水电离出的H+的物质的量之比是
A.1∶10∶107∶107 B.107∶107∶1∶1
C.107∶106∶2∶2 D.107∶106∶(2×107)∶2
√
小本P184
14.某学生为探究Kw的影响因素,做了以下实验。
(1)查阅资料,不同温度下水的离子积常数如表所示。
t/ ℃ 0 10 20 25 40 50 90 100
Kw/10-14 0.115 0.296 0.687 1.01 2.87 5.31 37.1 54.5
由此推出:随着温度的升高,Kw (填“增大”或“减小”,下同),水的电离程度 ;水的电离平衡向 (填“左”或“右”)移动,水的电离过程是 (填“吸热”或“放热”)过程。
增大
增大
右
吸热
(2)取三只烧杯A、B、C,分别加入适量水,再向B、C烧杯中分别加入少量盐酸和NaOH溶液,分析并填写下表。
A(纯水) B(加少量盐酸) C(加少量NaOH溶液)
c(H+) 1.0×10-7 mol·L-1 增大
c(OH-) 1.0×10-7 mol·L-1 增大
c(H+)和c(OH-)大小比较 c(H+)=c(OH-) c(H+) c(OH-) c(H+) c(OH-)
水的电离平衡移动方向
Kw 1.0×10-14
减小
减小
>
<
向左
向左
1.0×10-14
1.0×10-14
①温度、 、 均能影响水的电离平衡。②Kw只受 的影响,而与其他因素无关。
酸
碱
温度
作业:大本62-63页
觉得作业量不够的有能力的同学可以再做小本184-185页(其中很多老师已经挑出来在课堂上讲解了)
