化学人教版(2019)必修第二册8.1.2海水资源的开发与利用(共38张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册8.1.2海水资源的开发与利用(共38张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-13 10:20:42 | ||
图片预览











文档简介
(共38张PPT)
人教版必修第二册
第八章 化学与可持续发展
第一节 自然资源的开发利用
第2课时 海水资源的开发利用
我们能从海洋中获得哪些资源呢?
水资源
生物资源
能源
化学资源
潮汐能和波浪能
一、水资源的利用
1、海水淡化
2、海水循环冷却
目的:
从海水中提取淡水
方法:
服务于火电厂、核电厂的循环冷却
蒸馏法 将海水加热至沸腾汽化,然后将蒸气冷凝而得到蒸馏水
电渗 析法 在外加直流电场的作用下,利用阴、阳离子交换膜对水中阴、阳离子的选择透过性,使水中的一部分离子转移到另一部分水中而达到除盐的目的
离子 交换法 用阳离子交换树脂和阴离子交换树脂除去海水中的阴离子、阳离子,得到去离子水
——分离沸点相差较大的液体混合物,也可除去水等液体中难挥发或不挥发的杂质.
蒸馏
酒精灯
蒸馏烧瓶
温度计
冷凝管
牛角管
锥形瓶
沸石
温度计水银球的顶端与支管下沿处于同一水平线
蒸馏烧瓶中液体的量不得超过烧瓶容量的2/3
在蒸馏烧瓶内放有沸石,防止爆沸
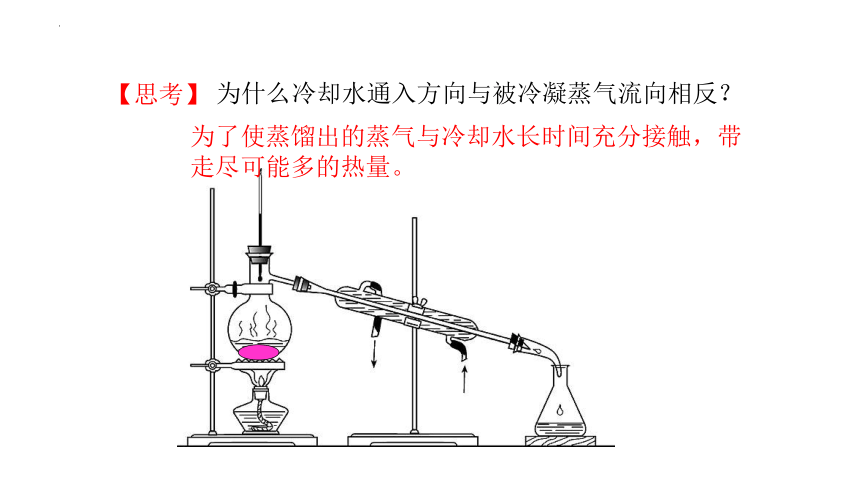
冷凝管横放时头高尾
低保证冷凝液自然下
流,冷却水进水通入
与被冷凝蒸气流向相反
给蒸馏烧瓶加热要垫石棉网
牛角管
圆底烧瓶
水冷凝管
实验模拟
操作要点:
【思考】
为什么冷却水通入方向与被冷凝蒸气流向相反?
为了使蒸馏出的蒸气与冷却水长时间充分接触,带走尽可能多的热量。
【思考】
为什么温度计水银球的顶端要与圆底烧瓶支管下沿处于同一水平线
对于蒸馏来说,只有精确控制蒸馏的温度才能达到分离提纯的目的,而蒸馏烧瓶支管口的温度正是被蒸馏变为气体某组分的温度,故温度计水银球顶端要与圆底烧瓶支管下沿处于同一水平线
【思考】刚开始时,先加热还是先通冷凝水?
结束实验时,立即停止通冷凝水还是继续通一段时间
先通水,再加热
停止加热后还要通一段时间的蒸馏水。
海水蒸馏原理示意图
原理:加热到
水的沸点,液态水
变为水蒸汽与海水
中的盐分离,水蒸
汽冷凝得到淡水
(1)蒸馏法
优点:历史最久,技术和工艺比较成熟;
缺点:成本较高
太阳能蒸发原理示意图
(2)电渗析法
+
-
【原理】离子交换膜,通电后海水中的阳离子和阴离子在电场的作用下渗出膜外
(3)离子交换法
阳离子交换树脂:HR+Na+=NaR+H+
阳离子和海水中的钠离子交换
阴离子能和海水中的氯离子交换
阴离子交换树脂:ROH+Cl-=RCl+OH-
目前正迅速发展,但需要不断更新离子交换树脂
离子交换法净化水过程如图所示。下列说法中错误的是
A. 经过阳离子交换树脂后,水中阳离子的总数不变
B. 水中的 NO3-、SO42-、Cl 通过阴离子树脂后被除去
C. 通过净化处理后,水的导电性降低
D. 阴离子树脂填充段存在反应H++OH =H2O
A
海水淡化可采用膜分离技术。如下图所示,对淡化膜右侧的海水加压,水分子可以透过淡化膜进入左侧淡水池,而海水中其他各种离子不能通过淡化膜,从而得到淡水。对加压后右侧海水成分变化分析正确的是( )
A.溶质质量增加 B.溶剂质量减少
C.溶液质量不变 D.溶质质量分数减小
B
二、化学资源的利用
分散性
元素种类很多,总计含有80多种元素
许多元素的富集程度很低
多样性
海水矿物资源的特点:
二、化学资源的利用
(1)海水中的化学元素
海水中元素
主要元素:______
常量元素: 、 、 、 、S、Ca、Br、C、
Sr、B、F等11种元素
微量元素:铀元素、碘元素等
O、H
Cl Na K Mg
铀和重水是核能开发中的重要原料,从海水中提取铀和重水具有一定战略意义
海水晒盐
NaCl
食用
饱和溶液
钠
纯碱
氯气
氢气
盐酸
氢氧化钠
冶炼金属
合成农药
消毒液
造纸、玻璃、肥皂等
水
食盐的用途:
写出相关的化学反应方程式
写出相关的化学反应方程式:
NaCl+NH3+H2O+CO2=NH4Cl+NaHCO3↓
2NaHCO3==Na2CO3+CO2↑+H2O(侯氏制碱法)
(氯碱工业)
(制钠和氯气)
(制备盐酸)
(制漂白液)
△
2.海水化学资源的开发利用
(1)海水中的化学元素
海水中元素
主要元素:______
常量元素: 、 、 、 、S、Ca、Br、C、
Sr、B、F等11种元素
微量元素:铀元素、碘元素等
O、H
Cl Na K Mg
四、海水资源的开发利用
溴——海洋元素:地球上99%的溴分布在海水中
溴及其化合物在医药、农药、染料和阻燃剂等生产中广泛应用。
从海水中获得溴
【思考与讨论】
1、为什么要从海水中提溴?
(1)用途广泛
(2)溴是海洋元素,地球上99%的溴分布在海水中,以Br-的形式存在。海水中溴元素的含量约为67mg/L。
【思考与讨论】
2、海水提溴的原理是什么?请结合教材中的流程图用一句话简述。
以海水中的含溴物质为原料,通过化学和物理方法分离提纯,得到溴单质。
【思考与讨论】
3、如何将Br-转化为Br2?
为什么选择氧化剂氯气来氧化Br-?
氧化剂的选择要考虑哪些因素?
溴元素由化合物变为单质,化合价升高,发生了氧化反应,所以用氧化剂把Br-氧化为Br2
1、氯气的氧化性大于溴
2、氯气的成本
3、生成物对环境无污染
成本、氧化效果、反应条件、设备要求、环境影响等
4、根据教材中海水提溴的工艺流程图,思考和讨论每一环节的作用,写出各环节主要反应的离子方程式:
“吹出法”海水提溴
环节 作用 化学方程式(或离子方程式)
氧化
吹出
吸收
蒸馏
用氯气氧化海水中的溴离子
用空气将生成的溴吹出
用SO2作还原剂使溴转化为氢溴酸,以使其与空气分离
用氯气将氢溴酸氧化为溴后蒸馏分离
冷凝
将气态溴转化为液态溴
2Br-+Cl2=2Cl-+Br2
Br2+SO2+2H2O=4H++SO42-+2Br-
2Br-+Cl2=2Cl-+Br2
5、蒸馏过程中温度控制在一定温度,温度过高或过低都不利于生产,原因是什么?
提示 温度过高,水蒸气挥发性增强,使溴的纯度降低,温度太低,溴的挥发性减小,导致溴单质不能充分挥发。
酸和Cl2
海水Br-
Br2
氧化室
1
2
3
4
空气
SO2和H2O
Cl2
吹出塔
吸收塔
蒸馏塔
工业生产流程图
6、吹出过程和蒸馏过程利用单质溴的什么性质?过程①获取了游离态的溴,过程③又将其转变为化合态的溴,其目的是什么?
Br2易挥发,利用空气或水蒸气可以将Br2从海水中吹出;将单质溴再转化为溴离子的目的是使Br-浓缩,提高Br2的提取效率。
溴与空气分离
溴与海水分离
溴与吸收液分离
1
2
4
3
海水Br2
氧化
吹出
吸收
海水Br-
空气 Br2
吸收液Br2
吸收液Br-
氧化
高浓度Br -
低浓度Br -
富集溴元素
含有溴0.0672g/L
蒸馏
Br2
4
工业原料到具体产品的一般思路
工业原料
富集
中间产物1
转化
酸碱性
氧化性
中间产物2
分离提纯
产品
除去杂质
提纯产物
工业生产流程设计的思路与方法
工业原料
富集
中间产物1
转化
中间产物2
分离提纯
产品
根据教材图8-3“海水的综合利用示意图”以及金属的冶炼原理,思考讨论海水提钠的工艺流程图的绘制
酸碱性
氧化性
除去杂质
提纯产物
海水
MgCl2
Mg
……
根据上述方法和相关物质性质设计方案
学以致用
海水提镁
中间原料
电解
富集
分离提纯
生石灰
石灰乳
盐酸
物质转化
【课堂练习】
1、海水淡化是海岛地区获得淡水的重要手段,海水淡化是指除去海水中的盐分以获得淡水的工艺过程,其方法较多,如电渗析法、离子交换法等。下列方法中也可以用来进行海水淡化的是( )
A.过滤法 B.蒸馏法
C.分液法 D.萃取法
B
2、地球上的大部分水是以海水形式存在的,若能找到海水淡化的大规模生产方法,将极大地缓解目前人类面临的水资源日益紧缺的状况。下列有关海水淡化的方法在原理上完全不可行的是( )
A.加明矾使海水中的盐分沉淀而淡化
B.利用太阳能使海水蒸馏淡化
C.将海水缓慢凝固以获取淡化的饮用水
D.将海水通过离子交换树脂,以除去所含离子
【课堂练习】
A
3、海水是一个巨大的化学资源库,下列有关海水综合利用的说法正确的是( )
A.利用潮汐发电是将化学能转化为电能
B.海水蒸发制海盐的过程中发生了化学变化
C.从海水中可以得到MgCl2,电解熔融MgCl2可制备Mg
D.海水中含有溴元素,只需经过物理变化就可以得到溴单质
【课堂练习】
C
4、海洋中蕴藏着巨大的化学资源,下列有关海水综合利用的说法正确的是( )
A.蒸发海水可以生产单质碘
B.蒸馏海水可以得到淡水
C.电解海水可以得到单质镁
D.电解海水可以制得金属钠
【课堂练习】
B
5、从淡化海水中提取溴的流程如下:
下列有关说法不正确的是( )
A.X试剂可用Na2SO3饱和溶液
B.步骤Ⅲ的离子反应:2Br-+Cl2===2Cl-+Br2
C.工业上每获得1 mol Br2,需要消耗Cl2 44.8 L
D.步骤Ⅳ包含萃取、分液和蒸馏
【课堂练习】
C
6、海水中溴元素以Br-形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如图所示:
(1) 步骤①反应的离子方程式是________________________。
(2) 步骤③反应的化学方程式是_______________________________。
(3) 从理论上考虑,下列物质也能充分吸收Br2的是_____(填字母)。
A.NaOH B.FeCl2 C.Na2SO3 D.H2O
2Br-+Cl2===Br2+2Cl-
SO2+Br2+2H2O===H2SO4+2HBr
ABC
(4)步骤⑤蒸馏过程中,温度应控制在80~90 ℃。温度过高或过低都不利于生产,若温度过高,大量水蒸气随溴排出,溴蒸气中水分增加;若温度过低,则___________
______________。
溴不能完全
蒸出,产率低
【课堂练习】
人教版必修第二册
第八章 化学与可持续发展
第一节 自然资源的开发利用
第2课时 海水资源的开发利用
我们能从海洋中获得哪些资源呢?
水资源
生物资源
能源
化学资源
潮汐能和波浪能
一、水资源的利用
1、海水淡化
2、海水循环冷却
目的:
从海水中提取淡水
方法:
服务于火电厂、核电厂的循环冷却
蒸馏法 将海水加热至沸腾汽化,然后将蒸气冷凝而得到蒸馏水
电渗 析法 在外加直流电场的作用下,利用阴、阳离子交换膜对水中阴、阳离子的选择透过性,使水中的一部分离子转移到另一部分水中而达到除盐的目的
离子 交换法 用阳离子交换树脂和阴离子交换树脂除去海水中的阴离子、阳离子,得到去离子水
——分离沸点相差较大的液体混合物,也可除去水等液体中难挥发或不挥发的杂质.
蒸馏
酒精灯
蒸馏烧瓶
温度计
冷凝管
牛角管
锥形瓶
沸石
温度计水银球的顶端与支管下沿处于同一水平线
蒸馏烧瓶中液体的量不得超过烧瓶容量的2/3
在蒸馏烧瓶内放有沸石,防止爆沸
冷凝管横放时头高尾
低保证冷凝液自然下
流,冷却水进水通入
与被冷凝蒸气流向相反
给蒸馏烧瓶加热要垫石棉网
牛角管
圆底烧瓶
水冷凝管
实验模拟
操作要点:
【思考】
为什么冷却水通入方向与被冷凝蒸气流向相反?
为了使蒸馏出的蒸气与冷却水长时间充分接触,带走尽可能多的热量。
【思考】
为什么温度计水银球的顶端要与圆底烧瓶支管下沿处于同一水平线
对于蒸馏来说,只有精确控制蒸馏的温度才能达到分离提纯的目的,而蒸馏烧瓶支管口的温度正是被蒸馏变为气体某组分的温度,故温度计水银球顶端要与圆底烧瓶支管下沿处于同一水平线
【思考】刚开始时,先加热还是先通冷凝水?
结束实验时,立即停止通冷凝水还是继续通一段时间
先通水,再加热
停止加热后还要通一段时间的蒸馏水。
海水蒸馏原理示意图
原理:加热到
水的沸点,液态水
变为水蒸汽与海水
中的盐分离,水蒸
汽冷凝得到淡水
(1)蒸馏法
优点:历史最久,技术和工艺比较成熟;
缺点:成本较高
太阳能蒸发原理示意图
(2)电渗析法
+
-
【原理】离子交换膜,通电后海水中的阳离子和阴离子在电场的作用下渗出膜外
(3)离子交换法
阳离子交换树脂:HR+Na+=NaR+H+
阳离子和海水中的钠离子交换
阴离子能和海水中的氯离子交换
阴离子交换树脂:ROH+Cl-=RCl+OH-
目前正迅速发展,但需要不断更新离子交换树脂
离子交换法净化水过程如图所示。下列说法中错误的是
A. 经过阳离子交换树脂后,水中阳离子的总数不变
B. 水中的 NO3-、SO42-、Cl 通过阴离子树脂后被除去
C. 通过净化处理后,水的导电性降低
D. 阴离子树脂填充段存在反应H++OH =H2O
A
海水淡化可采用膜分离技术。如下图所示,对淡化膜右侧的海水加压,水分子可以透过淡化膜进入左侧淡水池,而海水中其他各种离子不能通过淡化膜,从而得到淡水。对加压后右侧海水成分变化分析正确的是( )
A.溶质质量增加 B.溶剂质量减少
C.溶液质量不变 D.溶质质量分数减小
B
二、化学资源的利用
分散性
元素种类很多,总计含有80多种元素
许多元素的富集程度很低
多样性
海水矿物资源的特点:
二、化学资源的利用
(1)海水中的化学元素
海水中元素
主要元素:______
常量元素: 、 、 、 、S、Ca、Br、C、
Sr、B、F等11种元素
微量元素:铀元素、碘元素等
O、H
Cl Na K Mg
铀和重水是核能开发中的重要原料,从海水中提取铀和重水具有一定战略意义
海水晒盐
NaCl
食用
饱和溶液
钠
纯碱
氯气
氢气
盐酸
氢氧化钠
冶炼金属
合成农药
消毒液
造纸、玻璃、肥皂等
水
食盐的用途:
写出相关的化学反应方程式
写出相关的化学反应方程式:
NaCl+NH3+H2O+CO2=NH4Cl+NaHCO3↓
2NaHCO3==Na2CO3+CO2↑+H2O(侯氏制碱法)
(氯碱工业)
(制钠和氯气)
(制备盐酸)
(制漂白液)
△
2.海水化学资源的开发利用
(1)海水中的化学元素
海水中元素
主要元素:______
常量元素: 、 、 、 、S、Ca、Br、C、
Sr、B、F等11种元素
微量元素:铀元素、碘元素等
O、H
Cl Na K Mg
四、海水资源的开发利用
溴——海洋元素:地球上99%的溴分布在海水中
溴及其化合物在医药、农药、染料和阻燃剂等生产中广泛应用。
从海水中获得溴
【思考与讨论】
1、为什么要从海水中提溴?
(1)用途广泛
(2)溴是海洋元素,地球上99%的溴分布在海水中,以Br-的形式存在。海水中溴元素的含量约为67mg/L。
【思考与讨论】
2、海水提溴的原理是什么?请结合教材中的流程图用一句话简述。
以海水中的含溴物质为原料,通过化学和物理方法分离提纯,得到溴单质。
【思考与讨论】
3、如何将Br-转化为Br2?
为什么选择氧化剂氯气来氧化Br-?
氧化剂的选择要考虑哪些因素?
溴元素由化合物变为单质,化合价升高,发生了氧化反应,所以用氧化剂把Br-氧化为Br2
1、氯气的氧化性大于溴
2、氯气的成本
3、生成物对环境无污染
成本、氧化效果、反应条件、设备要求、环境影响等
4、根据教材中海水提溴的工艺流程图,思考和讨论每一环节的作用,写出各环节主要反应的离子方程式:
“吹出法”海水提溴
环节 作用 化学方程式(或离子方程式)
氧化
吹出
吸收
蒸馏
用氯气氧化海水中的溴离子
用空气将生成的溴吹出
用SO2作还原剂使溴转化为氢溴酸,以使其与空气分离
用氯气将氢溴酸氧化为溴后蒸馏分离
冷凝
将气态溴转化为液态溴
2Br-+Cl2=2Cl-+Br2
Br2+SO2+2H2O=4H++SO42-+2Br-
2Br-+Cl2=2Cl-+Br2
5、蒸馏过程中温度控制在一定温度,温度过高或过低都不利于生产,原因是什么?
提示 温度过高,水蒸气挥发性增强,使溴的纯度降低,温度太低,溴的挥发性减小,导致溴单质不能充分挥发。
酸和Cl2
海水Br-
Br2
氧化室
1
2
3
4
空气
SO2和H2O
Cl2
吹出塔
吸收塔
蒸馏塔
工业生产流程图
6、吹出过程和蒸馏过程利用单质溴的什么性质?过程①获取了游离态的溴,过程③又将其转变为化合态的溴,其目的是什么?
Br2易挥发,利用空气或水蒸气可以将Br2从海水中吹出;将单质溴再转化为溴离子的目的是使Br-浓缩,提高Br2的提取效率。
溴与空气分离
溴与海水分离
溴与吸收液分离
1
2
4
3
海水Br2
氧化
吹出
吸收
海水Br-
空气 Br2
吸收液Br2
吸收液Br-
氧化
高浓度Br -
低浓度Br -
富集溴元素
含有溴0.0672g/L
蒸馏
Br2
4
工业原料到具体产品的一般思路
工业原料
富集
中间产物1
转化
酸碱性
氧化性
中间产物2
分离提纯
产品
除去杂质
提纯产物
工业生产流程设计的思路与方法
工业原料
富集
中间产物1
转化
中间产物2
分离提纯
产品
根据教材图8-3“海水的综合利用示意图”以及金属的冶炼原理,思考讨论海水提钠的工艺流程图的绘制
酸碱性
氧化性
除去杂质
提纯产物
海水
MgCl2
Mg
……
根据上述方法和相关物质性质设计方案
学以致用
海水提镁
中间原料
电解
富集
分离提纯
生石灰
石灰乳
盐酸
物质转化
【课堂练习】
1、海水淡化是海岛地区获得淡水的重要手段,海水淡化是指除去海水中的盐分以获得淡水的工艺过程,其方法较多,如电渗析法、离子交换法等。下列方法中也可以用来进行海水淡化的是( )
A.过滤法 B.蒸馏法
C.分液法 D.萃取法
B
2、地球上的大部分水是以海水形式存在的,若能找到海水淡化的大规模生产方法,将极大地缓解目前人类面临的水资源日益紧缺的状况。下列有关海水淡化的方法在原理上完全不可行的是( )
A.加明矾使海水中的盐分沉淀而淡化
B.利用太阳能使海水蒸馏淡化
C.将海水缓慢凝固以获取淡化的饮用水
D.将海水通过离子交换树脂,以除去所含离子
【课堂练习】
A
3、海水是一个巨大的化学资源库,下列有关海水综合利用的说法正确的是( )
A.利用潮汐发电是将化学能转化为电能
B.海水蒸发制海盐的过程中发生了化学变化
C.从海水中可以得到MgCl2,电解熔融MgCl2可制备Mg
D.海水中含有溴元素,只需经过物理变化就可以得到溴单质
【课堂练习】
C
4、海洋中蕴藏着巨大的化学资源,下列有关海水综合利用的说法正确的是( )
A.蒸发海水可以生产单质碘
B.蒸馏海水可以得到淡水
C.电解海水可以得到单质镁
D.电解海水可以制得金属钠
【课堂练习】
B
5、从淡化海水中提取溴的流程如下:
下列有关说法不正确的是( )
A.X试剂可用Na2SO3饱和溶液
B.步骤Ⅲ的离子反应:2Br-+Cl2===2Cl-+Br2
C.工业上每获得1 mol Br2,需要消耗Cl2 44.8 L
D.步骤Ⅳ包含萃取、分液和蒸馏
【课堂练习】
C
6、海水中溴元素以Br-形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如图所示:
(1) 步骤①反应的离子方程式是________________________。
(2) 步骤③反应的化学方程式是_______________________________。
(3) 从理论上考虑,下列物质也能充分吸收Br2的是_____(填字母)。
A.NaOH B.FeCl2 C.Na2SO3 D.H2O
2Br-+Cl2===Br2+2Cl-
SO2+Br2+2H2O===H2SO4+2HBr
ABC
(4)步骤⑤蒸馏过程中,温度应控制在80~90 ℃。温度过高或过低都不利于生产,若温度过高,大量水蒸气随溴排出,溴蒸气中水分增加;若温度过低,则___________
______________。
溴不能完全
蒸出,产率低
【课堂练习】
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
