2022-2023学年高一化学人教版2019必修第二册第五章第一节第2课时硫酸硫酸根离子的检验(含解析)
文档属性
| 名称 | 2022-2023学年高一化学人教版2019必修第二册第五章第一节第2课时硫酸硫酸根离子的检验(含解析) |  | |
| 格式 | zip | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-13 14:42:19 | ||
图片预览




文档简介
2022-2023学年高一化学人教版2019必修第二册第五章
第一节第2课时硫酸硫酸根离子的检验
学校:___________姓名:___________班级:___________
一、单选题
1.硫酸是一种重要的化工原料,下列关于硫酸的说法中不正确的是 ( )
A.硫酸可用于生产化肥、农药和炸药等
B.硫黄和黄铁矿可以作为制备硫酸的原料
C.工业制备硫酸时,SO2转化为SO3的反应需要在加热和催化剂存在的条件下进行
D.反应生成的SO3可以用水直接吸收来制备硫酸
2.常温下,铁片遇浓硫酸产生钝化现象,该现象可说明浓硫酸具有( )
A.挥发性 B.吸水性 C.脱水性 D.强氧化性
3.在如图所示的实验中,实验进行一段时间后,下列关于实验现象的叙述不正确的是 ( )
A.苹果块会干瘪 B.胆矾晶体表面有“白斑”生成
C.饱和硝酸钾溶液中有晶体析出 D.试纸变红
4.盛有浓硫酸的烧杯敞口放置一段时间后,质量增加.是因为浓硫酸具有( )
A.吸水性 B.脱水性 C.强氧化性 D.酸性
5.下列关于浓硫酸与稀硫酸的说法,不正确的是 ( )
A.浓硫酸有脱水性,稀硫酸没有脱水性
B.浓硫酸有氧化性,稀硫酸没有氧化性
C.浓硫酸和稀硫酸都有酸性
D.常温下,浓硫酸和稀硫酸都不能与铜反应
6.鉴别时所选用的试剂及顺序最合理的是( )
A.稀盐酸、BaCl2溶液 B.稀硝酸、BaCl2溶液
C.Ba(NO3)2溶液、稀盐酸 D.BaCl2溶液、稀盐酸
7.下列现象或用途与浓硫酸的吸水性和脱水性无关的是( )
A.浓硫酸可作氯气的干燥剂
B.浓硫酸滴加到蔗糖中,蔗糖变黑
C.浓硫酸滴加到胆矾上,蓝色晶体变成白色粉末
D.浓硫酸在加热条件下可与铜等不活泼金属反应
8.向浓盐酸中加入浓硫酸时,会有白雾生成。下列叙述与该现象无关的是 ( )
A.浓硫酸具有脱水性
B.浓硫酸具有吸水性
C.浓盐酸具有挥发性
D.气态溶质的溶解度随温度的升高而降低
9.下列实验说明浓硫酸有强腐蚀性的是( )
A.浓硫酸慢慢地注入水中产生大量的热
B.含有水蒸气的氧气通过浓硫酸得到干燥的氧气
C.浓硫酸久置在空气中质量增加
D.用小木棍蘸少量浓硫酸,小木棍变黑
10.下列对硫酸的叙述正确的是( )
A.因浓硫酸具有强氧化性,故不可用它来干燥氢气
B.浓硫酸可用铁铝容器存放是因为常温下浓硫酸不与这两种金属反应
C.浓硫酸有强氧化性,稀硫酸不具有氧化性
D.实验室中利用浓硫酸的高沸点性来制备HCl等气体
11.为了验证浓硫酸和木炭粉在加热条件下产生的气体产物,某同学选用了如图所示的实验装置。下列说法错误的是( )
A.B装置用来检验产物中是否有水蒸气生成
B.C装置用来检验产物中是否有SO2生成
C.D装置中溴水褪色,则说明SO2具有漂白性
D.F装置用来检验产物中是否有CO2生成
二、实验题
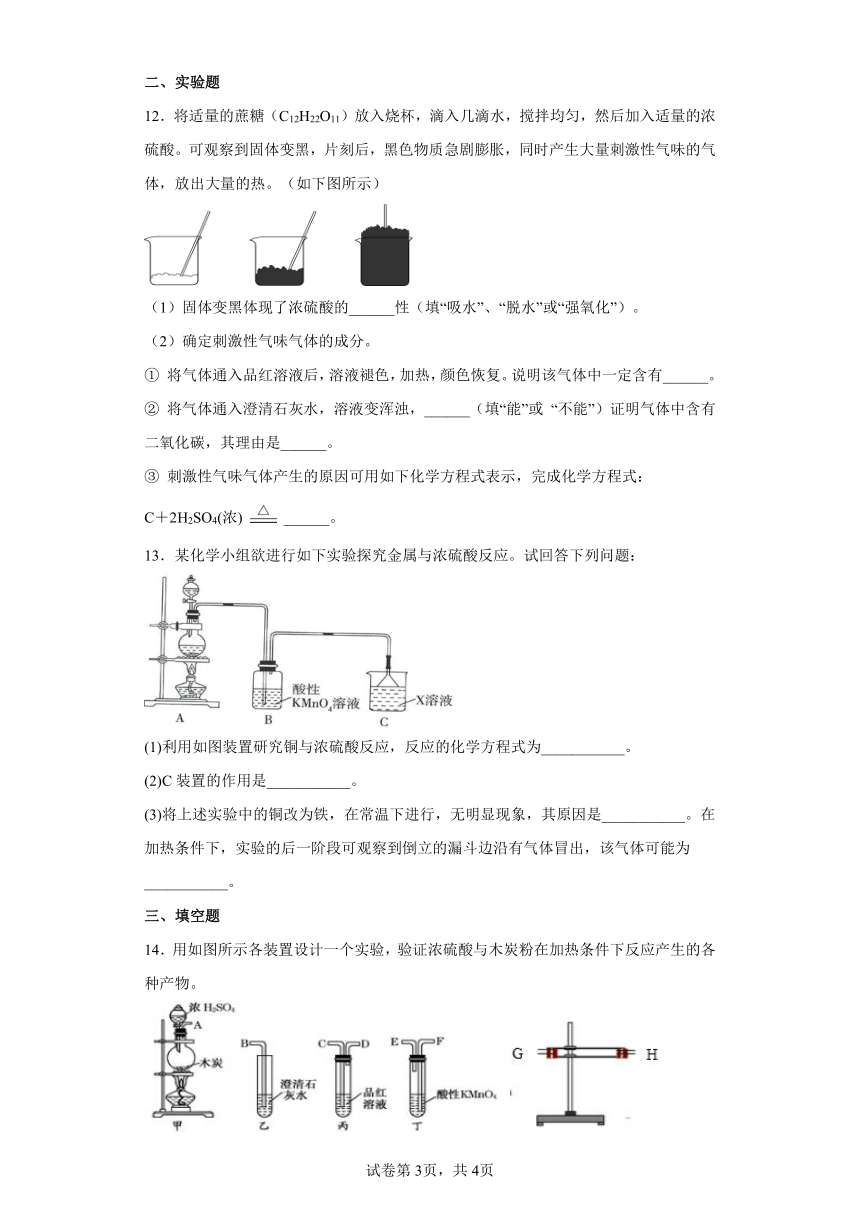
12.将适量的蔗糖(C12H22O11)放入烧杯,滴入几滴水,搅拌均匀,然后加入适量的浓硫酸。可观察到固体变黑,片刻后,黑色物质急剧膨胀,同时产生大量刺激性气味的气体,放出大量的热。(如下图所示)
(1)固体变黑体现了浓硫酸的______性(填“吸水”、“脱水”或“强氧化”)。
(2)确定刺激性气味气体的成分。
① 将气体通入品红溶液后,溶液褪色,加热,颜色恢复。说明该气体中一定含有______。
② 将气体通入澄清石灰水,溶液变浑浊,______(填“能”或 “不能”)证明气体中含有二氧化碳,其理由是______。
③ 刺激性气味气体产生的原因可用如下化学方程式表示,完成化学方程式:
C+2H2SO4(浓) ______。
13.某化学小组欲进行如下实验探究金属与浓硫酸反应。试回答下列问题:
(1)利用如图装置研究铜与浓硫酸反应,反应的化学方程式为___________。
(2)C装置的作用是___________。
(3)将上述实验中的铜改为铁,在常温下进行,无明显现象,其原因是___________。在加热条件下,实验的后一阶段可观察到倒立的漏斗边沿有气体冒出,该气体可能为___________。
三、填空题
14.用如图所示各装置设计一个实验,验证浓硫酸与木炭粉在加热条件下反应产生的各种产物。
(1)如按气流由左向右流向,连接上述装置的正确顺序是(填各接口字母):
A接G,H接C,D接_______,_______接C,D接B ;
(2)仪器乙、丙应有怎样的实验现象才表明已检验出CO2 乙中_____________________________,丙中_____________________________;
(3)丁中酸性KMnO4溶液的作用是___________________________________________;
(4)写出甲中反应的化学方程式_________________________________________ 。
(5)硫酸有很多的性质,将下列性质对应的字母填入各小题后面对应的括号中:
A.脱水性 B.酸性 C.强氧化性 D.吸水性
Ⅰ.在化学实验中,浓硫酸可做SO2、CO2等气体的干燥剂。 ( )
Ⅱ.Na2CO3与H2SO4反应,可生成Na2SO4和CO2。 ( )
Ⅲ.向滤纸上滴加浓H2SO4 ,滤纸变黑。 ( )
Ⅳ.在冷浓H2SO4中放入铁片没明显现象 ( )
参考答案:
1.D
【详解】A.硫酸可用于生产化肥,如硫酸铵,生产农药,如制备硫酸铜来配制波尔多液,生产炸药,如制备TNT作催化剂,A项正确;
B.硫黄或黄铁矿和氧气焙烧产生二氧化硫、二氧化硫和氧气反应产生三氧化硫、三氧化硫溶于水得硫酸,因此以硫黄或黄铁矿作为原料可用于制取硫酸,B项正确;
C.工业制备硫酸时,SO2转化为SO3的反应在400-500℃、作催化剂的条件下进行,C项正确;
D.三氧化硫极易溶于水,溶于水易形成酸雾,因此工业生产中用98.3%的浓硫酸来吸收SO3,D项错误;
答案选D。
2.D
【详解】常温下,铁片遇浓硫酸产生钝化现象,是因为浓硫酸使铁表面氧化为致密的保护膜,阻止浓硫酸继续与内层的铁进行反应,所以该现象说明了浓硫酸具有强氧化性。故合理选项是D。
3.D
【详解】A.浓硫酸具有脱水性,会使得苹果干瘪,A正确;
B.浓硫酸具有吸水性,胆矾晶体失去结晶水,表面有“白斑”生成,B正确;
C.浓硫酸具有吸水性,饱和硝酸钾溶液中水减小,有硝酸钾晶体析出,C正确;
D.浓硫酸具有脱水性、强氧化性,使得试纸脱水变黑色,D错误;
故选D。
4.A
【详解】浓硫酸具有吸水性,盛有浓硫酸的烧杯敞口放置一段时间后,会吸收周围的水蒸气,而使溶液质量增加,答案选A。
【点睛】注意浓硫酸吸水性与特殊性的区别,浓H2SO4夺取的水在原物质中以H2O分子形式存在时浓H2SO4表现吸水性,不以H2O分子形式而以H和O原子形式存在时,而浓H2SO4表现脱水性。利用浓硫酸的吸水性可以作干燥剂,但浓硫酸不能干燥碱性气体(例如氨气)和具有还原性的气体,例如H2S等。
5.B
【详解】A.浓硫酸可按水分子中氢氧原子数的比(2∶1)夺取被脱水物中的氢原子和氧原子,具有脱水性,而稀硫酸没有脱水性,A正确;
B.稀硫酸有氧化性,稀硫酸与活泼金属反应时,表现氧化性,发生还原反应生成H2,B错误;
C.浓硫酸和稀硫酸在与金属单质的反应中均能提供硫酸根离子,生成相应的硫酸盐,从而表现酸性,C正确;
D.铜属于不活泼金属,不能与稀硫酸反应,而铜与浓硫酸的反应需要在加热条件下才能进行,常温下不反应,D正确;
故选B。
6.A
【详解】可根据是BaSO4既不溶于水,也不溶于酸的性质进行鉴别。方法是取待测溶液,向其中加入稀盐酸,无现象,证明溶液中无Ag+、,然后再加入BaCl2溶液,若产生白色沉淀,就证明含有,故合理选项是A。
7.D
【详解】A.浓硫酸做干燥剂与其具有吸水性有关,故A不选;
B.浓硫酸使蔗糖变黑与其具有脱水性有关,故B不选;
C.浓硫酸能将胆矾从蓝色晶体变成白色粉末,与其吸水性有关,故C不选;
D.浓硫酸在加热条件下可与铜等不活泼金属反应是因为浓硫酸具有强氧化性,与吸水性和脱水性无关,故D选;
故选:D。
8.A
【详解】A.HCl中没有O元素,浓硫酸不可能从HCl中脱去H2O,A符合题意;
B.浓硫酸滴入浓盐酸中,会吸收浓盐酸中的水分,放出大量的热,B不符合题意;
C.浓盐酸具有挥发性,因此HCl能够逸出,与空气中的水蒸气结合,形成白雾,C不符合题意;
D.浓硫酸滴入浓盐酸中,放出大量的热,由于气体的溶解度随着温度的升高而降低,有利于HCl挥发,D不符合题意;
答案选A。
9.D
【详解】A.浓硫酸慢慢地注入水中产生大量的热,浓硫酸稀释放热,是物理变化,A错误;
B.含有水蒸气的氧气通过浓硫酸得到干燥的氧气,浓硫酸具有吸水性,是物理变化,B错误;
C.浓硫酸久置在空气中质量增加,浓硫酸吸收空气中的水蒸气,吸水性,是物理变化,C错误;
D.用小木棍蘸少量浓硫酸,小木棍变黑,浓硫酸具有脱水性,小木棍被腐蚀,是化学变化,具有腐蚀性,D正确;
故答案为:D。
10.D
【详解】A.浓硫酸和氢气不反应,可用于干燥氢气,故A错误;
B.浓硫酸具有强氧化性,可与铝、铁发生钝化反应,在铝、铁表面生成一层致密的氧化膜保护内部金属不被氧化,故浓硫酸可用铁铝容器存放,故B错误;
C.稀硫酸具有氧化性,可与活泼金属反应生成氢气,故C错误;
D.浓硫酸沸点高,难挥发,可用于制备易挥发性的酸如HCl,故D正确;
故选:D。
【点睛】浓硫酸具有强氧化性,可与铝、铁发生钝化反应;浓硫酸具有吸水性,可用于干燥剂;浓硫酸还具有脱水性,沸点高,难挥发,以此解答该题。
11.C
【分析】浓硫酸和碳在加热时生成SO2、CO2和水。先通过无水硫酸铜检验水的生成,无水硫酸铜会变蓝;再通过品红,检验二氧化硫,二氧化硫有漂白性,可以使品红溶液褪色;再通过溴水,二氧化硫可以和溴水反应以除去二氧化硫;再通过品红溶液,检验二氧化硫是否除尽,最后通入澄清石灰水检验二氧化碳。
【详解】由以上分析可知:
A.B装置用来检验产物中是否有水蒸气生成,正确;
B.C装置用来检验产物中是否有SO2生成,正确;
C.D装置中溴水和SO2反应:Br2+2H2O+SO2=H2SO4+2HBr,溴水褪色,体现了SO2的还原性,错误;
D.F装置用来检验产物中是否有CO2生成,正确;
故选C。
12. 脱水 SO2 不能 SO2也可使澄清的石灰水变浑浊 C+2H2SO4(浓) CO2↑+2SO2↑+2H2O
【分析】蔗糖的组成元素为碳、氢、氧,说明有碳单质生成,将适量的蔗糖(C12H22O11)放入烧杯,滴入几滴水,搅拌均匀,然后加入适量的浓硫酸,观察到固体变黑,证明浓硫酸的脱水作用,体积膨胀说明有气体生成,形成疏松多孔的海绵状黑色物质,同时闻到刺激性气味,碳单质与浓硫酸反应生成二氧化碳和有刺激性气味的二氧化硫,表现了浓硫酸的强氧化性。
【详解】(1)装置中使蔗糖变黑,是利用浓硫酸的脱水性把蔗糖中的氢元素和氧元素按2:1脱去,故答案为脱水;
(2)①有刺激性气味的气体通入品红溶液中,可以看到品红溶液褪色,加热,颜色恢复,说明该气体中一定含有二氧化硫,故答案为SO2;
②二氧化硫和二氧化碳通入澄清石灰水都会生成沉淀溶液变浑浊,澄清石灰水变浑浊不能证明气体中含有二氧化碳,故答案为不能;SO2也可使澄清的石灰水变浑浊;
③脱水过程中反应放热,所生产的碳和浓硫酸共热反应生成二氧化硫、二氧化碳和水,反应的化学方程式为C+2H2SO4(浓) CO2↑+2SO2↑+2H2O,故答案为C+2H2SO4(浓) CO2↑+2SO2↑+2H2O。
13. Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O 吸收多余的SO2,防止污染空气,防倒吸 在常温下,铁遇浓硫酸发生钝化 氢气(或H2)
【分析】本实验目的是探究金属与浓硫酸反应,实验原理是Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O,装置A制备SO2,装置B验证SO2的还原性,SO2对环境有污染,必须尾气处理,装置C的作用是吸收尾气中SO2,防止倒吸,即X溶液为NaOH溶液,据此分析;
【详解】(1)铜与浓硫酸反应需要加热,化学方程式为Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O;故答案为Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O;
(2)SO2是有毒气体,装置C中溶液可吸收多余的SO2,防止污染空气;SO2在水中溶解度较大,装置C中倒置漏斗可防倒吸;故答案为吸收多余的SO2,防止污染空气,防倒吸;
(3)常温下,铁遇浓硫酸会发生钝化,阻碍反应的进行;加热条件下,铁与浓硫酸的反应能持续进行,反应后期,浓硫酸变稀,铁与稀硫酸反应放出氢气;故答案为在常温下,铁遇浓硫酸发生钝化;氢气或H2。
14. F E 澄清石灰水变浑浊 品红不褪色 除去气体中的SO2 C+2H2SO4(浓)CO2↑+2SO2↑+2H2O D B A C
【分析】浓硫酸与木炭粉反应C+2H2SO4(浓)CO2↑+2SO2↑+2H2O,实验目的是验证反应产生的各种产物。水蒸气通常用无水硫酸铜检验,SO2用品红溶液检验,用澄清石灰水检验CO2。因为SO2也能使澄清石灰水变浑浊:Ca(OH)2+SO2=CaSO3↓+H2O,所以在检验CO2前必须除尽SO2,并实验证明SO2已经除尽,以此连接实验装置。浓硫酸具有强酸性,能够制取碳酸产生CO2,浓硫酸的强氧化性使铁钝化,浓硫酸的吸水性使浓硫酸可作某些气体的干燥剂,浓硫酸能够将纤维素中的氢、氧元素按水的比例脱下,生成水而使纤维素炭化。由此分析。
【详解】(1)本实验的目的是验证浓硫酸与木炭粉反应产生的水蒸气、二氧化硫、二氧化碳。应该先用无水硫酸铜验证水蒸气,再用品红溶液检验SO2。因为SO2也能使澄清石灰水变浑浊,在检验CO2前必须除去气体中的SO2。酸性KMnO4溶液能充分吸收SO2,再用品红溶液证明SO2已除尽,最后用澄清石灰水验证CO2。所以连接上述装置的正确顺序是A接G,H接C,D接F,E接C,D接B。
(2)只有丙中品红不褪色,才能确信SO2已经除尽;能够使澄清石灰水变浑浊的只有CO2,所以表明已检验出CO2的实验现象是乙中澄清石灰水变浑浊,丙中品红不褪色。
(3)KMnO4酸性溶液能够充分吸收SO2气体:2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+,所以丁中酸性KMnO4溶液的作用是除去气体中的SO2。
(4)加热条件下浓硫酸氧化木炭粉的化学方程式为C+2H2SO4(浓)CO2↑+2SO2↑+2H2O。
(5)I、浓硫酸具有吸收性,能干燥SO2、CO2等气体,答案选D;II、硫酸属于强酸,强酸制弱酸,答案选B。III、浓硫酸具有脱水性,滤纸的主要成分是纤维素[(C6H10O5)n],(C6H10O5)n6nC+5nH2O,答案选A。IV、浓硫酸具有强氧化性,常温下浓硫酸能使铁的表面形成一层致密氧化物薄膜阻止浓硫酸与铁继续反应(称为钝化),答案选C。
试卷第1页,共3页
试卷第1页,共3页
第一节第2课时硫酸硫酸根离子的检验
学校:___________姓名:___________班级:___________
一、单选题
1.硫酸是一种重要的化工原料,下列关于硫酸的说法中不正确的是 ( )
A.硫酸可用于生产化肥、农药和炸药等
B.硫黄和黄铁矿可以作为制备硫酸的原料
C.工业制备硫酸时,SO2转化为SO3的反应需要在加热和催化剂存在的条件下进行
D.反应生成的SO3可以用水直接吸收来制备硫酸
2.常温下,铁片遇浓硫酸产生钝化现象,该现象可说明浓硫酸具有( )
A.挥发性 B.吸水性 C.脱水性 D.强氧化性
3.在如图所示的实验中,实验进行一段时间后,下列关于实验现象的叙述不正确的是 ( )
A.苹果块会干瘪 B.胆矾晶体表面有“白斑”生成
C.饱和硝酸钾溶液中有晶体析出 D.试纸变红
4.盛有浓硫酸的烧杯敞口放置一段时间后,质量增加.是因为浓硫酸具有( )
A.吸水性 B.脱水性 C.强氧化性 D.酸性
5.下列关于浓硫酸与稀硫酸的说法,不正确的是 ( )
A.浓硫酸有脱水性,稀硫酸没有脱水性
B.浓硫酸有氧化性,稀硫酸没有氧化性
C.浓硫酸和稀硫酸都有酸性
D.常温下,浓硫酸和稀硫酸都不能与铜反应
6.鉴别时所选用的试剂及顺序最合理的是( )
A.稀盐酸、BaCl2溶液 B.稀硝酸、BaCl2溶液
C.Ba(NO3)2溶液、稀盐酸 D.BaCl2溶液、稀盐酸
7.下列现象或用途与浓硫酸的吸水性和脱水性无关的是( )
A.浓硫酸可作氯气的干燥剂
B.浓硫酸滴加到蔗糖中,蔗糖变黑
C.浓硫酸滴加到胆矾上,蓝色晶体变成白色粉末
D.浓硫酸在加热条件下可与铜等不活泼金属反应
8.向浓盐酸中加入浓硫酸时,会有白雾生成。下列叙述与该现象无关的是 ( )
A.浓硫酸具有脱水性
B.浓硫酸具有吸水性
C.浓盐酸具有挥发性
D.气态溶质的溶解度随温度的升高而降低
9.下列实验说明浓硫酸有强腐蚀性的是( )
A.浓硫酸慢慢地注入水中产生大量的热
B.含有水蒸气的氧气通过浓硫酸得到干燥的氧气
C.浓硫酸久置在空气中质量增加
D.用小木棍蘸少量浓硫酸,小木棍变黑
10.下列对硫酸的叙述正确的是( )
A.因浓硫酸具有强氧化性,故不可用它来干燥氢气
B.浓硫酸可用铁铝容器存放是因为常温下浓硫酸不与这两种金属反应
C.浓硫酸有强氧化性,稀硫酸不具有氧化性
D.实验室中利用浓硫酸的高沸点性来制备HCl等气体
11.为了验证浓硫酸和木炭粉在加热条件下产生的气体产物,某同学选用了如图所示的实验装置。下列说法错误的是( )
A.B装置用来检验产物中是否有水蒸气生成
B.C装置用来检验产物中是否有SO2生成
C.D装置中溴水褪色,则说明SO2具有漂白性
D.F装置用来检验产物中是否有CO2生成
二、实验题
12.将适量的蔗糖(C12H22O11)放入烧杯,滴入几滴水,搅拌均匀,然后加入适量的浓硫酸。可观察到固体变黑,片刻后,黑色物质急剧膨胀,同时产生大量刺激性气味的气体,放出大量的热。(如下图所示)
(1)固体变黑体现了浓硫酸的______性(填“吸水”、“脱水”或“强氧化”)。
(2)确定刺激性气味气体的成分。
① 将气体通入品红溶液后,溶液褪色,加热,颜色恢复。说明该气体中一定含有______。
② 将气体通入澄清石灰水,溶液变浑浊,______(填“能”或 “不能”)证明气体中含有二氧化碳,其理由是______。
③ 刺激性气味气体产生的原因可用如下化学方程式表示,完成化学方程式:
C+2H2SO4(浓) ______。
13.某化学小组欲进行如下实验探究金属与浓硫酸反应。试回答下列问题:
(1)利用如图装置研究铜与浓硫酸反应,反应的化学方程式为___________。
(2)C装置的作用是___________。
(3)将上述实验中的铜改为铁,在常温下进行,无明显现象,其原因是___________。在加热条件下,实验的后一阶段可观察到倒立的漏斗边沿有气体冒出,该气体可能为___________。
三、填空题
14.用如图所示各装置设计一个实验,验证浓硫酸与木炭粉在加热条件下反应产生的各种产物。
(1)如按气流由左向右流向,连接上述装置的正确顺序是(填各接口字母):
A接G,H接C,D接_______,_______接C,D接B ;
(2)仪器乙、丙应有怎样的实验现象才表明已检验出CO2 乙中_____________________________,丙中_____________________________;
(3)丁中酸性KMnO4溶液的作用是___________________________________________;
(4)写出甲中反应的化学方程式_________________________________________ 。
(5)硫酸有很多的性质,将下列性质对应的字母填入各小题后面对应的括号中:
A.脱水性 B.酸性 C.强氧化性 D.吸水性
Ⅰ.在化学实验中,浓硫酸可做SO2、CO2等气体的干燥剂。 ( )
Ⅱ.Na2CO3与H2SO4反应,可生成Na2SO4和CO2。 ( )
Ⅲ.向滤纸上滴加浓H2SO4 ,滤纸变黑。 ( )
Ⅳ.在冷浓H2SO4中放入铁片没明显现象 ( )
参考答案:
1.D
【详解】A.硫酸可用于生产化肥,如硫酸铵,生产农药,如制备硫酸铜来配制波尔多液,生产炸药,如制备TNT作催化剂,A项正确;
B.硫黄或黄铁矿和氧气焙烧产生二氧化硫、二氧化硫和氧气反应产生三氧化硫、三氧化硫溶于水得硫酸,因此以硫黄或黄铁矿作为原料可用于制取硫酸,B项正确;
C.工业制备硫酸时,SO2转化为SO3的反应在400-500℃、作催化剂的条件下进行,C项正确;
D.三氧化硫极易溶于水,溶于水易形成酸雾,因此工业生产中用98.3%的浓硫酸来吸收SO3,D项错误;
答案选D。
2.D
【详解】常温下,铁片遇浓硫酸产生钝化现象,是因为浓硫酸使铁表面氧化为致密的保护膜,阻止浓硫酸继续与内层的铁进行反应,所以该现象说明了浓硫酸具有强氧化性。故合理选项是D。
3.D
【详解】A.浓硫酸具有脱水性,会使得苹果干瘪,A正确;
B.浓硫酸具有吸水性,胆矾晶体失去结晶水,表面有“白斑”生成,B正确;
C.浓硫酸具有吸水性,饱和硝酸钾溶液中水减小,有硝酸钾晶体析出,C正确;
D.浓硫酸具有脱水性、强氧化性,使得试纸脱水变黑色,D错误;
故选D。
4.A
【详解】浓硫酸具有吸水性,盛有浓硫酸的烧杯敞口放置一段时间后,会吸收周围的水蒸气,而使溶液质量增加,答案选A。
【点睛】注意浓硫酸吸水性与特殊性的区别,浓H2SO4夺取的水在原物质中以H2O分子形式存在时浓H2SO4表现吸水性,不以H2O分子形式而以H和O原子形式存在时,而浓H2SO4表现脱水性。利用浓硫酸的吸水性可以作干燥剂,但浓硫酸不能干燥碱性气体(例如氨气)和具有还原性的气体,例如H2S等。
5.B
【详解】A.浓硫酸可按水分子中氢氧原子数的比(2∶1)夺取被脱水物中的氢原子和氧原子,具有脱水性,而稀硫酸没有脱水性,A正确;
B.稀硫酸有氧化性,稀硫酸与活泼金属反应时,表现氧化性,发生还原反应生成H2,B错误;
C.浓硫酸和稀硫酸在与金属单质的反应中均能提供硫酸根离子,生成相应的硫酸盐,从而表现酸性,C正确;
D.铜属于不活泼金属,不能与稀硫酸反应,而铜与浓硫酸的反应需要在加热条件下才能进行,常温下不反应,D正确;
故选B。
6.A
【详解】可根据是BaSO4既不溶于水,也不溶于酸的性质进行鉴别。方法是取待测溶液,向其中加入稀盐酸,无现象,证明溶液中无Ag+、,然后再加入BaCl2溶液,若产生白色沉淀,就证明含有,故合理选项是A。
7.D
【详解】A.浓硫酸做干燥剂与其具有吸水性有关,故A不选;
B.浓硫酸使蔗糖变黑与其具有脱水性有关,故B不选;
C.浓硫酸能将胆矾从蓝色晶体变成白色粉末,与其吸水性有关,故C不选;
D.浓硫酸在加热条件下可与铜等不活泼金属反应是因为浓硫酸具有强氧化性,与吸水性和脱水性无关,故D选;
故选:D。
8.A
【详解】A.HCl中没有O元素,浓硫酸不可能从HCl中脱去H2O,A符合题意;
B.浓硫酸滴入浓盐酸中,会吸收浓盐酸中的水分,放出大量的热,B不符合题意;
C.浓盐酸具有挥发性,因此HCl能够逸出,与空气中的水蒸气结合,形成白雾,C不符合题意;
D.浓硫酸滴入浓盐酸中,放出大量的热,由于气体的溶解度随着温度的升高而降低,有利于HCl挥发,D不符合题意;
答案选A。
9.D
【详解】A.浓硫酸慢慢地注入水中产生大量的热,浓硫酸稀释放热,是物理变化,A错误;
B.含有水蒸气的氧气通过浓硫酸得到干燥的氧气,浓硫酸具有吸水性,是物理变化,B错误;
C.浓硫酸久置在空气中质量增加,浓硫酸吸收空气中的水蒸气,吸水性,是物理变化,C错误;
D.用小木棍蘸少量浓硫酸,小木棍变黑,浓硫酸具有脱水性,小木棍被腐蚀,是化学变化,具有腐蚀性,D正确;
故答案为:D。
10.D
【详解】A.浓硫酸和氢气不反应,可用于干燥氢气,故A错误;
B.浓硫酸具有强氧化性,可与铝、铁发生钝化反应,在铝、铁表面生成一层致密的氧化膜保护内部金属不被氧化,故浓硫酸可用铁铝容器存放,故B错误;
C.稀硫酸具有氧化性,可与活泼金属反应生成氢气,故C错误;
D.浓硫酸沸点高,难挥发,可用于制备易挥发性的酸如HCl,故D正确;
故选:D。
【点睛】浓硫酸具有强氧化性,可与铝、铁发生钝化反应;浓硫酸具有吸水性,可用于干燥剂;浓硫酸还具有脱水性,沸点高,难挥发,以此解答该题。
11.C
【分析】浓硫酸和碳在加热时生成SO2、CO2和水。先通过无水硫酸铜检验水的生成,无水硫酸铜会变蓝;再通过品红,检验二氧化硫,二氧化硫有漂白性,可以使品红溶液褪色;再通过溴水,二氧化硫可以和溴水反应以除去二氧化硫;再通过品红溶液,检验二氧化硫是否除尽,最后通入澄清石灰水检验二氧化碳。
【详解】由以上分析可知:
A.B装置用来检验产物中是否有水蒸气生成,正确;
B.C装置用来检验产物中是否有SO2生成,正确;
C.D装置中溴水和SO2反应:Br2+2H2O+SO2=H2SO4+2HBr,溴水褪色,体现了SO2的还原性,错误;
D.F装置用来检验产物中是否有CO2生成,正确;
故选C。
12. 脱水 SO2 不能 SO2也可使澄清的石灰水变浑浊 C+2H2SO4(浓) CO2↑+2SO2↑+2H2O
【分析】蔗糖的组成元素为碳、氢、氧,说明有碳单质生成,将适量的蔗糖(C12H22O11)放入烧杯,滴入几滴水,搅拌均匀,然后加入适量的浓硫酸,观察到固体变黑,证明浓硫酸的脱水作用,体积膨胀说明有气体生成,形成疏松多孔的海绵状黑色物质,同时闻到刺激性气味,碳单质与浓硫酸反应生成二氧化碳和有刺激性气味的二氧化硫,表现了浓硫酸的强氧化性。
【详解】(1)装置中使蔗糖变黑,是利用浓硫酸的脱水性把蔗糖中的氢元素和氧元素按2:1脱去,故答案为脱水;
(2)①有刺激性气味的气体通入品红溶液中,可以看到品红溶液褪色,加热,颜色恢复,说明该气体中一定含有二氧化硫,故答案为SO2;
②二氧化硫和二氧化碳通入澄清石灰水都会生成沉淀溶液变浑浊,澄清石灰水变浑浊不能证明气体中含有二氧化碳,故答案为不能;SO2也可使澄清的石灰水变浑浊;
③脱水过程中反应放热,所生产的碳和浓硫酸共热反应生成二氧化硫、二氧化碳和水,反应的化学方程式为C+2H2SO4(浓) CO2↑+2SO2↑+2H2O,故答案为C+2H2SO4(浓) CO2↑+2SO2↑+2H2O。
13. Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O 吸收多余的SO2,防止污染空气,防倒吸 在常温下,铁遇浓硫酸发生钝化 氢气(或H2)
【分析】本实验目的是探究金属与浓硫酸反应,实验原理是Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O,装置A制备SO2,装置B验证SO2的还原性,SO2对环境有污染,必须尾气处理,装置C的作用是吸收尾气中SO2,防止倒吸,即X溶液为NaOH溶液,据此分析;
【详解】(1)铜与浓硫酸反应需要加热,化学方程式为Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O;故答案为Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O;
(2)SO2是有毒气体,装置C中溶液可吸收多余的SO2,防止污染空气;SO2在水中溶解度较大,装置C中倒置漏斗可防倒吸;故答案为吸收多余的SO2,防止污染空气,防倒吸;
(3)常温下,铁遇浓硫酸会发生钝化,阻碍反应的进行;加热条件下,铁与浓硫酸的反应能持续进行,反应后期,浓硫酸变稀,铁与稀硫酸反应放出氢气;故答案为在常温下,铁遇浓硫酸发生钝化;氢气或H2。
14. F E 澄清石灰水变浑浊 品红不褪色 除去气体中的SO2 C+2H2SO4(浓)CO2↑+2SO2↑+2H2O D B A C
【分析】浓硫酸与木炭粉反应C+2H2SO4(浓)CO2↑+2SO2↑+2H2O,实验目的是验证反应产生的各种产物。水蒸气通常用无水硫酸铜检验,SO2用品红溶液检验,用澄清石灰水检验CO2。因为SO2也能使澄清石灰水变浑浊:Ca(OH)2+SO2=CaSO3↓+H2O,所以在检验CO2前必须除尽SO2,并实验证明SO2已经除尽,以此连接实验装置。浓硫酸具有强酸性,能够制取碳酸产生CO2,浓硫酸的强氧化性使铁钝化,浓硫酸的吸水性使浓硫酸可作某些气体的干燥剂,浓硫酸能够将纤维素中的氢、氧元素按水的比例脱下,生成水而使纤维素炭化。由此分析。
【详解】(1)本实验的目的是验证浓硫酸与木炭粉反应产生的水蒸气、二氧化硫、二氧化碳。应该先用无水硫酸铜验证水蒸气,再用品红溶液检验SO2。因为SO2也能使澄清石灰水变浑浊,在检验CO2前必须除去气体中的SO2。酸性KMnO4溶液能充分吸收SO2,再用品红溶液证明SO2已除尽,最后用澄清石灰水验证CO2。所以连接上述装置的正确顺序是A接G,H接C,D接F,E接C,D接B。
(2)只有丙中品红不褪色,才能确信SO2已经除尽;能够使澄清石灰水变浑浊的只有CO2,所以表明已检验出CO2的实验现象是乙中澄清石灰水变浑浊,丙中品红不褪色。
(3)KMnO4酸性溶液能够充分吸收SO2气体:2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+,所以丁中酸性KMnO4溶液的作用是除去气体中的SO2。
(4)加热条件下浓硫酸氧化木炭粉的化学方程式为C+2H2SO4(浓)CO2↑+2SO2↑+2H2O。
(5)I、浓硫酸具有吸收性,能干燥SO2、CO2等气体,答案选D;II、硫酸属于强酸,强酸制弱酸,答案选B。III、浓硫酸具有脱水性,滤纸的主要成分是纤维素[(C6H10O5)n],(C6H10O5)n6nC+5nH2O,答案选A。IV、浓硫酸具有强氧化性,常温下浓硫酸能使铁的表面形成一层致密氧化物薄膜阻止浓硫酸与铁继续反应(称为钝化),答案选C。
试卷第1页,共3页
试卷第1页,共3页
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
