第三章第二节第一课时-铁铝合金(17张ppt)
文档属性
| 名称 | 第三章第二节第一课时-铁铝合金(17张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-14 08:39:08 | ||
图片预览





文档简介
(共17张PPT)
第二节 金属材料
第一课时 铁合金 铝合金
第三章 铁 金属材料
【课堂引入】生活中的金属材料
金属材料包括纯金属和它们的合金。日常使用的金属材料,大多数属于合金。这是为什么呢?
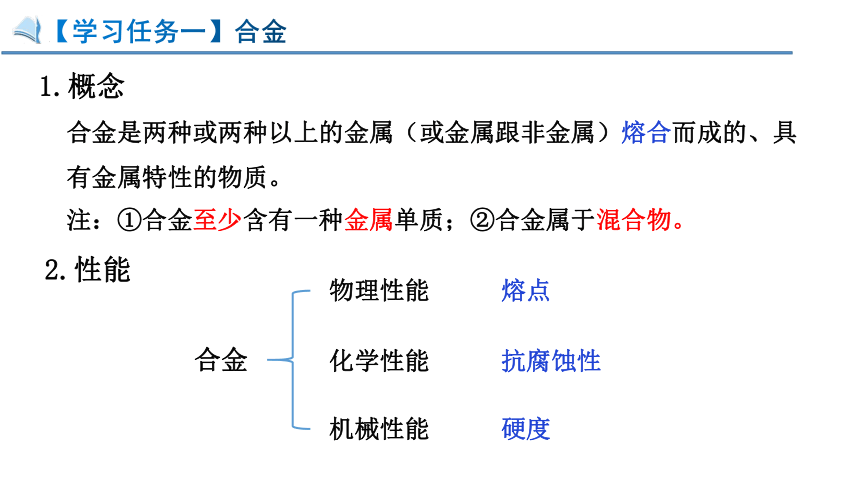
【学习任务一】合金
1.概念
合金是两种或两种以上的金属(或金属跟非金属)熔合而成的、具有金属特性的物质。
注:①合金至少含有一种金属单质;②合金属于混合物。
2.性能
物理性能
化学性能
机械性能
熔点
抗腐蚀性
硬度
合金
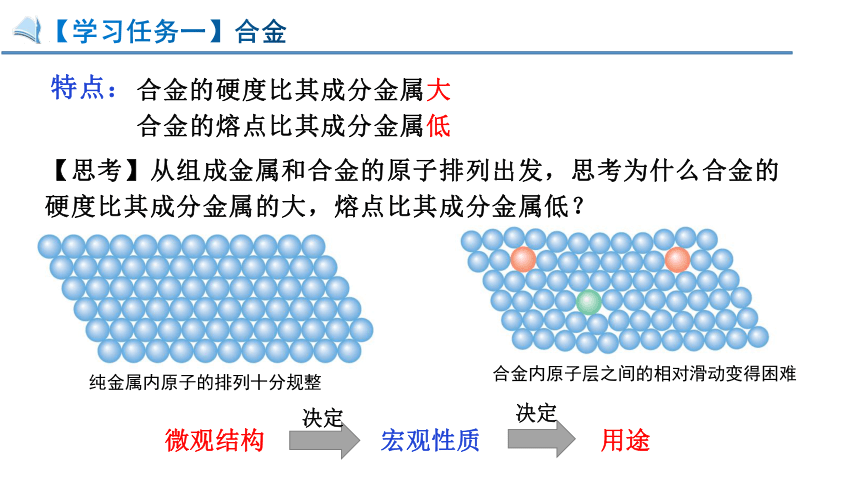
【学习任务一】合金
纯金属内原子的排列十分规整
合金内原子层之间的相对滑动变得困难
合金的熔点比其成分金属低
合金的硬度比其成分金属大
特点:
【思考】从组成金属和合金的原子排列出发,思考为什么合金的硬度比其成分金属的大,熔点比其成分金属低?
微观结构
宏观性质
决定
决定
用途
【学习任务二】铁合金
生铁
钢
铁合金
含碳量不同
含碳量在2%~4.3%之间
含碳量在0.03%~2%之间
硬度大、抗压、性脆、可以铸造成型,是制作机座、管道的重要材料
延展性和机械性能好,可以锻轧和铸造,广泛用于制造机械和交通工具
用量最大、用途最广的合金
【学习任务二】铁合金
碳素钢
含碳量不同
高碳钢
>0.6%
中碳钢
0.3%~0.6%
低碳钢
<0.3%
韧性好、焊接性好、强度低,用于制造钢板、钢丝和钢管等
强度高、韧性及加工性好,用于 制造钢轨、车轮和建材等
硬而脆、热处理后弹性好,用于 制造器械、弹簧和刀具等
合金钢
钢
按其化学成分
是在碳素钢里适量地加入一种或几种合金元素,使钢的组织结构发生变化,从而使钢具有各种特殊性能,如强度、硬度大,可塑性、韧性好,耐磨, 耐腐蚀等。
(特种钢)
【学习任务二】铁合金
最常见一种的合金钢
不锈钢
主要是铬 (Cr)和镍 (Ni )
合金元素:
性能:
在大气中比较稳定,不容易生锈,具有 很强的抗腐蚀能力。
用途:
生活中常见的医疗器材、厨房用具和餐具等,很多都是用不锈钢制造的;有些地铁列车的车体材质也是不锈钢。
【学习任务二】铁合金
超级钢
2017年8月24日,我国宣布已经成功完成某种性能优异的超级钢的研制。我国研制的这种超级钢具有优异的强度和延展性的结合。这种超级钢中含Mn 10%、C 0.47%、Al 2%、V 0.7%,这种合金配方低廉,强度很大。
可运用于汽车、航空和航天等领域的轻量化发展,不仅可以节约材料,还可以降低能源消耗和减少环境污染等。
钢的含碳量越低,韧性越好,硬度越低;含碳量越高,韧性越差,硬度越高。
(1)合金一定是不同金属熔合而成的具有金属特性的化合物( )
(2)生铁的熔点比纯铁低,但机械强度和硬度比纯铁高( )
(3)铁、铬、镍熔合成不锈钢是化学变化( )
(4)生铁中的铁与纯铁的化学性质不同( )
(5)地震灾区重建要使用大量钢材,钢材是合金( )
×
√
1.判断正误
√
×
×
学习评价1
2.根据下表数据判断,能否制得Cu-Na合金
金属 Na K Al Cu Fe
熔点/℃ 97.5 63.6 660 1083 1535
沸点/℃ 883 774 2467 2567 2750
不能。
【学习任务三】铝和铝合金
铝是地壳中含量最多的金属元素
铝原子结构示意图:
铝是一种活泼金属,在常温下就能与空气中的氧气发生反应,表面生产一层致密的氧化铝薄膜,起到保护内部金属的作用。
4Al+3O2 ===2Al2O3
【学习任务三】铝和铝合金
【实验3-4】在一支试管中加入5mL盐酸,再向试管中放入一小块铝片。
观察现象。过一段时间后,将点燃的木条放在试管口,你观察到什么现象?
实验 现象
实验 结论
化学 方程式
离子 方程式
铝片逐渐溶解,有无色气泡冒出;
将点燃的木条放在试管口有爆鸣声
Al2O3+6HCl==2AlCl3+3H2O、
2Al+6HCl==2AlCl3+3H2↑
Al2O3+6H+==2Al3++3H2O、
2Al+6H+==2Al3++3H2↑
铝表面的保护膜和铝均能与盐酸发生反应
实验探究:Al、Al2O3和盐酸的反应
【学习任务三】铝和铝合金
【实验3-5】在两支试管中加入少量NaOH溶液,然后向其中一支试管中放入一小块铝片,向另一支试管中放入用砂纸仔细打磨过(除去表面的氧化膜)的一小块铝片,观察现象。过一段时间后,将点燃的木条放在试管口,你观察到什么现象?
实验 现象
实验 结论
化学 方程式
离子 方程式
试管①中一开始无气泡产生,一段时间后,铝片溶解,有气泡冒出。
试管②中铝片溶解,立即产生气泡,将点燃的木条放在试管口,都有爆鸣声。
实验探究:Al、Al2O3和NaOH溶液反应
Al2O3+2NaOH==2NaAlO2+H2O、
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
Al2O3+2OH- =2AlO2-+H2O
2Al+2OH-+2H2O=2AlO2- +3H2↑
偏铝酸钠
铝表面的保护膜和铝均能与NaOH溶液发生反应
【学习任务三】铝和铝合金
【思考与交流】对比实验3-4、3-5,你对铝和氧化铝的性质有什么认识?如何除去铝片表面的氧化膜?
Al和 A12O3均能与酸、碱反应,可以采取酸溶或碱浸的方法除去铝表面的氧化膜。
既能与酸反应生成盐和水,又能与碱反应生成盐和水的氧化物,例如Al2O3。
【新概念】两性氧化物
【应用】铝制餐具不宜用来蒸煮或长时间存放酸性或碱性食物。
【学习任务三】铝和铝合金
【知识归纳】
1.铝的化学性质
还原性
(1)易与O2反应生成Al2O3
4Al+3O2 ===2Al2O3
(2)与酸的反应
铝与稀盐酸、稀硫酸发生置换反应:
2Al+6H+==2Al3++3H2↑
(3)与氢氧化钠溶液反应:
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
【学习任务三】铝和铝合金
【知识归纳】
2.铝的氧化物(Al2O3)
两性氧化物
(1)Al2O3的物理性质
②与碱的反应:
Al2O3+2OH- =2AlO2-+H2O
(2)Al2O3的两性
Al2O3难溶于水,熔点很高,可做耐火材料
耐火坩埚
①与酸的反应:
Al2O3+6H+==2Al3++3H2O
【学习任务三】铝和铝合金
铝合金
例如:硬铝(含Cu 4%、Mg 0.5%、Mn 0.5%、Si 0.7%)
密度小、强度高、具有较强的抗腐蚀能力,是制造飞机和宇宙飞船的理想材料。
纯铝的硬度和强度较小,不适合制造机器零件。 向铝中加人少量的合金元素,如 Cu、 Mg、 Si、 Mn、 Zn及稀土元素等,可制成铝合金,并成为目前用途广泛的合金之一。
1.下列关于铝的说法中,正确的是 ( )。
A.铝的化学性质不活泼 B.铝不与酸、碱反应
C.常温下铝不与氧气反应 D.铝表面容易生成一层致密的氧化铝保护膜
学习评价2
C
2.向一个铝质易拉罐中充满CO2,然后往罐中注人足量的浓NaOH溶液,立即用胶布封严罐口。一会儿听到罐内发出 “咔、咔”的响声,且易拉罐变瘪;再过一会儿易拉罐又鼓起来恢复原样。请完成下列空白。
(1)易拉罐变瘪的原因________________________________________________ ,反应的离子方程式为______________________________。
(2)易拉罐又鼓原因是___________________________________________________,反应的离子方程式为_______________________________________。
CO2和NaOH溶液反应,导致易拉罐内压强变小
CO2+2OH- = CO32-+H2O
2Al+2OH-+2H2O===2AlO2-+3H2↑
Al和NaOH溶液反应产生H2,导致易拉罐内压强又变大
第二节 金属材料
第一课时 铁合金 铝合金
第三章 铁 金属材料
【课堂引入】生活中的金属材料
金属材料包括纯金属和它们的合金。日常使用的金属材料,大多数属于合金。这是为什么呢?
【学习任务一】合金
1.概念
合金是两种或两种以上的金属(或金属跟非金属)熔合而成的、具有金属特性的物质。
注:①合金至少含有一种金属单质;②合金属于混合物。
2.性能
物理性能
化学性能
机械性能
熔点
抗腐蚀性
硬度
合金
【学习任务一】合金
纯金属内原子的排列十分规整
合金内原子层之间的相对滑动变得困难
合金的熔点比其成分金属低
合金的硬度比其成分金属大
特点:
【思考】从组成金属和合金的原子排列出发,思考为什么合金的硬度比其成分金属的大,熔点比其成分金属低?
微观结构
宏观性质
决定
决定
用途
【学习任务二】铁合金
生铁
钢
铁合金
含碳量不同
含碳量在2%~4.3%之间
含碳量在0.03%~2%之间
硬度大、抗压、性脆、可以铸造成型,是制作机座、管道的重要材料
延展性和机械性能好,可以锻轧和铸造,广泛用于制造机械和交通工具
用量最大、用途最广的合金
【学习任务二】铁合金
碳素钢
含碳量不同
高碳钢
>0.6%
中碳钢
0.3%~0.6%
低碳钢
<0.3%
韧性好、焊接性好、强度低,用于制造钢板、钢丝和钢管等
强度高、韧性及加工性好,用于 制造钢轨、车轮和建材等
硬而脆、热处理后弹性好,用于 制造器械、弹簧和刀具等
合金钢
钢
按其化学成分
是在碳素钢里适量地加入一种或几种合金元素,使钢的组织结构发生变化,从而使钢具有各种特殊性能,如强度、硬度大,可塑性、韧性好,耐磨, 耐腐蚀等。
(特种钢)
【学习任务二】铁合金
最常见一种的合金钢
不锈钢
主要是铬 (Cr)和镍 (Ni )
合金元素:
性能:
在大气中比较稳定,不容易生锈,具有 很强的抗腐蚀能力。
用途:
生活中常见的医疗器材、厨房用具和餐具等,很多都是用不锈钢制造的;有些地铁列车的车体材质也是不锈钢。
【学习任务二】铁合金
超级钢
2017年8月24日,我国宣布已经成功完成某种性能优异的超级钢的研制。我国研制的这种超级钢具有优异的强度和延展性的结合。这种超级钢中含Mn 10%、C 0.47%、Al 2%、V 0.7%,这种合金配方低廉,强度很大。
可运用于汽车、航空和航天等领域的轻量化发展,不仅可以节约材料,还可以降低能源消耗和减少环境污染等。
钢的含碳量越低,韧性越好,硬度越低;含碳量越高,韧性越差,硬度越高。
(1)合金一定是不同金属熔合而成的具有金属特性的化合物( )
(2)生铁的熔点比纯铁低,但机械强度和硬度比纯铁高( )
(3)铁、铬、镍熔合成不锈钢是化学变化( )
(4)生铁中的铁与纯铁的化学性质不同( )
(5)地震灾区重建要使用大量钢材,钢材是合金( )
×
√
1.判断正误
√
×
×
学习评价1
2.根据下表数据判断,能否制得Cu-Na合金
金属 Na K Al Cu Fe
熔点/℃ 97.5 63.6 660 1083 1535
沸点/℃ 883 774 2467 2567 2750
不能。
【学习任务三】铝和铝合金
铝是地壳中含量最多的金属元素
铝原子结构示意图:
铝是一种活泼金属,在常温下就能与空气中的氧气发生反应,表面生产一层致密的氧化铝薄膜,起到保护内部金属的作用。
4Al+3O2 ===2Al2O3
【学习任务三】铝和铝合金
【实验3-4】在一支试管中加入5mL盐酸,再向试管中放入一小块铝片。
观察现象。过一段时间后,将点燃的木条放在试管口,你观察到什么现象?
实验 现象
实验 结论
化学 方程式
离子 方程式
铝片逐渐溶解,有无色气泡冒出;
将点燃的木条放在试管口有爆鸣声
Al2O3+6HCl==2AlCl3+3H2O、
2Al+6HCl==2AlCl3+3H2↑
Al2O3+6H+==2Al3++3H2O、
2Al+6H+==2Al3++3H2↑
铝表面的保护膜和铝均能与盐酸发生反应
实验探究:Al、Al2O3和盐酸的反应
【学习任务三】铝和铝合金
【实验3-5】在两支试管中加入少量NaOH溶液,然后向其中一支试管中放入一小块铝片,向另一支试管中放入用砂纸仔细打磨过(除去表面的氧化膜)的一小块铝片,观察现象。过一段时间后,将点燃的木条放在试管口,你观察到什么现象?
实验 现象
实验 结论
化学 方程式
离子 方程式
试管①中一开始无气泡产生,一段时间后,铝片溶解,有气泡冒出。
试管②中铝片溶解,立即产生气泡,将点燃的木条放在试管口,都有爆鸣声。
实验探究:Al、Al2O3和NaOH溶液反应
Al2O3+2NaOH==2NaAlO2+H2O、
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
Al2O3+2OH- =2AlO2-+H2O
2Al+2OH-+2H2O=2AlO2- +3H2↑
偏铝酸钠
铝表面的保护膜和铝均能与NaOH溶液发生反应
【学习任务三】铝和铝合金
【思考与交流】对比实验3-4、3-5,你对铝和氧化铝的性质有什么认识?如何除去铝片表面的氧化膜?
Al和 A12O3均能与酸、碱反应,可以采取酸溶或碱浸的方法除去铝表面的氧化膜。
既能与酸反应生成盐和水,又能与碱反应生成盐和水的氧化物,例如Al2O3。
【新概念】两性氧化物
【应用】铝制餐具不宜用来蒸煮或长时间存放酸性或碱性食物。
【学习任务三】铝和铝合金
【知识归纳】
1.铝的化学性质
还原性
(1)易与O2反应生成Al2O3
4Al+3O2 ===2Al2O3
(2)与酸的反应
铝与稀盐酸、稀硫酸发生置换反应:
2Al+6H+==2Al3++3H2↑
(3)与氢氧化钠溶液反应:
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
【学习任务三】铝和铝合金
【知识归纳】
2.铝的氧化物(Al2O3)
两性氧化物
(1)Al2O3的物理性质
②与碱的反应:
Al2O3+2OH- =2AlO2-+H2O
(2)Al2O3的两性
Al2O3难溶于水,熔点很高,可做耐火材料
耐火坩埚
①与酸的反应:
Al2O3+6H+==2Al3++3H2O
【学习任务三】铝和铝合金
铝合金
例如:硬铝(含Cu 4%、Mg 0.5%、Mn 0.5%、Si 0.7%)
密度小、强度高、具有较强的抗腐蚀能力,是制造飞机和宇宙飞船的理想材料。
纯铝的硬度和强度较小,不适合制造机器零件。 向铝中加人少量的合金元素,如 Cu、 Mg、 Si、 Mn、 Zn及稀土元素等,可制成铝合金,并成为目前用途广泛的合金之一。
1.下列关于铝的说法中,正确的是 ( )。
A.铝的化学性质不活泼 B.铝不与酸、碱反应
C.常温下铝不与氧气反应 D.铝表面容易生成一层致密的氧化铝保护膜
学习评价2
C
2.向一个铝质易拉罐中充满CO2,然后往罐中注人足量的浓NaOH溶液,立即用胶布封严罐口。一会儿听到罐内发出 “咔、咔”的响声,且易拉罐变瘪;再过一会儿易拉罐又鼓起来恢复原样。请完成下列空白。
(1)易拉罐变瘪的原因________________________________________________ ,反应的离子方程式为______________________________。
(2)易拉罐又鼓原因是___________________________________________________,反应的离子方程式为_______________________________________。
CO2和NaOH溶液反应,导致易拉罐内压强变小
CO2+2OH- = CO32-+H2O
2Al+2OH-+2H2O===2AlO2-+3H2↑
Al和NaOH溶液反应产生H2,导致易拉罐内压强又变大
