专题4 第二单元 第1课时 醛的性质和应用 学案(含答案)
文档属性
| 名称 | 专题4 第二单元 第1课时 醛的性质和应用 学案(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 933.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-13 22:57:56 | ||
图片预览




文档简介
第二单元 醛 羧酸
第1课时 醛的性质和应用
[核心素养发展目标] 1.通过醛基中原子成键情况的分析,了解醛类的结构特点,理解乙醛的化学性质与醛基的关系,学会醛基的检验方法。2.了解甲醛对环境和健康的影响,关注有机化合物安全使用的问题。
一、醛的结构与常见的醛
1.认识甲醛、乙醛的结构特点
(1)根据甲醛和乙醛的1H核磁共振谱图,尝试写出甲醛、乙醛分子的结构式。
甲醛:____________________;
乙醛:____________________。
(2)分析结构:甲醛和乙醛分子中都存在________。醛基中包含________,羰基中的碳原子与氧原子之间通过________连接在一起,羰基再与一个氢原子相连则构成醛基。羰基以及与羰基直接相连的原子处于____________上。例如,甲醛分子中的4个原子就处于__________上。
2.醛的概念与结构
(1)概念:醛是由烃基(或氢原子)与______相连构成的化合物。
(2)结构特点:醛类官能团的结构简式是________,饱和一元醛的通式为______________________或__________________________________________________。
3.常见的醛
(1)甲醛:俗称蚁醛,是结构最简单的醛,结构简式为________。通常状况下是一种无色有________气味的气体,沸点:-21 ℃,易溶于水。35%~40%的甲醛水溶液俗称“____________”,可用于农作物种子的________及动物标本的________。
(2)乙醛:分子式为________,乙醛的结构简式为________,是一种无色有________气味的液体,密度比水小,沸点是20.8 ℃,易挥发,易燃烧,能跟水、乙醇等互溶。
(1)乙醛分子中所有原子处于同一平面上( )
(2)福尔马林是甲醛的水溶液,可用于浸制生物标本,具有防腐性( )
(3)碳原子数相同的醛和醚互为同分异构体( )
(4)甲醛的1H核磁共振谱图中只有一组峰( )
1.甲醛为什么可用来消毒、杀菌?装修房屋后,房中存在一定甲醛气体,如何处置?
________________________________________________________________________
________________________________________________________________________
2.乙醛分子中共面原子最多有几个?
________________________________________________________________________
1.下列有机物不属于醛类物质的是( )
A.
B.
C.CH2==CHCHO
D.
2.已知甲醛(HCHO) 分子中的4个原子是共平面的,下列分子中所有原子不可能同时存在于同一个平面上的是( )
A.
苯乙烯
B.
苯甲酸
C.
苯甲醛
D.
苯乙酮
二、醛的化学性质——以乙醛为例
1.氧化反应
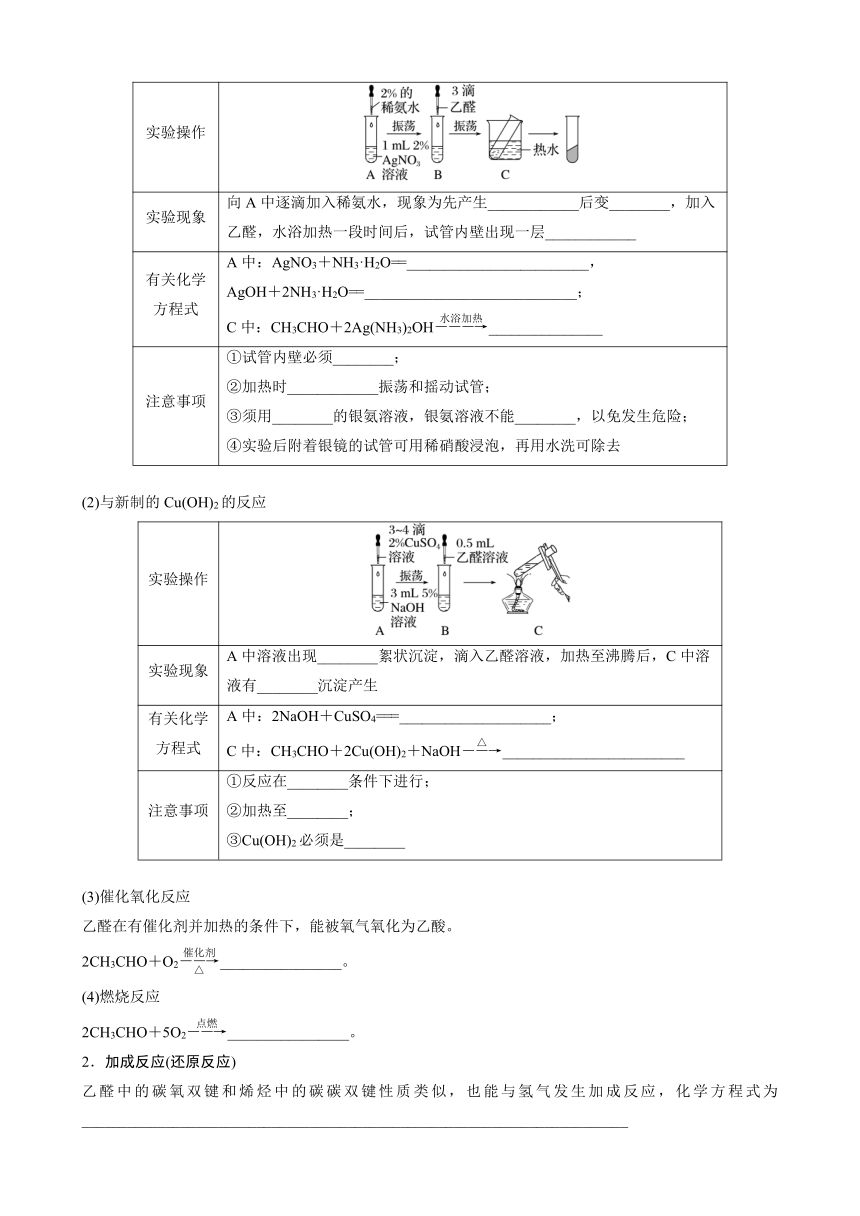
(1)银镜反应
实验操作
实验现象 向A中逐滴加入稀氨水,现象为先产生____________后变________,加入乙醛,水浴加热一段时间后,试管内壁出现一层____________
有关化学方程式 A中:AgNO3+NH3·H2O==________________________, AgOH+2NH3·H2O==____________________________; C中:CH3CHO+2Ag(NH3)2OH_______________
注意事项 ①试管内壁必须________; ②加热时____________振荡和摇动试管; ③须用________的银氨溶液,银氨溶液不能________,以免发生危险; ④实验后附着银镜的试管可用稀硝酸浸泡,再用水洗可除去
(2)与新制的Cu(OH)2的反应
实验操作
实验现象 A中溶液出现________絮状沉淀,滴入乙醛溶液,加热至沸腾后,C中溶液有________沉淀产生
有关化学方程式 A中:2NaOH+CuSO4===____________________; C中:CH3CHO+2Cu(OH)2+NaOH________________________
注意事项 ①反应在________条件下进行; ②加热至________; ③Cu(OH)2必须是________
(3)催化氧化反应
乙醛在有催化剂并加热的条件下,能被氧气氧化为乙酸。
2CH3CHO+O2________________。
(4)燃烧反应
2CH3CHO+5O2________________。
2.加成反应(还原反应)
乙醛中的碳氧双键和烯烃中的碳碳双键性质类似,也能与氢气发生加成反应,化学方程式为________________________________________________________________________
________________________________________________________________________。
3.醛的化学通性
(1)醛可被氧化为羧酸,也可被氢气还原为醇,因此醛既有________性,又有________性,其氧化、还原的关系为R-CH2OH。
(2)醛的加成反应(试剂:H2、HCN)
①RCHO+H2____________________________________________________;
②RCHO+HCN―→_______________________________________________________。
(3)醛类的两个特征反应
①+2Ag(NH3)2OH______________________________________________;
②+2Cu(OH)2+NaOH__________________________________________。
(1)乙醛能使酸性高锰酸钾溶液褪色( )
(2)乙醛和乙酸的混合液可以用分液漏斗分离( )
(3)用新制银氨溶液可区分甲酸甲酯和乙醛( )
(4)银氨溶液的配制,将硝酸银溶液滴加到稀氨水中至生成的白色沉淀恰好完全溶解为止( )
(5)乙醛加氢得到乙醇的反应是加成反应,也称为还原反应( )
1.乙醇、乙醛和乙酸三者转化关系如图所示,请结合具体反应和三者的分子结构、官能团的变化情况,谈谈有机化学反应中的氧化反应和还原反应的特点。
乙醇乙醛乙酸
________________________________________________________________________
________________________________________________________________________
2.在做乙醛和银氨溶液的银镜反应实验时,为什么要控制在碱性条件?
________________________________________________________________________
3.某同学用2 mL 1 mol·L-1的CuSO4溶液与4 L 0.5 mol·L-1的NaOH溶液混合,然后加入0.5 mL 4%的CH3CHO溶液,加热后未见红色沉淀生成,实验失败的原因是什么?
________________________________________________________________________
4.能发生银镜反应或能与新制的Cu(OH)2反应的物质一定是醛吗?
________________________________________________________________________
________________________________________________________________________
1.一个学生做乙醛的还原性实验时,取1 mol·L-1 CuSO4溶液和0.5 mol·L-1NaOH各1 mL,在一支洁净的试管内混合后,向其中又加入0.5 mL 40%的乙醛,加热至沸腾,结果无红色沉淀出现,实验失败的原因可能是( )
A.未充分加热
B.加入乙醛太少
C.加入NaOH溶液的量不足
D.加入CuSO4溶液的量不足
2.某醛的结构简式为(CH3)2C==CHCH2CH2CHO,通过实验方法检验其中的官能团。
(1)实验操作中,应先检验哪种官能团?______,原因是________________________。
(2)检验分子中醛基的方法是________________________________________________
________________________________________________________________________,
化学方程式为____________________________________________________________
________________________________________________________________________。
(3)检验分子中碳碳双键的方法是____________________________________________
________________________________________________________________________。
使溴水、酸性KMnO4溶液褪色的有机物及褪色原因的比较
官能团 试剂 碳碳双键 碳碳三键 苯的同 系物 醇 酚 醛
能否褪色 原因 能否褪色 原因 能否褪色 原因 能否褪色 原因 能否褪色 原因 能否褪色 原因
溴水 √ 加成反应 √ 加成反应 × - × - √ 取代反应 √ 取代反应
酸性KMnO4溶液 √ 氧化反应 √ 氧化反应 √ 氧化反应 √ 氧化反应 √ 氧化反应 √ 氧化反应
注:“√”代表能,“×”代表不能。
三、甲醛、酮的结构与性质
1.甲醛的结构与性质
(1)结构特点
甲醛的分子式为CH2O,其分子可以看成含两个醛基,如图所示:
(2)氧化反应的特殊性
甲醛发生氧化反应时,可理解为
所以,1个甲醛分子中相当于有2个 —CHO,当与足量的银氨溶液或新制的Cu(OH)2悬浊液反应时,可存在如下量的关系:
1 mol HCHO~4 mol Ag
1 mol HCHO~4 mol Cu(OH)2~2 mol Cu2O
(3)甲醛与苯酚反应生成酚醛树脂:
nHCHO+n____________________________________________________。
①反应机理:在浓盐酸(或浓氨水)的催化下,甲醛分子中的________与苯酚分子中羟基____________上的氢原子结合生成水,其余部分形成________________。像这种由有机化合物分子间脱去____________获得________化合物的反应,称为______________________。
②制取酚醛树脂
酸催化 碱催化
实验操作
a.待混合物接近沸腾时,取出试管并用玻璃棒搅拌反应物,观察现象; b.试管冷却至室温后,向试管中加入适量乙醇,观察现象; c.再把试管放在热水浴中加热,观察现象
实验现象 混合溶液变浑浊,有黏稠的粉红色物质生成;加入乙醇,________;再加热,黏稠物质________ 混合溶液变浑浊,有黏稠的乳黄色物质生成;加入乙醇,________;再加热,黏稠物质________溶解
结论 在酸催化条件下,生成________酚醛树脂,具有________性 在碱催化条件下,生成______酚醛树脂,具有________性
注意事项 ①加热方法:沸水浴加热,__________温度计; ②因为反应物易挥发,所以要使用________; ③此实验需在通风良好的条件下进行,树脂及残液需统一回收处理
2.酮的代表物
(1)酮的概念和结构特点
(2)丙酮
①丙酮是最简单的酮类化合物,结构简式为____________,其1H核磁共振谱图有____组特征峰,其球棍模型为。
②常温下丙酮是无色透明液体,易______,能与水、乙醇等混溶,是常用的有机溶剂,主要用于制备重要化工原料双酚A和制备有机玻璃。
(3)环己酮(C6H10O)也是一种常见的酮,环己酮的键线式为________________,常作为生产合成纤维、合成树脂、合成橡胶、石蜡、虫胶、油漆、染料和制药中间体的溶剂,还可用于制备己二酸和己内酰胺,它们都是生产聚酰胺纤维的重要原料。
3.酮的化学性质
不能被________________________等弱氧化剂氧化,但能催化加氢生成______。
如反应的化学方程式:
+H2_________________________________________________。
+H2____________________________________________________。
(1)1 mol HCHO发生银镜反应最多生成2 mol Ag( )
(2)酮类物质能与氢气发生加成反应,不能被银氨溶液氧化,所以只能发生还原反应,不能发生氧化反应( )
(3)丙酮是结构最简单的酮,也可以发生银镜反应和加氢还原反应( )
(4)丙酮难溶于水,但丙酮是常用的有机溶剂( )
(5)环己酮的1H核磁共振谱图只有一组特征峰( )
请写出HCHO与银氨溶液、新制的Cu(OH)2反应的化学方程式。
________________________________________________________________________
________________________________________________________________________
1.香料茉莉酮是一种人工合成的有机化合物,其结构简式为,下列关于茉莉酮的说法正确的是( )
A.该有机物的化学式是C11H16O
B.1 mol该有机物与H2充分反应,消耗4 mol H2
C.该有机物属于不饱和酮类物质,能发生银镜反应
D.该有机物能发生加成反应,但不能发生氧化反应
2.有机玻璃是聚甲基丙烯酸甲酯,其合成路线如下:
D
A B C
E
(1)A的名称为________。
(2)C中官能团的名称为________________。
(3)D的结构简式为________________________________________________。
(4)A→B、D→E的反应类型分别为__________、____________。
第二单元 醛 羧酸
第1课时 醛的性质和应用
一、
1.(1) (2)醛基 羰基 双键 同一平面 同一平面
2.(1)醛基 (2)—CHO CnH2nO(n≥1) CnH2n+1CHO(n≥0)
3.(1)HCHO 刺激性 福尔马林 消毒 保存 (2)C2H4O CH3CHO 刺激性
正误判断
(1)× (2)√ (3)× (4)√
深度思考
1.细菌、病毒都是蛋白质,分子中都含—NH2。甲醛能与—NH2发生反应使蛋白质分子经过化学变化生成新的分子而变性。蛋白质变性后失去了生理活性,即死亡。这就是甲醛能消毒、杀菌的原因。装修房屋后,在一定时间内打开门窗,进行通风,使甲醛跑掉,否则影响人体健康。
2.5
应用体验
1.D
2.D
二、
1.(1)白色沉淀 澄清 光亮的银镜 AgOH↓(白色)+NH4NO3 Ag(NH3)2OH+2H2O 2Ag↓+CH3COONH4+3NH3+H2O 洁净 不可 新配制 久置
(2)蓝色 红色 Cu(OH)2↓+Na2SO4 CH3COONa+Cu2O↓+3H2O 碱性 沸腾 新制的 (3)2CH3COOH
(4)4CO2+4H2O
2.CH3CHO+H2CH3CH2OH
3.(1)还原 氧化 (2)①RCH2OH ②
(3)①2Ag↓++3NH3+H2O
②Cu2O↓++3H2O
正误判断
(1)√ (2)× (3)× (4)× (5)√
深度思考
1.乙醇被氧化为乙醛时醇羟基被氧化为—CHO,从组成上看减少了2个氢原子,乙醛被氧化成乙酸时,—CHO变成—COOH,从组成上看增加了氧原子,乙醛被还原为乙醇时—CHO变成—CH2OH,从组成上看增加了氢原子。因此,有机化学反应若从氢、氧原子数目变化角度来看,失去氢原子、增加氧原子的反应称为氧化反应。增加氢原子、失去氧原子的反应称为还原反应。
2.在酸性或弱酸条件下,H+与NH3反应生成NH,Ag(NH3)不能存在,不能发生银镜反应。
3.乙醛与新制的Cu(OH)2的反应必须在碱性条件下进行,实验失败的原因是NaOH的量偏少。
4.不一定。只要有机物分子中含有—CHO,就能发生银镜反应,或与新制的Cu(OH)2反应。含有醛基的物质可能是醛、葡萄糖或其他含有醛基的化合物。故可用与银氨溶液发生银镜反应或与新制的Cu(OH)2反应生成红色沉淀来检验醛基的存在。
应用体验
1.C [醛与新制的Cu(OH)2反应,必须在强碱性条件下进行。该学生配制Cu(OH)2时CuSO4有余,NaOH溶液的量不足,则不能发生反应生成红色沉淀。]
2.(1)醛基 检验碳碳双键要使用溴水或酸性KMnO4溶液,而醛基也能使溴水或酸性KMnO4溶液褪色
(2)在洁净的试管中加入新制银氨溶液和少量试样后,水浴加热有银镜生成(或在洁净的试管中加入少量试样和新制的氢氧化铜悬浊液,加热煮沸,有红色沉淀生成)
(CH3)2C==CHCH2CH2CHO+2Ag(NH3)2OH2Ag↓+3NH3+(CH3)2C==CHCH2CH2COONH4+H2O[或(CH3)2C==CHCH2CH2CHO+2Cu(OH)2+NaOH(CH3)2C==CHCH2CH2COONa+Cu2O↓+3H2O]
(3)加入过量银氨溶液氧化醛基后,调节溶液至酸性再加入溴水(或酸性KMnO4溶液),看是否褪色
三、
1.(3)+(n-1)H2O ①氧原子 邻位或对位 高分子化合物 小分子 高分子 缩聚反应
②不溶解 溶解 不溶解 仍不 线型 热塑 体型 热固 不需要 冷凝管
2.(2)① 一 ②挥发 (3)
3.银氨溶液、新制的氢氧化铜 醇
正误判断
(1)× (2)× (3)× (4)× (5)×
深度思考
HCHO+4Ag(NH3)2OH(NH4)2CO3+4Ag↓+6NH3+2H2O、
HCHO+4Cu(OH)2+2NaOHNa2CO3+2Cu2O↓+6H2O。
应用体验
1.A [该有机物中含有羰基和碳碳双键,能发生加成反应,也能被酸性KMnO4溶液等强氧化剂氧化,但不能发生银镜反应,1 mol该有机物与H2充分反应消耗3 mol H2。]
2.(1)丙酮 (2)羟基、羧基 (3) (4)加成反应 加聚反应
第1课时 醛的性质和应用
[核心素养发展目标] 1.通过醛基中原子成键情况的分析,了解醛类的结构特点,理解乙醛的化学性质与醛基的关系,学会醛基的检验方法。2.了解甲醛对环境和健康的影响,关注有机化合物安全使用的问题。
一、醛的结构与常见的醛
1.认识甲醛、乙醛的结构特点
(1)根据甲醛和乙醛的1H核磁共振谱图,尝试写出甲醛、乙醛分子的结构式。
甲醛:____________________;
乙醛:____________________。
(2)分析结构:甲醛和乙醛分子中都存在________。醛基中包含________,羰基中的碳原子与氧原子之间通过________连接在一起,羰基再与一个氢原子相连则构成醛基。羰基以及与羰基直接相连的原子处于____________上。例如,甲醛分子中的4个原子就处于__________上。
2.醛的概念与结构
(1)概念:醛是由烃基(或氢原子)与______相连构成的化合物。
(2)结构特点:醛类官能团的结构简式是________,饱和一元醛的通式为______________________或__________________________________________________。
3.常见的醛
(1)甲醛:俗称蚁醛,是结构最简单的醛,结构简式为________。通常状况下是一种无色有________气味的气体,沸点:-21 ℃,易溶于水。35%~40%的甲醛水溶液俗称“____________”,可用于农作物种子的________及动物标本的________。
(2)乙醛:分子式为________,乙醛的结构简式为________,是一种无色有________气味的液体,密度比水小,沸点是20.8 ℃,易挥发,易燃烧,能跟水、乙醇等互溶。
(1)乙醛分子中所有原子处于同一平面上( )
(2)福尔马林是甲醛的水溶液,可用于浸制生物标本,具有防腐性( )
(3)碳原子数相同的醛和醚互为同分异构体( )
(4)甲醛的1H核磁共振谱图中只有一组峰( )
1.甲醛为什么可用来消毒、杀菌?装修房屋后,房中存在一定甲醛气体,如何处置?
________________________________________________________________________
________________________________________________________________________
2.乙醛分子中共面原子最多有几个?
________________________________________________________________________
1.下列有机物不属于醛类物质的是( )
A.
B.
C.CH2==CHCHO
D.
2.已知甲醛(HCHO) 分子中的4个原子是共平面的,下列分子中所有原子不可能同时存在于同一个平面上的是( )
A.
苯乙烯
B.
苯甲酸
C.
苯甲醛
D.
苯乙酮
二、醛的化学性质——以乙醛为例
1.氧化反应
(1)银镜反应
实验操作
实验现象 向A中逐滴加入稀氨水,现象为先产生____________后变________,加入乙醛,水浴加热一段时间后,试管内壁出现一层____________
有关化学方程式 A中:AgNO3+NH3·H2O==________________________, AgOH+2NH3·H2O==____________________________; C中:CH3CHO+2Ag(NH3)2OH_______________
注意事项 ①试管内壁必须________; ②加热时____________振荡和摇动试管; ③须用________的银氨溶液,银氨溶液不能________,以免发生危险; ④实验后附着银镜的试管可用稀硝酸浸泡,再用水洗可除去
(2)与新制的Cu(OH)2的反应
实验操作
实验现象 A中溶液出现________絮状沉淀,滴入乙醛溶液,加热至沸腾后,C中溶液有________沉淀产生
有关化学方程式 A中:2NaOH+CuSO4===____________________; C中:CH3CHO+2Cu(OH)2+NaOH________________________
注意事项 ①反应在________条件下进行; ②加热至________; ③Cu(OH)2必须是________
(3)催化氧化反应
乙醛在有催化剂并加热的条件下,能被氧气氧化为乙酸。
2CH3CHO+O2________________。
(4)燃烧反应
2CH3CHO+5O2________________。
2.加成反应(还原反应)
乙醛中的碳氧双键和烯烃中的碳碳双键性质类似,也能与氢气发生加成反应,化学方程式为________________________________________________________________________
________________________________________________________________________。
3.醛的化学通性
(1)醛可被氧化为羧酸,也可被氢气还原为醇,因此醛既有________性,又有________性,其氧化、还原的关系为R-CH2OH。
(2)醛的加成反应(试剂:H2、HCN)
①RCHO+H2____________________________________________________;
②RCHO+HCN―→_______________________________________________________。
(3)醛类的两个特征反应
①+2Ag(NH3)2OH______________________________________________;
②+2Cu(OH)2+NaOH__________________________________________。
(1)乙醛能使酸性高锰酸钾溶液褪色( )
(2)乙醛和乙酸的混合液可以用分液漏斗分离( )
(3)用新制银氨溶液可区分甲酸甲酯和乙醛( )
(4)银氨溶液的配制,将硝酸银溶液滴加到稀氨水中至生成的白色沉淀恰好完全溶解为止( )
(5)乙醛加氢得到乙醇的反应是加成反应,也称为还原反应( )
1.乙醇、乙醛和乙酸三者转化关系如图所示,请结合具体反应和三者的分子结构、官能团的变化情况,谈谈有机化学反应中的氧化反应和还原反应的特点。
乙醇乙醛乙酸
________________________________________________________________________
________________________________________________________________________
2.在做乙醛和银氨溶液的银镜反应实验时,为什么要控制在碱性条件?
________________________________________________________________________
3.某同学用2 mL 1 mol·L-1的CuSO4溶液与4 L 0.5 mol·L-1的NaOH溶液混合,然后加入0.5 mL 4%的CH3CHO溶液,加热后未见红色沉淀生成,实验失败的原因是什么?
________________________________________________________________________
4.能发生银镜反应或能与新制的Cu(OH)2反应的物质一定是醛吗?
________________________________________________________________________
________________________________________________________________________
1.一个学生做乙醛的还原性实验时,取1 mol·L-1 CuSO4溶液和0.5 mol·L-1NaOH各1 mL,在一支洁净的试管内混合后,向其中又加入0.5 mL 40%的乙醛,加热至沸腾,结果无红色沉淀出现,实验失败的原因可能是( )
A.未充分加热
B.加入乙醛太少
C.加入NaOH溶液的量不足
D.加入CuSO4溶液的量不足
2.某醛的结构简式为(CH3)2C==CHCH2CH2CHO,通过实验方法检验其中的官能团。
(1)实验操作中,应先检验哪种官能团?______,原因是________________________。
(2)检验分子中醛基的方法是________________________________________________
________________________________________________________________________,
化学方程式为____________________________________________________________
________________________________________________________________________。
(3)检验分子中碳碳双键的方法是____________________________________________
________________________________________________________________________。
使溴水、酸性KMnO4溶液褪色的有机物及褪色原因的比较
官能团 试剂 碳碳双键 碳碳三键 苯的同 系物 醇 酚 醛
能否褪色 原因 能否褪色 原因 能否褪色 原因 能否褪色 原因 能否褪色 原因 能否褪色 原因
溴水 √ 加成反应 √ 加成反应 × - × - √ 取代反应 √ 取代反应
酸性KMnO4溶液 √ 氧化反应 √ 氧化反应 √ 氧化反应 √ 氧化反应 √ 氧化反应 √ 氧化反应
注:“√”代表能,“×”代表不能。
三、甲醛、酮的结构与性质
1.甲醛的结构与性质
(1)结构特点
甲醛的分子式为CH2O,其分子可以看成含两个醛基,如图所示:
(2)氧化反应的特殊性
甲醛发生氧化反应时,可理解为
所以,1个甲醛分子中相当于有2个 —CHO,当与足量的银氨溶液或新制的Cu(OH)2悬浊液反应时,可存在如下量的关系:
1 mol HCHO~4 mol Ag
1 mol HCHO~4 mol Cu(OH)2~2 mol Cu2O
(3)甲醛与苯酚反应生成酚醛树脂:
nHCHO+n____________________________________________________。
①反应机理:在浓盐酸(或浓氨水)的催化下,甲醛分子中的________与苯酚分子中羟基____________上的氢原子结合生成水,其余部分形成________________。像这种由有机化合物分子间脱去____________获得________化合物的反应,称为______________________。
②制取酚醛树脂
酸催化 碱催化
实验操作
a.待混合物接近沸腾时,取出试管并用玻璃棒搅拌反应物,观察现象; b.试管冷却至室温后,向试管中加入适量乙醇,观察现象; c.再把试管放在热水浴中加热,观察现象
实验现象 混合溶液变浑浊,有黏稠的粉红色物质生成;加入乙醇,________;再加热,黏稠物质________ 混合溶液变浑浊,有黏稠的乳黄色物质生成;加入乙醇,________;再加热,黏稠物质________溶解
结论 在酸催化条件下,生成________酚醛树脂,具有________性 在碱催化条件下,生成______酚醛树脂,具有________性
注意事项 ①加热方法:沸水浴加热,__________温度计; ②因为反应物易挥发,所以要使用________; ③此实验需在通风良好的条件下进行,树脂及残液需统一回收处理
2.酮的代表物
(1)酮的概念和结构特点
(2)丙酮
①丙酮是最简单的酮类化合物,结构简式为____________,其1H核磁共振谱图有____组特征峰,其球棍模型为。
②常温下丙酮是无色透明液体,易______,能与水、乙醇等混溶,是常用的有机溶剂,主要用于制备重要化工原料双酚A和制备有机玻璃。
(3)环己酮(C6H10O)也是一种常见的酮,环己酮的键线式为________________,常作为生产合成纤维、合成树脂、合成橡胶、石蜡、虫胶、油漆、染料和制药中间体的溶剂,还可用于制备己二酸和己内酰胺,它们都是生产聚酰胺纤维的重要原料。
3.酮的化学性质
不能被________________________等弱氧化剂氧化,但能催化加氢生成______。
如反应的化学方程式:
+H2_________________________________________________。
+H2____________________________________________________。
(1)1 mol HCHO发生银镜反应最多生成2 mol Ag( )
(2)酮类物质能与氢气发生加成反应,不能被银氨溶液氧化,所以只能发生还原反应,不能发生氧化反应( )
(3)丙酮是结构最简单的酮,也可以发生银镜反应和加氢还原反应( )
(4)丙酮难溶于水,但丙酮是常用的有机溶剂( )
(5)环己酮的1H核磁共振谱图只有一组特征峰( )
请写出HCHO与银氨溶液、新制的Cu(OH)2反应的化学方程式。
________________________________________________________________________
________________________________________________________________________
1.香料茉莉酮是一种人工合成的有机化合物,其结构简式为,下列关于茉莉酮的说法正确的是( )
A.该有机物的化学式是C11H16O
B.1 mol该有机物与H2充分反应,消耗4 mol H2
C.该有机物属于不饱和酮类物质,能发生银镜反应
D.该有机物能发生加成反应,但不能发生氧化反应
2.有机玻璃是聚甲基丙烯酸甲酯,其合成路线如下:
D
A B C
E
(1)A的名称为________。
(2)C中官能团的名称为________________。
(3)D的结构简式为________________________________________________。
(4)A→B、D→E的反应类型分别为__________、____________。
第二单元 醛 羧酸
第1课时 醛的性质和应用
一、
1.(1) (2)醛基 羰基 双键 同一平面 同一平面
2.(1)醛基 (2)—CHO CnH2nO(n≥1) CnH2n+1CHO(n≥0)
3.(1)HCHO 刺激性 福尔马林 消毒 保存 (2)C2H4O CH3CHO 刺激性
正误判断
(1)× (2)√ (3)× (4)√
深度思考
1.细菌、病毒都是蛋白质,分子中都含—NH2。甲醛能与—NH2发生反应使蛋白质分子经过化学变化生成新的分子而变性。蛋白质变性后失去了生理活性,即死亡。这就是甲醛能消毒、杀菌的原因。装修房屋后,在一定时间内打开门窗,进行通风,使甲醛跑掉,否则影响人体健康。
2.5
应用体验
1.D
2.D
二、
1.(1)白色沉淀 澄清 光亮的银镜 AgOH↓(白色)+NH4NO3 Ag(NH3)2OH+2H2O 2Ag↓+CH3COONH4+3NH3+H2O 洁净 不可 新配制 久置
(2)蓝色 红色 Cu(OH)2↓+Na2SO4 CH3COONa+Cu2O↓+3H2O 碱性 沸腾 新制的 (3)2CH3COOH
(4)4CO2+4H2O
2.CH3CHO+H2CH3CH2OH
3.(1)还原 氧化 (2)①RCH2OH ②
(3)①2Ag↓++3NH3+H2O
②Cu2O↓++3H2O
正误判断
(1)√ (2)× (3)× (4)× (5)√
深度思考
1.乙醇被氧化为乙醛时醇羟基被氧化为—CHO,从组成上看减少了2个氢原子,乙醛被氧化成乙酸时,—CHO变成—COOH,从组成上看增加了氧原子,乙醛被还原为乙醇时—CHO变成—CH2OH,从组成上看增加了氢原子。因此,有机化学反应若从氢、氧原子数目变化角度来看,失去氢原子、增加氧原子的反应称为氧化反应。增加氢原子、失去氧原子的反应称为还原反应。
2.在酸性或弱酸条件下,H+与NH3反应生成NH,Ag(NH3)不能存在,不能发生银镜反应。
3.乙醛与新制的Cu(OH)2的反应必须在碱性条件下进行,实验失败的原因是NaOH的量偏少。
4.不一定。只要有机物分子中含有—CHO,就能发生银镜反应,或与新制的Cu(OH)2反应。含有醛基的物质可能是醛、葡萄糖或其他含有醛基的化合物。故可用与银氨溶液发生银镜反应或与新制的Cu(OH)2反应生成红色沉淀来检验醛基的存在。
应用体验
1.C [醛与新制的Cu(OH)2反应,必须在强碱性条件下进行。该学生配制Cu(OH)2时CuSO4有余,NaOH溶液的量不足,则不能发生反应生成红色沉淀。]
2.(1)醛基 检验碳碳双键要使用溴水或酸性KMnO4溶液,而醛基也能使溴水或酸性KMnO4溶液褪色
(2)在洁净的试管中加入新制银氨溶液和少量试样后,水浴加热有银镜生成(或在洁净的试管中加入少量试样和新制的氢氧化铜悬浊液,加热煮沸,有红色沉淀生成)
(CH3)2C==CHCH2CH2CHO+2Ag(NH3)2OH2Ag↓+3NH3+(CH3)2C==CHCH2CH2COONH4+H2O[或(CH3)2C==CHCH2CH2CHO+2Cu(OH)2+NaOH(CH3)2C==CHCH2CH2COONa+Cu2O↓+3H2O]
(3)加入过量银氨溶液氧化醛基后,调节溶液至酸性再加入溴水(或酸性KMnO4溶液),看是否褪色
三、
1.(3)+(n-1)H2O ①氧原子 邻位或对位 高分子化合物 小分子 高分子 缩聚反应
②不溶解 溶解 不溶解 仍不 线型 热塑 体型 热固 不需要 冷凝管
2.(2)① 一 ②挥发 (3)
3.银氨溶液、新制的氢氧化铜 醇
正误判断
(1)× (2)× (3)× (4)× (5)×
深度思考
HCHO+4Ag(NH3)2OH(NH4)2CO3+4Ag↓+6NH3+2H2O、
HCHO+4Cu(OH)2+2NaOHNa2CO3+2Cu2O↓+6H2O。
应用体验
1.A [该有机物中含有羰基和碳碳双键,能发生加成反应,也能被酸性KMnO4溶液等强氧化剂氧化,但不能发生银镜反应,1 mol该有机物与H2充分反应消耗3 mol H2。]
2.(1)丙酮 (2)羟基、羧基 (3) (4)加成反应 加聚反应
