人教版九年级化学下册第十单元课题1《常见的酸和碱 酸的化学性质》(课件30页
文档属性
| 名称 | 人教版九年级化学下册第十单元课题1《常见的酸和碱 酸的化学性质》(课件30页 |  | |
| 格式 | pptx | ||
| 文件大小 | 37.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-15 16:39:20 | ||
图片预览










文档简介
(共30张PPT)
课题1 常见的酸和碱
第十单元 酸和碱
(第3课时)
3
知道稀盐酸和稀硫酸能使指示剂变色;
知道金属与稀盐酸、稀硫酸反应;
4
学习目标
1
2
知道金属氧化物与稀酸反应;
知道某些盐与稀酸反应;
1、有两瓶未贴标签的稀盐酸和NaCl溶液(中性溶液),请同学们想想有哪些方法可以鉴别出来?
2、你提出的这些方案的依据什么?
一、情景引入,导入新知
二、自主学习,发现疑问
01
疑问一
酸有哪些化学性质?
02
疑问二
不同酸的性质是否相同?为什么?
探究活动1:稀盐酸、稀硫酸能使指示剂变色吗?
紫色石蕊试液 无色酚酞试液
HCl
H2SO4
变红
变红
不变色(无色)
不变色(无色)
性质1:酸能与酸碱指示剂作用,酸可以使紫色石蕊变红,酸不能使无色酚酞变色
三、合作探究,质疑解难
镁、锌、铁、铜四位游泳运动员正在稀盐酸的泳池中展开了激烈的一百米蛙泳决赛,请同学们根据所学知识,判断他们最后谁会是最后的冠军?为什么?上面四幅图分别代表哪种运动员?
镁
锌
铁
铜
三、合作探究,质疑解难
酸与活泼金属作用
三、合作探究,质疑解难
思考: 镁、锌、铁、铜4位运动员中,为什么铜能最先到达终点,并安然无恙呢?
因为在金属活动性顺序表中,位于氢前面的金属才能与酸反应,铜排在氢的后面,所以不能和酸反应。
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性逐渐减弱
钾 钙 钠 镁 铝 锌 铁 锡 铅 (氢) 铜 汞 银 铂 金
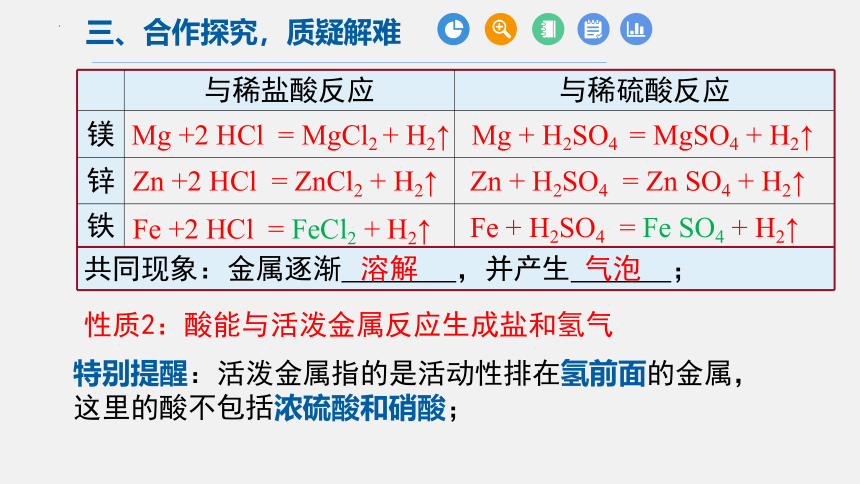
与稀盐酸反应 与稀硫酸反应
镁
锌
铁
性质2:酸能与活泼金属反应生成盐和氢气
Mg +2 HCl = MgCl2 + H2↑
Zn +2 HCl = ZnCl2 + H2↑
Zn + H2SO4 = Zn SO4 + H2↑
Mg + H2SO4 = MgSO4 + H2↑
Fe + H2SO4 = Fe SO4 + H2↑
Fe +2 HCl = FeCl2 + H2↑
三、合作探究,质疑解难
特别提醒:活泼金属指的是活动性排在氢前面的金属,这里的酸不包括浓硫酸和硝酸;
共同现象:金属逐渐 ,并产生 ;
溶解
气泡
在金属活动性顺序里:①金属的位置越_____,它的活动性越强。②位于_______的金属能置换出盐酸、稀硫酸中的氢。③位于_____的金属一般能把位于_____的金属从它们_____________里置换出来。
靠前
氢前面
前面
后面
化合物的盐溶液
三、合作探究,质疑解难
写出铝与盐酸和稀硫酸反应的方程式
我能写
你还想知道方案三吗?
2Al + 6HCl = 2AlCl3 + 3H2 ↑
2Al + 3H2SO4 = Al2(SO4 )3+ 3H2↑
三、合作探究,质疑解难
三、合作探究,质疑解难
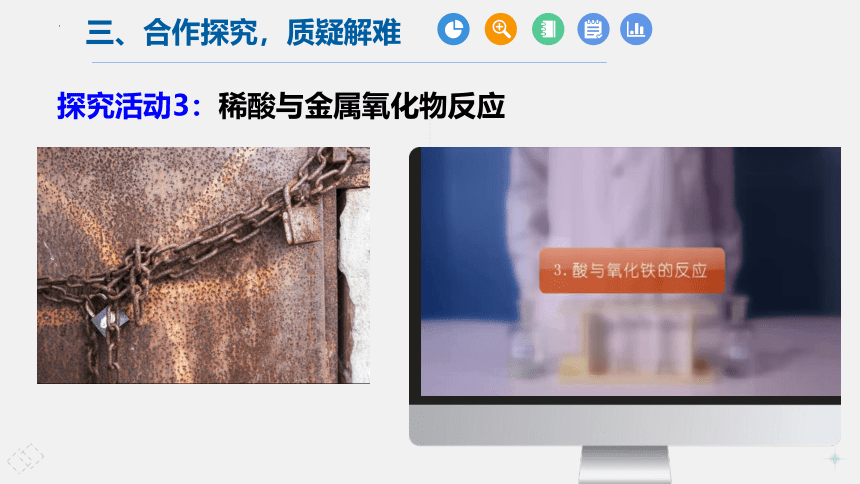
探究活动3:稀酸与金属氧化物反应
现象 化学方程式
铁锈 + 稀盐酸
铁锈 + 稀硫酸
Fe2O3+6HCl=2FeCl3+3H2O
铁锈逐渐消失,溶液由无色变为黄色
铁锈逐渐消失,溶液由无色变为黄色
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
性质3: 酸能与金属氧化物反应,生成盐和水
三、合作探究,质疑解难
小明看见爸爸常常用稀盐酸给铁制器皿除锈,他自己想亲自试一试。于是,他找出一颗生锈铁钉出来,放入足量稀盐酸中,然后,美滋滋地去睡觉了……
可是,当他醒来之后,发现铁钉不见了,你知道为什么吗?用两个化学方程式表示出来。
三、合作探究,质疑解难
思考:利用酸清除铁锈时,能否将金属制品长时间浸泡在酸中,为什么?
不能,当酸把铁锈除去后,铁就会与酸反应,就会腐蚀铁制品。
注意:盐酸与铁反应后是生成FeCl2,溶液为浅绿色,其中铁元素为+2价;而与铁锈反应是生成的FeCl3溶液为黄色,其中铁无素为+3价
Fe2O 3+6HCl=2FeCl3+3H2O
Fe +2 HCl =FeCl2 + H2↑
三、合作探究,质疑解难
三、合作探究,质疑解难
在两支装有黑色氧化铜粉末的试管里分别倒入适量的稀硫酸和稀盐酸,观察试管中的现象。
现象 化学方程式
氧化铜 + 稀硫酸
氧化铜 + 稀硫酸
黑色固体逐渐消失,溶液由无色变成蓝色
CuO+H2SO4==CuSO4+H20
CuO+2HCl==CuCl2+H20
三、合作探究,质疑解难
黑色固体逐渐消失,溶液由无色变成蓝色
初中常见溶液的颜色
Fe2+ 浅绿色
Fe3+ 黄色
Cu2+ 蓝色
MnO4-紫红色
FeCl2\FeSO4
FeCl3\Fe2(SO4)3
CuCl2\CuSO4
KMnO4
其他溶液不做特殊说明,一般为无色
三、合作探究,质疑解难
知识回顾:
CaCO3+2HCl==CaCl2+H2O+CO2↑
Na2CO3+2HCl==2NaCl+H2O+CO2↑
实验室制取CO2的原理:
灭火器原理:
性质4: 酸能与某些盐反应,生成新盐和新酸;
三、合作探究,质疑解难
一、酸的定义
二、酸的化学性质
1、跟指示剂的反应
2、跟金属的反应
3、跟金属氧化物的反应
4、跟盐的反应
酸可以使紫色石蕊变红,不能使无色酚酞变色
酸+金属==盐+氢气↑
Fe +2 HCl = FeCl2 + H2↑
金属氧化物+酸==盐+水
Fe2O3+6HCl= 2FeCl3+3H2O
酸+某些盐 =新酸+新盐(不是普遍的)CaCO3+2HCl==CaCl2+H2O+CO2↑
四、展示归纳,点拨提升
例1、某溶液可使酚酞试液变红,则该溶液会使石蕊试液( )。
A、变红 B、变紫 C、变蓝 D、不变色
例2、泉州是白蚂蚁的高发地区,白蚂蚁会蛀蚀木头,它分泌的蚁酸是一种酸,还能腐蚀很多建筑材料。下列建筑材料最不容易被白蚂蚁腐蚀的是( )。
A.钢筋 B.铜制品 C.大理石 D.铝合金
C
B
典例精析,揭示规律
例3、下列实验能达到预期目的是( )。
A、用稀盐酸除去金属表面的铁锈
B、用浓硫酸除去氢气中的氯化氢气体
C、用铜屑、稀硫酸制取硫酸铜
D、用稀硫酸和大理石制取较多量二氧化碳
D
典例精析,揭示规律
1.下列物质放入到稀硫酸中,无气体生成的是( )
A.铝 B 碳酸钠 C铁锈 D石灰石
2.下列物质可由金属与酸发生置换反应得到的是( )
A.CuCl2 B.Fe2(SO4)3 C.ZnCl2 D.AgCl
3.盐酸和稀硫酸常用作金属表面的清洁剂,是利用了它们化学性质中的( )
A 能与金属反应 B 能与金属氧化物反应
C 能使指示剂变色 D能溶于水
C
C
B
五、目标检测,检查效果
4、柠檬酸(C6H8O7)是一种较强的有机酸,在水溶液中可以解离出H+,从而呈现酸性,主要用于香料或作为饮料的酸化剂。下列物质不能与柠檬酸反应的是( )
A.Mg B.Fe2O3
C.CO2 D.Na2CO3
C
五、目标检测,检查效果
5、稀盐酸和稀硫酸具有相似的化学性质,其本质原因是( )
A.都能与指示剂作用
B.都能解离出酸根离子
C.溶液中的阳离子都是氢离子
D.都含有氢元素
6.向盛有下列物质的试管中加入过量的稀盐酸,最后能形成无色溶液的是( )
A.氧化铜 B.氧化铁
C.镁粉 D.紫色石蕊溶液
C
C
五、目标检测,检查效果
7、下列叙述错误的是( )
A.打开浓盐酸的试剂瓶盖,瓶口出现白烟
B.用浓硫酸在白纸上写字,白纸上的字迹慢慢变黑
C.稀释浓硫酸时,应将浓硫酸沿器壁慢慢注入水中,
并用玻璃棒不断搅拌
D.稀硫酸、稀盐酸都可以用于金属表面除锈
A
五、目标检测,检查效果
8.下列实验现象的描述正确的是( )
A.用盐酸除铁锈时,铁锈逐渐溶解,溶液变成浅绿色
B.铁与稀硫酸反应时有气泡产生,溶液变成黄色
C.将铜片放入稀硫酸中,铜片溶解,形成蓝色溶液
D.氧化铜与稀硫酸反应时,黑色粉末溶解,形成蓝色溶液
D
五、目标检测,检查效果
易错点:用盐酸除铁锈时,铁锈溶解,溶液变成黄色;铁与稀硫酸反应时,铁的表面有气泡产生,形成浅绿色溶液;在金属活动性顺序中,铜位于氢后,因此将铜片放入稀硫酸中不发生反应,无明显现象;氧化铜能与稀硫酸反应,反应现象为黑色粉末逐渐溶解,溶液由无色变成蓝色。
9、下图化学反应的溶液颜色变化体现了“魔法世界,魅力化学”。请回答:
(1)溶液X是 (填“酸”或“碱”)溶液。
(2)若X是稀硫酸、B是氧化物,则B的化学式为
。
(3)若X是稀盐酸、C是单质,则C的名称为 。
(4)若X是稀盐酸、D是氧化物,则X与D反应的化学方程式为 ;
酸
CuO+2HCl===CuCl2+H2O
Fe2O3
铁
五、目标检测,检查效果
再见!
课题1 常见的酸和碱
第十单元 酸和碱
(第3课时)
3
知道稀盐酸和稀硫酸能使指示剂变色;
知道金属与稀盐酸、稀硫酸反应;
4
学习目标
1
2
知道金属氧化物与稀酸反应;
知道某些盐与稀酸反应;
1、有两瓶未贴标签的稀盐酸和NaCl溶液(中性溶液),请同学们想想有哪些方法可以鉴别出来?
2、你提出的这些方案的依据什么?
一、情景引入,导入新知
二、自主学习,发现疑问
01
疑问一
酸有哪些化学性质?
02
疑问二
不同酸的性质是否相同?为什么?
探究活动1:稀盐酸、稀硫酸能使指示剂变色吗?
紫色石蕊试液 无色酚酞试液
HCl
H2SO4
变红
变红
不变色(无色)
不变色(无色)
性质1:酸能与酸碱指示剂作用,酸可以使紫色石蕊变红,酸不能使无色酚酞变色
三、合作探究,质疑解难
镁、锌、铁、铜四位游泳运动员正在稀盐酸的泳池中展开了激烈的一百米蛙泳决赛,请同学们根据所学知识,判断他们最后谁会是最后的冠军?为什么?上面四幅图分别代表哪种运动员?
镁
锌
铁
铜
三、合作探究,质疑解难
酸与活泼金属作用
三、合作探究,质疑解难
思考: 镁、锌、铁、铜4位运动员中,为什么铜能最先到达终点,并安然无恙呢?
因为在金属活动性顺序表中,位于氢前面的金属才能与酸反应,铜排在氢的后面,所以不能和酸反应。
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性逐渐减弱
钾 钙 钠 镁 铝 锌 铁 锡 铅 (氢) 铜 汞 银 铂 金
与稀盐酸反应 与稀硫酸反应
镁
锌
铁
性质2:酸能与活泼金属反应生成盐和氢气
Mg +2 HCl = MgCl2 + H2↑
Zn +2 HCl = ZnCl2 + H2↑
Zn + H2SO4 = Zn SO4 + H2↑
Mg + H2SO4 = MgSO4 + H2↑
Fe + H2SO4 = Fe SO4 + H2↑
Fe +2 HCl = FeCl2 + H2↑
三、合作探究,质疑解难
特别提醒:活泼金属指的是活动性排在氢前面的金属,这里的酸不包括浓硫酸和硝酸;
共同现象:金属逐渐 ,并产生 ;
溶解
气泡
在金属活动性顺序里:①金属的位置越_____,它的活动性越强。②位于_______的金属能置换出盐酸、稀硫酸中的氢。③位于_____的金属一般能把位于_____的金属从它们_____________里置换出来。
靠前
氢前面
前面
后面
化合物的盐溶液
三、合作探究,质疑解难
写出铝与盐酸和稀硫酸反应的方程式
我能写
你还想知道方案三吗?
2Al + 6HCl = 2AlCl3 + 3H2 ↑
2Al + 3H2SO4 = Al2(SO4 )3+ 3H2↑
三、合作探究,质疑解难
三、合作探究,质疑解难
探究活动3:稀酸与金属氧化物反应
现象 化学方程式
铁锈 + 稀盐酸
铁锈 + 稀硫酸
Fe2O3+6HCl=2FeCl3+3H2O
铁锈逐渐消失,溶液由无色变为黄色
铁锈逐渐消失,溶液由无色变为黄色
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
性质3: 酸能与金属氧化物反应,生成盐和水
三、合作探究,质疑解难
小明看见爸爸常常用稀盐酸给铁制器皿除锈,他自己想亲自试一试。于是,他找出一颗生锈铁钉出来,放入足量稀盐酸中,然后,美滋滋地去睡觉了……
可是,当他醒来之后,发现铁钉不见了,你知道为什么吗?用两个化学方程式表示出来。
三、合作探究,质疑解难
思考:利用酸清除铁锈时,能否将金属制品长时间浸泡在酸中,为什么?
不能,当酸把铁锈除去后,铁就会与酸反应,就会腐蚀铁制品。
注意:盐酸与铁反应后是生成FeCl2,溶液为浅绿色,其中铁元素为+2价;而与铁锈反应是生成的FeCl3溶液为黄色,其中铁无素为+3价
Fe2O 3+6HCl=2FeCl3+3H2O
Fe +2 HCl =FeCl2 + H2↑
三、合作探究,质疑解难
三、合作探究,质疑解难
在两支装有黑色氧化铜粉末的试管里分别倒入适量的稀硫酸和稀盐酸,观察试管中的现象。
现象 化学方程式
氧化铜 + 稀硫酸
氧化铜 + 稀硫酸
黑色固体逐渐消失,溶液由无色变成蓝色
CuO+H2SO4==CuSO4+H20
CuO+2HCl==CuCl2+H20
三、合作探究,质疑解难
黑色固体逐渐消失,溶液由无色变成蓝色
初中常见溶液的颜色
Fe2+ 浅绿色
Fe3+ 黄色
Cu2+ 蓝色
MnO4-紫红色
FeCl2\FeSO4
FeCl3\Fe2(SO4)3
CuCl2\CuSO4
KMnO4
其他溶液不做特殊说明,一般为无色
三、合作探究,质疑解难
知识回顾:
CaCO3+2HCl==CaCl2+H2O+CO2↑
Na2CO3+2HCl==2NaCl+H2O+CO2↑
实验室制取CO2的原理:
灭火器原理:
性质4: 酸能与某些盐反应,生成新盐和新酸;
三、合作探究,质疑解难
一、酸的定义
二、酸的化学性质
1、跟指示剂的反应
2、跟金属的反应
3、跟金属氧化物的反应
4、跟盐的反应
酸可以使紫色石蕊变红,不能使无色酚酞变色
酸+金属==盐+氢气↑
Fe +2 HCl = FeCl2 + H2↑
金属氧化物+酸==盐+水
Fe2O3+6HCl= 2FeCl3+3H2O
酸+某些盐 =新酸+新盐(不是普遍的)CaCO3+2HCl==CaCl2+H2O+CO2↑
四、展示归纳,点拨提升
例1、某溶液可使酚酞试液变红,则该溶液会使石蕊试液( )。
A、变红 B、变紫 C、变蓝 D、不变色
例2、泉州是白蚂蚁的高发地区,白蚂蚁会蛀蚀木头,它分泌的蚁酸是一种酸,还能腐蚀很多建筑材料。下列建筑材料最不容易被白蚂蚁腐蚀的是( )。
A.钢筋 B.铜制品 C.大理石 D.铝合金
C
B
典例精析,揭示规律
例3、下列实验能达到预期目的是( )。
A、用稀盐酸除去金属表面的铁锈
B、用浓硫酸除去氢气中的氯化氢气体
C、用铜屑、稀硫酸制取硫酸铜
D、用稀硫酸和大理石制取较多量二氧化碳
D
典例精析,揭示规律
1.下列物质放入到稀硫酸中,无气体生成的是( )
A.铝 B 碳酸钠 C铁锈 D石灰石
2.下列物质可由金属与酸发生置换反应得到的是( )
A.CuCl2 B.Fe2(SO4)3 C.ZnCl2 D.AgCl
3.盐酸和稀硫酸常用作金属表面的清洁剂,是利用了它们化学性质中的( )
A 能与金属反应 B 能与金属氧化物反应
C 能使指示剂变色 D能溶于水
C
C
B
五、目标检测,检查效果
4、柠檬酸(C6H8O7)是一种较强的有机酸,在水溶液中可以解离出H+,从而呈现酸性,主要用于香料或作为饮料的酸化剂。下列物质不能与柠檬酸反应的是( )
A.Mg B.Fe2O3
C.CO2 D.Na2CO3
C
五、目标检测,检查效果
5、稀盐酸和稀硫酸具有相似的化学性质,其本质原因是( )
A.都能与指示剂作用
B.都能解离出酸根离子
C.溶液中的阳离子都是氢离子
D.都含有氢元素
6.向盛有下列物质的试管中加入过量的稀盐酸,最后能形成无色溶液的是( )
A.氧化铜 B.氧化铁
C.镁粉 D.紫色石蕊溶液
C
C
五、目标检测,检查效果
7、下列叙述错误的是( )
A.打开浓盐酸的试剂瓶盖,瓶口出现白烟
B.用浓硫酸在白纸上写字,白纸上的字迹慢慢变黑
C.稀释浓硫酸时,应将浓硫酸沿器壁慢慢注入水中,
并用玻璃棒不断搅拌
D.稀硫酸、稀盐酸都可以用于金属表面除锈
A
五、目标检测,检查效果
8.下列实验现象的描述正确的是( )
A.用盐酸除铁锈时,铁锈逐渐溶解,溶液变成浅绿色
B.铁与稀硫酸反应时有气泡产生,溶液变成黄色
C.将铜片放入稀硫酸中,铜片溶解,形成蓝色溶液
D.氧化铜与稀硫酸反应时,黑色粉末溶解,形成蓝色溶液
D
五、目标检测,检查效果
易错点:用盐酸除铁锈时,铁锈溶解,溶液变成黄色;铁与稀硫酸反应时,铁的表面有气泡产生,形成浅绿色溶液;在金属活动性顺序中,铜位于氢后,因此将铜片放入稀硫酸中不发生反应,无明显现象;氧化铜能与稀硫酸反应,反应现象为黑色粉末逐渐溶解,溶液由无色变成蓝色。
9、下图化学反应的溶液颜色变化体现了“魔法世界,魅力化学”。请回答:
(1)溶液X是 (填“酸”或“碱”)溶液。
(2)若X是稀硫酸、B是氧化物,则B的化学式为
。
(3)若X是稀盐酸、C是单质,则C的名称为 。
(4)若X是稀盐酸、D是氧化物,则X与D反应的化学方程式为 ;
酸
CuO+2HCl===CuCl2+H2O
Fe2O3
铁
五、目标检测,检查效果
再见!
同课章节目录
