1.1.1能层与能级 基态与激发态 课件(30张ppt) 2022-2023学年高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 1.1.1能层与能级 基态与激发态 课件(30张ppt) 2022-2023学年高二化学人教版(2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 5.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-14 11:16:35 | ||
图片预览









文档简介
(共30张PPT)
化学研究的是构成宏观物体的物质。
一、研究物质的组成与结构
二、研究物质的性质与变化
决定
前言
深度思考
物质的组成与结构如何决定物质的性质与变化呢?
物质的元素组成决定了物质的性质
为什么不同元素有不同性质?
为什么有的元素性质相似?
原子结构不同或相似
原子结构如何决定元素性质?
第一章 内容
分子的组成决定了物质的性质
有的分子的组成形同却有不同的性质
O2和O3
CO易燃,CO2却能灭火
分子式为C2H6O的物质 可能有两种不同的结构
分子的结构也是决定物质性质的重要因素
简单分子结构实例分析
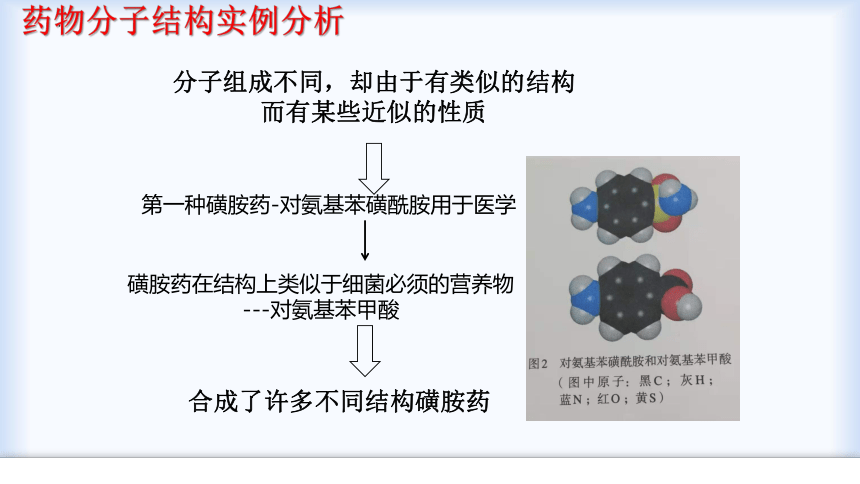
药物分子结构实例分析
分子组成不同,却由于有类似的结构
而有某些近似的性质
第一种磺胺药-对氨基苯磺酰胺用于医学
磺胺药在结构上类似于细菌必须的营养物
---对氨基苯甲酸
合成了许多不同结构磺胺药
分子结构前沿案例
模拟生物体中酶的结构
21世纪化学的重要课题之一
通过分子设计,创造与酶结构相似从而具有酶的性质的物质
第二章 认识分子结构与性质
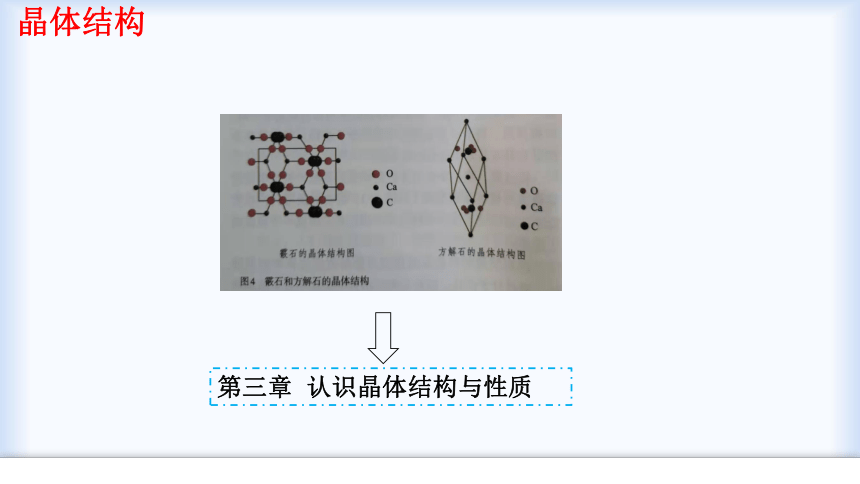
晶体结构是决定物质性质的有一个重要因素
晶体结构
金刚石与石墨
贝壳的无机成分主要是CaCO3
内层叫霰石
外壳叫方解石
晶体结构
第三章 认识晶体结构与性质
第一课时
第一节 原子结构
第一章 原子结构与性质
复习回顾
请以钠原子为例,谈谈你对原子结构的认识。
钠的原子结构示意图
想一想
新的问题
问题1 研究核外电子排布的实验依据是什么?
复习回顾
原子光谱
研究原子结构的方法——原子光谱
一些生活中的光现象
霓虹灯
激光
原子光谱
研究原子结构的方法——原子光谱
光谱与可见光光谱
光谱:
按照一定能量次序排列的光带。
可见光光谱:
可以被人眼观察的光带。
研究原子结构的方法——原子光谱
氢原子光谱
原子光谱
原子光谱
研究原子结构的方法——原子光谱
能量的量子化
位置和能量是连续的
原子光谱
研究原子结构的方法——原子光谱
能量的量子化
位置和能量是连续的
E
性质预测
研究原子结构的方法——原子光谱
能量的量子化
位置和能量是连续的
位置和能量是不连续的
E
原子光谱
原子光谱的产生
基态
K
L
M
N
基态氢原子:
处于能量最低状态的氢原子。
原子光谱
激发态
K
L
M
N
能量
激发态:
基态原子吸收能量,其中的电子会发生跃迁,由于电子跃迁,原子处于比基态能量高的状态,形成激发态原子。
光是电子跃迁释放能量的重要形式之一。
原子光谱的产生
原子光谱
能量
K
L
M
N
当电子从较高能量的状态跃迁至较低能量的状态,乃至基态时,会释放能量。
光是电子跃迁释放能量的重要形式之一。
原子
激发原子
基态原子
释放能量
吸收能量
处于较高能量
处于最低能量
原子光谱的产生
原子光谱
各种原子的吸收光谱或发射光谱,总称为原子光谱。
锂、氦、汞的吸收光谱
锂、氦、汞的发射光谱
原子光谱的产生
原子光谱
原子光谱的应用(1)——发现新元素
He 氦
原子光谱的应用(2)——焰色反应检验元素
认识能层
玻尔模型
电子只能在原子核外具有特定能量的“壳层”中运动。
能层
所谓能层,就是电子层。
认识能层
任务一 认识能层
请填写下表,并将各能层按能量由低到高排序。
能层 一 二 三 四 五 六 七
符号 K L M N O P Q
最多可容纳电子数
第n层最多可容纳的电子数为2n2
认识能层
任务一 认识能层
请填写下表,并将各能层按能量由低到高排序。
能层 一 二 三 四 五 六 七
符号 K L M N O P Q
最多可容纳电子数 2 8 18 32 50 72 98
将能量按从低到高排序为:
E(K)< E(L)< E(M)< E(N)< E(O)< E(P)< E(Q)
即离原子核越近,能量越低。
认识能层
原子结构理论的发展 I
原子核外电子在能层中的排布规律
一般来讲,核外电子总是尽量先排布在能量较低的能层,然后依次排布在能量逐渐升高的能层。
原子核外各能层最多容纳2n2个电子。
最外层最多容纳8个电子(K层为最外层最多只能容纳2个电子。)
原子结构理论的发展 II
钠原子光谱实验
钠原子光谱
分析钠原子光谱时发现:
即便是相同的两个能层之间发生电子跃迁,也会出现多条谱线。
对于这个现象,你会提出何种假设?
认识能级
能级
多电子原子中,同一能层的电子,能量也可能不同。
还可以把一个能层分为不同能级。
1.任一能层的能级总是从s开始。
2.任一能层的能级数等于能层序数。
3.能级符号按照s、p、d、f、g……排序。
4.能级符号前面用数字表示能层序数。
例如,K层中只有1s能级,L层中有2s和2p能级
认识能级
任务二 认识能级
请填写下表,归纳各能级最多可容纳的电子数有何规律。
能层 K L M N
最多电子数 2 8 18 32
能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f
最多电子数 2 2 6 2 6 10 2 6 10 14
s、p、d、f能级可容纳的最多电子数分别为2、6、10、14,依次为奇数数列1、3、5、7的二倍。
多电子原子中:E(ns) < E(np) < E(nd) < E(nf)
能级的能量特点:
认识能级
思考
第五能层最多可以容纳多少个电子?分别容纳在哪些能级中?各能级最多容纳多少个电子?
各能级最多容纳的电子数为:
5s能级 2×1=2
5p能级 2×3=6
5d能级 2×5=10
5f能级 2×7=14
5g能级 2×9=18
总计50个电子,与前面能层的计算结果相同。
分别容纳在5s、5p、5d、5f、5g五个能级中。
能层与能级
?
回顾:核外电子的运动状态和排布规律
实验
核外电子的
运动状态
核外电子的
排布规律
表示方法
原子
光谱
能量
量子化
能层
能级
原子结构示意图
化学研究的是构成宏观物体的物质。
一、研究物质的组成与结构
二、研究物质的性质与变化
决定
前言
深度思考
物质的组成与结构如何决定物质的性质与变化呢?
物质的元素组成决定了物质的性质
为什么不同元素有不同性质?
为什么有的元素性质相似?
原子结构不同或相似
原子结构如何决定元素性质?
第一章 内容
分子的组成决定了物质的性质
有的分子的组成形同却有不同的性质
O2和O3
CO易燃,CO2却能灭火
分子式为C2H6O的物质 可能有两种不同的结构
分子的结构也是决定物质性质的重要因素
简单分子结构实例分析
药物分子结构实例分析
分子组成不同,却由于有类似的结构
而有某些近似的性质
第一种磺胺药-对氨基苯磺酰胺用于医学
磺胺药在结构上类似于细菌必须的营养物
---对氨基苯甲酸
合成了许多不同结构磺胺药
分子结构前沿案例
模拟生物体中酶的结构
21世纪化学的重要课题之一
通过分子设计,创造与酶结构相似从而具有酶的性质的物质
第二章 认识分子结构与性质
晶体结构是决定物质性质的有一个重要因素
晶体结构
金刚石与石墨
贝壳的无机成分主要是CaCO3
内层叫霰石
外壳叫方解石
晶体结构
第三章 认识晶体结构与性质
第一课时
第一节 原子结构
第一章 原子结构与性质
复习回顾
请以钠原子为例,谈谈你对原子结构的认识。
钠的原子结构示意图
想一想
新的问题
问题1 研究核外电子排布的实验依据是什么?
复习回顾
原子光谱
研究原子结构的方法——原子光谱
一些生活中的光现象
霓虹灯
激光
原子光谱
研究原子结构的方法——原子光谱
光谱与可见光光谱
光谱:
按照一定能量次序排列的光带。
可见光光谱:
可以被人眼观察的光带。
研究原子结构的方法——原子光谱
氢原子光谱
原子光谱
原子光谱
研究原子结构的方法——原子光谱
能量的量子化
位置和能量是连续的
原子光谱
研究原子结构的方法——原子光谱
能量的量子化
位置和能量是连续的
E
性质预测
研究原子结构的方法——原子光谱
能量的量子化
位置和能量是连续的
位置和能量是不连续的
E
原子光谱
原子光谱的产生
基态
K
L
M
N
基态氢原子:
处于能量最低状态的氢原子。
原子光谱
激发态
K
L
M
N
能量
激发态:
基态原子吸收能量,其中的电子会发生跃迁,由于电子跃迁,原子处于比基态能量高的状态,形成激发态原子。
光是电子跃迁释放能量的重要形式之一。
原子光谱的产生
原子光谱
能量
K
L
M
N
当电子从较高能量的状态跃迁至较低能量的状态,乃至基态时,会释放能量。
光是电子跃迁释放能量的重要形式之一。
原子
激发原子
基态原子
释放能量
吸收能量
处于较高能量
处于最低能量
原子光谱的产生
原子光谱
各种原子的吸收光谱或发射光谱,总称为原子光谱。
锂、氦、汞的吸收光谱
锂、氦、汞的发射光谱
原子光谱的产生
原子光谱
原子光谱的应用(1)——发现新元素
He 氦
原子光谱的应用(2)——焰色反应检验元素
认识能层
玻尔模型
电子只能在原子核外具有特定能量的“壳层”中运动。
能层
所谓能层,就是电子层。
认识能层
任务一 认识能层
请填写下表,并将各能层按能量由低到高排序。
能层 一 二 三 四 五 六 七
符号 K L M N O P Q
最多可容纳电子数
第n层最多可容纳的电子数为2n2
认识能层
任务一 认识能层
请填写下表,并将各能层按能量由低到高排序。
能层 一 二 三 四 五 六 七
符号 K L M N O P Q
最多可容纳电子数 2 8 18 32 50 72 98
将能量按从低到高排序为:
E(K)< E(L)< E(M)< E(N)< E(O)< E(P)< E(Q)
即离原子核越近,能量越低。
认识能层
原子结构理论的发展 I
原子核外电子在能层中的排布规律
一般来讲,核外电子总是尽量先排布在能量较低的能层,然后依次排布在能量逐渐升高的能层。
原子核外各能层最多容纳2n2个电子。
最外层最多容纳8个电子(K层为最外层最多只能容纳2个电子。)
原子结构理论的发展 II
钠原子光谱实验
钠原子光谱
分析钠原子光谱时发现:
即便是相同的两个能层之间发生电子跃迁,也会出现多条谱线。
对于这个现象,你会提出何种假设?
认识能级
能级
多电子原子中,同一能层的电子,能量也可能不同。
还可以把一个能层分为不同能级。
1.任一能层的能级总是从s开始。
2.任一能层的能级数等于能层序数。
3.能级符号按照s、p、d、f、g……排序。
4.能级符号前面用数字表示能层序数。
例如,K层中只有1s能级,L层中有2s和2p能级
认识能级
任务二 认识能级
请填写下表,归纳各能级最多可容纳的电子数有何规律。
能层 K L M N
最多电子数 2 8 18 32
能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f
最多电子数 2 2 6 2 6 10 2 6 10 14
s、p、d、f能级可容纳的最多电子数分别为2、6、10、14,依次为奇数数列1、3、5、7的二倍。
多电子原子中:E(ns) < E(np) < E(nd) < E(nf)
能级的能量特点:
认识能级
思考
第五能层最多可以容纳多少个电子?分别容纳在哪些能级中?各能级最多容纳多少个电子?
各能级最多容纳的电子数为:
5s能级 2×1=2
5p能级 2×3=6
5d能级 2×5=10
5f能级 2×7=14
5g能级 2×9=18
总计50个电子,与前面能层的计算结果相同。
分别容纳在5s、5p、5d、5f、5g五个能级中。
能层与能级
?
回顾:核外电子的运动状态和排布规律
实验
核外电子的
运动状态
核外电子的
排布规律
表示方法
原子
光谱
能量
量子化
能层
能级
原子结构示意图
