第五章第二节第四课时 硝酸及酸雨的防治 课件(42张ppt) 2022-2023学年高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 第五章第二节第四课时 硝酸及酸雨的防治 课件(42张ppt) 2022-2023学年高一下学期化学人教版(2019)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 36.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-14 11:31:27 | ||
图片预览











文档简介
(共42张PPT)
03
硝酸
(强水):西洋人所造,性最猛烈,能蚀五金。王怡堂先生云∶其水至强,五金八石皆能穿漏,惟玻璃可盛
此水性猛烈,不可服食。西人凡画洋画,必须镂板于铜上者,先以笔画铜,或山水人物,以此水渍其间一昼夜,其渍处铜自烂,胜于雕刻
中医书籍《本草纲目拾遗》记载:
强水是什么?
颜色
气味
溶解性
挥发性
无色液体
有刺激性气味
易挥发(沸点是83℃)
与水以任意比互溶,质量分数为95%以上的硝酸叫发烟硝酸
【注意】
硝酸具有强腐蚀性和挥发性,使用时须注意防护和通风
【思考】
硝酸是无色液体,但久置的浓硝酸为什么会显黄色?
瓶口有白雾
一、硝酸
1.物理性质
不稳定性
4HNO3(浓) 4NO2↑+O2↑+2H2O
或光照
【思考】
硝酸该如何保存?
一般将浓硝酸保存在棕色细口瓶中,并放置于阴凉处
一、硝酸
2.化学性质
酸性
硝酸是一元强酸
HNO3 H++NO3-
稀硝酸使石蕊溶液由紫色变为红色,浓硝酸使紫色石蕊溶液先变红(酸性)后褪色(强氧化性)
②与碱反应:
NaOH+HNO3=NaNO3+H2O
③与碱性氧化物反应:
Na2O+2HNO3=2NaNO3+H2O
④与弱酸盐反应:
CaCO3+2HNO3=Ca(NO3)2+CO2↑+H2O
①与指示剂反应:
回顾浓硫酸,硝酸能与与活泼金属反应生成氢气吗?
【思考】
一、硝酸
2.化学性质
探究稀硝酸和浓硝酸氧化性强弱(与Cu反应)
一、硝酸
2.化学性质
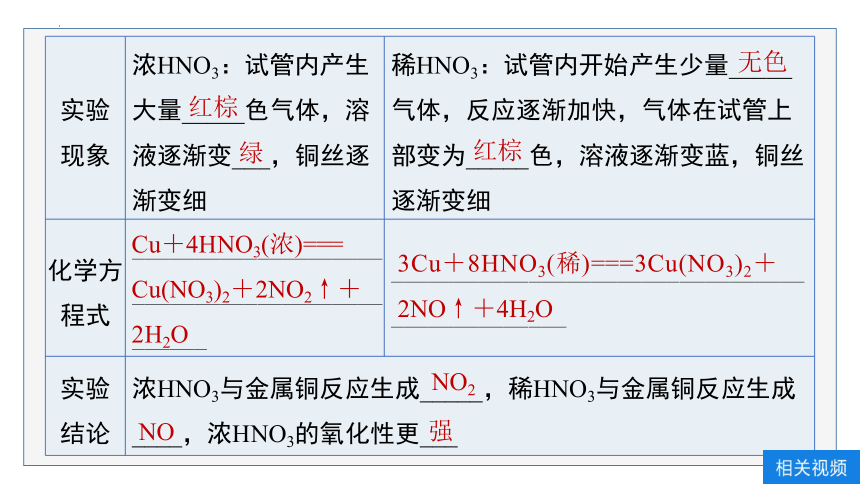
实验 现象 浓HNO3:试管内产生大量_____色气体,溶液逐渐变___,铜丝逐渐变细 稀HNO3:试管内开始产生少量_____气体,反应逐渐加快,气体在试管上部变为_____色,溶液逐渐变蓝,铜丝逐渐变细
化学方程式 ______________________________________________ _______________________________________________
实验 结论 浓HNO3与金属铜反应生成_____,稀HNO3与金属铜反应生成____,浓HNO3的氧化性更___ 红棕
绿
无色
红棕
Cu+4HNO3(浓)===
Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀)===3Cu(NO3)2+
2NO↑+4H2O
NO2
NO
强
1、足量的Cu中加入少量的浓硝酸,可能会发生什么反应
一开始是铜与浓硝酸反应:
Cu+4HNO3(浓) Cu(NO3)2+2NO2↑+2H2O
随着反应进行, 硝酸由浓变稀,则发生:
3Cu+8HNO3(稀) 3Cu(NO3)2+2NO↑+4H2O
一、硝酸
2.化学性质
强氧化性
2、反应停止后,如果在溶液中再加入足量硫酸会出现什么情况
溶液中存在NO3-,它遇到H+后,会继续氧化铜,当然此时NO3-/H+的溶度较稀.
一、硝酸
2.化学性质
强氧化性
3. 浓硝酸、稀硝酸与Cu反应产物分别为NO2、NO,反应中稀硝酸化合价降低较多,说明稀硝酸氧化性比浓硝酸强,对吗?
浓硝酸氧化性比稀硝酸强,浓HNO3反应更剧烈。
【思考】
硝酸能大多数金属反应(除铂、金),那么运输硝酸用什么容器呢?
大多数金属能与硝酸反应,但在常温下,铁和铝会被冷的浓硝酸、浓硫酸钝化
试着写出少量/过量Fe粉分别于稀硝酸反应的方程式。
Fe + 4HNO3(稀) == Fe(NO3)3 + NO↑ + 2H2O ( Fe少量)
3Fe+ 8HNO3(稀) == 3Fe(NO3)2 + 2NO↑ + 4H2O ( Fe过量)
【思考】
为什么铁少量生成三价铁,铁过量生成二价铁?
一、硝酸
2.化学性质
强氧化性
与某些非金属单质反应
S+6HNO3(浓) H2SO4+6NO2↑+2H2O
△
C+4HNO3(浓) 2H2O+4NO2↑+CO2↑
一、硝酸
2.化学性质
强氧化性
【拓展】
金属抛光
金属抛光的过程中都发生了哪些反应?体现了硝酸的什么性质?
变光亮
生成红棕色气体
Cu + 4HNO3(浓) === Cu(NO3)2 + 2NO2↑ + 2H2O
酸性
酸性、氧化性
【注意】
硝酸的浓度不同,氧化性强弱不同,与金属反应的产物也不同
CuO+2HNO3 Cu(NO3)2+H2O
一、硝酸
2.化学性质
硝酸的工业制备
硝酸是重要的化工原料,用于制化肥、农药、炸药、染料等。工业上制硝酸的原理是将氨经过一系列反应得到硝酸,如下图所示:
一、硝酸
3.制备
N2+3H2 2NH3
高温高压
催化剂
4NH3+5O2 4NO+6H2O
2NO+O2===2NO2
3NO2+H2O===2HNO3+NO
硝酸的实验室制备
原理
H2SO4+KNO3===HNO3↑+KHSO4
不挥发性酸制备挥发性酸
【注意】
硝酸见光易分解,实验中应该避光
一、硝酸
3.制备
炸药、燃料、医药、硝化纤维,化肥等
一、硝酸
4.硝酸的用途
(1)硝酸具有很强的氧化性,硝酸的浓度不同,与金属反应的产物也不同( )
(2)浓HNO3使紫色石蕊溶液先变红后褪色( )
(3)稀硝酸可溶解Fe(OH)2生成Fe(NO3)2和水( )
(4)碳、铜与浓硝酸反应时,浓硝酸只表现强氧化性( )
(5)过量的铜和一定量浓硝酸反应,生成的气体只有二氧化氮( )
(6)常温下,将铝片放入浓硝酸,无明显现象,是因为铝和浓硝酸不反应( )
×
正误判断
√
×
×
×
√
深度思考
1.(1)将铁粉溶于稀硝酸,铁元素的存在形式可能为①___________、
②_________、③___________________。
(2)其原因为____________________________________________________
__________________________________________________________________________________________________________________________________________________________________________________________。
Fe(NO3)3
Fe(NO3)2
Fe(NO3)3和Fe(NO3)2
硝酸与变价金属(如Fe)反应,根据硝酸量的多少分别得到高价、低价或两种价态共存的混合物。
Fe(少量)+4HNO3(稀)===Fe(NO3)3+NO↑+2H2O;
3Fe(过量)+8HNO3(稀)===3Fe(NO3)2+2NO↑+4H2O
深度思考
2.某研究小组为了探究硝酸的性质,进行如下实验操作。
(1)从试剂柜中取一瓶浓硝酸,发现其保存在___色试剂瓶中,取少量浓硝酸于试管中,发现其溶液呈“黄色”,其原因是__________________
______________________________________________________________
_____________(用化学方程式和适当文字描述)。该研究小组尝试将显“黄色”的浓硝酸恢复到原本的无色。下列措施合理的是__(填字母)。
a.向浓硝酸中加水 b.向浓硝酸中通入适量空气
c.加热浓硝酸 d.向浓硝酸中加入适量的NaOH固体
棕
浓硝酸不稳定,见
光或受热易分解,4HNO3 4NO2↑+O2↑+2H2O,NO2溶于浓HNO3
使溶液呈黄色
b
深度思考
(2)向浓硝酸中加入稍过量铜片,该小组同学发现,生成的气体开始呈红棕色后逐渐变浅,最终气体变为无色,试写出上述反应的化学方程式:
_______________________________________________________________________________________,在上述反应中,硝酸体现的性质为_______________。
Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O、3Cu+8HNO3(稀)===
3Cu(NO3)2+2NO↑+4H2O
强氧化性和酸性
深度思考
(3)当实验完毕,该小组同学向试管中滴入少量稀H2SO4,发现铜片又逐渐溶解,产生无色气体,试写出上述反应的离子方程式:____________
____________________________。
(4)该小组同学向浓硝酸中加入少量碳粉,无明显现象,缓慢加热,发现碳粉逐渐溶解,产生红棕色气体,试写出上述反应的化学方程式:________________________________________,在该反应中硝酸体现的性质为_________。
3Cu+8H++
强氧化性
04
酸雨及防治
二、酸雨及防治
煤、石油和某些金属矿物中含有硫,在燃烧或冶炼时往往会生成二氧化硫。在机动车发动机中,燃料燃烧产生的高温条件会使空气中的氮气与氧气反应,生成氮氧化物。它们会引起呼吸道疾病,危害人体健康,严重时会使人死亡。
酸雨:主要指 pH小于5.6 的雨水,其主要是含有硫酸和硝酸。
S
SO2
SO3
H2SO4
硫酸型酸雨:
硝酸型酸雨:
NO2
HNO3
成因:主要是大气中的SO2与NOx溶于水形成的。
1. 酸雨的形成
a.硫酸型酸雨的形成过程如图:
写出图中标号所对应的化学方程式:
①___________________。
②__________________。
③___________________。
④_____________________。
SO3+H2O===H2SO4
2H2SO3+O2===2H2SO4
b.硝酸型酸雨的形成过程如图:
写出图中标号所对应的化学方程式:
①_________________。
②_________________________。
2NO+O2===2NO2
3NO2+H2O===2HNO3+NO
(1)对人体的直接危害首先是它的刺激性,其次是它会形成硫酸雾和硫酸盐雾,其毒性比SO2大,能浸入人的肺部,引起肺水肿等疾病而使人致死。
(2)引起河流、湖泊的水体酸化,严重影响水生
动物生长。
(3)破坏土壤、植被、森林。
(4)腐蚀金属、油漆、皮革、纺织品及建筑材料等。
(5)渗入地下,可引起地下水酸化,酸化后的地下水中铝、铜、锌、镉等对人体有害金属元素的含量会偏高。
2. 酸雨的危害
(1)调整能源结构,积极开发新能源;
(2)对煤(其中含硫为0.3%-5%)进行处理,如选洗加工、综合开发、在煤中加入适量的生石灰、对排放的烟进行处理等;
(3)种植能够吸收SO2的有关树木(如臭椿、垂柳、柳杉)等;
(4)加强工厂废气的回收处理;
(5)改进汽车尾气的处理技术,控制尾气排放。
3. 酸雨的防治
汽车尾气
NOx产生
在机动车发动机中,燃料燃烧产生的高温条件会使空气中的氮气与氧气反应,生成氮氧化物
尾气处理
2xCO+2NOx === 2xCO2↑+N2↑
催化剂
主要含CO和NOX
(1)酸雨是指pH小于7的降雨( )
(2)化石燃料燃烧产生大量CO2,是形成酸雨的主要原因( )
(3)氮氧化物、硫的氧化物都可以形成酸雨( )
(4)防治酸雨的根本途径是减少人为SO2、NOx的排放( )
×
正误判断
√
×
√
应用体验
1.以下非金属氧化物与其引起的环境问题及主要来源对应正确的是
选项 氧化物 环境问题 主要来源
A CO2 破坏臭氧层 化石燃料的燃烧
B SO2 温室效应 工厂废气的排放
C NO2 光化学烟雾 汽车尾气的排放
D CO 酸雨 汽车尾气和化石燃料的不完全燃烧
√
2.(1)现有雨水样品1份,每隔一段时间测定该雨水样品的pH,所得数据如下:
测试时间/h 0 1 2 3 4
雨水的pH 4.73 4.63 4.56 4.55 4.55
分析数据,回答下列问题:
①雨水样品的pH变化的原因是____________________________________
________(用化学方程式表示)。
SO2+H2O H2SO3、2H2SO3+O2===
2H2SO4
②如果将刚取样的上述雨水与自来水相混合,pH将变___,原因是_____
_______________________________________________________(用化学方程式表示)。
小
2H2O+SO2===H2SO4+2HCl(或H2SO3+HClO===H2SO4+HCl)
Cl2+
(2)下列可以减少酸雨产生的途径是___(填字母)。
①少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
A.①②③ B.②③④⑤
C.①③⑤ D.①③④⑤
C
1.下列反应中硝酸既表现出酸性又表现出氧化性的是
A.使石蕊溶液变红
B.与铜反应放出NO气体,生成Cu(NO3)2
C.与Na2CO3反应放出CO2气体,生成NaNO3
D.与S单质混合共热时生成H2SO4和NO2
√
1
2
3
在A、C项反应中HNO3均表现出酸性;
在B、D项反应中HNO3中氮元素的化合价均降低,表现出氧化性,并且在B项中又有Cu(NO3)2生成,说明此反应中HNO3还表现出酸性。
2.(2022·广东中山高一月考)酸雨是对pH小于5.6的降水的统称。下列说法错误的是
A.空气中的SO2溶于水,最终形成酸雨
B.工业废水任意排放是造成酸雨的主要原因
C.汽车排放的尾气、硝酸厂和化肥厂的废气都含有能形成酸雨的氮氧化物
D.为了减少酸雨的形成,必须减少SO2的排放量,可对燃料进行脱硫处理
1
2
3
√
3.(2022·济南高一检测)某校课外活动小组为了探究铜与稀硝酸反应产生的气体是NO,设计了如图实验,实验过程中同时用石灰水吸收产生的氮氧化物获得应用广泛的Ca(NO2)2,实验装置如图所示。(已知:NO+
1
2
3
(1)实验之前通入N2的目的是________
_______________________________。
赶走装
置中的空气,防止对实验造成干扰
(2)在(1)操作后将装置A中铜丝插入稀硝酸,溶液显蓝色,有无色气体生成,该反应中表现氧化性的硝酸与参与反应的硝酸物质的量之比为_____。
铜和稀硝酸反应的化学方程式为3Cu+8HNO3===3Cu(NO3)2+2NO↑+4H2O,若有8 mol硝酸参加反应,表现氧化性的硝酸即生成NO的硝酸为2 mol,所以表现氧化性的硝酸与参与反应的硝酸物质的量之比为1∶4。
1
2
3
1∶4
(3)装置B中用注射器压入空气之后现象是_______________________。
1
2
3
烧瓶E中气体变为红棕色
(4)D装置的作用是__________________
______________。
吸收处理尾气NO2、
NO;防止倒吸
05
硝酸的计算
1.取38.4gCu与适量浓硝酸反应,Cu完全反应完,共22.4L气体,则消耗的HNO3( )
A.1mol B.1.6mol C.2.2mol D.2.4mol
2.某浓度的HNO3与Zn反应生成NO2和NO, NO2:NO=1:3,1mol Zn反应完全,则消耗的HNO3( )
A.2.8mol B.2.6mol C.2.4mol D.0.8mol
3.1L稀HNO3与HSO4混合液,浓度分别为0.1mol/L和0.4mol/L,加入足量Cu粉, 最多溶解Cu的质量( )
A.2.4mol B.3.2mol C.6.4mol D.9.6mol
03
硝酸
(强水):西洋人所造,性最猛烈,能蚀五金。王怡堂先生云∶其水至强,五金八石皆能穿漏,惟玻璃可盛
此水性猛烈,不可服食。西人凡画洋画,必须镂板于铜上者,先以笔画铜,或山水人物,以此水渍其间一昼夜,其渍处铜自烂,胜于雕刻
中医书籍《本草纲目拾遗》记载:
强水是什么?
颜色
气味
溶解性
挥发性
无色液体
有刺激性气味
易挥发(沸点是83℃)
与水以任意比互溶,质量分数为95%以上的硝酸叫发烟硝酸
【注意】
硝酸具有强腐蚀性和挥发性,使用时须注意防护和通风
【思考】
硝酸是无色液体,但久置的浓硝酸为什么会显黄色?
瓶口有白雾
一、硝酸
1.物理性质
不稳定性
4HNO3(浓) 4NO2↑+O2↑+2H2O
或光照
【思考】
硝酸该如何保存?
一般将浓硝酸保存在棕色细口瓶中,并放置于阴凉处
一、硝酸
2.化学性质
酸性
硝酸是一元强酸
HNO3 H++NO3-
稀硝酸使石蕊溶液由紫色变为红色,浓硝酸使紫色石蕊溶液先变红(酸性)后褪色(强氧化性)
②与碱反应:
NaOH+HNO3=NaNO3+H2O
③与碱性氧化物反应:
Na2O+2HNO3=2NaNO3+H2O
④与弱酸盐反应:
CaCO3+2HNO3=Ca(NO3)2+CO2↑+H2O
①与指示剂反应:
回顾浓硫酸,硝酸能与与活泼金属反应生成氢气吗?
【思考】
一、硝酸
2.化学性质
探究稀硝酸和浓硝酸氧化性强弱(与Cu反应)
一、硝酸
2.化学性质
实验 现象 浓HNO3:试管内产生大量_____色气体,溶液逐渐变___,铜丝逐渐变细 稀HNO3:试管内开始产生少量_____气体,反应逐渐加快,气体在试管上部变为_____色,溶液逐渐变蓝,铜丝逐渐变细
化学方程式 ______________________________________________ _______________________________________________
实验 结论 浓HNO3与金属铜反应生成_____,稀HNO3与金属铜反应生成____,浓HNO3的氧化性更___ 红棕
绿
无色
红棕
Cu+4HNO3(浓)===
Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀)===3Cu(NO3)2+
2NO↑+4H2O
NO2
NO
强
1、足量的Cu中加入少量的浓硝酸,可能会发生什么反应
一开始是铜与浓硝酸反应:
Cu+4HNO3(浓) Cu(NO3)2+2NO2↑+2H2O
随着反应进行, 硝酸由浓变稀,则发生:
3Cu+8HNO3(稀) 3Cu(NO3)2+2NO↑+4H2O
一、硝酸
2.化学性质
强氧化性
2、反应停止后,如果在溶液中再加入足量硫酸会出现什么情况
溶液中存在NO3-,它遇到H+后,会继续氧化铜,当然此时NO3-/H+的溶度较稀.
一、硝酸
2.化学性质
强氧化性
3. 浓硝酸、稀硝酸与Cu反应产物分别为NO2、NO,反应中稀硝酸化合价降低较多,说明稀硝酸氧化性比浓硝酸强,对吗?
浓硝酸氧化性比稀硝酸强,浓HNO3反应更剧烈。
【思考】
硝酸能大多数金属反应(除铂、金),那么运输硝酸用什么容器呢?
大多数金属能与硝酸反应,但在常温下,铁和铝会被冷的浓硝酸、浓硫酸钝化
试着写出少量/过量Fe粉分别于稀硝酸反应的方程式。
Fe + 4HNO3(稀) == Fe(NO3)3 + NO↑ + 2H2O ( Fe少量)
3Fe+ 8HNO3(稀) == 3Fe(NO3)2 + 2NO↑ + 4H2O ( Fe过量)
【思考】
为什么铁少量生成三价铁,铁过量生成二价铁?
一、硝酸
2.化学性质
强氧化性
与某些非金属单质反应
S+6HNO3(浓) H2SO4+6NO2↑+2H2O
△
C+4HNO3(浓) 2H2O+4NO2↑+CO2↑
一、硝酸
2.化学性质
强氧化性
【拓展】
金属抛光
金属抛光的过程中都发生了哪些反应?体现了硝酸的什么性质?
变光亮
生成红棕色气体
Cu + 4HNO3(浓) === Cu(NO3)2 + 2NO2↑ + 2H2O
酸性
酸性、氧化性
【注意】
硝酸的浓度不同,氧化性强弱不同,与金属反应的产物也不同
CuO+2HNO3 Cu(NO3)2+H2O
一、硝酸
2.化学性质
硝酸的工业制备
硝酸是重要的化工原料,用于制化肥、农药、炸药、染料等。工业上制硝酸的原理是将氨经过一系列反应得到硝酸,如下图所示:
一、硝酸
3.制备
N2+3H2 2NH3
高温高压
催化剂
4NH3+5O2 4NO+6H2O
2NO+O2===2NO2
3NO2+H2O===2HNO3+NO
硝酸的实验室制备
原理
H2SO4+KNO3===HNO3↑+KHSO4
不挥发性酸制备挥发性酸
【注意】
硝酸见光易分解,实验中应该避光
一、硝酸
3.制备
炸药、燃料、医药、硝化纤维,化肥等
一、硝酸
4.硝酸的用途
(1)硝酸具有很强的氧化性,硝酸的浓度不同,与金属反应的产物也不同( )
(2)浓HNO3使紫色石蕊溶液先变红后褪色( )
(3)稀硝酸可溶解Fe(OH)2生成Fe(NO3)2和水( )
(4)碳、铜与浓硝酸反应时,浓硝酸只表现强氧化性( )
(5)过量的铜和一定量浓硝酸反应,生成的气体只有二氧化氮( )
(6)常温下,将铝片放入浓硝酸,无明显现象,是因为铝和浓硝酸不反应( )
×
正误判断
√
×
×
×
√
深度思考
1.(1)将铁粉溶于稀硝酸,铁元素的存在形式可能为①___________、
②_________、③___________________。
(2)其原因为____________________________________________________
__________________________________________________________________________________________________________________________________________________________________________________________。
Fe(NO3)3
Fe(NO3)2
Fe(NO3)3和Fe(NO3)2
硝酸与变价金属(如Fe)反应,根据硝酸量的多少分别得到高价、低价或两种价态共存的混合物。
Fe(少量)+4HNO3(稀)===Fe(NO3)3+NO↑+2H2O;
3Fe(过量)+8HNO3(稀)===3Fe(NO3)2+2NO↑+4H2O
深度思考
2.某研究小组为了探究硝酸的性质,进行如下实验操作。
(1)从试剂柜中取一瓶浓硝酸,发现其保存在___色试剂瓶中,取少量浓硝酸于试管中,发现其溶液呈“黄色”,其原因是__________________
______________________________________________________________
_____________(用化学方程式和适当文字描述)。该研究小组尝试将显“黄色”的浓硝酸恢复到原本的无色。下列措施合理的是__(填字母)。
a.向浓硝酸中加水 b.向浓硝酸中通入适量空气
c.加热浓硝酸 d.向浓硝酸中加入适量的NaOH固体
棕
浓硝酸不稳定,见
光或受热易分解,4HNO3 4NO2↑+O2↑+2H2O,NO2溶于浓HNO3
使溶液呈黄色
b
深度思考
(2)向浓硝酸中加入稍过量铜片,该小组同学发现,生成的气体开始呈红棕色后逐渐变浅,最终气体变为无色,试写出上述反应的化学方程式:
_______________________________________________________________________________________,在上述反应中,硝酸体现的性质为_______________。
Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O、3Cu+8HNO3(稀)===
3Cu(NO3)2+2NO↑+4H2O
强氧化性和酸性
深度思考
(3)当实验完毕,该小组同学向试管中滴入少量稀H2SO4,发现铜片又逐渐溶解,产生无色气体,试写出上述反应的离子方程式:____________
____________________________。
(4)该小组同学向浓硝酸中加入少量碳粉,无明显现象,缓慢加热,发现碳粉逐渐溶解,产生红棕色气体,试写出上述反应的化学方程式:________________________________________,在该反应中硝酸体现的性质为_________。
3Cu+8H++
强氧化性
04
酸雨及防治
二、酸雨及防治
煤、石油和某些金属矿物中含有硫,在燃烧或冶炼时往往会生成二氧化硫。在机动车发动机中,燃料燃烧产生的高温条件会使空气中的氮气与氧气反应,生成氮氧化物。它们会引起呼吸道疾病,危害人体健康,严重时会使人死亡。
酸雨:主要指 pH小于5.6 的雨水,其主要是含有硫酸和硝酸。
S
SO2
SO3
H2SO4
硫酸型酸雨:
硝酸型酸雨:
NO2
HNO3
成因:主要是大气中的SO2与NOx溶于水形成的。
1. 酸雨的形成
a.硫酸型酸雨的形成过程如图:
写出图中标号所对应的化学方程式:
①___________________。
②__________________。
③___________________。
④_____________________。
SO3+H2O===H2SO4
2H2SO3+O2===2H2SO4
b.硝酸型酸雨的形成过程如图:
写出图中标号所对应的化学方程式:
①_________________。
②_________________________。
2NO+O2===2NO2
3NO2+H2O===2HNO3+NO
(1)对人体的直接危害首先是它的刺激性,其次是它会形成硫酸雾和硫酸盐雾,其毒性比SO2大,能浸入人的肺部,引起肺水肿等疾病而使人致死。
(2)引起河流、湖泊的水体酸化,严重影响水生
动物生长。
(3)破坏土壤、植被、森林。
(4)腐蚀金属、油漆、皮革、纺织品及建筑材料等。
(5)渗入地下,可引起地下水酸化,酸化后的地下水中铝、铜、锌、镉等对人体有害金属元素的含量会偏高。
2. 酸雨的危害
(1)调整能源结构,积极开发新能源;
(2)对煤(其中含硫为0.3%-5%)进行处理,如选洗加工、综合开发、在煤中加入适量的生石灰、对排放的烟进行处理等;
(3)种植能够吸收SO2的有关树木(如臭椿、垂柳、柳杉)等;
(4)加强工厂废气的回收处理;
(5)改进汽车尾气的处理技术,控制尾气排放。
3. 酸雨的防治
汽车尾气
NOx产生
在机动车发动机中,燃料燃烧产生的高温条件会使空气中的氮气与氧气反应,生成氮氧化物
尾气处理
2xCO+2NOx === 2xCO2↑+N2↑
催化剂
主要含CO和NOX
(1)酸雨是指pH小于7的降雨( )
(2)化石燃料燃烧产生大量CO2,是形成酸雨的主要原因( )
(3)氮氧化物、硫的氧化物都可以形成酸雨( )
(4)防治酸雨的根本途径是减少人为SO2、NOx的排放( )
×
正误判断
√
×
√
应用体验
1.以下非金属氧化物与其引起的环境问题及主要来源对应正确的是
选项 氧化物 环境问题 主要来源
A CO2 破坏臭氧层 化石燃料的燃烧
B SO2 温室效应 工厂废气的排放
C NO2 光化学烟雾 汽车尾气的排放
D CO 酸雨 汽车尾气和化石燃料的不完全燃烧
√
2.(1)现有雨水样品1份,每隔一段时间测定该雨水样品的pH,所得数据如下:
测试时间/h 0 1 2 3 4
雨水的pH 4.73 4.63 4.56 4.55 4.55
分析数据,回答下列问题:
①雨水样品的pH变化的原因是____________________________________
________(用化学方程式表示)。
SO2+H2O H2SO3、2H2SO3+O2===
2H2SO4
②如果将刚取样的上述雨水与自来水相混合,pH将变___,原因是_____
_______________________________________________________(用化学方程式表示)。
小
2H2O+SO2===H2SO4+2HCl(或H2SO3+HClO===H2SO4+HCl)
Cl2+
(2)下列可以减少酸雨产生的途径是___(填字母)。
①少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
A.①②③ B.②③④⑤
C.①③⑤ D.①③④⑤
C
1.下列反应中硝酸既表现出酸性又表现出氧化性的是
A.使石蕊溶液变红
B.与铜反应放出NO气体,生成Cu(NO3)2
C.与Na2CO3反应放出CO2气体,生成NaNO3
D.与S单质混合共热时生成H2SO4和NO2
√
1
2
3
在A、C项反应中HNO3均表现出酸性;
在B、D项反应中HNO3中氮元素的化合价均降低,表现出氧化性,并且在B项中又有Cu(NO3)2生成,说明此反应中HNO3还表现出酸性。
2.(2022·广东中山高一月考)酸雨是对pH小于5.6的降水的统称。下列说法错误的是
A.空气中的SO2溶于水,最终形成酸雨
B.工业废水任意排放是造成酸雨的主要原因
C.汽车排放的尾气、硝酸厂和化肥厂的废气都含有能形成酸雨的氮氧化物
D.为了减少酸雨的形成,必须减少SO2的排放量,可对燃料进行脱硫处理
1
2
3
√
3.(2022·济南高一检测)某校课外活动小组为了探究铜与稀硝酸反应产生的气体是NO,设计了如图实验,实验过程中同时用石灰水吸收产生的氮氧化物获得应用广泛的Ca(NO2)2,实验装置如图所示。(已知:NO+
1
2
3
(1)实验之前通入N2的目的是________
_______________________________。
赶走装
置中的空气,防止对实验造成干扰
(2)在(1)操作后将装置A中铜丝插入稀硝酸,溶液显蓝色,有无色气体生成,该反应中表现氧化性的硝酸与参与反应的硝酸物质的量之比为_____。
铜和稀硝酸反应的化学方程式为3Cu+8HNO3===3Cu(NO3)2+2NO↑+4H2O,若有8 mol硝酸参加反应,表现氧化性的硝酸即生成NO的硝酸为2 mol,所以表现氧化性的硝酸与参与反应的硝酸物质的量之比为1∶4。
1
2
3
1∶4
(3)装置B中用注射器压入空气之后现象是_______________________。
1
2
3
烧瓶E中气体变为红棕色
(4)D装置的作用是__________________
______________。
吸收处理尾气NO2、
NO;防止倒吸
05
硝酸的计算
1.取38.4gCu与适量浓硝酸反应,Cu完全反应完,共22.4L气体,则消耗的HNO3( )
A.1mol B.1.6mol C.2.2mol D.2.4mol
2.某浓度的HNO3与Zn反应生成NO2和NO, NO2:NO=1:3,1mol Zn反应完全,则消耗的HNO3( )
A.2.8mol B.2.6mol C.2.4mol D.0.8mol
3.1L稀HNO3与HSO4混合液,浓度分别为0.1mol/L和0.4mol/L,加入足量Cu粉, 最多溶解Cu的质量( )
A.2.4mol B.3.2mol C.6.4mol D.9.6mol
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
