第五章第二节 第一课时 氮气及氮氧化物 课件(41张ppt) 2022-2023学年高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 第五章第二节 第一课时 氮气及氮氧化物 课件(41张ppt) 2022-2023学年高一下学期化学人教版(2019)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 58.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-14 11:32:40 | ||
图片预览










文档简介
(共41张PPT)
氮气
新课导入
在超临界状态下,通过氮气物理发泡将颠覆性的弹力赋能于鞋中底,带来高回弹缓震功能,能量回归率达86.8%;
一整杯氮气啤酒里面,大约会产生 3000000 个氮气气泡,口感丝滑
氮气是惰性气体,化学性质很稳定,能更好的保存啤酒自身风味,
空气中的氮气
土壤海洋中硝酸盐和铵盐
动植物蛋白质
氮的存在形式
在自然界里,氮元素主要以氮分子的形式存在于空气中
少部分存在于生物的蛋白质中、以及土壤、海洋中的硝酸盐和铵盐。
游离态
化合态
【活动一】
通过视频总结氮气的物理性质
一、氮
1.氮气
一、氮
1.氮气
(1)物理性质
颜色 状态 气味 密度 溶解性
_____ 气体 _____ 密度与空气接近(略小) ___溶于水
无色
无味
难
思考
氮气在低温加压时可以液化形成液氮,液氮汽化会吸热使温度降低,你知道液氮有什么用途吗?
冷冻治疗
液氮食品
制冷剂
一、氮
1.氮气
(2)化学性质
电子式
结构式
+7
2
5
【总结】
氮分子内两个氮原子间以氮氮三键结合,断开该化学键需要较多的能量,所以氮气的化学性质很稳定,
焊接保护气
充氮灯泡
食品保护气
一、氮
1.氮气
(2)化学性质
1)常温不活泼,很难与其它物质发生化学反应。
2)高温或放电等条件下能与Mg、H2、O2等物质发生化合反应
N2可作保护气
③与Mg反应:
N2+O2=== 2NO
放电
N2+3H2 2NH3
N2+3Mg === Mg3N2
①与O2反应:
②与H2反应:
高温、高压
催化剂
点燃
(或高温)
离子化合物,遇水强烈水解
还原性
氧化性
氮元素是一切动植物的生长都需要的营养元素。大气中含有大量的氮气,但是不能被多数生物直接吸收,多数生物只能吸收含氮元素的化合物。
将空气中游离的氮转变为氮的化合物的方法叫做氮的固定。
1. 含义: 将大气中_______的氮转化为___________的过程叫做氮的固定。
二、氮的固定
游离态
含氮化合物
即:N2
氮的化合物
思考:NH3→NH3·H2O能称为氮的固定吗?
N2 → NH4+
N2 + 3H2 2NH3
高温、高压
催化剂
(用于工业合成氨)
二、氮的固定
2NO+O2====2NO2(红棕色)
雷雨发庄稼
N2 → NH4+
合成氮肥
应用体验
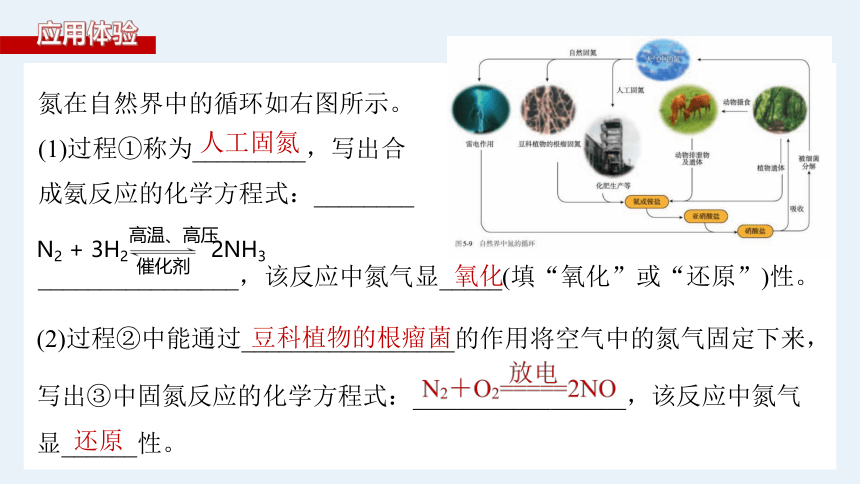
氮在自然界中的循环如右图所示。
(1)过程①称为_________,写出合
成氨反应的化学方程式:________
________________,该反应中氮气显_____(填“氧化”或“还原”)性。
人工固氮
氧化
N2 + 3H2 2NH3
高温、高压
催化剂
(2)过程②中能通过_________________的作用将空气中的氮气固定下来,
写出③中固氮反应的化学方程式:_________________,该反应中氮气
显______性。
豆科植物的根瘤菌
还原
(3)过程④中的亚硝酸盐有毒,工业上若直接排放将造成对环境的污染。已知NaNO2遇到还原性较强的 会被还原为N2,在废液中加入下列物质不能使NaNO2无害化排放的是____(填字母)。
a.H2O2 b.NH4Cl c.KNO3 d.NaOH
acd
(1)氮原子与其他原子只能形成共价键,不能形成离子键( )
(2)氮的固定中氮元素一定被氧化( )
(3)工业上将NH3转化为其他铵态化肥属于人工固氮( )
(4)N2和足量的O2在放电条件下会生成NO2( )
(5)镁条在空气中燃烧时,可以与O2、N2、CO2等反应生成MgO、Mg3N2、C
( )
×
正误判断
√
×
×
×
1.下列说法不正确的是( )
A.豆科植物通过根瘤菌吸收空气中的氮是化学变化
B.汽车尾气中排放的氮氧化合物是由游离态氮转化来的
C.化石燃料燃烧通常不释放出氮氧化合物
D.植物秸秆燃烧时放出氮氧化合物,参与了氮的循环
C
随堂练习
2.下列关于自然界中氮循环(如下图)的说法不正确的是( )
AD
A.氮元素均被氧化
B.工业合成氨属于人工固氮
C.含氮无机物和含氮有机物可相互转化
D.碳、氢、氧三种元素没有参与氮循环
一氧化氮和二氧化氮
雷雨发庄稼,将N2转化为硝酸盐要经过几步转化,每一步转化分别是什么?
+O2
+O2
+H2O
+NH3
N2 NO NO2 HNO3
NH4NO3
氮氧化物有哪些?
【思考】
1.氮的氧化物
氮的氧化物种类很多,如下表:
N的化合价 +1 +2 +3 +4 +5
对应氧化物 N2O(笑气) ____ N2O3 _____、N2O4 _____
其中属于酸性氧化物的是_____和_____,对应的酸分别是HNO2(亚硝酸)和HNO3。
NO
NO2
N2O5
N2O3
N2O5
三、一氧化氮和二氧化氮
一种麻醉剂
NO和NO2具有哪些性质?
【思考】
NO是无色、无味的有毒气体,难溶于水,常温下能与氧气反应
2NO + O2 2NO2 (红棕色)
实验室如何收集、检验NO?
【思考】
收集:排水法
检验:无色气体变为红棕色
NO
三、一氧化氮和二氧化氮
NO是人体内的“信号分子”可以舒张血管,抗氧化
NO
三、一氧化氮和二氧化氮
NO2 是红棕色、有剌激性气味的有毒气体,密度比空气大,易液化,易溶于水,能与水发生反应。
标准状况下,22.4 L NO2是 1 mol 吗?
3NO2 + H2O = 2HNO3 + NO
(工业上利用这一原理生产硝酸)
NO2
三、一氧化氮和二氧化氮
不是酸性氧化物
【实验5-5】
探究NO2与水的反应
三、一氧化氮和二氧化氮
实验 装置 实验 操作 在如图注射器里充入20 mL NO,然后吸入5 mL水,用乳胶管和弹簧夹封住管口,振荡注射器 打开弹簧夹,快速吸入10 mL空气后夹上弹簧夹 振荡注射器
实验 现象
化学 方程式 、 。 2NO+O2 === 2NO2
3NO2+H2O === 2HNO3+NO
无明显现象
无色气体变为红棕色
红棕色气体变浅至消失,有无色气体生成,注射器活塞向内滑动
三、一氧化氮和二氧化氮
(2)实验结论及解释
①NO不溶于水,也不与水反应,但能与空气中的氧气反应生成红棕色的NO2,化学方程式:_________________。
②NO2能与水反应生成无色的NO,化学方程式:___________________
______。工业上利用这一原理生产硝酸。
(3)思考与讨论
①如果要将注射器中的NO充分转化,应采取的措施是_______________
_____。
②上述实验对工业上生产硝酸的启示是____________________________
____________________________________________________。
2NO+O2===2NO2
3NO2+H2O===2HNO3
+NO
继续通入过量的
空气
在用水吸收NO2制取硝酸的反应过程中,要不断地补充空气,使NO2尽可能多地转化为硝酸
氮的氧化物 NO NO2
物理性质 颜色
刺激性毒性
溶解性
化学性质 与O2反应
与H2O反应
收集方法 排水法 排空气法
无色
红棕色
刺激性、有毒
刺激性、有毒
不溶于水
易溶于水,会反应
2NO+O2=2NO2
不反应
不反应
3NO2+H2O=2HNO3+NO
三、一氧化氮和二氧化氮
氮氧化物与氧气和水反应,若有气体剩余,剩余的气体可能是什么?有什么规律?
【思考】
思考
叠加法
充入NO和O2
3NO2 + H2O = 2HNO3 + NO ②
2NO + O2 = 2NO2 ①
4NO+3O2+2H2O=4HNO3
氮氧化物与氧气和水反应,若有气体剩余,剩余的气体可能是什么?有什么规律?
【思考】
思考
叠加法
充入NO2和O2
3NO2 + H2O = 2HNO3 + NO ②
2NO + O2 = 2NO2 ①
4NO2+O2+2H2O=4HNO3
(1)由于NO极易与O2反应,并且其密度与空气相差不多,因此收集NO只能用排水法( )
(2)由于NO2极易与水反应且密度比空气大,因此收集NO2只能用向上排空气法( )
(3)NO2易溶于水生成HNO3,故NO2是酸性氧化物( )
(4)N2与O2反应时,不论O2是否足量,其一步反应都只能得到NO,不能生成NO2( )
(5)可用湿润的淀粉碘化钾试纸鉴别NO2与溴蒸气( )
×
正误判断
√
√
√
×
深度思考
2.工业生产硝酸时,由于NO2与H2O反应会生成HNO3和NO,NO又可与O2反应生成NO2,因此通入适量的氧气可使NO或NO2恰好完全溶于水。
(1)试根据反应
①3NO2+H2O===2HNO3+NO
②2NO+O2===2NO2
推出NO2与O2的混合气体、NO与O2的混合气体被水完全吸收转化为HNO3的化学方程式:___________________________________________
___________________________________________。
①×2+②得:4NO2+O2+2H2O===4HNO3
①×2+②×3得:4NO+3O2+2H2O===4HNO3
深度思考
(2)将一支充有12 mL NO2气体的试管倒置于水槽中,充分反应。
①下列图示正确的是___(填字母)。
C
②若水不能充满试管,需再向试管中缓缓充入O2,现象为____________
____________________,最终充入___ mL氧气,才能使水全部充满。
红棕色,液面逐渐上升
3
无色气体变为
思考
1.向盛有15mLNO气体,倒立于水槽的试管A中通入O2,充分反应后,试管中还剩余气体3mL,则通入的O2体积可能是多少?
气体剩余只能是NO或O2,不可能是NO2。
剩余气体3mL
①3mLNO
②3mLO2
4NO+3O2+2H2O==4HNO3
3
12mL 9mL
4NO+3O2+2H2O==4HNO3
3
15mL 11.25mL
思考
2.向盛有15mLNO2气体,倒立于水槽的试管A中通入O2,充分反应后,试管中还剩余气体3mL,则通入的O2体积可能是多少?
气体剩余只能是NO或O2,不可能是NO2。
剩余气体3mL
①NO2过量→3mLNO
②3mLO2
1
6mL 1.5mL
1
15mL 3.75mL
4NO2+O2+2H2O==4HNO3
3NO2+H2O==2HNO3+NO
3 1
9mL 3mL
4NO2+O2+2H2O==4HNO3
治理空气需要车牌限号
汽油加氧气反应
提供了高温高压
2NO+O2====2NO2
汽车尾气中含有氮氧化物
三、一氧化氮和二氧化氮
(2)处理方法
①开发新能源:电动汽车
(1)危害:
酸雨
光化学烟雾:并不就是氮氧化物,但是可以由氮氧化物引起
②安装尾气催化处理装置
2CO+2NO === 2CO2 + N2
催化剂
③工业生产主要用碱液吸收
2NO2+2NaOH===NaNO3+NaNO2+H2O 345反应
NO2+NO+2NaOH===2NaNO2+H2O 234反应
1.氮元素在海洋中的循环,是整个海洋生
态系统的基础和关键。海洋中无机氮的
循环过程可用如图表示。下列关于海洋
氮循环的说法正确的是
A.海洋中的氮循环起始于氮的氧化
B.海洋中的氮循环属于固氮作用的是③
C.海洋中的反硝化作用一定有氧气的参与
1
2
3
4
5
√
2.最新病毒学研究证实,一氧化氮对SARS病毒有直接的抑制作用。下列关于一氧化氮的叙述正确的是
A.一氧化氮是一种红棕色的气体
B.常温常压下,一氧化氮不能与空气中的氧气直接化合
C.一氧化氮可由氮气和氧气在放电条件下直接化合得到
D.一氧化氮易溶于水,不能用排水法收集
NO是无色气体,不溶于水,易与O2化合生成NO2,在放电的条件下N2与O2化合生成NO。
1
2
3
4
5
√
3.下列有关NO2的说法中正确的是
A.NO2能与水反应生成硝酸,在反应中NO2只是还原剂
B.除去O2中混有的NO2,可将混合气体通过水,将NO2溶解
C.NO2与溴蒸气的鉴别可用NaOH溶液,溶于NaOH溶液得无色溶液的是
NO2,得橙色溶液的为溴蒸气
D.在NO2与水的反应中氧化剂与还原剂的质量之比为1∶2
√
1
2
3
4
5
4.如图所示,试管中盛装的气体呈红棕色,当倒扣在盛有水的水槽中时,试管内水面上升,但不能充满试管,当向试管内鼓入氧气后,可以观察到试管中水面继续上升,经过多次重复后,试管被水充满,对原试管中盛装的气体说法正确的是
A.可能是N2与NO2的混合气体
B.可能是N2O气体
C.可能是NO与NO2的混合气体
D.只可能是NO2一种气体
1
2
3
4
5
√
1
2
3
4
5
5.氮氧化物会严重污染大气,所以实验室必须对含有氮氧化物的废气进行处理。用NaOH溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:
①NO+NO2+2NaOH===2NaNO2+H2O
②2NO2+2NaOH===NaNO2+NaNO3+H2O
(1)在反应①中,参加反应的氧化剂和还原剂的物质的量之比为____。
1∶1
1
2
3
4
5
(2)下列措施能提高尾气中NO和NO2去除率的是_____(填字母)。
A.加快通入尾气的速率 B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
(3)吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是________(填化学式,下同);吸收后排放的尾气中含量较高的氮氧化物是____。
BC
NaNO3
NO
(4)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。在酸性NaClO溶液中,HClO氧化NO生成Cl-和 ,反应的离子方程式为_____________________________________。
氮气
新课导入
在超临界状态下,通过氮气物理发泡将颠覆性的弹力赋能于鞋中底,带来高回弹缓震功能,能量回归率达86.8%;
一整杯氮气啤酒里面,大约会产生 3000000 个氮气气泡,口感丝滑
氮气是惰性气体,化学性质很稳定,能更好的保存啤酒自身风味,
空气中的氮气
土壤海洋中硝酸盐和铵盐
动植物蛋白质
氮的存在形式
在自然界里,氮元素主要以氮分子的形式存在于空气中
少部分存在于生物的蛋白质中、以及土壤、海洋中的硝酸盐和铵盐。
游离态
化合态
【活动一】
通过视频总结氮气的物理性质
一、氮
1.氮气
一、氮
1.氮气
(1)物理性质
颜色 状态 气味 密度 溶解性
_____ 气体 _____ 密度与空气接近(略小) ___溶于水
无色
无味
难
思考
氮气在低温加压时可以液化形成液氮,液氮汽化会吸热使温度降低,你知道液氮有什么用途吗?
冷冻治疗
液氮食品
制冷剂
一、氮
1.氮气
(2)化学性质
电子式
结构式
+7
2
5
【总结】
氮分子内两个氮原子间以氮氮三键结合,断开该化学键需要较多的能量,所以氮气的化学性质很稳定,
焊接保护气
充氮灯泡
食品保护气
一、氮
1.氮气
(2)化学性质
1)常温不活泼,很难与其它物质发生化学反应。
2)高温或放电等条件下能与Mg、H2、O2等物质发生化合反应
N2可作保护气
③与Mg反应:
N2+O2=== 2NO
放电
N2+3H2 2NH3
N2+3Mg === Mg3N2
①与O2反应:
②与H2反应:
高温、高压
催化剂
点燃
(或高温)
离子化合物,遇水强烈水解
还原性
氧化性
氮元素是一切动植物的生长都需要的营养元素。大气中含有大量的氮气,但是不能被多数生物直接吸收,多数生物只能吸收含氮元素的化合物。
将空气中游离的氮转变为氮的化合物的方法叫做氮的固定。
1. 含义: 将大气中_______的氮转化为___________的过程叫做氮的固定。
二、氮的固定
游离态
含氮化合物
即:N2
氮的化合物
思考:NH3→NH3·H2O能称为氮的固定吗?
N2 → NH4+
N2 + 3H2 2NH3
高温、高压
催化剂
(用于工业合成氨)
二、氮的固定
2NO+O2====2NO2(红棕色)
雷雨发庄稼
N2 → NH4+
合成氮肥
应用体验
氮在自然界中的循环如右图所示。
(1)过程①称为_________,写出合
成氨反应的化学方程式:________
________________,该反应中氮气显_____(填“氧化”或“还原”)性。
人工固氮
氧化
N2 + 3H2 2NH3
高温、高压
催化剂
(2)过程②中能通过_________________的作用将空气中的氮气固定下来,
写出③中固氮反应的化学方程式:_________________,该反应中氮气
显______性。
豆科植物的根瘤菌
还原
(3)过程④中的亚硝酸盐有毒,工业上若直接排放将造成对环境的污染。已知NaNO2遇到还原性较强的 会被还原为N2,在废液中加入下列物质不能使NaNO2无害化排放的是____(填字母)。
a.H2O2 b.NH4Cl c.KNO3 d.NaOH
acd
(1)氮原子与其他原子只能形成共价键,不能形成离子键( )
(2)氮的固定中氮元素一定被氧化( )
(3)工业上将NH3转化为其他铵态化肥属于人工固氮( )
(4)N2和足量的O2在放电条件下会生成NO2( )
(5)镁条在空气中燃烧时,可以与O2、N2、CO2等反应生成MgO、Mg3N2、C
( )
×
正误判断
√
×
×
×
1.下列说法不正确的是( )
A.豆科植物通过根瘤菌吸收空气中的氮是化学变化
B.汽车尾气中排放的氮氧化合物是由游离态氮转化来的
C.化石燃料燃烧通常不释放出氮氧化合物
D.植物秸秆燃烧时放出氮氧化合物,参与了氮的循环
C
随堂练习
2.下列关于自然界中氮循环(如下图)的说法不正确的是( )
AD
A.氮元素均被氧化
B.工业合成氨属于人工固氮
C.含氮无机物和含氮有机物可相互转化
D.碳、氢、氧三种元素没有参与氮循环
一氧化氮和二氧化氮
雷雨发庄稼,将N2转化为硝酸盐要经过几步转化,每一步转化分别是什么?
+O2
+O2
+H2O
+NH3
N2 NO NO2 HNO3
NH4NO3
氮氧化物有哪些?
【思考】
1.氮的氧化物
氮的氧化物种类很多,如下表:
N的化合价 +1 +2 +3 +4 +5
对应氧化物 N2O(笑气) ____ N2O3 _____、N2O4 _____
其中属于酸性氧化物的是_____和_____,对应的酸分别是HNO2(亚硝酸)和HNO3。
NO
NO2
N2O5
N2O3
N2O5
三、一氧化氮和二氧化氮
一种麻醉剂
NO和NO2具有哪些性质?
【思考】
NO是无色、无味的有毒气体,难溶于水,常温下能与氧气反应
2NO + O2 2NO2 (红棕色)
实验室如何收集、检验NO?
【思考】
收集:排水法
检验:无色气体变为红棕色
NO
三、一氧化氮和二氧化氮
NO是人体内的“信号分子”可以舒张血管,抗氧化
NO
三、一氧化氮和二氧化氮
NO2 是红棕色、有剌激性气味的有毒气体,密度比空气大,易液化,易溶于水,能与水发生反应。
标准状况下,22.4 L NO2是 1 mol 吗?
3NO2 + H2O = 2HNO3 + NO
(工业上利用这一原理生产硝酸)
NO2
三、一氧化氮和二氧化氮
不是酸性氧化物
【实验5-5】
探究NO2与水的反应
三、一氧化氮和二氧化氮
实验 装置 实验 操作 在如图注射器里充入20 mL NO,然后吸入5 mL水,用乳胶管和弹簧夹封住管口,振荡注射器 打开弹簧夹,快速吸入10 mL空气后夹上弹簧夹 振荡注射器
实验 现象
化学 方程式 、 。 2NO+O2 === 2NO2
3NO2+H2O === 2HNO3+NO
无明显现象
无色气体变为红棕色
红棕色气体变浅至消失,有无色气体生成,注射器活塞向内滑动
三、一氧化氮和二氧化氮
(2)实验结论及解释
①NO不溶于水,也不与水反应,但能与空气中的氧气反应生成红棕色的NO2,化学方程式:_________________。
②NO2能与水反应生成无色的NO,化学方程式:___________________
______。工业上利用这一原理生产硝酸。
(3)思考与讨论
①如果要将注射器中的NO充分转化,应采取的措施是_______________
_____。
②上述实验对工业上生产硝酸的启示是____________________________
____________________________________________________。
2NO+O2===2NO2
3NO2+H2O===2HNO3
+NO
继续通入过量的
空气
在用水吸收NO2制取硝酸的反应过程中,要不断地补充空气,使NO2尽可能多地转化为硝酸
氮的氧化物 NO NO2
物理性质 颜色
刺激性毒性
溶解性
化学性质 与O2反应
与H2O反应
收集方法 排水法 排空气法
无色
红棕色
刺激性、有毒
刺激性、有毒
不溶于水
易溶于水,会反应
2NO+O2=2NO2
不反应
不反应
3NO2+H2O=2HNO3+NO
三、一氧化氮和二氧化氮
氮氧化物与氧气和水反应,若有气体剩余,剩余的气体可能是什么?有什么规律?
【思考】
思考
叠加法
充入NO和O2
3NO2 + H2O = 2HNO3 + NO ②
2NO + O2 = 2NO2 ①
4NO+3O2+2H2O=4HNO3
氮氧化物与氧气和水反应,若有气体剩余,剩余的气体可能是什么?有什么规律?
【思考】
思考
叠加法
充入NO2和O2
3NO2 + H2O = 2HNO3 + NO ②
2NO + O2 = 2NO2 ①
4NO2+O2+2H2O=4HNO3
(1)由于NO极易与O2反应,并且其密度与空气相差不多,因此收集NO只能用排水法( )
(2)由于NO2极易与水反应且密度比空气大,因此收集NO2只能用向上排空气法( )
(3)NO2易溶于水生成HNO3,故NO2是酸性氧化物( )
(4)N2与O2反应时,不论O2是否足量,其一步反应都只能得到NO,不能生成NO2( )
(5)可用湿润的淀粉碘化钾试纸鉴别NO2与溴蒸气( )
×
正误判断
√
√
√
×
深度思考
2.工业生产硝酸时,由于NO2与H2O反应会生成HNO3和NO,NO又可与O2反应生成NO2,因此通入适量的氧气可使NO或NO2恰好完全溶于水。
(1)试根据反应
①3NO2+H2O===2HNO3+NO
②2NO+O2===2NO2
推出NO2与O2的混合气体、NO与O2的混合气体被水完全吸收转化为HNO3的化学方程式:___________________________________________
___________________________________________。
①×2+②得:4NO2+O2+2H2O===4HNO3
①×2+②×3得:4NO+3O2+2H2O===4HNO3
深度思考
(2)将一支充有12 mL NO2气体的试管倒置于水槽中,充分反应。
①下列图示正确的是___(填字母)。
C
②若水不能充满试管,需再向试管中缓缓充入O2,现象为____________
____________________,最终充入___ mL氧气,才能使水全部充满。
红棕色,液面逐渐上升
3
无色气体变为
思考
1.向盛有15mLNO气体,倒立于水槽的试管A中通入O2,充分反应后,试管中还剩余气体3mL,则通入的O2体积可能是多少?
气体剩余只能是NO或O2,不可能是NO2。
剩余气体3mL
①3mLNO
②3mLO2
4NO+3O2+2H2O==4HNO3
3
12mL 9mL
4NO+3O2+2H2O==4HNO3
3
15mL 11.25mL
思考
2.向盛有15mLNO2气体,倒立于水槽的试管A中通入O2,充分反应后,试管中还剩余气体3mL,则通入的O2体积可能是多少?
气体剩余只能是NO或O2,不可能是NO2。
剩余气体3mL
①NO2过量→3mLNO
②3mLO2
1
6mL 1.5mL
1
15mL 3.75mL
4NO2+O2+2H2O==4HNO3
3NO2+H2O==2HNO3+NO
3 1
9mL 3mL
4NO2+O2+2H2O==4HNO3
治理空气需要车牌限号
汽油加氧气反应
提供了高温高压
2NO+O2====2NO2
汽车尾气中含有氮氧化物
三、一氧化氮和二氧化氮
(2)处理方法
①开发新能源:电动汽车
(1)危害:
酸雨
光化学烟雾:并不就是氮氧化物,但是可以由氮氧化物引起
②安装尾气催化处理装置
2CO+2NO === 2CO2 + N2
催化剂
③工业生产主要用碱液吸收
2NO2+2NaOH===NaNO3+NaNO2+H2O 345反应
NO2+NO+2NaOH===2NaNO2+H2O 234反应
1.氮元素在海洋中的循环,是整个海洋生
态系统的基础和关键。海洋中无机氮的
循环过程可用如图表示。下列关于海洋
氮循环的说法正确的是
A.海洋中的氮循环起始于氮的氧化
B.海洋中的氮循环属于固氮作用的是③
C.海洋中的反硝化作用一定有氧气的参与
1
2
3
4
5
√
2.最新病毒学研究证实,一氧化氮对SARS病毒有直接的抑制作用。下列关于一氧化氮的叙述正确的是
A.一氧化氮是一种红棕色的气体
B.常温常压下,一氧化氮不能与空气中的氧气直接化合
C.一氧化氮可由氮气和氧气在放电条件下直接化合得到
D.一氧化氮易溶于水,不能用排水法收集
NO是无色气体,不溶于水,易与O2化合生成NO2,在放电的条件下N2与O2化合生成NO。
1
2
3
4
5
√
3.下列有关NO2的说法中正确的是
A.NO2能与水反应生成硝酸,在反应中NO2只是还原剂
B.除去O2中混有的NO2,可将混合气体通过水,将NO2溶解
C.NO2与溴蒸气的鉴别可用NaOH溶液,溶于NaOH溶液得无色溶液的是
NO2,得橙色溶液的为溴蒸气
D.在NO2与水的反应中氧化剂与还原剂的质量之比为1∶2
√
1
2
3
4
5
4.如图所示,试管中盛装的气体呈红棕色,当倒扣在盛有水的水槽中时,试管内水面上升,但不能充满试管,当向试管内鼓入氧气后,可以观察到试管中水面继续上升,经过多次重复后,试管被水充满,对原试管中盛装的气体说法正确的是
A.可能是N2与NO2的混合气体
B.可能是N2O气体
C.可能是NO与NO2的混合气体
D.只可能是NO2一种气体
1
2
3
4
5
√
1
2
3
4
5
5.氮氧化物会严重污染大气,所以实验室必须对含有氮氧化物的废气进行处理。用NaOH溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:
①NO+NO2+2NaOH===2NaNO2+H2O
②2NO2+2NaOH===NaNO2+NaNO3+H2O
(1)在反应①中,参加反应的氧化剂和还原剂的物质的量之比为____。
1∶1
1
2
3
4
5
(2)下列措施能提高尾气中NO和NO2去除率的是_____(填字母)。
A.加快通入尾气的速率 B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
(3)吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是________(填化学式,下同);吸收后排放的尾气中含量较高的氮氧化物是____。
BC
NaNO3
NO
(4)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。在酸性NaClO溶液中,HClO氧化NO生成Cl-和 ,反应的离子方程式为_____________________________________。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
