第五章第二节第二课时 氨气及铵盐的性质 课件(36张ppt) 2022-2023学年高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 第五章第二节第二课时 氨气及铵盐的性质 课件(36张ppt) 2022-2023学年高一下学期化学人教版(2019)必修第二册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 136.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-14 00:00:00 | ||
图片预览










文档简介
氨气
古希腊的亚历山大大帝征服近东的中东后,希腊文化就传播到这些地区,建立了一座新的庙宇。被命名为宙斯——阿摩庙宇。
骆驼粪是沙漠中普遍使用的燃料。由于长期烧骆驼粪,使阿摩庙宇的墙和天花板蒙上一层烟灰。这种烟灰里包含着一些白色晶体,不时散发出一阵阵刺鼻的气味。当地人把这种白色晶体称作sal ammonic(阿摩神之盐)。
1774年,英国化学家普利斯特列收集了这种气体,对它进行研究,发现这种气体可溶于水,并表现出碱性,因而把它称为“碱气”。可是这个名词没有为化学界所接受,最后人们还是从这种气体的来源“阿摩神之盐”中,给它取了个名字“am-monia”(阿摩尼亚)
你知道阿摩神之盐和阿摩尼亚水是什么吗?
1.物理性质
颜色
气味
状态
密度
溶解性
沸点
____
__________气味
气体
比空气
的___
_____溶于水(常温常压1∶700)
较低,易液化
无色
有刺激
性
小
极易
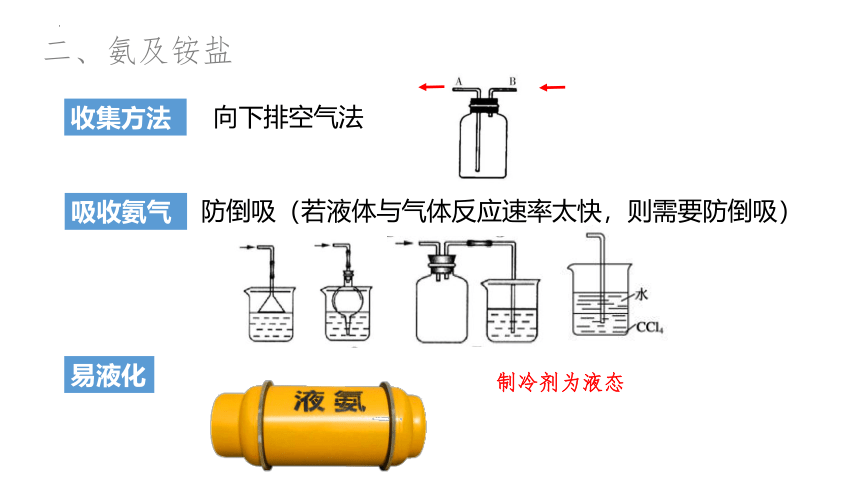
二、氨及铵盐
1、收集氨气用什么方法?有哪些注意事项?
【思考】
2、若用水吸收氨气应该注意什么?
3、氨气可以用于制冷剂,为什么?
收集方法
向下排空气法
吸收氨气
防倒吸(若液体与气体反应速率太快,则需要防倒吸)
二、氨及铵盐
易液化
制冷剂为液态
画出氮元素的价类二维图,从物质和分类的角度讨论氨气都具有哪些化学性质
物质分类
化合价
氢化物 单质 氧化物 酸 碱 盐
+5
+4
+3
+2
0
-3
NH3
NH4+
N2
N2O3
N2O4
N2O5
NO
NO2
HNO3
HNO2
NH3?H2O
NO-3
NO-2
二、氨及铵盐
【实验5-6】
氨气的喷泉实验
二、氨及铵盐
在干燥的圆底烧瓶里充满NH3,用带有玻璃管和胶头滴管(预先吸入水)的橡胶塞塞紧瓶口。倒置烧瓶,使玻璃管插入盛有水的烧杯中(预先在水里滴入少量酚酞溶液)。打开弹簧夹,挤压胶头滴管,使水进入烧瓶。观察并描述现象,分析出现这些现象的可能原因。
烧杯中的酚酞溶液由玻璃管进入烧瓶,形成红色喷泉。
引发操作
现象:
结论:
①氨极易溶于水 ②氨水显碱性
喷泉实验
二、氨及铵盐
NH3 + H2O NH3·H2O NH4+ + OH-
思考
喷泉实验
1.喷泉实验成功的关键
三要
①装置气密性——要好;
②烧瓶和气体——要干;
③烧瓶内的气体——要满。
2.产生喷泉的条件
容器内外产生较大的压强差
思考
喷泉实验
3.常见喷泉实验装置
挤压滴管,气体溶解,P内捂住烧瓶(用热毛巾),
气体逸出溶解,松手后,P内锥形瓶发生化学反应,
产生气体,P下>P上
气体
液体
原理
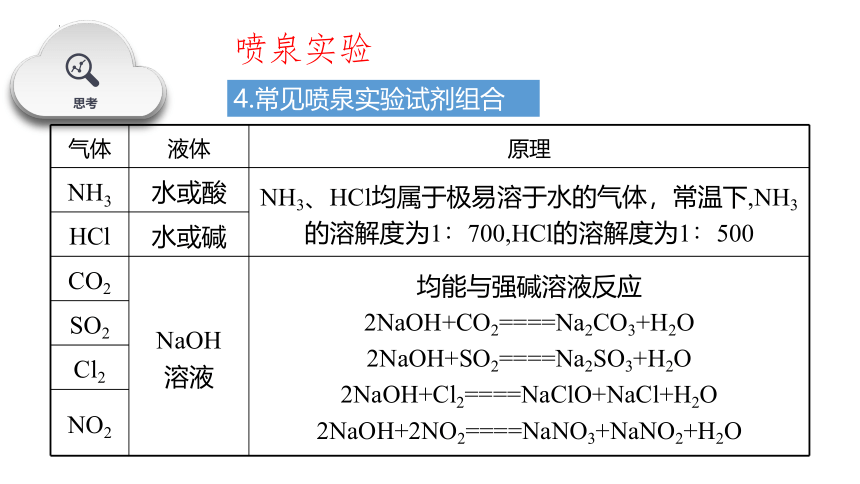
NH3
水或酸
NH3、HCl均属于极易溶于水的气体,常温下,NH3的溶解度为1∶700,HCl的溶解度为1∶500
HCl
水或碱
CO2
NaOH
溶液
均能与强碱溶液反应
2NaOH+CO2====Na2CO3+H2O
2NaOH+SO2====Na2SO3+H2O
2NaOH+Cl2====NaClO+NaCl+H2O
2NaOH+2NO2====NaNO3+NaNO2+H2O
SO2
Cl2
NO2
4.常见喷泉实验试剂组合
思考
喷泉实验
【实验】
氨气与氯化氢的反应
二、氨及铵盐
现象:
氨气与氯化氢反应产生白烟
原理:
NH3+HCl NH4Cl (白烟)
【思考】
这个实验还体现氨水什么性质?
二、氨及铵盐
氨气遇到浓硝酸、浓硫酸也会产生白烟吗?
NH3 + HCl ==== NH4Cl (现象:白烟)
NH3 + HNO3 ==== NH4NO3 (现象:白烟)
2NH3 + H2SO4====(NH4)2SO4
NH 3·H 2O ==== NH3↑ +H2O
△
与挥发性的酸反应才有白烟
【实验】
氨气的催化氧化
二、氨及铵盐
(工业制硝酸)
催化剂
?
还原性
2. 氨化学性质
蓝
NH3+HCl===NH4Cl
大量白烟
还原性
二、氨及铵盐
NH3
硝酸
铵盐
纯碱
有机合成工业原料
用稀氨水治疗
蚊虫叮咬
消除二氧化氮
的污染
吸收硫酸生产中的二氧化硫
致冷剂
二、氨及铵盐
3. 氨用途
(1)液氨可用作制冷剂,是因为其汽化时吸收大量的热( )
(2)氨水呈碱性,是因为NH3溶于水发生反应:NH3+H2O +OH-
( )
(3)氨溶于水,溶液可以导电,因此NH3为电解质( )
(4)将蘸有浓氨水的玻璃棒靠近浓硫酸有白烟产生( )
(5)氨水与液氨一样都是混合物( )
(6)新制饱和氨水中含氮粒子物质的量浓度最大的是 ( )
×
正误判断
√
×
×
×
×
应用体验
1.某化学兴趣小组利用下列图示装置探究氨的性质。
(1)①中湿润的红色石蕊试纸____,化学方程式为____________________。
(2)向②中滴入浓盐酸,现象为____________,反应的化学方程式:___________________。
变蓝
NH3+H2O NH3·H2O
产生白烟
NH3+HCl===NH4Cl
(3)将灼热的铂丝伸入③中锥形瓶,可观察到铂丝保持红热,有红棕色气体及少量白烟生成。该过程会同时发生多个反应,写出NH3和O2催化氧
化的化学方程式:___________________________,该反应______(填
“吸热”或“放热”),锥形瓶中出现白烟,该物质的化学式为________。
放热
NH4NO3
2.喷泉是一种常见的自然现象,其产生的原因是存在压强差。
(1)装置图1中的气体a可能为①氯气、②氢气、③氨、
④氯化氢、⑤二氧化碳。打开装置中的止水夹,挤压胶头滴管,若液体b为水时,能产生喷泉现象的气体a可能是_____(填序号,下同);若液体b为浓氢氧化钠溶液时,能产生喷泉现象的气体a可能是_______。
③④
①④⑤
(2)如果只提供如图2的装置(气体为氨,液体为水),请说明引发喷泉的方法:________________________________
_______________________________。
打开止水夹,用热毛巾捂住圆底烧瓶至有气泡从水中冒出,移去热毛巾
(3)某同学用图1所示装置,在圆底烧瓶中盛放不同的气体
进行喷泉实验。
请帮助分析实验后圆底烧瓶中所得溶液的浓度(假设是在
标准状况下完成实验,且溶质不扩散)。
①若用HCl气体,则c(HCl)=_____________。
②若用NO2气体,则c(HNO3)=_____________。
铵盐
植物缺氮症状: 叶片黄化,植株瘦弱
1.铵盐
(1)概念:由铵根离子( )和酸根离子构成的化合物,如_________、_________、________等。铵盐是农业上常用的化肥。
(2)物理性质:绝大多数铵盐都是白色或无色晶体,且___溶于水。
(NH4)2SO4
NH4HCO3
NH4NO3
易
二、氨及铵盐
【活动一】
了解铵盐的不稳定性
二、氨及铵盐
NH4HCO3 ____________________________。
1.铵盐(3)化学性质
①受热易分解
NH4Cl _____________(生成的NH3和HCl遇冷又结合生成NH4Cl);
NH4HCO3 ____________________________。
二、氨及铵盐
NH3↑+HCl↑
NH3↑+H2O+CO2↑
【注意】
铵态氮肥要避光保存在阴凉处
不稳定性
并不是所有的铵盐都会分解生成氨气和相应的酸受热易分解
△
2NH4NO3 2N2↑+O2↑+4H2O
高温或
猛烈撞击
是升华吗
铵盐的检验
实验探究
二、氨及铵盐
1.铵盐(3)化学性质
②与碱反应
与碱溶液在不加热条件下反应: +OH-===_________;
与碱溶液在加热条件下反应: +OH- ____________。
如NH4Cl和Ca(OH)2在加热条件下反应的化学方程式为_______________
____________________________。
NH3·H2O
NH3↑+H2O
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
二、氨及铵盐
现象:
湿润的红色石蕊试纸变红
结论:
生成一种碱性气体
△
【注意】
铵态氮肥不能与碱(如草木灰)混合施用,否则会生成氨气,降低肥效。
二、氨及铵盐
铵盐的检验
NH4+检验
思路:
二、氨及铵盐
(1)铵盐都易溶于水,且都易分解( )
(2)铵盐都不稳定,受热分解都生成NH3( )
(3)向某溶液中加入稀NaOH溶液,湿润的红色石蕊试纸不变蓝,则原溶液中一定无 ( )
(4)NH4Cl受热分解,所以可用加热的方法分离NH4Cl和NaCl( )
(5)NH4HCO3与足量NaOH溶液共热时,发生反应的离子方程式为 +
OH- NH3↑+H2O( )
×
正误判断
√
×
×
×
应用体验
1.下列关于铵盐的叙述正确的是_______(填序号)。
①所有铵盐中,氮元素化合价都是-3价 ②绝大多数铵盐易溶于水 ③铵态氮肥不宜与碱性肥料混合施用 ④铵盐都是由离子构成的化合物 ⑤铵盐都能与碱反应,不能与酸反应 ⑥铵盐受热分解一定都会产生氨气
②③④
2.为检验一种氮肥的成分,某学习小组的同学进行了以下实验:
①加热氮肥样品生成两种气体,其中一种气体能使湿润的红色石蕊试纸变蓝,另一种气体能使澄清石灰水变浑浊;
②取少量该氮肥样品溶于水,并加入少量BaCl2溶液没有明显变化。
由此可知该氮肥的主要成分是__________。
NH4HCO3
1.下列关于氨水的叙述正确的是
A.氨水显碱性,是因为氨水是一种弱碱
B.氨水和液氨成分相同
C.氨水中物质的量浓度最大的粒子是NH3(除水外)
D.1 mol·L-1的氨水指在1 L溶液中含NH3、NH3·H2O、 物质的量之和
为1 mol
1
2
3
4
√
2.试管中盛有少量白色固体,可能是铵盐,检验的方法是
A.加水,将湿润的红色石蕊试纸放在试管口
B.加氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在试管口
C.加氢氧化钠溶液,加热,滴入酚酞溶液
D.加氢氧化钠溶液,加热,滴入石蕊溶液
√
1
2
3
4
3.(2022·沈阳高一期中)喷泉是一种常见的现象,其产生原因是存在压强差。下面是某同学设计的四个不同的喷泉装置,则下列说法不正确的是
A.若向图1烧瓶中充满HI(与HCl水溶性相似)气体,烧杯和胶头滴管中加入AgNO3溶
液,则挤压胶头滴管可以产生黄色喷泉
B.若向图2锥形瓶中加水,烧瓶中充满NH3,引发喷泉的操作是捂热上方的圆底烧瓶
C.向图3装置的水槽中加入冰块或慢慢滴入浓硫酸都可以形成喷泉
D.图4所示的装置,若要在该
装置中产生双喷现象,其操
作方法可以是关闭活塞c,
打开活塞a、b,再挤压胶头
滴管,当产生大量的白烟时,
再打开活塞c
1
2
3
4
√
4.物质A是一种白色晶体,它与浓NaOH溶液共热,放出无色气体B,用圆底烧瓶收集干燥的气体B。按如图所示组装仪器,打开
止水夹,挤压胶头滴管后,可以得到蓝色喷泉。向放出气
体B的溶液中加入稀硝酸酸化,再加入硝酸银溶液,产生
白色沉淀。
(1)A的化学式是_______。
1
2
3
4
NH4Cl
(2)可用于除去B中水分的干燥剂是____________________。收集气体B的方法是_____________。
碱石灰(或生石灰、
向下排空气法
(3)溶液显蓝色的原因是______________________(用化学用语表示)。
1
2
3
4
(4)取实验后烧瓶中的溶液加热,观察到的现象是____________________
_____________________。
有刺激性气味气体产生,
溶液由蓝色又变为紫色
古希腊的亚历山大大帝征服近东的中东后,希腊文化就传播到这些地区,建立了一座新的庙宇。被命名为宙斯——阿摩庙宇。
骆驼粪是沙漠中普遍使用的燃料。由于长期烧骆驼粪,使阿摩庙宇的墙和天花板蒙上一层烟灰。这种烟灰里包含着一些白色晶体,不时散发出一阵阵刺鼻的气味。当地人把这种白色晶体称作sal ammonic(阿摩神之盐)。
1774年,英国化学家普利斯特列收集了这种气体,对它进行研究,发现这种气体可溶于水,并表现出碱性,因而把它称为“碱气”。可是这个名词没有为化学界所接受,最后人们还是从这种气体的来源“阿摩神之盐”中,给它取了个名字“am-monia”(阿摩尼亚)
你知道阿摩神之盐和阿摩尼亚水是什么吗?
1.物理性质
颜色
气味
状态
密度
溶解性
沸点
____
__________气味
气体
比空气
的___
_____溶于水(常温常压1∶700)
较低,易液化
无色
有刺激
性
小
极易
二、氨及铵盐
1、收集氨气用什么方法?有哪些注意事项?
【思考】
2、若用水吸收氨气应该注意什么?
3、氨气可以用于制冷剂,为什么?
收集方法
向下排空气法
吸收氨气
防倒吸(若液体与气体反应速率太快,则需要防倒吸)
二、氨及铵盐
易液化
制冷剂为液态
画出氮元素的价类二维图,从物质和分类的角度讨论氨气都具有哪些化学性质
物质分类
化合价
氢化物 单质 氧化物 酸 碱 盐
+5
+4
+3
+2
0
-3
NH3
NH4+
N2
N2O3
N2O4
N2O5
NO
NO2
HNO3
HNO2
NH3?H2O
NO-3
NO-2
二、氨及铵盐
【实验5-6】
氨气的喷泉实验
二、氨及铵盐
在干燥的圆底烧瓶里充满NH3,用带有玻璃管和胶头滴管(预先吸入水)的橡胶塞塞紧瓶口。倒置烧瓶,使玻璃管插入盛有水的烧杯中(预先在水里滴入少量酚酞溶液)。打开弹簧夹,挤压胶头滴管,使水进入烧瓶。观察并描述现象,分析出现这些现象的可能原因。
烧杯中的酚酞溶液由玻璃管进入烧瓶,形成红色喷泉。
引发操作
现象:
结论:
①氨极易溶于水 ②氨水显碱性
喷泉实验
二、氨及铵盐
NH3 + H2O NH3·H2O NH4+ + OH-
思考
喷泉实验
1.喷泉实验成功的关键
三要
①装置气密性——要好;
②烧瓶和气体——要干;
③烧瓶内的气体——要满。
2.产生喷泉的条件
容器内外产生较大的压强差
思考
喷泉实验
3.常见喷泉实验装置
挤压滴管,气体溶解,P内
气体逸出溶解,松手后,P内
产生气体,P下>P上
气体
液体
原理
NH3
水或酸
NH3、HCl均属于极易溶于水的气体,常温下,NH3的溶解度为1∶700,HCl的溶解度为1∶500
HCl
水或碱
CO2
NaOH
溶液
均能与强碱溶液反应
2NaOH+CO2====Na2CO3+H2O
2NaOH+SO2====Na2SO3+H2O
2NaOH+Cl2====NaClO+NaCl+H2O
2NaOH+2NO2====NaNO3+NaNO2+H2O
SO2
Cl2
NO2
4.常见喷泉实验试剂组合
思考
喷泉实验
【实验】
氨气与氯化氢的反应
二、氨及铵盐
现象:
氨气与氯化氢反应产生白烟
原理:
NH3+HCl NH4Cl (白烟)
【思考】
这个实验还体现氨水什么性质?
二、氨及铵盐
氨气遇到浓硝酸、浓硫酸也会产生白烟吗?
NH3 + HCl ==== NH4Cl (现象:白烟)
NH3 + HNO3 ==== NH4NO3 (现象:白烟)
2NH3 + H2SO4====(NH4)2SO4
NH 3·H 2O ==== NH3↑ +H2O
△
与挥发性的酸反应才有白烟
【实验】
氨气的催化氧化
二、氨及铵盐
(工业制硝酸)
催化剂
?
还原性
2. 氨化学性质
蓝
NH3+HCl===NH4Cl
大量白烟
还原性
二、氨及铵盐
NH3
硝酸
铵盐
纯碱
有机合成工业原料
用稀氨水治疗
蚊虫叮咬
消除二氧化氮
的污染
吸收硫酸生产中的二氧化硫
致冷剂
二、氨及铵盐
3. 氨用途
(1)液氨可用作制冷剂,是因为其汽化时吸收大量的热( )
(2)氨水呈碱性,是因为NH3溶于水发生反应:NH3+H2O +OH-
( )
(3)氨溶于水,溶液可以导电,因此NH3为电解质( )
(4)将蘸有浓氨水的玻璃棒靠近浓硫酸有白烟产生( )
(5)氨水与液氨一样都是混合物( )
(6)新制饱和氨水中含氮粒子物质的量浓度最大的是 ( )
×
正误判断
√
×
×
×
×
应用体验
1.某化学兴趣小组利用下列图示装置探究氨的性质。
(1)①中湿润的红色石蕊试纸____,化学方程式为____________________。
(2)向②中滴入浓盐酸,现象为____________,反应的化学方程式:___________________。
变蓝
NH3+H2O NH3·H2O
产生白烟
NH3+HCl===NH4Cl
(3)将灼热的铂丝伸入③中锥形瓶,可观察到铂丝保持红热,有红棕色气体及少量白烟生成。该过程会同时发生多个反应,写出NH3和O2催化氧
化的化学方程式:___________________________,该反应______(填
“吸热”或“放热”),锥形瓶中出现白烟,该物质的化学式为________。
放热
NH4NO3
2.喷泉是一种常见的自然现象,其产生的原因是存在压强差。
(1)装置图1中的气体a可能为①氯气、②氢气、③氨、
④氯化氢、⑤二氧化碳。打开装置中的止水夹,挤压胶头滴管,若液体b为水时,能产生喷泉现象的气体a可能是_____(填序号,下同);若液体b为浓氢氧化钠溶液时,能产生喷泉现象的气体a可能是_______。
③④
①④⑤
(2)如果只提供如图2的装置(气体为氨,液体为水),请说明引发喷泉的方法:________________________________
_______________________________。
打开止水夹,用热毛巾捂住圆底烧瓶至有气泡从水中冒出,移去热毛巾
(3)某同学用图1所示装置,在圆底烧瓶中盛放不同的气体
进行喷泉实验。
请帮助分析实验后圆底烧瓶中所得溶液的浓度(假设是在
标准状况下完成实验,且溶质不扩散)。
①若用HCl气体,则c(HCl)=_____________。
②若用NO2气体,则c(HNO3)=_____________。
铵盐
植物缺氮症状: 叶片黄化,植株瘦弱
1.铵盐
(1)概念:由铵根离子( )和酸根离子构成的化合物,如_________、_________、________等。铵盐是农业上常用的化肥。
(2)物理性质:绝大多数铵盐都是白色或无色晶体,且___溶于水。
(NH4)2SO4
NH4HCO3
NH4NO3
易
二、氨及铵盐
【活动一】
了解铵盐的不稳定性
二、氨及铵盐
NH4HCO3 ____________________________。
1.铵盐(3)化学性质
①受热易分解
NH4Cl _____________(生成的NH3和HCl遇冷又结合生成NH4Cl);
NH4HCO3 ____________________________。
二、氨及铵盐
NH3↑+HCl↑
NH3↑+H2O+CO2↑
【注意】
铵态氮肥要避光保存在阴凉处
不稳定性
并不是所有的铵盐都会分解生成氨气和相应的酸受热易分解
△
2NH4NO3 2N2↑+O2↑+4H2O
高温或
猛烈撞击
是升华吗
铵盐的检验
实验探究
二、氨及铵盐
1.铵盐(3)化学性质
②与碱反应
与碱溶液在不加热条件下反应: +OH-===_________;
与碱溶液在加热条件下反应: +OH- ____________。
如NH4Cl和Ca(OH)2在加热条件下反应的化学方程式为_______________
____________________________。
NH3·H2O
NH3↑+H2O
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
二、氨及铵盐
现象:
湿润的红色石蕊试纸变红
结论:
生成一种碱性气体
△
【注意】
铵态氮肥不能与碱(如草木灰)混合施用,否则会生成氨气,降低肥效。
二、氨及铵盐
铵盐的检验
NH4+检验
思路:
二、氨及铵盐
(1)铵盐都易溶于水,且都易分解( )
(2)铵盐都不稳定,受热分解都生成NH3( )
(3)向某溶液中加入稀NaOH溶液,湿润的红色石蕊试纸不变蓝,则原溶液中一定无 ( )
(4)NH4Cl受热分解,所以可用加热的方法分离NH4Cl和NaCl( )
(5)NH4HCO3与足量NaOH溶液共热时,发生反应的离子方程式为 +
OH- NH3↑+H2O( )
×
正误判断
√
×
×
×
应用体验
1.下列关于铵盐的叙述正确的是_______(填序号)。
①所有铵盐中,氮元素化合价都是-3价 ②绝大多数铵盐易溶于水 ③铵态氮肥不宜与碱性肥料混合施用 ④铵盐都是由离子构成的化合物 ⑤铵盐都能与碱反应,不能与酸反应 ⑥铵盐受热分解一定都会产生氨气
②③④
2.为检验一种氮肥的成分,某学习小组的同学进行了以下实验:
①加热氮肥样品生成两种气体,其中一种气体能使湿润的红色石蕊试纸变蓝,另一种气体能使澄清石灰水变浑浊;
②取少量该氮肥样品溶于水,并加入少量BaCl2溶液没有明显变化。
由此可知该氮肥的主要成分是__________。
NH4HCO3
1.下列关于氨水的叙述正确的是
A.氨水显碱性,是因为氨水是一种弱碱
B.氨水和液氨成分相同
C.氨水中物质的量浓度最大的粒子是NH3(除水外)
D.1 mol·L-1的氨水指在1 L溶液中含NH3、NH3·H2O、 物质的量之和
为1 mol
1
2
3
4
√
2.试管中盛有少量白色固体,可能是铵盐,检验的方法是
A.加水,将湿润的红色石蕊试纸放在试管口
B.加氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在试管口
C.加氢氧化钠溶液,加热,滴入酚酞溶液
D.加氢氧化钠溶液,加热,滴入石蕊溶液
√
1
2
3
4
3.(2022·沈阳高一期中)喷泉是一种常见的现象,其产生原因是存在压强差。下面是某同学设计的四个不同的喷泉装置,则下列说法不正确的是
A.若向图1烧瓶中充满HI(与HCl水溶性相似)气体,烧杯和胶头滴管中加入AgNO3溶
液,则挤压胶头滴管可以产生黄色喷泉
B.若向图2锥形瓶中加水,烧瓶中充满NH3,引发喷泉的操作是捂热上方的圆底烧瓶
C.向图3装置的水槽中加入冰块或慢慢滴入浓硫酸都可以形成喷泉
D.图4所示的装置,若要在该
装置中产生双喷现象,其操
作方法可以是关闭活塞c,
打开活塞a、b,再挤压胶头
滴管,当产生大量的白烟时,
再打开活塞c
1
2
3
4
√
4.物质A是一种白色晶体,它与浓NaOH溶液共热,放出无色气体B,用圆底烧瓶收集干燥的气体B。按如图所示组装仪器,打开
止水夹,挤压胶头滴管后,可以得到蓝色喷泉。向放出气
体B的溶液中加入稀硝酸酸化,再加入硝酸银溶液,产生
白色沉淀。
(1)A的化学式是_______。
1
2
3
4
NH4Cl
(2)可用于除去B中水分的干燥剂是____________________。收集气体B的方法是_____________。
碱石灰(或生石灰、
向下排空气法
(3)溶液显蓝色的原因是______________________(用化学用语表示)。
1
2
3
4
(4)取实验后烧瓶中的溶液加热,观察到的现象是____________________
_____________________。
有刺激性气味气体产生,
溶液由蓝色又变为紫色
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
