5.2.3硝酸酸雨及防治 课件(32张ppt) 2022-2023学年高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 5.2.3硝酸酸雨及防治 课件(32张ppt) 2022-2023学年高一下学期化学人教版(2019)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 16.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-15 11:00:20 | ||
图片预览











文档简介
(共32张PPT)
氮及其化合物 第3课时
新课导入
铂金饰品以其所代表着“永恒”的含义,受到大多数人的喜爱。但铂金真的是永恒的吗?
否,王水能很轻易的将铂金溶解,而王水的主要成分之一是硝酸。
资料卡片
能使不溶于硝酸的金属如 金、铂 等溶解。
浓硝酸 和 浓盐酸 按体积比为 1∶3
混合得到的混合物。
王 水
硝酸的性质
XIAO SUAN DE XING ZHI
01
1、硝酸的物理性质
颜色 气味 挥发性 状态 沸点 密度
无色
有刺激性气味
易挥发
液体
83℃
1.5027 g/cm3
① 硝酸能与水任意比互溶
② 常用浓硝酸质量分数为69%。
③ 质量分数为98%以上的硝酸为“发烟硝酸”
开瓶瓶口有白雾
发烟硝酸(W>98%)
参与化学反应温度不宜过高
运输硝酸的铝槽车发生泄露事故,造成大量红棕色烟雾,现场可闻到刺鼻的气味。消防人员运来纯碱进行处理,以便防止其扩散并污染黄河。
问题1:为什么现场有大量红棕色的烟雾?
2、化学性质
(1) 不稳定性,见光或受热易分解
4HNO3 4NO2↑ + O2↑ + 2H2O
光照或加热
硝酸泄漏
保 存:
一般将浓硝酸保存在棕色试剂瓶中,并避光放置于阴凉处
运输硝酸的铝槽车发生泄露事故,造成大量红棕色烟雾,现场可闻到刺鼻的气味。消防人员运来纯碱进行处理,以便防止其扩散并污染黄河。
问题2:为什么可以用纯碱处理泄漏出来的硝酸?
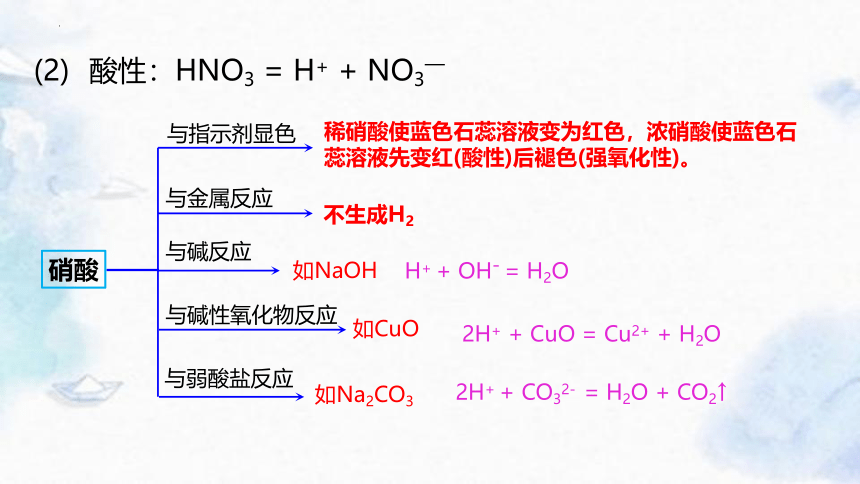
(2) 酸性:HNO3 = H+ + NO3—
与指示剂显色
与金属反应
与碱反应
与碱性氧化物反应
与弱酸盐反应
硝酸
稀硝酸使蓝色石蕊溶液变为红色,浓硝酸使蓝色石蕊溶液先变红(酸性)后褪色(强氧化性)。
不生成H2
如NaOH
H+ + OH- = H2O
如CuO
2H+ + CuO = Cu2+ + H2O
如Na2CO3
2H+ + CO32- = H2O + CO2↑
硝酸浓度 实验现象 实验结论
浓硝酸 反应 、铜丝 ,产生 色气体,溶液呈绿色 铜与浓硝酸反应生成 ,
化学方程式:_________________
________________________
剧烈
变细
红棕
NO2
Cu+4HNO3(浓)===
Cu(NO3)2+2NO2↑+2H2O
稀硝酸 反应 、铜丝 ,产生 气体,溶液呈蓝色 铜与稀硝酸反应生成 ,化学方程式:________________________
________________________
缓慢
变细
无色
NO
3Cu+8HNO3(稀)===
3Cu(NO3)2+2NO↑+4H2O
浓硝酸的还原产物为 NO2,稀硝酸的还原产物为 NO 。
(3) 强氧化性-——与金属反应(除Au、Pt)
运输硝酸的铝槽车发生泄露事故,造成大量红棕色烟雾,现场可闻到刺鼻的气味。消防人员运来纯碱进行处理,以便防止其扩散并污染黄河。
问题3:为什么可以用铝槽车运输浓硝酸?
常温下,浓硝酸能使较活泼金属 ( Fe、Al ) 钝化
冷的浓硝酸或浓硫酸使金属表面生成一层致密的氧化物薄膜,阻止内层金属被进一步腐蚀。
加热下,浓硝酸与较活泼金属 ( Fe、Al ) 直接反应
Al + 6HNO3(浓) Al(NO3)3 + 3NO2↑ + 3H2O
Fe + 6HNO3(浓) Fe(NO3)3 + 3NO2↑ + 3H2O
加热下,浓硝酸与非金属 ( C、S ) 反应
S + 6HNO3(浓) H2SO4 + 6NO2↑ + 2H2O
C + 4HNO3(浓) CO2 + 2NO2↑ + 2H2O
(3) 强氧化性-——与非金属反应
02
酸雨及防治
SUAN YU JI FANG ZHI
酸雨及防治
SO2、NOx 的主要来源
汽车的尾气。
煤、石油和某些含硫的金属矿物的燃烧或冶炼。
SO2、NOx的危害:
SO2与NOx会引起呼吸道疾病,严重时会使人死亡。溶于水形成酸雨;
SO2:
NOx:
酸雨:主要指 pH小于5.6 的雨水,主要含有硫酸和硝酸
成因:主要是大气中的 SO2 与 NOx 溶于雨水形成的
类型:
硫酸型:
硝酸型:
途径1
途径2
2SO2+O2 2SO3
△
催化剂
SO3+H2O===H2SO4
NO
HNO3
N2
NO2
3NO2+H2O===2HNO3+NO
2NO+O2 ==2NO2
放电
N2+O2=== 2NO
酸雨的危害 酸雨的防治
(1) 调整能源结构,积极开发新能源
(2) 对煤进行处理,如选洗加工、综合开发、在
煤中加入适量的生石灰、对排放的烟进行处理等
(3) 改进汽车尾气的处理技术,控制尾气排放
(4) 加强工厂废气的回收处理,充分利用原料
(5) 种植能够吸收 SO2 的有关树木
相关链接
常见的环境污染
环境污染 形成原因 主要危害
温室效应 大气中CO2含量不断增加 全球变暖,冰川融化
酸雨 SO2和氮氧化物的排放 土壤酸化,腐蚀建筑物
光化学烟雾 氮氧化物和碳氢化合物的排放 危害人体健康和植物生长
臭氧空洞 氮氧化物和氟氯代烃的排放 地球上的生物受太阳紫外线的伤害加剧
赤潮和水华 含磷洗衣粉的大量使用及废水的任意排放 使藻类过度繁殖,水质恶化,发生在海水中为赤潮,淡水中为水华
白色污染 聚乙烯塑料的大量使用、任意丢弃 破坏土壤结构和生态环境
下列反应中硝酸既能表现出酸性又表现出氧化性的是
( )
A. 使石蕊试液变红
B. 与铜反应放出 NO 气体,生成 Cu(NO3)2
C. 与 Na2CO3 反应放出 CO2 气体,生成 NaNO3
D. 与S单质混合共热时生成 H2SO4 和 NO2
B
课堂练习
下列对于硝酸的认识,不正确的是
A.浓硝酸在见光或受热时会发生分解
B.金属与硝酸反应不产生氢气
C.可用铁和铝制品盛装冷的浓硝酸
D.铜与硝酸的反应属于置换反应
√
0.3 mol铜和含1.2 mol HNO3的浓硝酸,充分反应后,生成NO2的量为
A.0.2 mol B.0.6 mol
C.小于0.6 mol D.大于0.6 mol
√
1、原子守恒法
2、电子得失守恒法
3、电荷守恒法
4、利用离子方程式计算法
小专题 硝酸与金属反应的相关计算
1、氮原子守恒
= 2n(Cu2+)+[n(NO) +n(NO2)]
n(HNO3)耗= n(NO3-)+n(还原产物中的氮原子)
例1、38.4g铜与足量的浓硝酸反应,铜全部反应后,共收集到22.4L(标况下)气体,反应消耗硝酸的物质的量可能是 ( )
A、1.0mol B、1.6mol C、2.2mol D、2.4mol
C
3Cu+8HNO3(稀) = 3Cu(NO3)2+2NO↑+4H2O
Cu+4HNO3(浓) = Cu(NO3)2+2NO2↑+2H2O
N原子守恒
2、电子得失守恒:
例2、锌与很稀的硝酸反应生成硝酸锌、硝酸铵和水。当生成1mol 硝酸锌时,被还原的硝酸的物质的量为 ( )
A.2mol B.1 mol C.0.5 mol D.0.25 mol
D
【变式】(双选)某二价金属与硝酸反应时,金属与硝酸所消耗的物质的量之比为2:5,则HNO3的还原产物是 ( )
A.NH4NO3 B.N2O C.NO D.NO2
AB
金属失去电子的物质的量等于氧化剂转化为还原产物
(氮的氧化物)时所得到电子的物质的量。
HNO3过量时反应后溶液中(不考虑OH-)则有:
c(NO3- )=c(H+)+nc(Mn+)(Mn+代表金属离子)。
3、电荷守恒法
例3、3.2 g铜与过量硝酸反应,硝酸被还原为NO2和NO。反应后溶液中
含H+ a mol,则此时溶液中含NO3-的物质的量为__________mol。
(a+0.1)
4、离子方程式计算法
例4、在4mol/L 的硫酸和2mol/L的硝酸混合溶液10mL中,加入0.96g铜粉,充分反应后,最多可收集到标况下的气体的体积为 ( )
A.89.6mL B.112mL C.168mL D.224mL
D
3Cu+8H+ + 2NO3- = 3Cu2++2NO↑+4H2O
金属与H2SO4、HNO3的混合酸反应时,由于硝酸盐中NO3- 在H2SO4 提供H+的条件下能继续与金属反应,因此,此类题目应用离子方程式来计算。
先作过量判断,然后根据完全反应的金属或H+或 NO3- 进行相关计算,且溶液中要符合电荷守恒。
【变式】1L稀硝酸和稀硫酸的混合液,其物质的量浓度分别为0.1mol/L和0.4mol/L。
若向该混合液中加入足量的铜粉,则最多能溶解铜粉的质量为
A.2.4g B.3.2g C. 6.4g D.9.6g
D
在标准状况下将 1.92 g 铜粉投入一定量浓硝酸中,随着铜粉的溶解,反应生成的气体颜色逐渐变浅,当铜粉完全溶解后共收集到由 NO2 和 NO 组成的混合气体 1.12 L,则混合气体中 NO 的体积为 ( )
A. 112 mL B. 1 008 mL C. 224 mL D. 448 mL
A
课堂练习
9.7 g Cu 和 Zn 的合金与足量的稀硝酸反应,还原产物只有 NO 气体,其体积在标准状况下为 2.24 L。将溶液稀释为 1 L,测得溶液的 c(H+) = 0.1 mol·L-1,此时溶液中 NO3- 的浓度为 ( )
A. 0.3 mol·L-1 B. 0.4 mol·L-1
C. 0.2 mol·L-1 D. 0.6 mol·L-1
B
氮及其化合物 第3课时
新课导入
铂金饰品以其所代表着“永恒”的含义,受到大多数人的喜爱。但铂金真的是永恒的吗?
否,王水能很轻易的将铂金溶解,而王水的主要成分之一是硝酸。
资料卡片
能使不溶于硝酸的金属如 金、铂 等溶解。
浓硝酸 和 浓盐酸 按体积比为 1∶3
混合得到的混合物。
王 水
硝酸的性质
XIAO SUAN DE XING ZHI
01
1、硝酸的物理性质
颜色 气味 挥发性 状态 沸点 密度
无色
有刺激性气味
易挥发
液体
83℃
1.5027 g/cm3
① 硝酸能与水任意比互溶
② 常用浓硝酸质量分数为69%。
③ 质量分数为98%以上的硝酸为“发烟硝酸”
开瓶瓶口有白雾
发烟硝酸(W>98%)
参与化学反应温度不宜过高
运输硝酸的铝槽车发生泄露事故,造成大量红棕色烟雾,现场可闻到刺鼻的气味。消防人员运来纯碱进行处理,以便防止其扩散并污染黄河。
问题1:为什么现场有大量红棕色的烟雾?
2、化学性质
(1) 不稳定性,见光或受热易分解
4HNO3 4NO2↑ + O2↑ + 2H2O
光照或加热
硝酸泄漏
保 存:
一般将浓硝酸保存在棕色试剂瓶中,并避光放置于阴凉处
运输硝酸的铝槽车发生泄露事故,造成大量红棕色烟雾,现场可闻到刺鼻的气味。消防人员运来纯碱进行处理,以便防止其扩散并污染黄河。
问题2:为什么可以用纯碱处理泄漏出来的硝酸?
(2) 酸性:HNO3 = H+ + NO3—
与指示剂显色
与金属反应
与碱反应
与碱性氧化物反应
与弱酸盐反应
硝酸
稀硝酸使蓝色石蕊溶液变为红色,浓硝酸使蓝色石蕊溶液先变红(酸性)后褪色(强氧化性)。
不生成H2
如NaOH
H+ + OH- = H2O
如CuO
2H+ + CuO = Cu2+ + H2O
如Na2CO3
2H+ + CO32- = H2O + CO2↑
硝酸浓度 实验现象 实验结论
浓硝酸 反应 、铜丝 ,产生 色气体,溶液呈绿色 铜与浓硝酸反应生成 ,
化学方程式:_________________
________________________
剧烈
变细
红棕
NO2
Cu+4HNO3(浓)===
Cu(NO3)2+2NO2↑+2H2O
稀硝酸 反应 、铜丝 ,产生 气体,溶液呈蓝色 铜与稀硝酸反应生成 ,化学方程式:________________________
________________________
缓慢
变细
无色
NO
3Cu+8HNO3(稀)===
3Cu(NO3)2+2NO↑+4H2O
浓硝酸的还原产物为 NO2,稀硝酸的还原产物为 NO 。
(3) 强氧化性-——与金属反应(除Au、Pt)
运输硝酸的铝槽车发生泄露事故,造成大量红棕色烟雾,现场可闻到刺鼻的气味。消防人员运来纯碱进行处理,以便防止其扩散并污染黄河。
问题3:为什么可以用铝槽车运输浓硝酸?
常温下,浓硝酸能使较活泼金属 ( Fe、Al ) 钝化
冷的浓硝酸或浓硫酸使金属表面生成一层致密的氧化物薄膜,阻止内层金属被进一步腐蚀。
加热下,浓硝酸与较活泼金属 ( Fe、Al ) 直接反应
Al + 6HNO3(浓) Al(NO3)3 + 3NO2↑ + 3H2O
Fe + 6HNO3(浓) Fe(NO3)3 + 3NO2↑ + 3H2O
加热下,浓硝酸与非金属 ( C、S ) 反应
S + 6HNO3(浓) H2SO4 + 6NO2↑ + 2H2O
C + 4HNO3(浓) CO2 + 2NO2↑ + 2H2O
(3) 强氧化性-——与非金属反应
02
酸雨及防治
SUAN YU JI FANG ZHI
酸雨及防治
SO2、NOx 的主要来源
汽车的尾气。
煤、石油和某些含硫的金属矿物的燃烧或冶炼。
SO2、NOx的危害:
SO2与NOx会引起呼吸道疾病,严重时会使人死亡。溶于水形成酸雨;
SO2:
NOx:
酸雨:主要指 pH小于5.6 的雨水,主要含有硫酸和硝酸
成因:主要是大气中的 SO2 与 NOx 溶于雨水形成的
类型:
硫酸型:
硝酸型:
途径1
途径2
2SO2+O2 2SO3
△
催化剂
SO3+H2O===H2SO4
NO
HNO3
N2
NO2
3NO2+H2O===2HNO3+NO
2NO+O2 ==2NO2
放电
N2+O2=== 2NO
酸雨的危害 酸雨的防治
(1) 调整能源结构,积极开发新能源
(2) 对煤进行处理,如选洗加工、综合开发、在
煤中加入适量的生石灰、对排放的烟进行处理等
(3) 改进汽车尾气的处理技术,控制尾气排放
(4) 加强工厂废气的回收处理,充分利用原料
(5) 种植能够吸收 SO2 的有关树木
相关链接
常见的环境污染
环境污染 形成原因 主要危害
温室效应 大气中CO2含量不断增加 全球变暖,冰川融化
酸雨 SO2和氮氧化物的排放 土壤酸化,腐蚀建筑物
光化学烟雾 氮氧化物和碳氢化合物的排放 危害人体健康和植物生长
臭氧空洞 氮氧化物和氟氯代烃的排放 地球上的生物受太阳紫外线的伤害加剧
赤潮和水华 含磷洗衣粉的大量使用及废水的任意排放 使藻类过度繁殖,水质恶化,发生在海水中为赤潮,淡水中为水华
白色污染 聚乙烯塑料的大量使用、任意丢弃 破坏土壤结构和生态环境
下列反应中硝酸既能表现出酸性又表现出氧化性的是
( )
A. 使石蕊试液变红
B. 与铜反应放出 NO 气体,生成 Cu(NO3)2
C. 与 Na2CO3 反应放出 CO2 气体,生成 NaNO3
D. 与S单质混合共热时生成 H2SO4 和 NO2
B
课堂练习
下列对于硝酸的认识,不正确的是
A.浓硝酸在见光或受热时会发生分解
B.金属与硝酸反应不产生氢气
C.可用铁和铝制品盛装冷的浓硝酸
D.铜与硝酸的反应属于置换反应
√
0.3 mol铜和含1.2 mol HNO3的浓硝酸,充分反应后,生成NO2的量为
A.0.2 mol B.0.6 mol
C.小于0.6 mol D.大于0.6 mol
√
1、原子守恒法
2、电子得失守恒法
3、电荷守恒法
4、利用离子方程式计算法
小专题 硝酸与金属反应的相关计算
1、氮原子守恒
= 2n(Cu2+)+[n(NO) +n(NO2)]
n(HNO3)耗= n(NO3-)+n(还原产物中的氮原子)
例1、38.4g铜与足量的浓硝酸反应,铜全部反应后,共收集到22.4L(标况下)气体,反应消耗硝酸的物质的量可能是 ( )
A、1.0mol B、1.6mol C、2.2mol D、2.4mol
C
3Cu+8HNO3(稀) = 3Cu(NO3)2+2NO↑+4H2O
Cu+4HNO3(浓) = Cu(NO3)2+2NO2↑+2H2O
N原子守恒
2、电子得失守恒:
例2、锌与很稀的硝酸反应生成硝酸锌、硝酸铵和水。当生成1mol 硝酸锌时,被还原的硝酸的物质的量为 ( )
A.2mol B.1 mol C.0.5 mol D.0.25 mol
D
【变式】(双选)某二价金属与硝酸反应时,金属与硝酸所消耗的物质的量之比为2:5,则HNO3的还原产物是 ( )
A.NH4NO3 B.N2O C.NO D.NO2
AB
金属失去电子的物质的量等于氧化剂转化为还原产物
(氮的氧化物)时所得到电子的物质的量。
HNO3过量时反应后溶液中(不考虑OH-)则有:
c(NO3- )=c(H+)+nc(Mn+)(Mn+代表金属离子)。
3、电荷守恒法
例3、3.2 g铜与过量硝酸反应,硝酸被还原为NO2和NO。反应后溶液中
含H+ a mol,则此时溶液中含NO3-的物质的量为__________mol。
(a+0.1)
4、离子方程式计算法
例4、在4mol/L 的硫酸和2mol/L的硝酸混合溶液10mL中,加入0.96g铜粉,充分反应后,最多可收集到标况下的气体的体积为 ( )
A.89.6mL B.112mL C.168mL D.224mL
D
3Cu+8H+ + 2NO3- = 3Cu2++2NO↑+4H2O
金属与H2SO4、HNO3的混合酸反应时,由于硝酸盐中NO3- 在H2SO4 提供H+的条件下能继续与金属反应,因此,此类题目应用离子方程式来计算。
先作过量判断,然后根据完全反应的金属或H+或 NO3- 进行相关计算,且溶液中要符合电荷守恒。
【变式】1L稀硝酸和稀硫酸的混合液,其物质的量浓度分别为0.1mol/L和0.4mol/L。
若向该混合液中加入足量的铜粉,则最多能溶解铜粉的质量为
A.2.4g B.3.2g C. 6.4g D.9.6g
D
在标准状况下将 1.92 g 铜粉投入一定量浓硝酸中,随着铜粉的溶解,反应生成的气体颜色逐渐变浅,当铜粉完全溶解后共收集到由 NO2 和 NO 组成的混合气体 1.12 L,则混合气体中 NO 的体积为 ( )
A. 112 mL B. 1 008 mL C. 224 mL D. 448 mL
A
课堂练习
9.7 g Cu 和 Zn 的合金与足量的稀硝酸反应,还原产物只有 NO 气体,其体积在标准状况下为 2.24 L。将溶液稀释为 1 L,测得溶液的 c(H+) = 0.1 mol·L-1,此时溶液中 NO3- 的浓度为 ( )
A. 0.3 mol·L-1 B. 0.4 mol·L-1
C. 0.2 mol·L-1 D. 0.6 mol·L-1
B
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
